| Информационная система |  |
Методические рекомендации
по лабораторной диагностике листериоза животных и людей
(утв.
Министерством здравоохранения СССР и Госагропромом СССР
4 сентября 1986 г. и 13 февраля 1987 г.)
1. Общие положения
1.1. Диагноз - листериоз ставят на основании комплекса эпизоотологических или эпидемиологических данных, клинических признаков, патологоанатомических и патологогистологических изменений, а также результатов лабораторного исследования (схема 1, Приложение 10.1). Решающее значение принадлежит бактериологическому исследованию - выделению культуры листерий. Серологические методы (РА, РНГА, РСК) применяют для выяснения эпизоотической ситуации в хозяйствах, где диагноз на листериоз поставлен комплексным методом с выделением культуры.
1.2. Для исследования в лабораторию направляют трупы мелких животных или голову (головной мозг), паренхиматозные органы (часть печени, селезенку, почку, пораженные участки легких), абортированный плод или его оболочки.
1.3. Для прижизненной диагностики в лабораторию направляют истечения из половых органов абортировавших самок, молоко из пораженных долей вымени при наличии мастита - для бактериологического исследования; кровь или сыворотку крови от больных и подозрительных по заболеванию животных - для серологического исследования.
1.4. При подозрении на листериоз у людей исследованию подвергают слизь из носоглотки и зева - при ангинозной форме; выделяемое из глаз - при глазной форме; кровь и ликвор - при септической форме, менингитах и менингоэнцефалитах; меконий - при заболевании новорожденных; околоплодную жидкость, плаценту, отделяемое родовых путей - у женщин, родивших мертвых или больных детей.
1.5. Показания для взятия материала у людей на исследование:
1.5.1. У женщин вне беременности: повторные ангины, воспаление яичников, шейки матки, отягощенный акушерский анамнез.
1.5.2. У беременных женщин: отягощенный акушерский анамнез, патологическое течение беременности (гриппоподобные заболевания, токсикозы, ангины, усиленное выделение из влагалища).
1.5.3. У рожениц: отягощенный акушерский анамнез, патологическое течение родов.
1.5.4. У новорожденных с подозрением на листериоз: обязательное бактериологическое исследование мекония.
1.5.5. От трупа мертворожденного или погибшего в первые дни жизни: необходимо взять кусочки мозга, печени, селезенки для посевов.
1.6. Рекомендуется в первую очередь исследовать кровь, ликвор, меконий, околоплодную жидкость, слизь из носоглотки.
1.7. После смерти возбудитель может быть обнаружен в печени, селезенке, лимфоузлах, в головном и продолговатом мозге, мозжечке, а также в других органах.
1.8. Материал для исследования в свежем или консервированном (в 30 %-ном водном растворе глицерина) виде упаковывают в полиэтиленовые пакеты, помещают в ящик или контейнер, опечатывают и вместе с сопроводительным документом направляют в лабораторию.
В сопроводительном документе указывают наименование и адрес отправителя, опись проб патологического материала, эпизоотологические (эпидемиологические) данные.
2. Бактериологическая диагностика
2.1. Бактериологическая диагностика включает микроскопическое исследование исходного материала, посевы на питательные среды, идентификацию выделенных культур по культурально-биохимическим, тинкториальным и серологическим свойствам, а также постановку биологической пробы на лабораторных животных.
2.2. Учитывая возможность существования нетипичных вариантов листерий, бактериологическое подтверждение считается обязательным для определения наличия возбудителя и распространения листериозной инфекции.
2.3. Микроскопическое исследование
2.3.1. Микроскопическому исследованию подвергают мазки-отпечатки из головного мозга, внутренних органов и тканей. При приготовлении мазков-отпечатков чистым предметным стеклом 3 - 4 раза прикасаются к поверхности среза органа. Мазки готовят непосредственно из патматериала, а также после подращивания его проб при 37 °C в течение 4 - 6 часов.
2.3.2. Мазки окрашивают по Граму, а также методами флюоресцирующих антител согласно пп. 4.6.2 - 4.6.3.
2.3.3. Возбудитель листериоза - Listeria monocytogenes - грамположительная подвижная неспорообразующая полиморфная, чаще палочковидная бактерия длиной 0,5 - 2,0 мкм.
2.4. Бактериологическое исследование
2.4.1. Из органов и обязательно головного мозга проводят обильные множественные посевы или предварительно готовят суспензию из головного мозга и паренхиматозных органов на физрастворе в соотношении 1:5 и из нее делают посевы. Для культивирования листерий используют обычные среды с добавлением 1 % глюкозы и 23 % глицерина или печеночный агар и бульон (pH среды 7,2 - 7,4), а также кровяной агар и элективные среды (Приложение 10.2).
2.4.2. В качестве дополнительного метода при отрицательном результате первичного посева рекомендуется часть исследуемого материала поместить в холодильник и хранить в течение 30 дней для проведения повторных исследований через каждые 10 дней. При хранении в холодильнике при +4 °C патологического материала, помещенного в глицерин, происходит размножение и накопление листерий. Рекомендуется хранение суспензии исследуемого материала в холодильнике в физиологическом растворе или мясопептонном бульоне (МПБ) с добавлением полимиксина 15 - 25 ЕД/мл для задержки роста контаминантов.
2.4.3. При исследовании абортированных плодов посевы делают из содержимого желудка и внутренних органов.
При исследовании истечений из половых органов, молока и силоса (Приложение 10.6) посевы проводят на печеночный агар в чашках и МПБ с 10 % хлорида натрия, из которого потом делают пересевы на твердые среды.
2.4.4. Посевы инкубируют в термостате при 37° с ежедневным просмотром в первые 3 - 4 дня. При отсутствии роста наблюдение за посевами проводят в течение двух недель.
2.4.5. Характерным для возбудителя листериоза является легкое помутнение бульона и появление мелких росинчатых колоний на агаре, наличие бета-гемолиза на кровяном агаре. Колонии листерий в проходящем свете имеют голубую окраску с зеленоватым оттенком и мелкозернистую структуру.
2.4.6. Из выделенной культуры делают мазки, окрашивая их по Граму, а также для люминесцентной микроскопии с применением прямого и непрямого метода флюоресцирующих антител согласно пп. 4.6.2 - 4.6.3.
2.4.7. При получении смешанной культуры ее очищают общепринятыми методами [отсев отдельных характерных колоний, дробный рассев на 2 %-ный мясопептонный агар (МПА) в чашках], а также путем заражения молодых мышей согласно п. 3.
3. Биологическое исследование
3.1. Биологическое исследование проводят на 2 - 3 белых мышах (масса 14 - 16 г). Животных заражают под кожу или внутрибрюшинно суспензией из головного мозга и внутренних органов или культурой в дозе 0,3 - 0,5 мл. При положительной биопробе животные погибают через 2 - 6 суток после заражения. При вскрытии отмечают множественные некротические очажки в печени, селезенке, почках. В отдельных случаях этих поражений может не быть. При наблюдении более 10 дней рекомендуется дополнительно делать посев из головного мозга. Очень чувствительны к подкожному заражению 5 - 6-дневные мыши-сосуны, которые гибнут через 18 - 36 часов.
3.2. Для повышения эффективности биопробы белым мышам за 3 - 4 часа до заражения суспензией патматериала или культурой листерий инъецируют внутримышечно кортизон в дозе 5 мг.
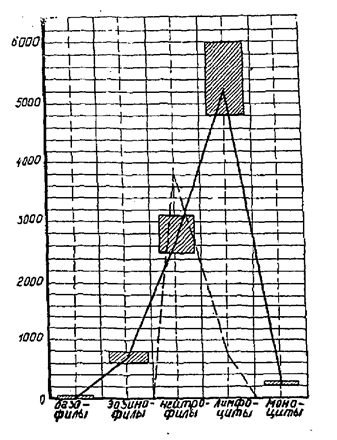
3.3. К заражению листериями восприимчивы и кролики. Показательно внутривенное заражение кроликов культурой листерий в дозе 0,5 - 1 млрд микробных тел (по стандарту мутности), при этом количество моноцитов в крови зараженных животных увеличивается в несколько раз. Это является дополнительной характеристикой возбудителя болезни.
3.4. Из внутренних органов (печень, селезенка, почки, сердце) павших животных делают мазки-отпечатки и высевы на питательные среды.
Срок наблюдения за подопытными животными - 14 суток.
4. Идентификация возбудителя
4.1. Определение подвижности проводят методом висячей или раздавленной капли, а также посевом методом укола в полужидкий МПА. На подвижность исследуют 6 - 18-часовую бульонную культуру, выращенную при комнатной температуре (22 °C). Листерии, выращенные при данной температуре, обладают активной подвижностью.
4.2. Для определения ферментативных свойств чистую бульонную культуру пересевают на пестрый ряд (глюкоза, мальтоза, маннит, салицин, трегалоза, дульцит, инулин, раффиноза), который выдерживают при 37 °C в течение 10 дней. Листерии разлагают с образованием кислоты (без газа) глюкозу, мальтозу, трегалозу, салицин и не разлагают дульцит, инулин, раффинозу, маннит.
4.3. Проба на каталазу. К суточной бульонной культуре добавляют равный объем свежеприготовленной 5 %-ной перекиси водорода, при исследовании агаровой культуры в пробирку вносят несколько капель перекиси водорода. При наличии фермента каталазы перекись водорода разлагается с образованием пузырьков газа (пена). Способность выделять фермент каталазу является характерным признаком листерий при дифференциации от возбудителя рожи свиней.
4.4. Определение чувствительности листерий к бактериофагам
4.4.1. Диагностический набор лиофилизированных листериозных бактериофагов включает два монофага - L2A и L4A. Набор бактериофагов позволяет идентифицировать более 85 % культур листерий, однако могут быть выделены штаммы листерий, которые не лизируются данными фагами.
4.4.2. Перед применением содержимое ампул растворяют бульоном Мартена или МПБ в объеме, указанном на этикетке ампулы, и переносят в пробирки с соблюдением правил асептики. Растворенные бактериофаги не пригодны к использованию при наличии осадка, хлопьев или помутнения.
Не использованные в день исследования растворенные бактериофаги могут быть применены в дальнейшей работе в течение 5 - 10 суток при хранении в холодильнике (+2° - +6°) после предварительной проверки на отсутствие бактериального загрязнения. Ампулы, пробирки и пипетки из-под бактериофага, а также выбракованный бактериофаг обезвреживают кипячением (не менее 30 минут).
4.4.3. Исследование проводят в бактериологических чашках, содержащих 2 %-ный агар Мартена или МПА с глюкозой (0,5 %), разлитый накануне или в день исследования. Перед нанесением испытуемой культуры поверхность агара необходимо подсушить. При подсушивании чашки открывают и переворачивают вверх дном. Агар, разлитый накануне, подсушивают 20 - 30 минут при комнатной температуре, а разлитый в день исследования - 1 - 1,5 часа при 37°.
Для идентификации используют 16 - 18-часовую агаровую культуру, выращенную при 37 °C. Ее засевают в бульон Мартена или МПБ с глюкозой (0,5 %). Количество посевного материала должно быть таким, чтобы после встряхивания в пробирке с бульоном образовалась легкая опалесценция. Культуры подращивают в термостате (37°) 4 часа. После этого бактериальную взвесь наносят газоном на поверхность подсушенного 2 %-ного агара в бактериологических чашках. Каждую культуру подвергают не менее чем 2 - 3 параллельным исследованиям.
4.4.4. В одной чашке можно одновременно проводить испытания 2-х культур. Для этого поверхность агара делят пополам и на каждую из половин наносят по 0,1 мл исследуемых культур, которые распределяют равномерно отдельным шпателем по отмеченному участку агаровой пластинки. Чашки с засеянными культурами выдерживают в термостате (37°) 1 - 1,5 часа при слегка приоткрытой крышке.
4.4.5. Для исследования действия бактериофага на культуру листерий с целью ее идентификации на газон испытуемой культуры тонко оттянутой пастеровской пипеткой или бактериологической петлей наносят по одной капле бактериофагов и отдельно каплю стерильного бульона (контроль).
Место нанесения каждой капли отмечают карандашом по стеклу с наружной стороны чашки. Расстояние между наносимыми каплями должно быть не менее одного сантиметра. Чашки после нанесения фага и бульона оставляют при комнатной температуре (22 - 23°) в затемненном месте.
4.4.6. Учет результатов проводят через 16 - 24 часа. Культуру признают листериями, если в месте нанесения одного из бактериофагов образуется прозрачная зона лизиса или полусливной лизис (в виде губки). Допускается наличие единичных колоний или сплошного нежного роста вторичной культуры в зоне лизиса при интенсивном бактериальном росте на остальной поверхности агара. В месте нанесения капли стерильного бульона зона лизиса отсутствует.
4.4.7. Если лизис культуры выражен нечетко (едва заметно место нанесения капли бактериофага) или полностью отсутствует литическая реакция, культуры идентифицируют согласно п. 4.
4.5. Методика постановки реакции нарастания титра фага для обнаружения возбудителя листериоза в организме животных и людей, кормах и объектах внешней среды.
4.5.1. Реакция нарастания титра фага (РНФ) - быстрый специфический метод обнаружения листерий, обеспечивающий выявление возбудителя в исследуемом материале без выделения его культуры.
4.5.2. РНФ основана на свойстве так называемого индикаторного бактериофага строго специфично размножаться только в клетках гомологичного микроба. Размножение бактериофага сопровождается увеличением количества его частиц и повышением титра.
4.5.3. РНФ рекомендуется использовать в качестве основного метода для обнаружения листерий в кормах и объектах внешней среды, а также при диагностике листериоза.
4.5.4. Для исследования используют органы животных и людей, корма и объекты внешней среды.
4.5.5. В реакции применяют листериозные бактериофаги L2A и L4A. Штаммы листерий I (9 - 127) и II (9 - 72) серогруппы. Питательные среды, содержащие 0,5 % глюкозы: мясопептонный бульон, 1,5 %-ный и 0,7 %-ный мясопептонный агар.
4.5.6. При постановке РНФ с пробами внутренних органов, кормов и почвы отвешивают 3 г исследуемого материала, измельчают, помещают в колбу емкостью 50-100 мл и добавляют 30 мл МПБ. Смесь в течение 5 - 10 минут встряхивают, затем 9 мл переносят в бактериологическую пробирку № 1 (опытная).
Для исследования воды ее наливают в количестве 8 мл в пробирку № 1 (опытная), в эту же пробирку добавляют 1 мл МПБ.
4.5.7. Бактериофаги используют в рабочем разведении (10000 фаговых корпускул в мл). Для этого их растворяют МПБ до исходного объема, указанного на этикетке ампулы, а затем на МПБ отдельными пипетками делают пять последовательных десятикратных разведений (в последнем разведении титр бактериофага составит 1 104).
Смесь фагов готовят путем смешивания равных объемов фага L2A и L4A в рабочем разведении.
4.5.8. Для контроля титра бактериофага, который ставят один на группу анализов, проводимых одновременно, в пробирку № 2 (контроль) вносят 9 мл МПБ.
4.5.9. В пробирки № 1 и 2 вносят по 1 мл смеси фагов в рабочем разведении (схема 2, с. 10) и выдерживают их в течение 16 - 24 часов при комнатной температуре, после чего в пробирки добавляют по 1 мл хлороформа. Содержимое тщательно встряхивают и оставляют при комнатной температуре на 30 - 40 минут. Хлороформ оседает на дно, надосадочную жидкость подвергают дальнейшим исследованиям.
Схема 2
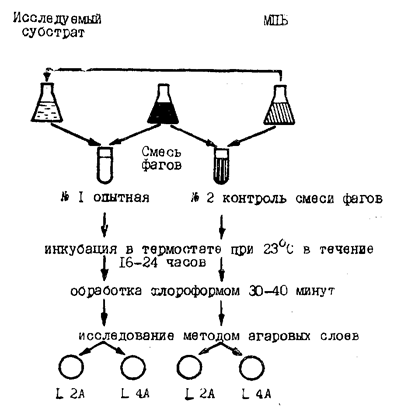
Схема постановки РНФ для обнаружения листерий
4.5.10. При использовании смеси фагов из опытной и контрольной пробирок (№ 1 и 2) берут по 0,2 мл и переносят по 0,1 мл в две пробирки, содержащие по 0,9 мл МПБ (один ряд для обнаружения фага L2A, а другой - L4A), а затем из каждой пробирки готовят еще одно десятикратное разведение.
4.5.11. Готовят 1-миллиардную взвесь штаммов I и II серогруппы по стандарту мутности путем разведения суточной агаровой культуры в физиологическом растворе. Во все пробирки с разведенным материалом добавляют по 0,1 мл взвеси штамма I серогруппы для выявления фага L2A или штамма II серогруппы для обнаружения фага L4A. Содержимое пробирок засевают методом агаровых слоев по Грациа. Для чего накануне дня исследования в бактериологические чашки Петри разливают по 10 мл 1,5 %-ного МПА; МПА можно разлить в чашки Петри и в день исследования, но в этом случае поверхность агара необходимо предварительно подсушить в течение 40 - 50 минут при 37° или 2 часов при комнатной температуре. Для второго слоя используют расплавленный и охлажденный до 48 - 50° 0,7 %-ный МПА, который следует использовать в течение часа, так как позже он приобретает гелеобразную консистенцию и не пригоден для исследования.
Затем в пробирки пипеткой вносят по 2,5 - 3 мл расплавленного и охлажденного до 48 - 50° 0,7 %-ного МПА. Содержимое быстро и тщательно перемешивают вращением пробирки между ладонями и выливают в чашку Петри. Смесь легким покачиванием чашки равномерно распределяют вторым слоем на поверхности 1,5 %-ного МПА. Чашки оставляют на ровном месте на 20 - 30 минут (до застывания 0,7 %-ного МПА), затем переворачивают и инкубируют при комнатной температуре.
4.5.12. Учет реакции проводят через 16 - 24 часа инкубирования посевов.
В опытных пробах и контроле титра фага подсчитывают число негативных колоний во всех чашках. Негативные колонии - округлые, хорошо заметные на фоне бактериального роста, прозрачные участки, образующиеся в результате лизиса бактерий.
При учете результатов сравнивают количество негативных колоний на чашках соответствующих разведений.
4.5.13. Результаты реакции оценивают по увеличению титра бактериофага (количества негативных колоний):
увеличение количества негативных колоний в опытной пробе по отношению к контролю в 5 и более раз (хотя бы по одному из разведений) оценивается как положительный результат, менее чем в 5 раз - отрицательный;
сплошной лизис или лизис с островками оценивается как положительный результат.
4.5.14. При получении положительного результата РНФ дают заключение, что в исследуемом материале (пробе) обнаружен возбудитель листериоза.
При получении отрицательного результата РНФ для окончательной постановки диагноза необходимо провести бактериологическое исследование материала.
4.6. Люминесцентно-серологическое исследование
4.6.1. Люминесцентно-серологическое исследование проводят с использованием прямого (ПМФА) и непрямого методов флюоресцирующих антител (НМФА). С помощью этих методов можно идентифицировать возбудителя в культурах, обнаружить листерии в органах и тканях, а также определить их серогрупповую принадлежность.
4.6.2. Окраска по прямому методу флюоресцирующих антител.
4.6.2.1. Для проведения исследования необходимо иметь:
- флюоресцирующие сыворотки против листерий сероваров 1, 4а, 4в;
- нефлюоресцирующее иммерсионное масло или его заменитель, приготовленный из диметилфталата чистого 100 мл, нафталина сублимированного 1,75 г или тимола чистого 5,0 г;
- глицерин с фосфатным буфером pH 8,0 (1 часть глицерина нейтрального и 9 частей фосфатного буфера);
- физиологический раствор хлорида натрия с фосфатным буфером pH 7,4, приготовленный следующим образом: на аналитических весах отвешивают 9,078 г химически чистого однозамещенного фосфата калия, помещают его в мерную колбу и доводят дистиллированной водой до 1 л; затем отвешивают 11,876 г двузамещенного фосфата натрия и в другой мерной колбе доводят дистиллированной водой до объема 1 л. При использовании двузамещенного фосфата натрия, содержащего 12 молекул воды, для получения 1 л раствора берут навеску 23,752 г, а безводного препарата - 9,476 г. Для получения буфера pH 7,4 смешивают 4 части раствора двузамещенного фосфата натрия и 1 часть раствора однозамещенного фосфата калия. Полученный буфер добавляют к физиологическому раствору (8,750 г хлорида натрия на 1 л дистиллированной воды) в соотношении 1:50. Если при смешении растворов фосфатов 4:1 не получают нужный pH, то изменяя соотношение растворов, достигают необходимой величины pH (при повышенной кислотности добавляют двузамещенный фосфат натрия, а при щелочном pH добавляют однозамещенный фосфат калия). Если при добавлении буфера в соотношении 1:50 к физиологическому раствору последний будет иметь pH ниже 7,4, то увеличением количества добавляемого буфера добиваются нужной реакции физиологического раствора;
- спирт этиловый, 96°;
- покровные стекла толщиной не более 0,2 мм;
- предметные стекла, нелюминесцирующие и хорошо обезжиренные.
Перед применением флюоресцирующие сыворотки разводят дистиллированной водой до рабочего разведения. Сыворотки в рабочем разведении могут храниться при температуре 2 - 4° в течение 2-х недель.
4.6.2.2. Определение возбудителя в культуре. Для исследования используют 18 - 24 часовые чистые или смешанные культуры, из которых готовят по два мазка на отдельных предметных стеклах для обработки листериозными люминесцирующими сыворотками.
Густые мазки для исследования непригодны, так как микробы в них могут светиться менее интенсивно. Мазки готовят средней густоты (несколько десятков микробов в поле зрения микроскопа) размером не более 1 см2.
Место нанесения культуры очерчивают карандашом по стеклу с обратной стороны, подсушивают мазки на воздухе, маркируют и фиксируют этиловым спиртом в течение 15 минут; мазки для фиксации погружают в вертикальном положении в стеклянный сосуд со спиртом. Каждое стекло отделяют металлической проволочкой или стеклянной палочкой.
После фиксации и испарения спирта мазки ополаскивают физиологическим раствором хлорида натрия с фосфатным буфером pH 7,4.
На слегка подсушенный мазок наносят 1 - 2 капли соответствующей люминесцирующей сыворотки в рабочем разведении. Мазки с сывороткой помещают во влажную камеру (в чашки Петри с влажной фильтровальной бумагой на дне) и выдерживают в термостате при температуре 37° в течение 30 минут. Затем сыворотку отмывают, погружая мазки в кювету, содержащую физиологический раствор с фосфатным буфером pH 7,4, на 20 минут. Раствор в кювете периодически помешивают и меняют через 10 минут.
Отмытые мазки ополаскивают дистиллированной водой и высушивают на воздухе. Для быстроты высушивания можно использовать настольный вентилятор.
На поверхность мазка наносят небольшую каплю глицерина с буфером pH 8,0, накрывают покровным стеклом, излишек глицерина удаляют.
На покровное стекло наносят нефлюоресцирующее иммерсионное масло или его заменитель и производят люминесцентную микроскопию. Люминесцентный микроскоп рекомендуется устанавливать в хорошо вентилируемой комнате с частично затемненным окном или в затемненной части комнаты.
Диагностическая оценка интенсивности свечения возбудителя листериоза.
Степень свечения оценивается по следующим показателям:
"++++" - ярко выраженное золотисто-зеленоватое свечение, четко заметны морфологические особенности бактерий, хорошо видна темная центральная зона клетки;
"+++" - яркое свечение, хорошо заметны цвет и морфологические особенности клетки;
"++" - выраженное свечение, но меньшей интенсивности;
"+" - заметное, но слабое свечение, цвет неясен, морфологические особенности различаются плохо;
"-" - свечение не обнаруживается.
Свечение бактериальных клеток на 4 и 3 креста расценивается как положительный результат.
4.6.2.3. Обнаружение возбудителя в патологическом материале.
Материал для исследования должен быть свежим.
Для люминесцентной микроскопии из паренхиматозных органов готовят суспензию на физиологическом растворе в соотношении 1:5. После осаждения крупных частиц в суспензии из разных участков ее поверхности готовят по 2 - 3 мазка.
Мазки из головного и костного мозга готовят отдельно и после фиксации спиртом дополнительно обезжиривают ацетоном в течение 5 минут, меняя его 2 - 3 раза. Дальнейшую обработку препаратов и люминесцентную микроскопию выполняют согласно п. 4.6.2.2.
При обнаружении возбудителя с типичной морфологией, специфическим свечением и интенсивностью не ниже чем на три креста, ставят положительный люминесцентно-серологический диагноз.
4.6.3. Окраска по непрямому методу флюоресцирующих антител.
4.6.3.1. Для постановки реакции необходимо иметь:
- материал для исследований (антиген) в виде микробной бульонной или агаровой культуры (500 млн микробных тел/мл), выращенной при 22 - 37° в течение 16 часов или мазков-отпечатков из органов и тканей павшего (убитого) животного;
- гипериммунные кроличьи сыворотки: листериозные-серогрупповые и поливалентную;
- флюоресцирующую сыворотку против глобулинов кролика;
- метиловый или этиловый спирт 96°;
- глицерин на забуференном физиологическом растворе 1:10 (pH 7,2 - 7,4);
- дистиллированную воду;
- нефлюоресцирующее иммерсионное масло;
- тонкие, обезжиренные предметные стекла.
Для приготовления рабочего разведения сухую флюоресцирующую сыворотку против глобулинов кролика растворяют в указанном на этикетке ампулы объеме дистиллированной воды. После растворения сыворотку центрифугируют при 3000 - 6000 оборотах в минуту в течение 30 минут для удаления крупных конгломератов. Разведенную сыворотку хранят в пробирке с резиновой пробкой или в запаянной ампуле при температуре +4° в течение 2 недель. Перед нанесением на препарат флюоресцирующую сыворотку необходимо развести физиологическим раствором (pH 7,2 - 7,4) в соответствии с указанным на этикетке ампулы рабочим разведением в нужном для работы объеме. Разведенная до рабочего разведения сыворотка используется в тот же день.
4.6.3.2. Методика приготовления препаратов для люминесцентной микроскопии:
- мазок из бактериальной культуры или тонкий мазок-отпечаток из органов высушивают на воздухе в течение 1 минуты и фиксируют этиловым или метиловым спиртом также в течение 1 минуты;
- наносят каплю гипериммунной листериозной кроличьей сыворотки, покрывают (разрезанным на 4 части 1×1 см) покровным стеклом на 5 минут при температуре 20 °C. Затем покровное стекло снимают и в течение 20 - 30 секунд препарат промывают дистиллированной водой. После этого препарат высушивают в сушильном шкафу при температуре 60 - 70° в течение 2 минут;
- наносят одну каплю флюоресцирующей сыворотки против глобулинов кролика, покрывают покровным стеклом (разрезанным на 4 части 1×1 см) - экспозиция 5 минут при температуре 20°. Снимают покровное стекло и под сильной струей водопроводной воды промывают препарат 5 - 10 минут;
- препарат высушивают в сушильном шкафу при температуре 60 - 70° в течение 2 минут. Затем на препарат наносят каплю жидкости (одна часть нейтрального глицерина и 9 частей физраствора, забуференного фосфатным буфером pH 7,2 - 7,4), накрывают покровным стеклом, на которое наносят одну каплю нефлюоресцирующего иммерсионного масла, и исследуют под люминесцентным микроскопом (объектив 90, окуляр 5, 7, 10) с системой светофильтров (ФС-1-4, БС-8-2).
4.6.4. Для обнаружения листерий в органах и тканях мазки обрабатывают поливалентной сывороткой, а для серологической типизации листерий готовят несколько мазков, половину которых обрабатывают сывороткой первой серогруппы, а другую половину - сывороткой второй серогруппы.
4.6.5. При исследовании материала необходимо ставить контроли с нормальной сывороткой, проверенной на отсутствие листериозных антител, и с заведомо известной листериозной культурой.
Обязательным контролем следует считать препарат с листериями, обработанный только люминесцирующей антивидовой сывороткой.
4.6.6. Клетки листерий, обработанные гомологичной листериозной сывороткой, обладают свечением, в то время как бактерии, обработанные гетерологичной листериозной сывороткой, не светятся при исследовании в люминесцентном микроскопе. Бактерии других видов, обработанные листериозной сывороткой, также не светятся.
4.6.7. При использовании метода флюоресцирующих антител для контрастирования фона препарат можно одновременно с флюоресцирующей сывороткой окрашивать бычьим альбумином, меченным родамином, в соответствии с Временным наставлением на его применение, утвержденным Минздравом СССР 14 апреля 1962 г. Совместное применение флюоресцирующей сыворотки и альбумина значительно повышает чувствительность и надежность иммунофлюоресцентного анализа - меченый альбумин снижает неспецифическое свечение фона, сообщая посторонним бактериям и тканям, а также прочим органическим частицам, содержащимся в препаратах, оранжево-красное неспецифическое свечение, на фоне которого листерии выделяются сияющим зеленоватым цветом.
4.7. Для дифференциации листерий от возбудителя рожи свиней можно использовать индикаторные среды; метод основан на редукции и оксидации красок в средах при выращивании листерий.
Исследуемую бульонную культуру или смыв агаровой культуры засевают в объеме 2 - 4 капель не менее чем на две из пяти следующих индикаторных сред: с лакмусом, нейтраль-ротом в смеси с метиленовой синью, метил-ротом, конго-ротом, амидочерным (приготовление сред см. приложение 10.2.1). Пробирки встряхивают и помещают в термостат при 37 - 38° вместе с контрольными (незасеянными) средами. Результат учитывают через 3 - 6, 24, 48 часов.
Возбудитель листериоза через 3 - 6 часов обесцвечивает среду с лакмусом и среду с нейтраль-ротом в смеси с метиленовой синью до цвета бульона, лишь у поверхности на границе с воздухом остается окрашенный ободок. При встряхивании цвет частично восстанавливается, поэтому посевы просматривают, не встряхивая пробирки.
Среда с метил-ротом обесцвечивается через 3 - 6 часов, но восстановление цвета среды не происходит.
Обесцвечивание сред с конго-ротом и с амидо-черным происходит в более поздние сроки: через 6 - 48 часов, при этом исходный цвет среды после обесцвечивания не восстанавливается.
Возбудитель рожи свиней не обесцвечивает ни одну из вышеуказанных сред.
4.8. Серологическая идентификация листерий
4.8.1. Поливалентная листериозная агглютинирующая сыворотка представляет собой смесь кроличьих листериозных агглютинирующих сывороток и содержит факторы (антитела) Н-АВ и 0 - II, V, VI, VII, IX. Поливалентная сыворотка в капельной реакции агглютинации на стекле агглютинирует все известные серовары листерий. Серогрупповые сыворотки агглютинируют культуры листерий соответствующих серогрупп. Сыворотка 1-го серовара ("1-я серогруппа") содержит 0-фактор II, а сыворотка 4-го "в" серовара ("2-я серогруппа") - 0-факторы V, VI.
4.8.2. Предназначенную для идентификации чистую 24-часовую бульонную культуру, выращенную при 37°, платиновой петлей засевают частым штрихом на 2 пробирки обычного МПА так, чтобы получить рост по всей поверхности агара, и выращивают в темном месте при комнатной температуре (18 - 26 °C) в течение 24 - 30 часов. Затем агаровую культуру смывают небольшим количеством физраствора, чтобы получить густую взвесь (10 - 15 млрд микробных клеток в 1 мл).
4.8.3. Реакцию агглютинации ставят на чистых обезжиренных предметных стеклах. На предметное стекло наносят две капли: каплю поливалентной сыворотки и каплю физраствора. К обеим каплям на стекле добавляют по одной капле смыва культуры, смесь тщательно и быстро перемешивают бактериологической петлей или запаянным концом пастеровской пипетки, после чего стекла плавно покачивают круговыми движениями. Одновременно для контроля один раз в день исследуют на стекле каплю сыворотки с добавлением капли физраствора.
4.8.4. Учет результатов РА проводят в течение 3-х минут. Реакция считается положительной при появлении четкой агглютинации (образование хлопьев) в капле с сывороткой при ее отсутствии в контроле. Запоздалые реакции не учитывают.
4.8.5. Исследуемую культуру признают листериями при получении положительной реакции с поливалентной сывороткой и отсутствии агглютинации в контроле с физраствором, а также наличии характерных морфологических, культуральных и биохимических свойств.
4.8.6. При наличии самоагглютинации РА ставят повторно по указанной выше методике, но при посеве на МПА в качестве посевного материала используют суточную бульонную культуру, выращенную при комнатной температуре, что предотвращает самоагглютинацию.
4.8.7. С помощью сероваровых ("серогрупповых") сывороток определяют серовар ("серогруппу") идентифицированных культур листерий. С этой целью чистую бульонную 24-часовую культуру листерий засевают на 1 - 2 пробирки МПА, как указано в п. 4.8.2, и выращивают при 37° 18 - 24 часа. Смыв с агаровой культуры делают так же, как и для РА с поливалентной сывороткой, и исследуют в РА одновременно с сыворотками 1-го и 4-го "в" сероваров. Техника постановки и учета РА описана в пп. 4.8.3 - 4.8.4.
4.8.8. Положительная РА с сывороткой 1-го серовара свидетельствует о принадлежности культуры к 1-му серовару ("1-я серогруппа"), а положительная РА с сывороткой 4-го "в" серовара указывает на принадлежность ее к 4-ому "в" серовару ("2-я серогруппа") листерий. В случае отрицательных или сомнительных показаний РА с сыворотками обоих сероваров, что возможно в результате изменчивости (диссоциации) культуры, для определения ее сероваровой ("серогрупповой") принадлежности ставят пробу роста.
4.8.9. Для постановки пробы роста используют обычный МПБ в пробирках по 4 - 5 мл с добавлением 1 % - 1,25 % стерильной сероваровой сыворотки, проверенной на стерильность путем экспозиции в термостате в течение 24 часов.
4.8.10. Для постановки пробы роста выращенную при 37° суточную бульонную культуру листерий пересевают платиновой петлей на две пробирки МПБ - одну пробирку с сывороткой 1-го и одну пробирку с сывороткой 4-го "в" серовара, которые инкубируют при температуре 37° в течение 24 - 48 часов.
4.8.11. Если культура является смесью двух сероваров ("серогрупп"), то из верхнего слоя бульона каждой пробирки производят посев на МПА с целью получения изолированных колоний. Полученную из изолированной колонии каждой пробирки культуру снова испытывают по описанной выше методике в РА с сероваровыми сыворотками. При этом из пробирки с сывороткой 1-го серовара выделяют культуру 4-го "в" серовара ("2-я серогруппа"), а из пробирки с сывороткой 4-го "в" серовара - культуру 1-го серовара ("1-я серогруппа"). Таким образом, с помощью пробы роста удается разделить смесь культур листерий двух серогрупп.
4.9. Специфические свойства листерий проверяют также конъюнктивальной пробой на морских свинках или дермонекротической пробой на морских свинках или кроликах.
4.9.1. Конъюнктивальная проба. На конъюнктиву глаза морской свинки наносят 2 капли испытуемой бульонной культуры с последующим легким массажем век ватным тампоном. Вирулентные штаммы листерий на 2 - 4 день вызывают у морской свинки гнойный кератоконъюнктивит. Пробу с каждым штаммом желательно ставить не менее, чем на двух морских свинках.
4.9.2. Дермонекротическая проба. В тщательно выстриженный участок кожи бока морской свинки или кролика внутрикожно вводят 0,3 - 0,5 мл бульонной культуры. Через 24 - 48 часов возникает воспаление с последующим некрозом и образованием струпа.
На одной морской свинке можно ставить конъюнктивальную и дермонекротическую пробу при изучении свойств одного штамма. При необходимости испытания нескольких культур в выстриженный участок кожи на правом и левом боку кролика можно инъецировать по 3 культуры с каждой стороны.
5. Дифференциальная таблица
Для дифференциации возбудителя листериоза от возбудителя рожи свиней пользуются таблицей 1:
Таблица 1
|
Признаки |
Возбудитель листериоза |
Возбудитель рожи свиней |
|
Подвижность |
Подвижен в молодой 6 - 18-часовой культуре, выращенной при комнатной температуре |
Неподвижен |
|
Лизис листериозным бактериофагом |
Лизируется |
Не лизируется |
|
Салицин |
Разлагает |
Не разлагает |
|
Проба на каталазу |
Положительная |
Отрицательная |
|
Индикаторные среды |
Обесцвечивает |
Не обесцвечивает |
|
РА с позитивной листериозной сывороткой |
Положительная |
Отрицательная |
|
Конъюнктивальная проба на морских свинках |
Положительная |
Отрицательная |
|
Дермонекротическая проба |
Положительная |
Отрицательная |
6. Положительный ответ на листреиоз
Диагноз на листериоз считается установленным при получении положительного результата РНФ; обнаружении листерий в патматериале иммунофлюоресцентным методом, а также при выделении грамположительной полиморфной подвижной палочки, образующей каталазу и разлагающей с образованием кислоты глюкозу, мальтозу, трегалозу и салицин; вызывающей (вирулентные штаммы) положительные конъюнктивальную и дермонекротическую пробы у морских свинок и кроликов; дающей положительную РА с листериозной сывороткой; лизирующейся листериозным бактериофагом; обладающей патогенностью для лабораторных животных (вирулентные штаммы).
7. Патологогистологическая диагностика
7.1. Для патологогистологического исследования необходимо брать следующие материалы: кусочки головного мозга (все отделы), спинного мозга и паренхиматозных органов.
7.2. Материал фиксируют в 10 %-ном растворе нейтрального формалина с последующим заключением в парафин и окраской гематоксилинэозином или в жидкости Карнуа с окраской по Браше, или в 96° этиловом спирте с окраской по Нисслю.
7.3. Гистологические изменения наиболее сильно проявляются в головном и спинном мозге, где хорошо выражены периваскулиты, состоящие из лимфоцитов и гистиоцитов; отек, дегенерация нейронов, нейронофагия, микроабсцессы и некротические очаги. Наличие микрофокусного энцефалита, проявляющегося очагами, состоящими из скопления моноцитарных и лимфоидных клеток с примесью сегментоядерных лейкоцитов, является отличительным признаком от энцефалита вирусного происхождения.
При септической форме болезни в печени, селезенке, надпочечниках обнаруживают гранулемы, состоящие из клеток лимфоидно-гистиоцитарного типа.
7.4. При гистологическом исследовании органов ягнят часто находят зернистую дистрофию клеток печени и почек; воспалительные изменения в тонком отделе кишечника и сычуге, мелкоочаговую бронхопневмонию.
7.5. Для экспрессной диагностики листериоза используют прямой или непрямой метод флюоресцирующих антител для выявления листерий в гистологических срезах проб органов и тканей животных и человека.
7.5.1. Для исследования необходимо иметь:
- листериозную культуру для контроля активности люминесцирующих сывороток;
- пробы органов и тканей для исследования, которые в случае хранения замораживают при -8 - 10 °C;
- люминесцирующую листериозную сыворотку (для прямого метода) или поливалентную листериозную кроличью сыворотку (если имеются, то и серогрупповые) и флюоресцирующую сыворотку против глобулинов кролика;
- микротом с ножом глубокого охлаждения или микрокриостат (криостат);
- люминесцентный микроскоп;
- чистый ацетон;
- 0,15 М раствор хлорида натрия;
- смесь глицерина (1 часть) и 0,15 М NaCl (9 частей);
- нефлюоресцирующее иммерсионное масло или его заменитель - диметилфталат;
- предметные и покровные стекла;
- 10 %-ный формалин.
7.5.2. Если невозможно исследовать материал на месте, то кусочки органов и тканей размером 1×1, 5×2 см помещают в плотно закрываемую стеклянную тару и заливают 10 %-ным формалином. В таком виде материал пересылают в лабораторию.
7.5.3. Для приготовления рабочих разведений сухую люминесцирующую сыворотку (для прямого метода) или флюоресцирующую сыворотку против глобулинов кролика (для непрямого метода) сначала растворяют в указанном на этикетке ампулы объеме дистиллированной воды.
При наличии осадка сыворотку центрифугируют. Перед нанесением на гистологические срезы тканей флюоресцирующую сыворотку разводят раствором 0,15 М хлорида натрия до рабочего титра, который указан на ампуле.
7.5.4. Методика приготовления гистологических срезов: из нефиксированных проб органов и тканей готовят на замораживающем микротоме с ножом глубокого охлаждения или криостате (микрокриостате) срезы толщиной не более 5 - 8 микрон в количестве 2 - 3 с каждой пробы; полученные срезы наклеивают на обезжиренные предметные стекла без клеящих растворов, фиксируют чистым ацетоном в течение 15 минут и подсушивают на воздухе; материал, фиксированный в 10 %-ном формалине, режут на обычном замораживающем микротоме толщиной не более 5 - 8 микрон, срезы промывают 30 минут в физиологическом растворе и наносят на чистые обезжиренные предметные стекла с наклеивающей жидкостью (белок). Приготовленные срезы на предметных стеклах подсушивают при комнатной температуре или в термостате до полного высыхания.
7.5.5. Окрашивание срезов прямым методом люминесцирующих антител: на срезы наносят 2 капли флюоресцирующей листериозной сыворотки и препараты выдерживают во влажной камере (в чашках Петри с увлажненной фильтровальной бумагой) при комнатной температуре в течение 30 минут; препараты промывают 2 раза по 10 минут раствором 0,15 М хлорида натрия и 1 раз 10 минут дистиллированной водой, затем высушивают при температуре 35 - 40 °C в течение 15 - 20 минут.
7.5.6. Окрашивание срезов непрямым методом флюоресцирующих антител: на срезы наносят 1 - 2 капли поливалентной листериозной агглютинирующей кроличьей сыворотки, выдерживают в течение 60 минут во влажной камере при комнатной температуре; сыворотку смывают в течение одной минуты физиологическим раствором хлорида натрия. Остатки раствора удаляют со стекла фильтровальной бумагой; наносят 1 - 2 капли флюоресцирующей сыворотки против глобулинов кролика в рабочем разведении и выдерживают 30 минут при комнатной температуре в закрытых чашках Петри; препараты промывают 2 раза по 10 минут физиологическим раствором хлорида натрия и 10 минут дистиллированной водой, а затем высушивают в термостате при 35 - 40 °С в течение 15 - 20 минут.
7.5.7. Для люминесцентной микроскопии окрашенные препараты (как прямым, так и непрямым методами) заключают в буферную смесь из 1 части глицерина и 9 частей 0,15 М NaCl. Гистологические срезы накрывают покровным стеклом, на которое наносят одну каплю нефлюоресцирующего иммерсионного масла (или диметилфталата) и исследуют в люминесцентном микроскопе.
7.5.8. Для контрастирования фона препарата при окрашивании гистологических срезов можно применять совместно с флюоресцирующей сывороткой бычий альбумин, меченный родамином (согласно наставлению по его применению), который окрашивает исследуемую ткань и постороннюю микрофлору в оранжево-красный цвет (различных оттенков). На этом фоне листерии четко выделяются специфическим золотисто-зеленоватым свечением.
7.5.9. В качестве контроля при исследовании проб органов и тканей необходимо ставить контроли с нормальной сывороткой, а также во всех случаях проводить окрашивание культуры листерий люминесцирующей сывороткой.
7.5.10. Оценку интенсивности свечения листерий проводят согласно п. 4.6.2.2. Положительным результатом обнаружения листерий считается наличие светящихся клеток соответствующей для листерий морфологии, свечение которых оценивается на 4 и 3 креста.
8. Серологическая диагностика
Для серологического исследования берут пробы от животных любого возраста, подозреваемых в заболевании листериозом, а также от животных из поголовья, где заболевание подтверждено.
От каждого животного берут из яремной вены 5 - 10 см3 крови в стерильные пробирки или используют кровь, полученную при убое животного.
Из отобранных проб крови получают сыворотку методом отстоя. Для свертывания крови и отстаивания сыворотки пробирки с кровью выдерживают 30 - 60 мин при температуре 20 - 30 °C, а затем при температуре 4 - 10 °C. Сыворотка крови должна быть прозрачной, без признаков гемолиза.
Допускается консервировать сыворотку 5 %-ным раствором карболовой кислоты (1 - 2 капли на 1 см3 сыворотки) или сухой борной кислоты (2 % кислоты к объему сыворотки).
Неконсервированные сыворотки пригодны для исследования в течение 6 суток со дня взятия пробы, сыворотки консервированные - в течение 30 суток.
8.1. Реакция агглютинации
8.1.1. Реакцию агглютинации (РА) в диагностике листериоза применяют для исследования сывороток животных с целью обнаружения листериозных агглютинирующих макроглобулиновых (19S) и микроглобулиновых (7S) антител.
8.1.2. Результаты РА используют при постановке диагноза в комплексе с другими данными (бактериологическое исследование, эпизоотическая ситуация, клинические признаки, патологоанатомические изменения), а также для выявления скрыто больных и переболевших животных.
8.1.3. Компоненты реакции и условия их применения
8.1.3.1. Для исследования используют консервированные и неконсервированные сыворотки крови без признаков гнилостного распада и гемолиза.
8.1.3.2. В реакции применяют антигены первой и второй серогрупп, представляющие собой взвесь инактивированных листерий, выпускаемые в лиофилизированном виде. Перед применением необходимо добавить к ним физиологический раствор pH 7,2 в количестве, указанном на этикетке. Разведенные антигены можно хранить при 4° в течение 1,5 - 2 месяцев. Перед употреблением антигены тщательно встряхивают.
8.1.3.3. Для контроля используют первую и вторую серогрупповые агглютинирующие листериозные сыворотки, содержащие 19S- и 7S-антитела, а также нормальную (отрицательную) сыворотку.
8.1.3.4. Для дифференцирования 19S- и 7S-антител используют 2-меркаптоэтанол (2-МЭ) или солянокислый цистеин, которые избирательно разрушают макроглобулины (19S).
8.1.4. Постановка реакции агглютинации
8.1.4.1. Испытуемые сыворотки исследуют параллельно с двумя антигенами. При исследовании сывороток крупного рогатого скота и лошадей реакцию ставят в разведениях 1:160 и 1:320, овец, коз и свиней - 1:80 и 1:160, кроликов - 1:20 и 1:40. Разведения сывороток делают в физиологическом растворе.
8.1.4.2. Реакцию проводят в объеме 1 мл. При исследовании сывороток кроликов в первую пробирку наливают 0,9 мл физиологического раствора, во вторую - 0,5 мл. Затем в первую пробирку добавляют 0,1 мл сыворотки, перемешивают и переносят 0,5 мл во вторую пробирку. Из второй пробирки 0,5 мл смеси удаляют. Получают разведение сывороток 1:10 и 1:20. Затем в обе пробирки добавляют по 0,5 мл разведенного антигена. Получают разведение сывороток 1:20 и 1:40.
8.1.4.3. При исследовании сывороток крови крупного рогатого скота и лошадей сначала готовят основное разведение сыворотки - 1:40, для чего в пробирки наливают 0,1 мл сыворотки и 3,9 мл физиологического раствора. Затем из полученного разведения готовят рабочие разведения сыворотки: наливают в две пробирки по 0,5 мл физиологического раствора. В первую пробирку переносят 0,5 мл основного разведения сыворотки, перемешивают и 0,5 мл смеси переносят во вторую пробирку. Затем из нее удаляют 0,5 мл смеси, после чего в обе пробирки добавляют по 0,5 мл разведенного антигена. Получают разведение сывороток 1:160 и 1:320.
8.1.4.4. При исследовании сывороток крови овец, коз и свиней готовят основное разведение сыворотки - 1:20 (0,1 мл сыворотки + 1,9 мл физиологического раствора). Для приготовления рабочих разведений наливают в две пробирки по 0,5 мл физиологического раствора. В первую пробирку переносят 0,5 мл основного разведения сыворотки, перемешивают и 0,5 мл смеси из нее переносят во вторую пробирку. Из второй пробирки удаляют 0,5 мл смеси. Затем в обе пробирки добавляют по 0,5 мл разведенного антигена. Получают необходимое разведение сыворотки 1:80 и 1:160.
8.1.4.5. При постановке реакции с испытуемыми сыворотками одновременно ставят следующие контроли:
- с отрицательной сывороткой в тех же разведениях, как и испытуемые;
- с положительной агглютинирующей сывороткой соответствующего серовара, содержащей 7S-антитела, в разведении до ее предельного общего титра;
- 1 мл разведенного антигена первой серогруппы (одну пробирку) и 1 мл разведенного антигена второй серогруппы (одну пробирку) - для контроля антигена.
8.1.4.6. Пробирки с испытуемыми и контрольными сыворотками и антигенами выдерживают в термостате 18 - 20 часов при 37°, затем при комнатной температуре в течение 1,5 - 2 часов, после чего учитывают результаты реакции.
8.1.5. Учет и диагностическая оценка реакции
8.1.5.1. Результаты реакции оценивают в крестах по следующей схеме:
"++++" - полное просветление жидкости при наличии четко выраженного зонтика, который при встряхивании разбивается на мелкие хлопья, комочки;
"+++" - те же явления, но надосадочная жидкость слегка опалесцирует;
"++" - просветление жидкости выражено слабее, имеется недостаточно четко сформированный зонтик, при встряхивании разбивается на мелкие хлопья и крупинки;
"+" - незначительное просветление при наличии зонтика, при встряхивании - мелкие крупинки и комочки;
"-" - отрицательная, отсутствие просветления и зонтика.
8.1.5.2. Реакция признается положительной при обнаружении агглютинации с оценкой не менее чем на два креста в разведениях сыворотки 1:160 для овец, свиней и коз; 1:320 для крупного рогатого скота, лошадей; 1:40 для кроликов. Сыворотки, давшие отрицательную реакцию в указанных разведениях, подлежат дополнительной обработке 2-МЭ или солянокислым цистеином (см. пункты 8.1.6 - 8.1.7).
8.1.6. Обработка сывороток 2-МЭ
8.1.6.1. 2-МЭ - бесцветная жидкость, обладающая запахом, поэтому работу с 2-МЭ проводят в вытяжном шкафу. Рабочий раствор 2-МЭ готовят непосредственно перед применением, разводя исходный препарат дистиллированной водой согласно титру, указанному на этикетке флакона.
8.1.6.2. Сыворотки крови кроликов разводят физиологическим раствором 1:5 (0,2 мл сыворотки + 0,8 мл физиологического раствора), сыворотки овец, коз и свиней - 1:10 (0,1 мл сыворотки + 0,9 мл физиологического раствора), сыворотки крови крупного рогатого скота и лошадей - 1:20 (0,05 мл сыворотки + 0,95 мл физиологического раствора).
8.1.6.3. Затем к 1 мл разведенной сыворотки добавляют 1 - 2 капли рабочего разведения 2-МЭ. Пробирки плотно закрывают резиновыми пробками и помещают в водяную баню (37°) на 1 час. После этого сыворотку, обработанную 2-МЭ, разливают в 2 пробирки по 0,5 мл и в одну из них добавляют 0,5 мл разведенного антигена первой серогруппы, в другую - 0,5 мл разведенного антигена второй серогруппы. Получают разведение 1:10 для сывороток кроликов, 1:20 - овец, коз и свиней, 1:40 - для сывороток крови крупного рогатого скота и лошадей.
8.1.6.4. При постановке реакции с испытуемыми сыворотками одновременно ставят следующие контроли:
- с отрицательной сывороткой в том же разведении, как и испытуемые;
- с агглютинирующей сывороткой, содержащей 19S-антитела, в том же разведении, что и испытуемые;
- с агглютинирующей сывороткой, содержащей 7S-антитела, в разведении до предельного титра 7S-антител;
- 1 мл разведенного антигена первой серогруппы (одна пробирка) и 1 мл разведенного антигена второй серогруппы (одна пробирка) - для контроля антигена.
8.1.6.5. Агглютинирующие контрольные сыворотки обрабатывают 2-МЭ так же, как и испытуемые. Отрицательная сыворотка обработке 2-МЭ не подлежит.
8.1.6.6. Пробирки с контрольными и испытуемыми сыворотками и антигенами выдерживают в термостате 18 - 20 часов при 37°, затем при комнатной температуре 1,5 - 2 часа, после чего учитывают результаты реакции.
8.1.7. Обработка сывороток солянокислым цистеином
Раствор цистеина готовят непосредственно перед применением. Для получения рабочего раствора цистеина 35,1 мг препарата растворяют в 1 мл 0,2 М NaOH. Для приготовления 0,2 М раствора едкого натра растворяют 8 г реактива в 1 л дистиллированной воды.
Сыворотки крови кроликов разводят в 2,5 раза (0,2 мл сыворотки + 0,3 мл физраствора), сыворотки овец, коз и свиней - 1:5 (0,1 мл сыворотки + 0,4 мл физраствора), сыворотки крупного рогатого скота и лошадей - 1:10 (0,05 мл сыворотки + 0,45 мл физраствора). Затем к 0,5 мл разведенной сыворотки добавляют 0,5 мл рабочего раствора цистеина. Пробирки закрывают резиновыми пробками и выдерживают в течение 18 - 20 часов в термостате при 37°. После этого сыворотку, обработанную цистеином, разливают в 2 пробирки по 0,5 мл, в одну из них добавляют 0,5 мл разведенного антигена первой серогруппы, в другую - 0,5 мл разведенного антигена второй серогруппы. Получают разведение сыворотки 1:10 для кроликов, 1:20 - для овец, коз и свиней и 1:40 - для крупного рогатого скота и лошадей.
Контроли реакции ставят как при обработке сывороток 2-МЭ с последующим выдерживанием испытуемых и контрольных проб при 37° (18 - 20 часов) и при комнатной температуре (1,5 - 2 часа).
8.1.8. Учет и оценка реакции после обработки сывороток 2-МЭ или солянокислым цистеином
8.1.8.1. Реакция признается положительной при обнаружении агглютинации с оценкой не менее чем на два креста в сыворотках, обработанных 2-МЭ или цистеином, в разведении 1:10 для кроликов, 1:20 - для овец, коз и свиней, 1:40 - для крупного рогатого скота и лошадей. При этом контрольная агглютинирующая сыворотка, содержащая 19S-антитела, должна дать отрицательную реакцию в том же разведении, а контрольная сыворотка, содержащая 7S-антитела, - положительную реакцию в разведении до предельного титра 7S-антител.
8.1.8.2. При оценке реакции необходимо учитывать, что цистеин легко окисляется на воздухе, образуя мелкие крупинки, которые можно легко отличить от специфической агглютинации.
8.1.8.3. В заключении лаборатории о результатах исследования проб сывороток крови должна быть сообщена диагностическая оценка результатов исследования (положительная или отрицательная).
8.2. Реакция связывания комплемента
Реакция связывания комплемента (РСК) с листериозным антигеном применяется для исследования на листериоз сывороток крови всех видов животных и человека. Применение РСК не исключает применения других методов диагностики листериоза, однако ценность этой реакции состоит в том, что она ускоряет постановку диагноза и позволяет выявлять больных животных, не имеющих выраженных клинических признаков болезни (листерионосителей).
Реакцию ставят в водяной бане в общем объеме 1,0 мл всех компонентов при температуре 37 - 38°.
8.2.1. Компоненты реакции и условия их применения:
- гемолизин с рабочим титром не ниже 1:500; титрование гемолизина по общепринятой схеме проводят периодически 1 раз в 3 месяца, а также при получении каждой новой серии;
- листериозный антиген для РСК; применяют в рабочем титре, указанном на этикетке флакона; срок годности антигена - 2 года, при условии хранения его в темном прохладном месте (5 - 10 °C);
- позитивные листериозные сыворотки (ТУ 46-21-182-75); используют при титровании комплемента в бактериолитической системе и для контроля реакции в главном опыте после предварительной инактивации в день постановки реакции в разведении 1:10 в течение 30 минут при 56 - 60 °C (сыворотки крупного рогатого скота и свиней при 56 - 57 °C, лошадей и овец при 58 - 59 °C, кроликов - 60 °C);
Примечание: Обработка сывороток морских млекопитающих (ластоногих и китообразных) СО2 для снятия антикомплементарности с последующим традиционным прогреванием для инактивации комплемента изложена в приложении 10.3.
- нормальные сыворотки заведомо здоровых животных тех же видов, как и испытуемые; применяют при титровании комплемента в бактериолитической системе и для контроля реакции в главном опыте так же, как и позитивные сыворотки после предварительной инактивации при указанном режиме и в таких же дозах;
- комплемент сухой для РСК (ГОСТ 16446-78); применяется в титре, установленном в день постановки реакции путем титрования в бактериолитической системе;
- 2,5 %-ная взвесь эритроцитов барана в физиологическом растворе; лучше применять сенсибилизированные эритроциты (гемолитическую систему). Для сенсибилизации эритроцитов гемолитическую систему (смесь равных объемов 2,5 %-ной взвеси эритроцитов и рабочего разведения гемолизина) выдерживают в водяной бане при 37 - 38 °C в течение 20 минут; гемолитическую систему применяют в реакции в дозе 0,4 мл;
- физиологический раствор (0,85 %-ный) химически чистого хлорида натрия в дистиллированной воде, pH 7,0 - 7,2.
8.2.2. Титрование компонентов
Перед постановкой главного опыта проводят титрование компонентов реакции: гемолизина и комплемента в гемолитической и бактериолитической системах. Титрование гемолизина.
Гемолизин титруют в разведениях: 1:1000, 1:1200, 1:1500, 1:1800, 1:2000, 1:2500, 1:3000 и т.д., которые готовят из основного его разведения 1:100.
Комплемент используют в реакции в разведении 1:10 или 1:20 по 0,2 мл. Взвесь эритроцитов барана по 0,2 мл. Взамен антигена и сыворотки в пробирки прибавляют по 0,4 мл физиологического раствора. Время течения реакции - 10 минут в водяной бане при температуре 37 - 38 °C.
При титровании гемолизина ставят следующие контроли:
- гемолизин 1:100 с эритроцитами и физраствором в отсутствии комплемента;
- комплемент с эритроцитами и физраствором в отсутствии гемолизина;
- эритроциты с физраствором в отсутствии гемолизина и комплемента.
Во всех контролях гемолиз эритроцитов должен отсутствовать.
Титром гемолизина считается наименьшее количество его, потребное для полного гемолиза 0,2 мл взвеси эритроцитов при комплементе 0,2 мл в разведении 1:10 или 1:20.
Для титрования комплемента и постановки главного опыта гемолизин применяют в рабочем титре, который является четырехкратной дозой по сравнению с предельным титром. Например, если предельный титр равен 1:2000, то в реакции следует применять разведение 1:500, для чего к 1 мл гемолизина приливают 499 мл физиологического раствора (таблица 2).
Таблица 2
Титрование гемолитической сыворотки
|
№ пробирки |
Разведенная гемолитическая сыворотка (мл) |
2,5 %-ная взвесь эритроцитов |
Комплемент 1:20 (мл) |
Физиологический раствор(мл) |
Результат опыта |
|
|
1 |
0,2 (1:1000) |
0,2 |
0,2 |
0,4 |
|
Полный гемолиз |
|
2 |
0,2 (1:1200) |
0,2 |
0,2 |
0,4 |
||
|
3 |
0,2 (1:1500) |
0,2 |
0,2 |
0,4 |
||
|
4 |
0,2 (1:1800) |
0,2 |
0,2 |
0,4 |
||
|
5 |
0,2 (1:2000) |
0,2 |
0,2 |
0,4 |
|
|
|
6 |
0,2 (1:2500) |
0,2 |
0,2 |
0,4 |
|
Частичный гемолиз |
|
7 |
0,2 (1:3000) |
0,2 |
0,2 |
0,4 |
||
|
8 |
0,2 (1:3500) |
0,2 |
0,2 |
0,4 |
||
|
9 |
0,2 (1:4000) |
0,2 |
0,2 |
0,4 |
||
|
10 |
0,2 (1:5000) |
0,2 |
0,2 |
0,4 |
|
|
|
Контрольные |
0,2 (1:100) |
0,2 |
- |
0,6 |
|
Полная задержка гемолиза |
|
- |
0,2 |
0,2 |
0,6 |
|||
|
- |
0,2 |
- |
0,8 |
|||
Примечание: В данном примере предельный титр гемолитической сыворотки равен 1:2000, а для реакции следует применять ее в титре 1:500.
Титрование комплемента в гемолитической системе
Комплемент титруют в дозах 0,02, 0,04, 0,06 и т.д. (с интервалом по 0,02 мл) до 0,20 мл основного его разведения. В каждую пробирку к недостающему до 0,2 мл количеству основного разведения комплемента добавляют физиологический раствор: в первую пробирку 0,18 мл, во вторую 0,16 мл и т.д. После этого во все пробирки наливают по 0,4 мл физиологического раствора и по 0,4 мл гемолитической системы. Реакция должна сопровождаться контролями компонентов в смеси с эритроцитами (контроль гемолизина, контроль комплемента, контроль физраствора), а также контролем гемолитической системы при максимальной дозе комплемента (0,2 мл основного разведения). После тщательного смешивания компонентов путем встряхивания штативы с пробирками помещают на 10 минут в водяную баню при 37 - 38 °C.
Титром комплемента в гемолитической системе считается наименьшее его количество, необходимое для полного гемолиза в указанных условиях 0,2 мл взвеси эритроцитов при рабочей дозе гемолизина (таблица 3).
Если титр комплемента в гемолитической системе определяется дозой 0,18 мл и выше (основное разведение 1:20), то титрование в гемолитической системе повторяют, пользуясь основным разведением комплемента 1:10.
Таблица 3
Титрование комплемента в гемолитической системе
|
1. Комплемент в разведении 1:10 или 1:20 |
0,02 |
0,04 |
0,06 |
0,08 |
0,10 |
0,12 |
0,14 |
0,16 |
0,18 |
0,20 |
|
2. Физраствор до объема 0,2 мл |
0,18 |
0,16 |
0,14 |
0,12 |
0,10 |
0,08 |
0,06 |
0,04 |
0,02 |
0 |
|
3. Сенсибилизированные эритроциты барана (гемолитическая система) |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
|
4. Физраствор |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
|
Водяная баня при 37 - 38 °C в течение 10 минут |
||||||||||
|
Результат реакции |
||||||||||
|
|
ЗГ |
ЗГ |
ЧГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
Примечание:
ЗГ - задержка гемолиза;
ЧГ - частичная задержка гемолиза;
ПГ - полный гемолиз.
Титрование комплемента в бактериолитической системе
В бактериолитической системе комплемент титруют, начиная с дозы на один - два интервала ниже против его титра в гемолитической системе. Если титр комплемента в гемолитической системе определяется дозой 0,08 мл основного разведения, то в бактериолитической системе его титруют в дозах: 0,04; 0,06; 0,08; 0,10 и т.д. до 0,20 мл того же основного разведения.
Каждую дозу комплемента исследуют с двумя листериозными и с двумя нормальными сыворотками в присутствии антигена (в рабочем титре) и с контролем сывороток без антигена.
Инактивированные в разведении 1:10 листериозные и нормальные сыворотки разливают по 0,2 мл в пробирки соответствующих рядов.
Таким образом, в бактериолитической системе комплемент титруют в 8-ми рядах пробирок (по 9 пробирок в каждом ряду).
Требуемые разведения комплемента целесообразно готовить сразу для всего опыта титрования; с этой целью берут дополнительный ряд пробирок, в который разливают применяемые при титровании дозы комплемента в десятикратном объеме, т.е. - 0,4; 0,6; 0,8; 1,0 и т.д. до 2,0 мл. Недостающий до 2 мл объем жидкости в пробирках доливают соответствующим количеством физиологического раствора: 1,6; 1,4; 1,2; 1,0 и т.д. Приготовленные таким способом разведения комплемента разливают пипеткой или аппаратом Флоринского в соответствующие опытные пробирки по 0,2 мл: в первые пробирки всех 8-ми рядов из первого разведения (доза основного разведения 0,04 мл), во вторые пробирки всех 8-ми рядов из второго разведения (доза основного разведения 0,06 мл) и т.д. После разлива комплемента в первые ряды пробирок с листериозными и нормальными сыворотками наливают по 0,2 мл антигена в рабочем титре, во вторые -по 0,2 мл физиологического раствора. Компоненты смешивают энергичным встряхиванием штативов и помещают в водяную баню при 37 - 38° на 20 минут (связывание комплемента). Затем во все пробирки наливают по 0,4 мл гемолитической системы, компоненты смешивают и штативы снова помещают в водяную баню при 37 - 38° на 20 минут (фаза гемолиза).
Титром комплемента в бактериолитической системе является минимальное его количество, вызывающее полный гемолиз в пробирках с нормальными сыворотками с антигеном и без антигена, с листериозными сыворотками без антигена, при задержке гемолиза в пробирках с листериозной сывороткой и антигеном в течение 20 минут при 37 - 38 °C (таблица 4), что принимается за рабочий титр комплемента для главного опыта.
8.2.3. Главный опыт.
Разведение комплемента для главного опыта.
Количество чистого комплемента, необходимого для всего опыта, определяется по формуле:
![]()
где А - титр комплемента, установленный в баксистеме;
В - количество проб, подлежащих исследованию;
С - разведение комплемента.
Например, требуется произвести исследование 100 проб сывороток (с антигеном и без, т.е. 200 пробирок). Титр комплемента в бактериолитической системе 0,10 мл основного разведения 1:10.
Доза чистого комплемента равна 2,0 мл ![]() . Количество разведенного комплемента
для исследования 100 проб равно 40 мл (0,2×200), поэтому к 2,0 мл чистого
комплемента следует добавить 38,0 мл физраствора.
. Количество разведенного комплемента
для исследования 100 проб равно 40 мл (0,2×200), поэтому к 2,0 мл чистого
комплемента следует добавить 38,0 мл физраствора.
Основные условия постановки главного опыта.
Реакцию ставят в общем объеме 1,0 мл всех компонентов, т.е. каждый компонент применяют в объеме 0,2 мл. Испытуемые сыворотки исследуют с антигеном и без антигена в разведении 1:10 после предварительной инактивации в водяной бане при температуре 56 - 60 °C и выше, в зависимости от вида животных, в течение 30 минут. Комплемент применяют в установленном титре. Время связывания комплемента в бактериолитической системе - 20 минут, реакция гемолиза - 20 минут (в водяной бане при 37 - 38 °C).
Титрование комплемента в бактериолитической системе
|
1. Комплемент в основном разведении 1:10 |
0,04 |
0,06 |
0,08 |
0,10 |
0,12 |
0,14 |
0,16 |
0,18 |
0,20 |
|
2. Физраствор до объема 0,2 мл |
0,16 |
0,14 |
0,12 |
0,10 |
0,08 |
0,06 |
0,04 |
0,02 |
0 |
|
3. Антиген в рабочем титре (первый ряд пробирок) или физиологический раствор (второй ряд пробирок без антигена) |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
4. Нормальная сыворотка в разведении 1:10 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
Водяная баня при 37 - 38 °C в течение 20 минут |
|||||||||
|
5. Гемолитическая система |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
|
Водяная баня при 37 - 38 °C в течение 20 минут |
|||||||||
|
Результат реакции |
|||||||||
|
|
ЧГ |
ЧГ |
ЧГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
Примечание: ЧГ - частичный гемолиз; ПГ - полный гемолиз.
Основные контроли главного опыта:
- отрицательная и положительная (листериозная) сыворотки в разведении 1:10 с антигеном и без антигена;
- антиген на антикомплементарность и гемотоксичность (двойная доза антигена с комплементом в рабочем титре и без комплемента), компоненты смешивают и ставят в водяную баню на 20 минут, после чего добавляют гемолитическую систему по 0,4 мл и снова выдерживают в водяной бане в течение 20 минут;
- гемолитическая система с комплементом и без комплемента;
- комплемент в двойной дозе с эритроцитами без гемолизина.
8.2.4. Учет и оценка результатов реакции.
Результаты реакции оценивают по степени задержки гемолиза эритроцитов в крестах 2 раза: первый раз - тотчас после водяной бани, второй раз - через 14 - 18 часов выдерживания проб при комнатной температуре по следующей схеме:
"++++" (4 креста) - отсутствие гемолиза эритроцитов, надосадочная жидкость прозрачная;
"+++" (3 креста) - гемолиз 25 % эритроцитов;
"++" (2 креста) - гемолиз 50 % эритроцитов;
"+" (1 крест) - гемолиз 75 % эритроцитов;
"-" (минус) - полный гемолиз, осадок отсутствует.
Реакцию считают: положительной - при задержке гемолиза эритроцитов на 3 - 4 креста; сомнительной - при задержке гемолиза на 2 креста; отрицательной - при задержке гемолиза на 1 крест или полном гемолизе эритроцитов.
Животные, с сыворотками крови которых получены сомнительные реакции, подлежат повторному исследованию через 2 - 3 недели. При повторном получении сомнительной реакции результат исследования считают отрицательным.
8.3. Реакция непрямой гемагглютинации (РНГА) при листериозе людей и животных
8.3.1. Общие положения
8.3.1.1. РНГА с листериозным антигенным инактивированным эритроцитарным диагностикумом (ЭД) применяют при исследовании сывороток крови людей и животных для обнаружения листериозных антител с целью диагностики болезни.
8.3.1.2. РНГА рекомендуется для оперативных и диагностических серологических обследований с целью выявления закономерностей формирования противолистериозного иммунитета у различных групп людей и животных.
8.3.1.3. Определение возрастных, сезонных, профессиональных среднемноголетних колебаний уровня иммунитета является необходимым для всестороннего анализа напряженности эпизоотического и эпидемического процесса на конкретной географической территории.
8.3.1.4. РНГА используют для дифференциации противолистериозных 19S- и 7S-антител, что дает возможность отличить свежий инфекционный процесс от скрытого бактерионосительства и хронических малосимптомных форм заболевания.
8.3.1.5. РНГА также применяют для дифференциации поствакцинальных антител от постинфекционных.
8.3.1.6. РНГА - доступный, экономичный, легко воспроизводимый метод, позволяющий получать стандартные результаты и исследовать большое количество проб сывороток крови в весьма короткие сроки.
8.3.2. Компоненты реакции и условия их применения
8.3.2.1. Солевые растворы и их приготовление:
- физиологический раствор (pH 7,0 - 7,2) для растворения сухой гипериммунной листериозной кроличьей сыворотки: 8,5 г хлорида натрия на 1 л дистиллированной воды;
- 0,15 М фосфатный буферный раствор (pH 7,2) для приготовления исходных разведений исследуемых сывороток, 0,2 М раствора солянокислого цистеина и постановки РНГА: раствор 1 - 21,19 г двузамещенного фосфорнокислого натрия (Na2HPO4·2H2O), предварительно высушенного в течение 3 суток при 37 °C, растворяют в 1 л дистиллированной воды; раствор 2 - 20,41 г однозамещенного фосфорнокислого калия (KH2PO4) растворяют в 1 л дистиллированной воды. Для получения 100 мл фосфатного буферного раствора (pH 7,2) 76,1 мл раствора 1 смешивают с 23,9 мл раствора 2;
- раствор мертиолата для консервирования исследуемых сывороток: препарат растворяют в дистиллированной воде в соотношении 1:1000. Для консервирования сывороток используют приготовленный раствор мертиолата из расчета 1:10, т.е. конечная концентрация реактива должна составлять 1:10000.
8.3.2.2. Сухая гипериммунная листериозная кроличья сыворотка, используемая как положительный контроль, характеризующий чувствительность эритроцитарного диагностикума. Сыворотку растворяют физиологическим раствором до ее первоначального объема, указанного на этикетке ампулы.
8.3.2.3. 50 %-ная взвесь формалинизированных бараньих эритроцитов для адсорбции исследуемых сывороток, содержащих антитела к эритроцитам барана.
8.3.2.4. Сухие контрольные формалинизированные эритроциты барана, представляющие 0,33 %-ную взвесь после растворения в фосфатном буферном растворе (pH 7,2) в объеме, указанном на этикетке ампулы.
8.3.2.5. Сухой ЭД, представляющий формалинизированные эритроциты барана, сенсибилизированные инактивированным антигеном возбудителя листериоза. Антиген приготовлен из штамма листерий 9 - 127 первого серовара методом гидролиза предварительно высушенной в ацетоне бактериальной массы в фосфатном буферном растворе (pH 6,4).
Сухой ЭД и контрольные к нему эритроциты имеют вид пористой коричневой таблетки, которая при добавлении дистиллированной воды в течение 2 минут образует однородную взвесь коричневого цвета.
8.3.2.6. Для исследования используют свежие и консервированные сыворотки крови без признаков гнилостного распада и гемолиза.
8.3.2.7. Для дифференциации 19S- и 7S-антител, позволяющей отличить свежий инфекционный процесс от скрытого бактерионосительства и хронических малосимптомных форм заболевания, а также постинфекционное иммунное состояние от поствакцинального, используют 0,2 М раствор солянокислого цистеина. Его готовят перед использованием: 35,1 мг препарата растворяют в 1 мл 0,2 М раствора едкого натра.
8.3.2.8. Приготовление 0,2 М раствора едкого натра: 8 г реактива растворяют в 1 л фосфатного буферного раствора (pH 7,2).
8.3.3. Исследование сывороток крови людей и животных в РНГА
8.3.3.1. Подготовка сывороток к исследованию.
Испытуемые сыворотки крови людей и животных разводят 1:5 в пробирках 0,15 М фосфатным буферным раствором (pH 7,2) для выявления наиболее специфичных 7S-антител, а для выявления антител суммарной активности (19S- + 7S-антитела) сыворотки крови кроликов разводят 1:10, сыворотки крови людей - 1:40, мелкого рогатого скота и свиней - 1:80, а крупного рогатого скота - 1:160. До постановки РНГА разведенные сыворотки, предназначенные для обнаружения антител суммарной активности, сохраняют при 4 °C.
В пробирки с сыворотками, разведенными 1:5, вносят равный объем 0,2 М раствора солянокислого цистеина, получая исходное разведение 1:10. Эти пробирки закрывают резиновыми пробками и выдерживают при 37 °C 2 часа. После этого обработанные и необработанные раствором солянокислого цистеина сыворотки исследуют в РНГА.
8.3.3.2. Подготовка к работе эритроцитарного диагностикума.
Для получения 0,33 %-ной взвеси сенсибилизированных эритроцитов сухой препарат растворяют 0,5 мл дистиллированной воды и к полученному объему добавляют 5,5 мл 0,15 М фосфатного буферного раствора (pH 7,2). Эритроцитарный диагностикум выдерживают 20 минут, хорошо перемешивая, при комнатной температуре.
8.3.3.3. Постановка РНГА микрометодом.
Реакцию ставят в объеме 0,1 мл. В каждую лунку капельницей вносят по 0,05 мл 0,15 М фосфатного буферного раствора (pH 7,2). В первую лунку ряда прибавляют 0,05 мл исследуемой сыворотки в соответствующем разведении. С помощью микродилюторов по 0,05 мл сыворотки переносят из первой лунки во вторую, из второй в третью и т.д., т.е. готовят последовательные двукратные разведения. С целью выявления 7S-антител у людей и всех видов животных разведения в лунках должны соответствовать значениям 1:20 и 1:40. Для выявления антител суммарной активности пробы сывороток крови кроликов должны быть разведены в лунках с 1:20 до 1:80, людей - с 1:80 до 1:640, мелкого рогатого скота и свиней - с 1:160 до 1:640, а крупного рогатого скота - с 1:320 до 1:640. При получении положительных результатов определяется максимальный титр сывороток. После титрования в каждую лунку вносят по 0,05 мл 0,33 %-ной взвеси ЭД. Панели оставляют при комнатной температуре и через 3 - 4 часа проводят предварительный учет результатов, а окончательный учет осуществляют на следующий день. Можно учитывать результат однократно после выдерживания панелей при 4 °C в течение 16 - 18 часов.
8.3.3.4. Контроли, используемые в реакции:
- контроль ЭД и несенсибилизированных эритроцитов на отсутствие спонтанной агглютинации.
Для этого в одну лунку к 0,05 мл фосфатного буферного раствора (pH 7,2) добавляют 0,05 мл 0,33 %-ной взвеси ЭД, а в другую лунку к тому же количеству буферного раствора - 0,05 мл контрольных 0,33 %-ных несенсибилизированных эритроцитов;
- контроль специфичности РНГА для каждой исследуемой сыворотки.
Для этого к 0,05 мл исследуемой сыворотки в наибольшей для данного опыта концентрации добавляют 0,05 мл 0,33 %-ной взвеси несенсибилизированных эритроцитов.
Во всех указанных случаях контроли должны быть отрицательными, т.е. агглютинации не должно быть. В случае положительного контроля исследуемой сыворотки ее адсорбируют 50 %-ной взвесью формалинизированных эритроцитов барана согласно п. 8.3.3.5;
- контроль чувствительности эритроцитарного диагностикума: титруют в объеме 0,05 мл гипериммунную листериозную кроличью сыворотку до титра, указанного на этикетке ампулы; в каждую лунку добавляют 0,05 мл 0,33 %-ной взвеси ЭД. С учетом результатов серологических реакций в дальнейшем может быть использован ЭД, дающий реакцию с листериозной сывороткой не менее 1/3 ее предельного титра (положительный контроль).
8.3.3.5. В случае необходимости адсорбции исследуемых сывороток бараньими эритроцитами к 1 мл сыворотки добавляют 2 капли (0,1 мл) 50 %-ной взвеси формалинизированных эритроцитов. Смесь встряхивают и выдерживают 30 минут при 37 °C или 60 минут при 20 - 22 °C либо 18 часов при 4 °C. Сыворотку центрифугируют при 1,5 тыс. оборотов в мин в течение 10 минут или отстаивают, после чего проводят ее повторное исследование в РНГА.
8.3.3.6. При использовании макрометода РНГА ставят в объеме 0,4 мл. В каждую лунку пипеткой вносят по 0,2 мл 0,15 М фосфатного буферного раствора (pH 7,2). В первую лунку ряда прибавляют 0,2 мл исследуемой сыворотки в соответствующем разведении. С помощью пипеток переносят по 0,2 мл сыворотки из первой лунки во вторую, из второй в третью и т.д., т.е. готовят последовательные двукратные разведения (п. 8.3.3.3). После титрования в каждую лунку вносят по 0,2 мл 0,33 %-ной взвеси эритроцитарного диагностикума. Учет результатов проводят так же, как и при микрометоде (п. 8.3.4).
8.3.4. Учет и оценка РНГА
8.3.4.1. Учет результатов реакции проводят по четырехплюсовой системе:
"++++" - эритроциты покрывают все дно лунки ровным слоем, наблюдается картина "зонтика" с ровными краями;
"+++" - эритроциты покрывают дно лунки "зонтиком" несколько меньшего размера;
"++" - маленький "зонтик" с неровными краями и "пуговкой" в центре;
"+" - "пуговка" в центре лунки, имеются отдельные зерна агглютината;
"-" - "пуговка" с ровными четко очерченными краями.
8.3.4.2. Реакция считается положительной, если наблюдается агглютинация на три и четыре плюса.
8.3.4.3. Оценку результатов РНГА проводят согласно титрам, указанным в таблице 5, с учетом антител суммарной активности и ZS-антител:
Таблица 5
|
Исследуемые сыворотки |
Положительные результаты |
Сомнительные результаты |
||
|
титр антител суммарной активности |
титр 7S-антител |
титр антител суммарной активности |
титр 7S-антител |
|
|
Люди |
1:640 |
1:40 |
1:320 |
1:20 |
|
1:640 |
1:20 |
1:320 |
- |
|
|
1:640 |
- |
|
|
|
|
1:320 |
1:40 |
1:160 |
1:20 |
|
|
1:160 |
1:40 |
1:80 |
1:20 |
|
|
1:80 |
1:40 |
|
|
|
|
- |
1:40 |
|
|
|
|
Крупный рогатый скот |
1:640 |
1:40 |
1:320 |
1:40 |
|
1:640 |
1:20 |
1:320 |
1:20 |
|
|
1:640 |
- |
|
|
|
|
Мелкий рогатый скот |
1:640 |
1:40 |
1:320 |
1:20 |
|
1:640 |
1:20 |
1:320 |
- |
|
|
1:640 |
- |
1:160 |
1:20 |
|
|
1:320 |
1:40 |
|
|
|
|
1:160 |
1:40 |
|
|
|
|
Свиньи |
1:640 |
1:40 |
1:160 |
1:20 |
|
1:640 |
1:20 |
1:160 |
- |
|
|
1:640 |
- |
|
|
|
|
1:320 |
1:40 |
|
|
|
|
1:320 |
1:20 |
|
|
|
|
1:320 |
- |
|
|
|
|
1:160 |
1:40 |
|
|
|
|
Кролики |
1:80 |
1:40 |
1:40 |
1:20 |
|
1:80 |
1:20 |
1:40 |
- |
|
|
1:80 |
- |
1:20 |
1:20 |
|
|
1:40 |
1:40 |
|
|
|
8.3.4.4. Во всех случаях более достоверные результаты могут быть получены при исследовании парных сывороток.
Для определения динамики нарастания антител суммарной активности первое исследование проводят на 8 - 9 день от начала болезни, а второе - на 16 - 18 день.
Для определения динамики нарастания 7S-антител первое исследование проводят также на 8 - 9 день от начала болезни, а второе - через 21 - 30 дней.
Нарастание титра антител суммарной активности в 4 и более раза, а 7S-антител - в 2 и более раза подтверждает диагноз листериоза.
8.3.4.5. Примерные значения титров антител суммарной активности и 7S-антител по срокам болезни указаны в таблице 6:
Таблица 6
|
Сроки болезни |
Значения титров |
|
|
антител суммарной активности |
7S-антител |
|
|
8 - 9 день |
1:20 - 1:160 |
0 |
|
16 - 18 день |
1:320 и более |
0 - 1:40 |
|
21 - 30 день |
1:160 и менее |
1:20 и более |
8.3.4.6. Наиболее специфичные 7S-антитела сохраняются в сыворотке крови людей и животных более трех месяцев, что дает возможность проводить ретроспективный анализ исследуемого материала.
9. Л-формы листерий и методы их обнаружения
Листерии существуют как в классической бактериальной форме, так и в виде Л-форм. Процесс Л-трансформации бактерий представляет собой широко распространенную биологическую закономерность. Возникают Л-формы под влиянием различных неблагоприятных воздействий и в дальнейшем проявляют высокую устойчивость к факторам, вызвавшим их появление. Частично или полностью утрачивая фрагменты клеточной стенки, Л-формы могут сохранять свою жизнеспособность в условиях, при которых невозможно существование классических бактериальных форм. В результате Л-трансформации в значительной степени изменяются биологические свойства микроорганизмов, что в свою очередь отражается на клиническом течении болезней, затрудняет их диагностику, а в ряде случаев может изменить характер эпидемического и эпизоотического процессов.
Листерии трансформируются в Л-форму под влиянием антибиотиков пенициллинового ряда, тетрациклина, факторов специфической и неспецифической резистентности организма (иммунной сыворотки, комплемента, глицина, лизоцима) и т.д. Трансформация происходит, когда перечисленные агенты не оказывают достаточного бактериостатического или бактерицидного эффекта. Л-формы, сохранившие фрагменты клеточной стенки, относятся к сферопластному типу. Л-формы, лишенные полностью клеточной стенки, принадлежат к протопластному типу.
При исключении фактора, вызывающего Л-трансформацию, Л-формы могут реверсировать в бактериальную культуру. Реверсирующие Л-формы называются нестабильными, а нереверсирующие - стабильными. Чаще реверсируют Л-формы листерий сферопластного типа.
9.1. Биологические свойства Л-форм листерий
9.1.1. Морфология.
Л-формы листерий имеют существенные морфологические различия с бактериальной формой возбудителя. Они состоят из разнообразных морфологических структур: шаровидных тел и тел неправильной конфигурации, вакуолизированных, гранулярных, зернистых форм и субмикроскопических (фильтрующихся) элементов. Все структуры связаны между собой цепью определенных взаимопревращений и способны к репродукции, размеры их варьируют от 5 - 8 до 0,15 - 0,2 мкм, что обусловливает возможность прохождения Л-форм через бактериальные фильтры. Л-формы листерий не отличаются по морфологии от Л-форм других бактерий, что исключает возможность использования этого теста в качестве дифференциального.
9.1.2. Культуральные свойства
Л-формы листерий растут на полутвердых (1,3 %), полужидких (0,3 %) и жидких питательных средах. Для поддержания их жизнедеятельности и активной репродукции в среды добавляют 2 - 2,5 % хлорида натрия и 2 - 5 % нормальной лошадиной сыворотки без консерванта. При культивировании нестабильных Л-форм (в отличие от стабильных) в среды дополнительно вносят антибиотики или другие Л-трансформирующие агенты, дозы которых избирательно подбираются в каждом конкретном случае. Оптимальная температура выращивания Л-форм листерий 30 °C, но они также хорошо растут при 20 - 37 °C. На 1,3 %-ном агаре Л-формы формируют типичные Л-колонии с оптически плотным гомогенным центром и ажурной периферией. В бульоне они растут в виде изолированных колоний или вызывают равномерное помутнение среды.
9.1.3. Биохимическая активность
Несмотря на то, что морфология (данные светооптического исследования) и питательные потребности нестабильных и стабильных Л-форм листерий одинаковы, их биохимическая активность различна. Нестабильные Л-формы обычно ферментируют те же дифференциально-диагностические среды, что и бактериальные формы, но кислотообразование у них замедленное. Ферментативная активность стабильных Л-культур может в значительной степени снижаться, вплоть до полной ее утраты в отношении некоторых сахаров и спиртов. Сахаролитическая активность Л-форм листерий, подверженная значительным вариациям, не имеет решающего значения при их идентификации. Однако другие биохимические тесты, такие как каталазная активность и использование глюкозы по гексозомонофосфатному пути, постоянно присущи Л-формам листерий, независимо от степени их стабилизации, и могут быть использованы при идентификации любых форм возбудителя листериоза.
9.1.4. Антигенность и иммуногенность
Антигенность и иммуногенность Л-форм листерий обусловлены наличием или отсутствием у них фрагментов клеточной стенки.
В антигенном отношении Л-формы сферопластного типа более близки бактериальным формам, чем Л-формы протопластного типа. Чем выше степень сохранности фрагментов клеточной стенки у Л-форм сферопластного типа, тем больше выражено их антигенное родство с бактериальными формами. В этих случаях они могут взаимодействовать с антибактериальной сывороткой в непрямом методе флюоресцирующих антител (НМФА) и в непрямом методе пероксидазных антител (НМПА), окрашиваясь на 3 и 4 креста.
Если степень сохранности фрагментов клеточной стенки у Л-форм сферопластного типа незначительна, то результаты НМФА и НМПА с антибактериальной сывороткой будут отрицательными или сомнительными.
Л-формы листерий протопластного типа не выявляются антибактериальной сывороткой в НМФА и НМПА. Несмотря на значительные изменения антигенных свойств листерий в процессе Л-трансформации между бактериальными формами и их Л-формами сохраняется определенная общность антигенного строения (таблица 7), которая выявляется в реакциях агглютинации (РА), связывания комплемента (РСК) и диффузионной преципитации в геле (РДП).
Степень сохранности фрагментов клеточной стенки определяет иммуногенность Л-форм листерий. Л-формы протопластного типа обладают наименьшей иммуногенной активностью.
Гипериммунные сыворотки против Л-форм протопластного типа обычно взаимодействуют с гомологичными Л-антигенами в РА 1:80 - 1:160 и РДП 1:8 - 1:16, а с антигеном исходной бактериальной формы взаимодействуют в РА 1:10 - 1:40, РДП 1:2 - 1:8 и РСК 1:10.
9.1.5. Патогенность
9.1.5.1. Вирулентные свойства
Нереверсирующие Л-формы сферопластного типа в условиях эксперимента вызывают в организме чувствительных животных изменения, характерные для инфицирования бактериальными культурами листерий. При гистологическом исследовании патологического материала при спонтанном листериозе от погибших людей (детей) и от животных, в органах которых бактериологическими методами были выявлены Л-формы листерий (НМФА они определены как Л-формы сферопластного типа), также обнаруживают изменения, типичные для листериозной инфекции. При нервной форме болезни они характеризуются развитием энцефалита с хорошо выраженным пролиферативным компонентом, наличием отека, дегенерации нейронов и нейронофагии. При септической форме болезни в печени, селезенке, надпочечниках, кишечнике образуются гранулемы, состоящие из клеток лимфоидного и гистиоцитарного типа.
Антигенные связи клеточных компонентов бактериальной формы листерий и их Л-форм сферопластного и протопластного типов
|
Антиген |
Иммунная сыворотка против |
Реакции |
||||
|
РА |
РДП |
РСК |
НМФА |
НМПА |
||
|
Бактериальная форма |
Бактериальной формы |
+ |
+ |
+ |
+ |
+ |
|
Л-форм протопластного типа |
± |
+ |
+ |
- |
- |
|
|
Л-формы сферопластного типа |
Бактериальной формы |
+ |
+ |
0 |
± |
± |
|
Л-форм протопластного типа |
+ |
+ |
0 |
± |
± |
|
|
Л-формы протопластного типа |
Бактериальной формы |
+ |
+ |
0 |
- |
- |
|
Л-форм протопластного типа |
+ |
+ |
0 |
+ |
+ |
|
Обозначения: "+" - результат положительный;
"-" - результат отрицательный;
"+" - результат сомнительный;
"0" - реакцию не ставили, так как антиген Л-форм антикомплементарен.
Иным патогенетическим действием обладают Л-формы листерий протопластного типа, не дающие реверсии в условиях организма. Они не вызывают гибели куриных эмбрионов и конъюнктивальной реакции у морских свинок, однако при внутрикожном введении развивается некроз на месте инъекции. Мыши не являются чувствительной моделью для выявления вирулентных свойств стабильных Л-форм листерий протопластного типа. Они не проявляют клинически выраженных признаков заболевания при внутривенном, внутрибрюшинном, внутримозговом и подкожном методах заражения. Кортикостероиды не повышают чувствительность мышей к Л-формам листерий.
К экспериментальному инфицированию стабильными Л-формами листерий протопластного типа чувствительны ягнята. Продолжительность инкубационного периода может исчисляться от нескольких суток до 2-х месяцев. Картина болезни, время ее проявления, а также сроки гибели животных значительно варьируют в зависимости от индивидуальных особенностей организма. В одних случаях Л-формы листерий вызывают нервную форму листериоза, как правило, заканчивающуюся летальным исходом, в других случаях те же дозы возбудителя обусловливают развитие незначительных патологических изменений обратимого характера.
При нервной форме экспериментального листериоза, вызванной стабильными Л-формами листерий, у ягнят нарушается координация движений, появляется "вертячка", перед гибелью развиваются клонические и тонические судороги мышц шеи, туловища, конечностей. Температура тела, как правило, остается в пределах нормы.
Приведенные данные свидетельствуют о том, что при экспериментальном инфицировании стабильными Л-формами листерий протопластного типа у ягнят в ряде случаев развивается классическая нейросимптоматика, характерная для спонтанного течения инфекции, которую обычно не удается моделировать при инфицировании овец бактериальными культурами.
9.1.5.2. Некоторые особенности патологических изменений, развивающихся в организме при инфицировании стабильными Л-формами протопластного типа. Клиническая картина нервной формы листериоза является однотипной как для спонтанного листериоза, так и для экспериментального, воспроизводимого Л-формами листерий протопластного типа. Однако в последнем случае патоморфологическая картина имеет свои особенности. При инфицировании Л-формами протопластного типа в головном и спинном мозге отсутствует пролиферативный компонент воспалительной реакции и на первый план выступают дистрофические и некротические поражения. Наиболее интенсивные изменения локализуются в коре больших полушарий, мозжечке, продолговатом мозге и хвостатом теле. Для поражений мозга характерны гиперемия сосудов и явления стаза, мелкие диапедезные кровоизлияния. Многие нервные клетки находятся в состоянии сильного отека, набухания, цитолиза и кариолизиса. В спинном мозге, кроме аналогичных дистрофических изменений со стороны нервных клеток, выявляют также изменения глиальных клеток. В сером веществе мозга обнаруживают кровоизлияния.
Таким образом, у ягнят развиваются изменения, которые можно отнести к энцефалопатии с распространенными дистрофическими поражениями центральной нервной системы, резким расстройством гемодинамики и почти полным отсутствием воспалительной клеточной реакции.
При летальном исходе дистрофические изменения обнаруживают также в печени, почках, надпочечниках, лимфоидной ткани. В селезенке и лимфатических узлах исчезают реактивные центры, происходит редукция фолликулов и вторичных узелков. У ягнят выявляют полную атрофию костного мозга. В синтиции ретикулярной стромы костного мозга остаются единичные клетки на фоне расширенных капилляров и мелких кровеносных сосудов.
При энцефалопатической форме листериоза, особенно если клиническая картина болезни возникла в отдаленные сроки после заражения, специфические антитела (агглютинины, комплементсвязывающие антитела, преципитины), как правило, отсутствуют. Они не выявляются ни антигеном Л-форм, ни бактериальным антигеном. Показатели лейкоформулы в это время резко изменены. Базофилы, эозинофилы и моноциты исчезают. Число лимфоцитов резко снижено, они дегенеративны. Элементы белой крови представлены в основном нейтрофилами, которые также претерпевают дегенеративные изменения. На рис. 1 изображен лейкоцитарный профиль, типичный для овец, больных нервной формой листериоза, в результате экспериментального инфицирования Л-формами листерий протопластного типа.
Таким образом, в процессе Л-трансформации изменяются морфологические, культуральные, биохимические, иммуногенные и вирулентные свойства листерий. Чем больше степень утраты возбудителем клеточной стенки, тем значительнее эти изменения. Трансформация листерий в Л-форму при спонтанном листериозе объясняет трудность обнаружения возбудителя обычными бактериологическими методами. При естественной листериозной инфекции Л-формы сферопластного типа вызывают в органах хозяина патологические изменения с хорошо выраженным пролиферативным компонентом, которые характерны для листериоза, обусловленного бактериальными формами. В тех случаях, когда возбудитель трансформируется в Л-формы протопластного типа, в организме имеют место дистрофические и некробиотические изменения при почти полном отсутствии пролиферативных явлений. Л-формы листерий протопластного типа являются индукторами энцефалопатической формы листериоза. В настоящее время энцефалопатии листериозной этиологии у людей и животных еще мало известны и почти не изучены.
Пониженная иммуногенная активность Л-форм листерий (особенно протопластного типа) и их способность вызывать атрофию лимфоидной ткани хозяина могут явиться причиной наличия низких титров специфических антител (или отсутствия их) при нервной форме листериоза человека и животных. В подобных случаях исследования сывороток крови в РА, РСК, РДП могут быть неэффективными, необходима бактериологическая диагностика.
Рис.1 Лейкоцитарный профиль овцы
Обозначения: - до заражения
------ при нервной форме листериоза после введения
стабильных Л-форм листерий
Прямоугольниками отмечены границы нормы
абсолютного количества различных видов лейкоцитов
9.2. Методы обнаружения Л-форм листерий
Методы обнаружения Л-форм листерий включают посевы патологического материала на питательные среды и идентификацию выделенных культур иммунофлюоресцентным или иммунопероксидазным методами.
9.2.1. Микробиологическое исследование
Из органов и тканей делают посевы на среды, обычно используемые для выделения бактериальных форм листерий (мясопептонный или мясопептонный печеночный агар (МПА, МППА) или бульон (МПБ, МППБ) с добавлением 1 % глюкозы и 2 - 3 % глицерина, pH 7,2 - 7,4), и на полутвердые и жидкие Л-среды для культивирования Л-форм листерий в условиях лаборатории - 1,3 %-ный МПА (МППА) и бульон, содержащие 2 % хлорида натрия и 2 % нормальной лошадиной сыворотки без консерванта.
При отрицательном результате первичного посева рекомендуется сохранять патологический материал в холодильнике при 4 °C в течение 30 дней и проводить повторные исследования через каждые 10 дней.
Посевы инкубируют в течение 3 - 4 суток при 30° или 37 °C. При отсутствии роста срок наблюдения увеличивают до 1 - 1,5 месяца, но посевы при этом выдерживают при комнатной температуре (20 - 22 °C).
Л-формы листерий при первичном посеве из организма могут вырастать не только на Л-среде, но и на обычных бактериальных средах, однако дальнейшие пересевы их, как правило, не удаются.
Выросшие на агаре Л-колонии листерий при визуальном просмотре похожи на бактериальные колонии этого возбудителя и в проходящем свете также имеют голубую окраску с зеленоватым оттенком. Однако при просмотре в микроскопе (объектив ×10) колонии Л-форм имеют не мелкозернистую, характерную для бактериальных колоний, а кружевную структуру. Нередко Л-формы листерий формируют классические Л-колонии, для которых типичен уплотненный, врастающий в агар центр и более светлая ажурная периферия. Величина колоний варьирует от 0,1 до 1 - 2 мм в диаметре. В жидкой среде Л-формы также могут расти в виде изолированных колоний.
Л-формы листерий обладают каталазной активностью. Выделенные культуры изучают в фазово-контрастном микроскопе, окрашивают по Граму и исследуют иммунофлюоресцентным или иммунопероксидазным методами.
Для окраски по Граму культуру Л-форм наносят на хорошо обезжиренные предметные стекла, подсушивают на воздухе и фиксируют на пламени. Окрашивать по Граму можно изолированные колонии агаровой культуры Л-форм либо бульонную культуру, если в жидкую среду пересевали колонии с агара. Нельзя окрашивать по Граму бульонную культуру (если в среду засевали суспензию органов) и мазки-отпечатки органов, так как при этом возможны артефакты.
При окраске по Граму большинство структур Л-форм листерий грамположительны, но могут встречаться и единичные грамотрицательные структуры. Иногда при посеве в бульон изолированных бактериальных колоний листерий происходит спонтанная трансформация их в Л-форму и при окраске по Граму в мазке выявляются различной величины нередко вакуолизированные шаровидные структуры.
По чувствительности выявления Л-формы листерий в мазках-отпечатках органов и мазки культур Л-форм иммунофлюоресцентный и иммунопероксидазный методы практически равноценны. Различия их состоят в том, что в одном случае в качестве маркера антител применяют изотиоционат флюоресцеина (ФИТЦ), а в другом случае -фермент пероксидазу, который выявляют с помощью 3,3-диаминобензидина тетрахлорида, при этом комплекс антиген-антитело окрашивается в темно-коричневый цвет.
Преимуществами иммунопероксидазного метода является слабое фоновое окрашивание препаратов, возможность их исследования в световом микроскопе и возможность хранения в течение длительного времени, а также возможность одновременного исследования препаратов морфологическими и иммунологическими методами.
Для выявления Л-форм листерий сферопластного типа с хорошо выраженной клеточной стенкой можно использовать сыворотку против бактериальных форм листерий, поэтому постановка реакции осуществляется в условиях любой бактериологической лаборатории. Л-формы листерий протопластного типа не выявляются антибактериальной сывороткой. Для работников научноисследовательских учреждений в приложениях 10.4 и 10.5 изложены схема получения гипериммунных сывороток против стабильных Л-форм листерий протопластного типа и метод выделения из них глобулиновой фракции, используемой в работе.
9.2.2. Окраска по непрямому методу флюоресцирующих антител (НМФА)
Для постановки реакции необходимы:
- поливалентная антибактериальная (против листерий 1-ой и 2-ой серогрупп) сыворотка кролика (для выявления бактериальных форм и Л-форм сферопластного типа) и глобулиновая фракция гипериммунной сыворотки кролика против Л-форм листерий протопластного типа (для выявления Л-форм протопластного типа);
- антитела диагностические против Jg кролика, меченные ФИТЦ;
- химически чистый ацетон;
- забуференный физиологический раствор pH 7,2 - 7,4;
- глицерин на забуференном физрастворе pH 7,2 - 7,4 (1 часть глицерина нейтрального и 9 частей забуференного физраствора);
- дистиллированная вода;
- нефлюоресцирующее иммерсионное масло или химически чистый диметилфталат;
- тонкие обезжиренные предметные стекла.
Мазки-отпечатки из органов высушивают на воздухе и фиксируют в течение 30 минут в химически чистом ацетоне. Мазки из культуры Л-форм фиксируют на пламени. После фиксации мазки делят на две группы - на 1 этапе на одни мазки наносят поливалентную антибактериальную сыворотку кролика (в рабочем разведении), на другие наносят немеченый глобулин сыворотки кролика против Л-форм протопластного типа листерий в разведении 1:4 (глобулины разводят забуференным физраствором pH 7,2 - 7,4);
- инкубируют во влажной камере при 37 °C в течение 1 часа;
- препараты трижды промывают в забуференном физиологическом растворе (каждое промывание по 10 минут), ополаскивают в дистиллированной воде и высушивают на воздухе;
- наносят антикроличью сыворотку, меченную ФИТЦ, в рабочем (не ниже 1:16) разведении (II этап);
- инкубируют во влажной камере при 37 °C в течение 30 минут;
- препараты в течение 30 минут трижды промывают в забуференном физрастворе, ополаскивают дистиллированной водой и высушивают на воздухе;
- на окрашенные препараты наносят глицерин на забуференном физрастворе, накрывают покровным стеклом, на которое наносят нефлюоресцирующее иммерсионное масло и исследуют в люминесцентном микроскопе.
При исследовании материала необходимо ставить контроли, указанные в таблице 8. Препараты-отпечатки органов для уменьшения неспецифического свечения ткани следует окрашивать методом контрастирования. С этой целью на мазки наносят смесь люминесцирующей сыворотки и бычьего альбумина, меченного родамином, в соответствии с Временным наставлением по его применению. Меченый альбумин окрашивает ткани в оранжево-красный цвет.
Таблица 8
Контроли, необходимые при постановке НМФА и НМПА
|
№№ п/п |
Антиген |
Реагент 1-го этапа |
Реагент 2-го этапа |
Результат |
|
1 |
Гомологичный: |
Гомологичные антитела |
|
|
|
|
а) бактериальная форма |
поливалентная антибактериальная сыворотка кролика |
Меченые антитела против глобулинов кролика |
Положительный |
|
|
б) Л-формы протопластного типа |
глобулин сыворотки кролика против Л-форм протопластного типа |
- " - |
- " - |
|
2 |
Гомологичный |
Забуференный физиологический раствор |
Меченые антитела против глобулинов кролика |
Отрицательный |
|
3 |
Гомологичный |
Гомологичные антитела |
Забуференный физиологический раствор |
- " - |
|
4 |
Гомологичный |
Нормальные антитела(глобулины) кролика |
Меченые антитела против глобулинов кролика |
- " - |
|
5 |
Гетерологичный: |
|
|
|
|
|
а) возбудитель рожи свиней (бактериальная форма) |
поливалентная листериозная антибактериальная сыворотка кролика |
- " - |
- " - |
|
|
б) стабильные Л- формы стрептококка или стафилококка |
глобулин сыворотки кролика против Л-форм листерий протопластного типа |
- " - |
- " - |
Целесообразно сочетать просмотр препаратов одного и того же поля зрения одновременно в люминесцентном микроскопе (освещение сверху) и в фазовоконтрастном устройстве (освещение снизу).
Для оценки интенсивности свечения используется четырехкрестовая система:
"++++" - яркая, изумрудно-зеленая люминесценция бактерий или различных по морфологии и величине структур Л-форм, часто свечение по периферии более интенсивное;
"+++" - отчетливо выраженная, достаточно яркая зеленая люминесценция, периферический ободок хорошо выражен;
"++" - недостаточно яркая желтовато-зеленоватая люминесценция, периферический ободок еле заметен;
"+" - люминесценция слабая, желтая.
Положительным результатом считается люминесценция клеток на 4 и 3 креста при наличии в каждом поле зрения не менее 2 - 5 специфически светящихся бактерий или полиморфных структур Л-форм различной величины.
9.2.3. Окраска по непрямому методу пероксидазных антител (НМПА)
Для постановки реакции необходимы:
- поливалентная антибактериальная (против листерий 1-ой и 2-ой серогрупп) сыворотка кролика и глобулиновая фракция гипериммунной сыворотки кролика против Л-форм листерий протопластного типа;
- антитела диагностические против Jg кролика, меченные пероксидазой;
- химически чистый ацетон;
- 0,5 %-ный раствор перекиси водорода в метаноле;
- забуференный физиологический раствор pH 7,2 - 7,4;
- сыворотка крупного рогатого скота, разведенная физиологическим раствором 1:5;
- 0,05 %-ный свежеприготовленный раствор 3,3-диаминобензидина тетрагидрохлорида (ДАБ), содержащий 0,3 % перекиси водорода. Приготовление раствора ДАБ: 5 мг 3,3-диаминобензидина тетрагидрохлорида растворяют в 10 мл забуференного физиологического раствора и добавляют 0,3 % перекиси водорода в конечном разведении.
Для иммунопероксидазного исследования патологического материала из паренхиматозных органов и головного мозга готовят мазки-отпечатки. После высушивания на воздухе их фиксируют в течение 30 минут в химически чистом ацетоне. Мазки культур Л-форм фиксируют на пламени. После фиксации для инактивирования эндогенной пероксидазы препараты обрабатывают свежеприготовленным 0,5 %-ным раствором перекиси водорода в метаноле в течение 30 минут;
- промывают в забуференном физиологическом растворе в течение 15 минут;
- обрабатывают в течение 10 минут сывороткой крупного рогатого скота, разведенной 1:5 (блокируют неспецифическое фоновое окрашивание ткани), высушивают фильтровальной бумагой.
Мазки делят на две группы - на 1 этапе на одни мазки наносят поливалентную антибактериальную сыворотку кролика (в рабочем разведении), на другие - немеченый глобулин антисыворотки кролика против Л-форм листерий протопластного типа в разведении 1:4 (разводят глобулины забуференным физиологическим раствором pH 7,2 - 7,4);
- инкубируют во влажной камере при 37 °C в течение 1 часа;
- препараты трижды промывают в забуференном физрастворе (каждое промывание по 10 минут), ополаскивают в дистиллированной воде и высушивают на воздухе;
- наносят в рабочем разведении антисыворотку к Jg кролика, меченную пероксидазой (II этап);
- инкубируют во влажной камере при 37 °C в течение 30 минут;
- промывают забуференным физраствором и окрашивают в течение 10 минут 0,05 %-ным свежеприготовленным, содержащим 0,3 % перекиси водорода, раствором ДАБ;
- препараты в течение 30 минут промывают в проточной воде, заключают в бальзам и просматривают в световом микроскопе.
Контроли, необходимые при постановке реакции, указаны в таблице 8.
При положительном результате на желтоватом фоне бактериальные формы и структуры Л-форм окрашиваются в коричневый или темно-коричневый цвет.
9.3. Предварительный диагноз ставят на основании комплекса эпизоотологических данных, клинических признаков, патологоанатомических и гистологических изменений, а также при наличии возбудителя в мазках-отпечатках органов.
9.4. Окончательный диагноз на листериоз устанавливают в случае выделения возбудителя (бактериальной формы, нестабильной или стабильной Л-формы). Стабильные Л-формы листерий, не давшие реверсии, должны быть идентифицированы иммунофлюоресцентным или иммунопероксидазным методами.
10. Приложения
Приложение 10.1
Схема лабораторного исследования на листериоз
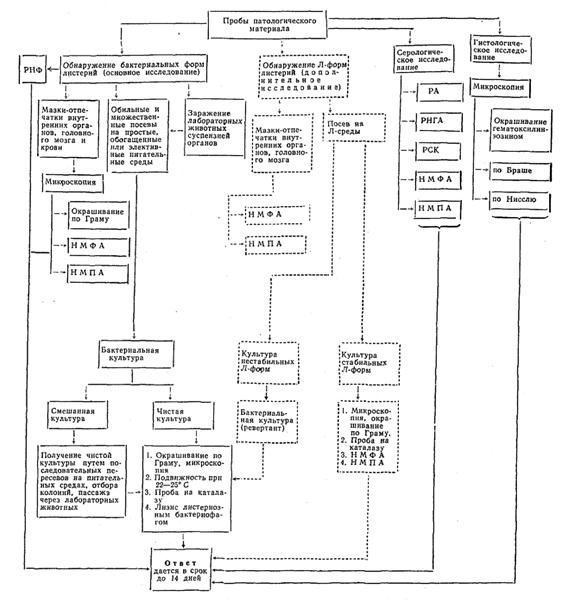
Приложение 10.2
Рецепты и способы приготовления индикаторных и элективных сред
Для приготовления индикаторных сред необходимо иметь:
а - мясопептонный бульон или бульон Хоттингера рН 7,3 - 7,5
б - индикаторы:
- настойка лакмуса - 5 г сухого лакмуса (но не лакмойда) растирают в порошок, смешивают с 50 мл спирта-ректификата и ставят в термостат при температуре 37° на 3 дня; каждый день спирт меняют. На четвертые сутки спирт сливают, порошок высушивают в чашке Петри и заливают десятикратным количеством дистиллированной воды; раствор фильтруют;
- метиленовую синь, нейтраль-рот, метил-рот, конго-рот и амидо-черный готовят в виде 0,1 %-ных растворов на дистиллированной воде и стерилизуют отдельно от питательной среды при 1 атм. 30 минут.
Приготовление индикаторных сред.
10.2.1.1. Среда с лакмусом: к 100 мл МПБ или бульона Хоттингера добавляют 1 мл настойки лакмуса. Цвет среды сиреневый.
10.2.1.2. Среда с нейтраль-ротом в смеси с метиленовой синью: к 100 мл МПБ или бульона Хоттингера добавляют по 1 мл 0,1 %-ных растворов нейтраль-рота и метиленовой сини. Цвет среды зеленовато-голубоватый или зеленый.
Среды с лакмусом и нейтраль-ротом в смеси с метиленовой синью разливают по пробиркам с ватными пробками и стерилизуют при 1 атм. 30 минут.
10.2.1.3. Среда с метил-ротом: в пробирку с 10 мл стерильного МПБ или бульона Хоттингера добавляют 0,3 мл стерильного 0,1 %-ного водного раствора метил-рота, цвет среды лимонно-желтый.
10.2.1.4. Среда с конго-ротом: в пробирку с 10 мл стерильного МПБ или бульона Хоттингера добавляют 0,3 мл стерильного 0,1 %-ного водного раствора конго-рота, цвет среды красный.
10.2.1.5. Среда с амидо-черным: к 10 мл стерильного МПБ или бульона Хоттингера добавляют 0,3 мл стерильного 0,1 %-ного водного раствора амидо-черного, цвет среды черный с фиолетовым оттенком.
Примечание: Практически 0,1 %-ные стерильные растворы метил-рота, конго-рота, амидо-черного можно добавлять в пробирки со стерильным МПБ или бульоном Хоттингера стерильной пастеровской пипеткой из расчета по 1 капле раствора индикатора на 1 мл бульона.
10.2.2. Элективные среды
10.2.2.1. Среда с теллуритом калия.
К 1 л расплавленного МПА (pH 7,2 - 7,4) перед разливом в бактериологические чашки добавляют 10 мл 2 %-ного водно-глицеринового раствора теллурита калия (выпускается хим. фарм. заводом им. Семашко).
Добавление к указанной среде 5 - 10 % сыворотки крови крупного рогатого скота улучшает рост листерий.
10.2.2.2. Среда с теллуритом калия и флоримицином или полимиксином.
К 1 л расплавленного МПА (pH 7,2 - 7,4) перед разливом добавляют 10 мл 2 %-ного водно-глицеринового раствора теллурита калия и 0,3 - 0,5 мл раствора флоримицина или полимиксина (500 тыс. ед. препарата разводят в 10 мл физиологического раствора). Цвет колоний на среде с теллуритом калия черный, в связи с восстановлением теллурита калия до металлического теллура.
Приложение 10.3
Определение комплементсвязывающих антител у китообразных при листериозе
10.3.1. Сероэпидемиологические исследования "одомашниваемых" китообразных и обслуживающего их персонала позволяют решать ряд важных вопросов, возникающих в процессе изучения инфекционных болезней, общих для человека и морских млекопитающих.
Изучение иммуноструктуры в отношении возбудителя листериоза в местах содержания китообразных является основным показателем, характеризующим интенсивность эпизоотического и эпидемического процесса. Кроме того, диагноз на эту болезнь можно опосредованно поставить по достоверной разнице титров гуморальных антител в парных сыворотках больных с характерной для листериоза клинической картиной.
Выявлена выраженная антикомплементарность сывороток морских млекопитающих (ластоногих и китообразных), которая полностью снимается дополнительной обработкой сыворотки СО2.
10.3.2. Методика обработки сыворотки
10.3.2.1. Техника взятия крови у китообразных.
Кровь у китообразных берут шприцом стерильно из хвостовой вены в количестве 5 - 10 мл. Участок кожи хвостового плавника обрабатывают в следующей последовательности:
а - 75 %-ным раствором этилового спирта;
б - 3 %-ным раствором перекиси водорода;
в - 96 %-ным раствором этилового спирта.
Сыворотку крови получают по общепринятой методике, ампулируют и хранят в холодильнике при температуре +4 °C.
10.3.2.2. Обработка сывороток углекислотой.
Полученную цельную сыворотку разводят 1:10 дистиллированной водой и из аппарата Кипа пропускают через нее CO2 в течение 5 - 7 мин до интенсивного помутнения.
Вместо газообразной кислоты используют сухой лед, которым насыщают дистиллированную воду. Насыщенным раствором CO2 разводят цельную сыворотку 1:10 и оставляют при комнатной температуре до интенсивного помутнения. Обработанную таким методом сыворотку центрифугируют при 1500 об./мин в течение 10 минут, надосадочную жидкость отсасывают и добавляют к ней 1/10 объема 8,5 %-ного раствора NaCl. Непосредственно перед постановкой РСК сыворотку инактивируют прогреванием в водяной бане при 50° в течение 30 минут или при 60 - 65° в течение 20 минут.
Приложение 10.4
Получение гипериммунных сывороток против стабильных Л-форм листерий протопластного типа
10.4.1. Для получения антигена Л-формы листерий выращивают в течение 6 - 7 суток (3 суток при температуре 37 °C, 3 - 4 суток - при 20 - 22°) в жидкой среде, содержащей 2 % хлорида натрия и 2 % нормальной лошадиной сыворотки без консерванта. Культуру 6 - 7-суточного возраста осаждают центрифугированием в течение 40 минут при 10000 об./мин. Осадок отмывают от среды в физрастворе трехкратным центрифугированием при этом же режиме. Отмытую культуру Л-форм разводят физраствором до сметанообразной консистенции (109 - 1010 колониеобразующих единиц в 1 мл), убивают прогреванием при 56 °C в течение часа и консервируют мертиолатом 1:10000 в конечном разведении.
10.4.2. Для получения гипериммунных сывороток кроликов иммунизируют по схеме Плесчиа, предусматривающей 3-кратное введение антигена с недельными интервалами. Вводят антиген в смеси с неполным адъювантом Фрейнда. Для гипериммунизации используют кроликов, давших до начала обработки отрицательные результаты в РА и РДП с бактериальным антигеном и антигеном Л-форм.
10.4.2.1. Схема гипериммунизации:
Первое введение: 1 мл антигена Л-форм смешивают с 1 мл подогретого неполного адъюванта Фрейнда. С помощью туберкулинового шприца по 0,02 мл смеси вводят внутрикожно в каждую подушечку 4-х коготков задней лапы кролика. Оставшиеся 1,9 мл вводят внутримышечно в бедро той же лапы.
Второе введение: через 7 дней смесь по той же методике и в той же дозе инъецируют в другую заднюю лапу.
Третье введение: через 14 дней 0,1 мл смеси вводят внутрикожно вдоль позвоночника кролика в пять точек по 0,02 мл в каждую из них. Остальные 1,9 мл инъецируют внутримышечно (в бедро) в ту же лапу, что и при первом введении.
10.4.3. Обескровливают животных через 10 - 12 суток после последней иммунизации при титре антител в РДП с антигеном Л-форм 1:4 - 1:8.
Из данных гипериммунных сывороток получают глобулины, которые используют при исследовании иммунопероксидазным и иммунофлюоресцентным методами.
Приложение 10.5
10.5.1. Для выделения глобулиновой фракции применяют полиэтиленгликоль (ПЭГ) с молекулярным весом - 6000. В работе используют 20 %-ный раствор ПЭГ на дистиллированной воде. Перед выделением глобулиновой фракции измеряют pH сыворотки. Сыворотка должна иметь pH 7,5. Регулирование pH до нужной величины проводят растворами соляной кислоты или щелочи.
10.5.2. К иммунной сыворотке (pH 7,5) прибавляют равный объем 20 %-ного раствора ПЭГ. Смесь оставляют на 15 минут для формирования осадка. Затем смесь центрифугируют при 6000 об./мин в течение 15 минут. Надосадок удаляют, а осадок растворяют до исходного объема сыворотки в 0,02 М Na-фосфатном буфере с 0,15 молями NaCl (pH 7,0)*. К осадку, растворенному в буфере, вновь добавляют равный объем 20 %-ного раствора ПЭГ и через 15 минут центрифугируют (растворение осадка в буфере, осаждение 20 %-ным раствором ПЭГ и центрифугирование повторяют еще дважды, т.е. в общей сложности эту манипуляцию проводят трижды). После третьего центрифугирования осадок в четвертый раз растворяют буфером, объем которого в 3 раза меньше исходного объема сыворотки. Полученную фракцию глобулинов для освобождения от ПЭГ смешивают с хлороформом (на 9 частей глобулиновой фракции прибавляют 1 часть хлороформа). Смесь встряхивают в течение 30 минут. После чего ее центрифугируют при 10000 об./мин в течение 20 минут. Хлороформ оседает на дно пробирки, а верхнюю фракцию глобулинов, свободную от ПЭГ, отсасывают и в дальнейшем используют в иммунофлюоресцентном и иммунопероксидазном исследованиях.
______________
* Приготовление 0,02 М Na-фосфатного буфера с 0,15 молями NaCl (pH 7,0): 3,12 г NaH2PO·2H2O (однозамещенный, м.в. -156) растворить в 1 л дистиллированной воды. Затем в раствор добавить 8,5 г NaCl.
Приложение 10.6
Методика выделения листерий из силоса
Силос плохого качества (pH свыше 5,5) является благоприятной средой для размножения листерий, особенно в его поверхностных слоях. При необходимости проводят бактериологическое исследование силоса.
Для исследования из разных участков берут 5 - 10 проб силоса массой около 100 граммов каждая. Из них отбирают среднюю пробу, из которой получают сок. Оставшуюся часть силоса хранят при +4 °C. Определяют pH сока; при pH 5,4 и ниже исследование проводить нецелесообразно.
Затем по 0,2 мл сока засевают в 9 пробирок МПБ с 10 % хлорида натрия. Посевы делят на 3 части (по 3 пробирки) и выращивают:
при +37 °C - 48 часов,
при +22 °C - 5 дней,
при +4 °C - 10 дней.
После истечения срока выращивания из бульонов делают пересев на элективные среды в чашках, готовят мазки, окрашивают их по Граму и микроскопируют. Независимо от результатов микроскопии заражают 2-х белых мышей (масса 14 - 16 г) подкожно в дозе 0,2 - 0,3 мл.
В случае гибели зараженных животных из их органов делают мазки и посевы на питательные среды. Полученные культуры идентифицируют согласно п. 4.
При отрицательном результате повторные исследования проб силоса, хранившихся при +4 °C, проводят через 10 дней в течение месяца.
|
Начальник
Главного управления |
А.Д. Третьяков |
|
|
|
|
Начальник
Главного управления |
В.П. Сергиев |
СОДЕРЖАНИЕ