| Информационная система |  |
Государственное санитарно-эпидемиологическое
нормирование
Российской Федерации
3.1.5.
ЭПИДЕМИОЛОГИЯ. ПРОФИЛАКТИКА
ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ. ВИЧ-ИНФЕКЦИИ
Надзор за распространением штаммов ВИЧ,
резистентных к антиретровирусным препаратам
Методические
рекомендации
MP 3.1.5.0075/1-13
Москва 2014
1. Разработаны ФБУН «ЦНИИ эпидемиологии» Роспотребнадзора, Федеральным научно-методическим центром по профилактике и борьбе со СПИД (Н.И. Ладная, Д.А. Куевда, Д.Е. Киреев, А.Э. Лопатухин, А.В. Кравченко, О.Г. Юрин, Н.В. Козырина, В.В. Покровский); Управлением эпидемиологического надзора Федеральной службы по надзору в сфере зашиты прав потребителей и благополучия человека (Л.А. Дементьева).
2. Утверждены и введены в действие руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 20 августа 2013 г.
3. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель
Федеральной службы ___________________ Г.Г. Онищенко |
3.1.5.
ЭПИДЕМИОЛОГИЯ. ПРОФИЛАКТИКА
ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ. ВИЧ-ИНФЕКЦИИ
Надзор за распространением штаммов ВИЧ,
резистентных к антиретровирусным препаратам
Методические рекомендации
МР 3.1.5.0075/1-13
1. Область применения
Методические рекомендации предназначены для специалистов органов и учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, научных учреждений, а также специализированных ЛПО, осуществляющих организационно-методическую работу по проведению диагностических, лечебных, профилактических и противоэпидемических мероприятий по ВИЧ-инфекции в субъектах Российской Федерации (центры по профилактике и борьбе со СПИД), организаторов здравоохранения, эпидемиологов, врачей-инфекционистов, специалистов в области лабораторной диагностики, а также специалистов других заинтересованных организаций.
В настоящих методических рекомендациях определены основные принципы организации и порядок осуществления эпидемиологического надзора за распространением штаммов ВИЧ, резистентных к АРВ-препаратам. Целью данных рекомендаций является представление подходов к осуществлению эпидемиологического надзора за генетическими вариантами ВИЧ, циркулирующими в России, для минимизации возникновения, распространения резистентности к АРВ-препаратам в Российской Федерации, ограничения последствий распространения резистентности для здоровья населения.
Подходы к организации обследования на резистентность к АРВ-препаратам инфицированных ВИЧ пациентов, получающих терапию по клиническим показаниям, не являются целью данного руководства и изложены в других публикациях.
2. Введение
В настоящее время в Российской Федерации растет распространенность инфекции, вызываемой вирусом иммунодефицита человека (ВИЧ-инфекции). Со времени выявления в 1987 г. первого случая заражения ВИЧ всего были обнаружены более 770 тыс. ВИЧ-инфицированных россиян и сообщено о смерти 150 тыс. из них. В 2012 г. были зарегистрированы более 70 тыс. новых случаев ВИЧ-инфекции среди граждан Российской Федерации, а общее число живущих с заболеванием в России оценивалось в 1,2 млн человек. Все эти люди могут погибнуть от СПИД, если не получат необходимого лечения. В 2013 г. в Российской Федерации получали антиретровирусную терапию более 150 тыс. инфицированных ВИЧ в Российской Федерации. Современная антиретровирусная терапия существенно продляет жизнь инфицированных ВИЧ и снижает риск передачи ВИЧ-инфекции от пациентов, получающих терапию.
Высокоактивная антиретровирусная терапия, которая должна проводиться пациенту пожизненно, может оказаться неэффективной в связи с выработкой резистентности к антиретровирусным препаратам. В связи с высокой степенью генетической вариабельности ВИЧ, активной репликацией вируса и необходимостью длительного приема АРВ-препаратов возникновение резистентности ВИЧ неизбежно. Резистентность потенциально развивается ко всем APB-препаратам и может проявляться уже через 14 - 28 дней после назначения препарата. Распространение резистентности ВИЧ к APB-препаратам приводит к снижению эффективности терапии, увеличению смертности от ВИЧ/СПИД и росту стоимости антиретровирусной терапии.
Надзор за резистентностью ВИЧ к антиретровирусным препаратам позволил выделить 3 этапа в развитии устойчивости в странах мира. Первый этап - до 2000 г. - был связан с началом программ лечения в странах и ростом распространенности резистентности к нуклеозидным ингибиторам обратной транскриптазы. В период с 2000 по 2005 гг. отмечался рост распространенности резистентности к ненуклеозидным ингибиторам обратной транскриптазы, связанный с расширением масштабов лечения преимущественно с применением препаратов этого класса. Последние несколько лет характеризуются, с одной стороны, снижением распространенности первичной (передаваемой) резистентности в связи с оптимизацией лечения, а с другой стороны, появлением множественно устойчивых штаммов ВИЧ.
В мире 9,7 млн человек получали антиретровирусную терапию к концу 2012 г. В странах с высоким уровнем дохода (в странах Западной Европы, Северной Америки, Австралии и Японии) средний уровень распространенности первичной резистентности у лиц, не имевших опыта применения APB-терапии, в последние годы составляет 10,0 - 17,0 %, оставаясь стабильным последнее десятилетие. В странах с низким и средним уровнем дохода распространенность первичной резистентности возрастала в период 2003 - 2010 гг., достигнув максимума - 6,6 % в 2009 г.
Для пациентов, получающих APT, в зависимости от длительности приема препаратов уровень распространенности резистентности может составлять от 5,0 - 18,8 % в течение первых 12 месяцев терапии до существенно более высоких показателей в последующие годы. Среди пациентов с вирусологической неэффективностью терапии через 12 месяцев после ее начала 60,0 - 81,0 % в разных регионах мира имеют резистентность ВИЧ к APB-препаратам, в основном к НИОТ и ННИОТ, у остальных пациентов основной причиной неэффективности терапии является низкая приверженность лечению.
В Российской Федерации в 2006 - 2010 гг. в 18 исследуемых регионах передающаяся лекарственная устойчивость ВИЧ встречалась с низкой частотой - менее 5 %, однако ее распространенность ежегодно увеличивалась.
На фоне быстро развивающейся эпидемии ВИЧ-инфекции в России и включения в лечение большого количества пациентов надзор за резистентностью ВИЧ к APB-препаратам в субъектах Российской Федерации является очень актуальным, поскольку предоставляет информацию для выбора предпочтительных эффективных схем антиретровирусной терапии первого и второго ряда, схем химиопрофилактики передачи ВИЧ-инфекции от матери к ребенку и схем постконтактной химиопрофилактики.
3. Общие положения
ВИЧ-инфекция - болезнь, вызываемая вирусом иммунодефицита человека (ВИЧ), хроническое заболевание, характеризующееся специфическим поражением иммунной системы, приводящим к медленному ее разрушению вплоть до формирования синдрома приобретенного иммунодефицита (СПИД), приводящего инфицированного ВИЧ к быстрой гибели. Преимущественное распространение ВИЧ среди молодого населения приводит к повышению смертности, сокращению рождаемости, уменьшению продолжительности жизни населения, сокращению численности работающего населения, увеличению затрат на здравоохранение, вызывает многофакторное деструктивное воздействие на социальную и экономическую жизнь общества.
Возбудитель ВИЧ-инфекции - вирус иммунодефицита человека - относится к подсемейству лентивирусов семейства ретровирусов. Существует два типа вируса: ВИЧ-1 и ВИЧ-2.
Антиретровирусная терапия (APT) является этиотропной терапией ВИЧ-инфекции. На современном этапе APT не позволяет полностью элиминировать ВИЧ из организма больного, но останавливает размножение вируса, что приводит к восстановлению иммунитета, предотвращению развития или регрессу вторичных заболеваний, сохранению или восстановлению трудоспособности пациента и предотвращению его гибели. Основным критерием эффективности APT является подавление размножения вируса, что выражается в снижении вирусной нагрузки до неопределяемого уровня. Эффективная противоретровирусная терапия одновременно является профилактической мерой, снижающей опасность пациента как источника инфекции. Кроме того, в настоящее время активно применяются методы постконтактной и доконтактной химиопрофилактики АРВ-препаратами.
Антиретровирусные (противоретровирусные) препараты подавляют размножение ВИЧ, но не способны уничтожить генетический материал вируса, интегрированный в ДНК клетки человека, поэтому не позволяют достигнуть полного излечения от ВИЧ-инфекции.
Резистентность (устойчивость) ВИЧ - это способность ВИЧ проникать в человеческие клетки и размножаться в присутствии антиретровирусных препаратов. Снижение чувствительности ВИЧ к APT обусловлено возникновением мутаций в генах-мишенях АРВТ (кодирующих нуклеотидные последовательности ревертазы, протеазы, интегразы, поверхностных и структурных белков).
Резистентные штаммы ВИЧ могут возникнуть за счет развития мутаций вируса у пациентов, принимающих антиретровирусную терапию (приобретенная резистентность), или быть переданы неинфицированным ранее людям от лиц, у которых такие штаммы присутствуют (первичная, передаваемая резистентность). Как первичная, так и приобретенная резистентность ВИЧ может приводить к снижению эффективности терапии ВИЧ-инфекции у отдельных пациентов и в популяции в целом, ограничивает возможности выбора антиретровирусных препаратов. И хотя для большинства пациентов с резистентностью ВИЧ стандартные схемы терапии второго ряда будут эффективны, в целом для популяции это может приводить к таким серьезным последствиям, как изменения в рекомендуемых предпочтительных схемах антиретровирусной терапии, удорожанию терапии, а как следствие, к снижению охвата лечением нуждающихся больных.
Резистентность ВИЧ возникает в том случае, если воздействие APB-препаратов недостаточно для подавления репликации ВИЧ. Факторы, способствующие развитию резистентности, ВОЗ разделяет на четыре категории:
1. Факторы, связанные с APB-препаратами и схемами терапии (неправильно подобранные схемы терапии, неверная дозировка, взаимодействие с иными лекарственными препаратами, сложные для приема схемы).
2. Факторы, связанные с вирусом (высокая репликативная активность вируса, наличие у пациента резистентных штаммов до начала APT, и вероятное наличие у некоторых субтипов ВИЧ более низкого барьера к выработке резистентности).
3. Факторы, связанные с пациентом (нарушение режима приема антиретровирусных препаратов при APT (приверженность), в том числе в связи с наличием других заболеваний, детским возрастом, боязнью стигмы и дискриминации и т.п.).
4. Факторы, связанные с организацией лечения (системы закупок и поставок APB-препаратов, дефицит кадров, неразвитая инфраструктура, снижение доступа для пациентов к различным видам медицинской помощи и т.п.).
При осуществлении надзора за распространением резистентности ВИЧ к APB-препаратам необходимо, согласно рекомендациям ВОЗ, организовать работу по трем ключевым направлениям: анализ индикаторов раннего предупреждения появления резистентности ВИЧ к АРВ-препаратам; анализ распространенности первичной резистентности к АРВ-препаратам; анализ распространенности резистентности к АРВП у больных на первой линии терапии (в том числе отдельно на старте терапии и у детей в возрасте до 18 месяцев). Ключевые составляющие системы надзора за циркуляцией резистентных штаммов ВИЧ, согласно рекомендациям ВОЗ от 2012 г., отражены на рис. 1. С увеличением числа пациентов, находящихся на антиретровирусной терапии второго ряда, должны потребоваться дополнительно исследования по распространенности резистентности к АРВП у больных на терапии второго ряда и схемах спасения, но в настоящее время в России это не актуально. Для более эффективного использования полученных данных должен также проводиться анализ распространенности различных типов, субтипов ВИЧ и циркулирующих рекомбинантных форм среди различных категорий больных. Исходя из полученной информации должны формироваться общенациональный подход к профилактике развития резистентности ВИЧ к APB-препаратам и осуществляться мероприятия по оптимизации диагностических исследований и разработке вакцин.
Рис. 1. Ключевые составляющие системы надзора за
циркуляцией
резистентных штаммов ВИЧ по рекомендациям (ВОЗ, 2012)
Целью надзора за резистентностью ВИЧ к APB-препаратам является минимизация возникновения и распространения резистентности, ограничения последствий ее распространения для здоровья населения Российской Федерации.
Для достижения поставленных целей необходимо выполнить следующие задачи:
1. Изучить уровень распространенности первичной резистентности и характер мутаций к APB-препаратам среди людей, недавно инфицированных ВИЧ, в субъектах Российской Федерации.
2. Изучить частоту возникновения резистентности и характер мутаций у пациентов, получающих АРТ-терапию первой линии, в том числе уровень распространенности резистентности до начала терапии и у детей в возрасте до 18 месяцев.
3. Изучить индикаторы раннего предупреждения появления резистентности ВИЧ к АРВ-препаратам.
4. На основании всех полученных данных оценить, насколько система предоставления APT в стране способствует профилактике распространения резистентности к АРВ-препаратам.
5. Выработать рекомендации по оптимизации системы лечения ВИЧ-инфекции и проведению мероприятий по профилактике распространения резистентности к АРВ-препаратам в стране и отдельных регионах.
Дополнительными задачами, выполнимыми в рамках тех же исследований, являются: оценка распространенности различных типов и субтипов ВИЧ среди инфицированных ВИЧ в субъектах Российской Федерации и, на основании этих данных, оценка адекватности использования различных диагностических систем и направлений разработки вакцин.
В Российской Федерации создана инфраструктура в области диагностики и надзора за резистентностью. В 2013 г. в стране 45 лабораторий сети центров СПИД имели оборудование для проведения исследований по резистентности к АРВП. Регулярно проводится обучение по диагностике устойчивости ВИЧ к APB-препаратам. Для обеспечения контроля качества исследований по резистентности создана и введена в работу контрольная панель по резистентности ФСВОК. Создана рабочая группа по резистентности ВИЧ к антиретровирусным препаратам при референс-центре по мониторингу за ВИЧ и ВИЧ-ассоциированными инфекциями ФГУН «ЦНИИ эпидемиологии» Роспотребнадзора. Разработана и внедрена Всероссийская электронная база данных устойчивости ВИЧ к APB-препаратам ФГУН «ЦНИИ эпидемиологии» Роспотребнадзора, сайт которой размещен в интернете по адресу http://hivresist.pcr.ru/.
4. Порядок осуществления надзора за резистентностью
ВИЧ
к АРВ-препаратам
Стратегия ВОЗ по надзору за резистентностью ВИЧ к АРВП включает восемь элементов:
- создание и функционирование рабочей группы по резистентности (включая утверждение плана работы на 5 лет и выделение соответствующего финансирования);
- слежение за индикаторами раннего предупреждения;
- исследования по мониторингу за резистентностью;
- пороговые исследования по первичной резистентности;
- разработка специализированной базы данных;
- аккредитация лаборатории по генотипированию;
- регулярный обзор профилактических мероприятий (в отношении развития и распространения резистентности ВИЧ);
- подготовка ежегодного отчета по резистентности ВИЧ.
Для осуществления эффективной работы по надзору за резистентностью ВИЧ к APB-препаратам необходимо следовать этому плану.
Необходимо поддерживать работу федеральной рабочей группы по резистентности ВИЧ к антиретровирусным препаратам и создать рабочие группы специалистов по резистентности на уровне каждого федерального округа Российской Федерации и в субъектах федерации с наибольшим количеством больных, получающих антиретровирусную терапию. В рабочую группу по резистентности ВИЧ к APB-препаратам на федеральном и региональном уровнях должны войти специалисты по ВИЧ-инфекции Министерства здравоохранения Российской Федерации и Роспотребнадзора, эпидемиологи, специалисты по лабораторной диагностике, врачи-инфекционисты, специалисты по мониторингу и оценке. Рабочая группа должна иметь утвержденный пятилетний план работы и необходимое для ее функционирования финансирование.
Очень важным, обычно не требующим значительного финансирования, а следовательно, доступным ресурсом данных для надзора за резистентностью ВИЧ к APB-препаратам является отслеживание индикаторов раннего предупреждения развития резистентности ВИЧ к АРВ-препаратам.
Сбор данных по первичной и приобретенной резистентности ВИЧ к APB-препаратам должен быть налажен среди детей в возрасте до 18 мес., взрослых мужчин и женщин.
Целесообразно также проводить исследования по надзору за распространенностью резистентности ВИЧ среди пациентов, начинающих получать APT (на момент начала APT, через 12, 24 мес. и среди детей). В некоторых странах мира рекомендовано проводить лабораторные исследования на резистентность ВИЧ среди всех впервые выявленных пациентов и всех пациентов перед началом APT. В Российской Федерации сбор данных по резистентности ВИЧ ведется путем проведения специальных выборочных исследований.
Для сбора и хранения данных по резистентности ВИЧ к АРВП в Российской Федерации создана Всероссийская электронная база данных устойчивости ВИЧ к APB-препаратам. Результаты проведенных исследований по резистентности ВИЧ к антиретровирусным препаратам в субъекте или федеральном округе Российской Федерации для анализа данных, подготовки ежегодного отчета по резистентности ВИЧ и принятия адекватных управленческих решений должны быть доложены во Всероссийскую электронную базу данных устойчивости ВИЧ к АРВ-препаратам ФГУН «ЦНИИ эпидемиологии» Роспотребнадзора (http://hivresist.pcr.ru/).
Каждый субъект Российской Федерации должен иметь лицензированную лабораторию для проведения исследований по резистентности ВИЧ к антиретровирусным препаратам.
Российской Федерации целесообразно иметь национальную и региональные, аккредитованные ВОЗ, лаборатории по генотипированию с целью обеспечения высокого качества исследований по резистентности. Всем лабораториям, проводящим исследования по резистентности ВИЧ к антиретровирусным препаратам, настоятельно рекомендуется участвовать в системе внешнего контроля качества (ФСВОК) по разделу резистентности ВИЧ.
Федеральная и региональные рабочие группы по лекарственной устойчивости должны ежегодно отчитываться по всем аспектам стратегии надзора за резистентностью ВИЧ к АРВП и распространять эти отчеты. Ежегодные отчеты должны включать рекомендации в отношении конкретных мер по предотвращению возникновения устойчивости и ее передачи.
4.1. Мониторинг индикаторов раннего
предупреждения
развития резистентности ВИЧ
Всемирная организация здравоохранения разработала систему индикаторов раннего предупреждения развития резистентности ВИЧ к АРВП для оценки проводимой антиретровирусной терапии и выявления факторов, способствующих выработке резистентности ВИЧ.
Целью мониторинга индикаторов раннего предупреждения развития резистентности ВИЧ (ИРП) является оценка качества лечения ВИЧ-инфекции в связи с профилактикой развития резистентности ВИЧ к АРВ-препаратам.
Данные для индикаторов за ограниченный период времени каждого года можно получить из медицинской документации и баз данных по APT. Индикаторы позволяют контролировать: практику назначения и эффективность APT; своевременность получения APB-препаратов пациентами и посещение ими ЛПО в назначенное время; долю пациентов, потерянных для последующего наблюдения и продолжающих получать APT первой линии на протяжении более чем 12 месяцев; а также перебои в поставках APB-препаратов в регионах страны.
Индикаторы раннего предупреждения характеризуются следующими особенностями:
- позволяют выявлять риски возникновения резистентности ВИЧ без применения дорогостоящих методов лабораторного определения лекарственной устойчивости ВИЧ на основе секвенирования;
- могут собираться из всех ЛПО, проводящих лечение ВИЧ-инфекции в стране, или из репрезентативной выборки ЛПО;
- отчеты ЛПО, проводящих лечение ВИЧ-инфекции в стране, предоставляемые ежегодно, дают практическую информацию для планирования мероприятий по минимизации возникновения и распространения резистентных штаммов ВИЧ в стране.
Мониторинг и оценка индикаторов раннего предупреждения может оперативно выявлять недостатки системы лечения ВИЧ-инфекции как на уровне ЛПО, так и на уровне региона или страны, которые могут привести к прерыванию лечения у больных и, как следствие, к развитию лекарственной устойчивости ВИЧ и нерациональному расходованию средств. Своевременное выявление проблемных ЛПО, предоставляющих не вполне адекватную медицинскую помощь по лечению ВИЧ-инфекции, дает возможность принять оперативные меры по нормализации ситуации. С другой стороны мониторинг индикаторов раннего предупреждения позволяет выявить наиболее передовые ЛПО, которые могли бы служить моделью наилучшей практики для других лечебных учреждений в стране.
В 2012 г. ВОЗ, с учетом ранее накопленного опыта применения индикаторов раннего предупреждения, пересмотрел, сократил набор индикаторов и привел их в соответствие с другими регулярно собираемыми индикаторами систем мониторинга и оценки мероприятий по противодействию эпидемии ВИЧ-инфекции. Набор основных показателей 2012 г. был сокращен до 5 пунктов, среди которых: своевременность получения APB-препаратов пациентами, адекватность выбора схем APT, бесперебойность обеспечения APB-препаратами и удержание пациентов в системе оказания медицинской помощи в течение 12 месяцев и подавление вирусной нагрузки через 12 месяцев после начала терапии. Пятый индикатор должен контролироваться в ЛПО, где вирусная нагрузка определяется для всех пациентов через 12 месяцев после начала терапии, что может представлять сложность для некоторых учреждений системы исполнения наказаний. В Российской Федерации должны отслеживаться все 5 индикаторов раннего предупреждения во всех ЛПО, предоставляющих лечение ВИЧ-инфекции.
Для облегчения интерпретации данных ВОЗ в 2012 г. предложил классификацию показателей индикаторов раннего предупреждения по трем основным категориям: красный (низкий показатель, ниже целевого уровня), желтый (умеренный показатель, но целевой уровень не достигнут) и зеленый (отличный показатель, целевое значение достигнуто). Если ЛПО не проводит сбор данных для какого-либо индикатора, то его значение классифицируется как серый уровень (нет данных), а если индикатор не собирается только в определенном году (обычно в следующем после утверждения индикатора), то ему присваивается белое значение.
Таблица 1
Набор индикаторов раннего предупреждения развития
резистентности ВИЧ
и рекомендованные ВОЗ целевые показатели (2012 г.)
|
Индикаторы раннего предупреждения |
Целевые показатели |
|
1. Своевременное получение АРВ-препаратов (% пациентов, своевременно получивших АРВ-препараты - до того момента как закончатся предыдущие выданные препараты) |
Красный: < 80 % Желтый: 80 - 90 % Зеленый: > 90 % |
|
2. Удержание в системе оказания медицинской помощи |
Красный: < 75 % удержанных через 12 месяцев после начала APТ Желтый: 75 - 85 % удержанных через 12 месяцев после начала APT Зеленый: > 85 % удержанных через 12 месяцев после начала APT |
|
3. Бесперебойное обеспечение АРВ- препаратами (% месяцев бесперебойного обеспечения ЛПО APB-препаратами в году) |
Красный: < 100 % из 12 месяцев в году без перебоев в поставках АРВ-препаратов Зеленый: 100 % от 12 месяцев в году без перебоев в поставках АРВ-препаратов |
|
4. Практика назначения APT |
Красный: > 0 % пациентов, получающих APB-терапию одним или двумя препаратами Зеленый: 0 % пациентов, получающих АРВ-терапию одним или двумя препаратами |
|
5. Подавление вирусной нагрузки через 12 месяцев |
Красный: < 70 % больных с подавленной вирусной нагрузкой через 12 месяцев после начала антиретровирусной терапии Желтый: 70 - 85 % больных с подавленной вирусной нагрузкой через 12 месяцев после начала антиретровирусной терапии Зеленый: > 85 % больных с подавленной вирусной нагрузкой через 12 месяцев после начала антиретровирусной терапии |
|
5.1. Подавление вирусной нагрузки через 12 месяцев для детей < 2 лет |
Красный: < 60 % детей с подавленной вирусной нагрузкой через 12 месяцев после начала антиретровирусной терапии Желтый: 60 - 70 % детей с подавленной вирусной нагрузкой через 12 месяцев после начала антиретровирусной терапии Зеленый: > 70 % детей с подавленной вирусной нагрузкой через 12 месяцев после начала антиретровирусной терапии |
Каждым центром по профилактике и борьбе со СПИД субъекта должен ежегодно проводиться сбор индикаторов раннего предупреждения. При этом данные по заданным параметрам, позволяющие рассчитать индикаторы, должны собираться обязательно из всех ЛПО, проводящих APT в регионе, поскольку ЛПО могут иметь принципиальные отличия, а средние показатели по субъекту не позволят отследить опасные тенденции и принять своевременные меры. Средние показатели по региону и стране рассчитываются путем суммирования данных по всем ЛПО.
Пример отчета региона X по индикаторам раннего предупреждения:
|
ЛПО, проводящие APT в регионе X |
№ 1 - % пациентов, вовремя получивших АРВ-препараты |
№ 2 - % пациентов, удержанных через 12 мес. после начала APT |
№ 3 - % месяцев бесперебойного обеспечения ЛПО АРВ-препаратами в году |
№ 4 - % получивших АРВ-терапию одним или двумя препаратами |
№ 5 - % больных с подавленной вирусной нагрузкой через 12 мес. после начала APT |
№ 5.1 - % детей с подавленной вирусной нагрузкой через 12 мес. после начала APT |
|
1 |
87/100 (87 %) |
78/100 (78 %) |
12 (100 %) |
0/100 (0 %) |
67/100 (67 %) |
3/4 (75 %) |
|
2 |
170/200 (85 %) |
142/200 (71 %) |
9 (75 %) |
1/200 (0,5 %) |
150/200 (75 %) |
6/7 (86 %) |
|
3 |
273/300 (91 %) |
255/300 (85 %) |
10 (83 %) |
6/300 (2 %) |
240/300 (80 %) |
10/15 (67 %) |
Электронные таблицы, позволяющие рассчитать значения индикаторов раннего предупреждения, и инструкция по их заполнению размещены на интернет сайте «Российская база данных устойчивости ВИЧ к антиретровирусным препаратам» (http://hivresist.pcr.ru/).
4.2. Исследования по эпидемиологическому надзору
за случаями передачи резистентных к АРВ-препаратам
штаммов от пациента к пациенту
(надзор за первичной резистентностью ВИЧ)
Эти исследования также называют «пороговыми исследованиями по первичной резистентности ВИЧ», поскольку они рекомендованы для проведения в выборочных регионах, где APT широко применяется на протяжении более 3 последних лет. Этот метод не позволяет рассчитать точные показатели распространенности резистентности в заданном году (с учетом очень небольшого количества исследуемых образцов) и не может быть репрезентативным на национальном уровне. Но его основной целью является предупреждение руководителей программ лечения ВИЧ-инфекции о передаче резистентных штаммов от пациента к пациенту в конкретных регионах страны и необходимости принятия организационных мер.
Всемирная организация здравоохранения выделяет три уровня распространенности первичной резистентности, на основании которых принимаются решения о методах минимизации возникновения и распространения резистентности и ограничения последствий распространения резистентности для здоровья населения.
Классификация распространенности первичной резистентности ВИЧ к APB-препаратам ВОЗ:
- низкая распространенность: < 5 %;
- высокая распространенность: > 15 %;
- средняя распространенность: между 5 и 15 %.
При этом при распространенности резистентности ниже порогового уровня в 5 % в испытуемом регионе не требуется внедрение срочных мероприятий по профилактике распространения резистентных штаммов, но необходимо проводить оценку индикаторов раннего предупреждения появления резистентности и повторить исследование через 2 года. Второй пороговый уровень распространенности первичной резистентности в 15 % был выбран, поскольку после его достижения резистентность уже может оказывать существенное влияние на эффективность программ лечения ВИЧ-инфекции, что в свою очередь требует пересмотра рекомендуемых схем антиретровирусной терапии с исключением препаратов, к которым наиболее часто обнаруживается резистентность, включения теста на резистентность в стандарты обследования пациентов с ВИЧ и принятия срочных мер по профилактике распространения резистентных штаммов ВИЧ. При среднем уровне распространенности резистентности ВИЧ к APB-препаратам необходимо проанализировать причины этого явления и принимать срочные меры по профилактике распространения резистентных штаммов ВИЧ, провести исследование в популяции больных, начинающих получать APT (если не проводилось). Повторить все виды исследований целесообразно через 2 года.
Цель данного исследования - определение масштабов передачи и распространенности первичной резистентности к APB-препаратам среди недавно инфицированных ВИЧ пациентов, не имевших опыта получения АРВ-терапии.
Задачи: оценка уровня распространенности первичной резистентности и характер мутаций к АРВ-препаратам среди людей, недавно инфицированных ВИЧ, в субъектах Российской Федерации. Дополнительная задача данного исследования - определение распространенности различных субтипов ВИЧ среди недавно инфицированных ЛЖВС.
Целевая группа: инфицированные ВИЧ, не имеющие опыта получения APB-препаратов, зараженные в течение последних 0,5 - 1,5 года.
Дизайн исследования: определение резистентности и субтипов ВИЧ в пробах, забранных от недавно инфицированных ЛЖВ. В связи с трудностями в идентификации людей, зараженных в течение последних 0,5 - 1,5 лет, а также проверки получения этими людьми когда-либо APB-препаратов, выбор критериев включения в исследование очень важен. При существенном сроке инфицирования резистентные штаммы не будут обнаружены у пациента, поскольку останутся только в минорных популяциях, а при наличии опыта получения АРВП мы обнаружим не первичную, а вторичную резистентность. Эти два фактора могут существенно искажать результаты исследования и привести к неверным выводам.
Для удобства создания выборки рекомендуется включать образцы от двух групп пациентов: от молодых, впервые выявленных с ВИЧ первобеременных женщин, или «сероконвертеров» - впервые выявленных инфицированных ВИЧ, имеющих предыдущий отрицательный/неопределенный результат тестирования на ВИЧ.
Критериями включения в исследование по первичной резистентности являются:
1. Для группы № 1 - сероконвертеры (люди, у которых произошла сероконверсия или недавно инфицированные ВИЧ):
- инфицированный ВИЧ должен получать медицинскую помощь в регионе исследования;
- первый положительный результат его теста на ВИЧ должен быть получен менее чем за 1 год до включения в исследование;
- должны присутствовать лабораторные доказательства сероконверсии в течение 1 года, к документальным свидетельствам относится последний отрицательный или сомнительный результат лабораторного обследования на ВИЧ, справка об обследовании на ВИЧ, журналы обследования на ВИЧ, базы данных:
- сероконверсия, выявленная в период окна одним из следующих тестов: ИФА, антиген р24 или иммуноблот, то есть последний тест в ИБ позитивный в течение года, а предыдущий - неопределенный;
- сероконверсия, выявленная при повторном тестировании, то есть результаты одного или нескольких тестов были негативные, а последнего ИБ - позитивный в течение года;
- пациент должен иметь непосредственно перед включением в исследование уровень СD4-лимфоцитов > 500 кл./мкл.
2. Для группы № 2 - молодые первобеременные женщины, не имевшие опыта получения АРВ-препаратов:
- беременная женщина, инфицированная ВИЧ, получающая помощь в субъекте Российской Федерации - участнике исследования;
- возраст 15 - 25 лет (по возможности не более 22 лет);
- первая беременность;
- впервые рискованное поведение, которое могло привести к заражению ВИЧ, отмечено не более 3 лет назад (до включения в исследование);
- первый положительный результат теста на антитела к ВИЧ получен менее чем за 1 год до включения в исследование;
- женщина должна иметь непосредственно перед включением в исследование уровень СD4-лимфоцитов > 500 кл./мкл;
- у беременных образец крови должен быть забран обязательно до начала приема АРВ-препаратов.
Критериями исключения являются:
- наличие опыта получения антиретровирусных препаратов у пациента (в том числе профилактическая терапия вертикальной передачи ВИЧ или применение АРВ-препаратов для других целей);
- давние сроки заражения ВИЧ:
- первый положительный в ИБ результат, выявленный более чем за 1 год до включения в исследование;
- признаки СПИД, оппортунистические инфекции и вторичные заболевания у пациента;
- количество CD4 < 500 кл./мл;
- отсутствие информированного согласия на участие в исследовании.
Выбор регионов для проведения исследования: исследования следует проводить в регионах, где APB-терапия применялась достаточно широко на протяжении ≥ 3 лет, отмечается быстрый рост охвата терапией инфицированных ВИЧ и где продолжает регистрироваться значительное количество новых случаев ВИЧ-инфекции. Образцы крови могут специально собираться для данного исследования, но для этих же целей могут быть использованы оставшиеся образцы после обследования на ВИЧ, CD4 или вирусную нагрузку в рамках скрининговых исследований или образцы крови, полученные при дозорных других сероэпидемиологических исследованиях.
Диагностическая проба: не менее 0,5 - 1,0 мл плазмы крови одного забора. В отдельных случаях, при невозможности получения плазмы крови, может быть использована сыворотка. Каждый образец должен сопровождаться направлением на определение лекарственной резистентности ВИЧ (прилож. 1) и информированным согласием на участие в исследовании (прилож. 2).
Количество участников исследования: для исследования необходимо проанализировать результаты тестирования образцов не менее чем от 47 лиц, удовлетворяющих критериям отбора, которым последовательно поставлен диагноз ВИЧ в регионах исследования. С учетом отбраковки части образцов на этапе доставки и определения нуклеотидной последовательности рекомендуется отбирать коллекцию из 70 - 100 образцов для исследования, что позволит повысить точность результатов и предотвратить снижение достоверности при возникновении проблемы с генотипированием образцов. Исследование минимального количества образцов позволит национальной программе минимизировать расходы и охватить большее количество регионов.
Полученные в результате исследования образцов данные должны анализироваться в программном обеспечении, предназначенном для выявления мутаций, значимых для надзора за передаваемыми лекарственно-устойчивыми штаммами ВИЧ (http://cpr.stanford.edu/cpr.cgi).
|
Основные мутации ВИЧ для надзора за первичной резистентностью* |
|||||||||
|
НИОТ |
ННИОТ |
ИП |
|
||||||
|
М41 |
L |
Q151 |
M |
L100 |
I |
L23 |
I |
G73 |
S, T, C, A |
|
K65 |
R |
M184 |
V, I |
K101 |
E, P |
L24 |
I |
L76 |
V |
|
D67 |
N, G, E |
L210 |
W |
K103 |
N, S |
D30 |
N |
V82 |
A, T, S, F, L, C, M |
|
Т69 |
D, lns |
T215 |
Y, F, S, C, D, E, I, V Q, E, N, R |
V106 |
A, M |
V32 |
I |
N83 |
D |
|
K70 |
R, E |
K219 |
|
V179 |
F |
M46 |
I, L |
184 |
V, A, C |
|
L74 |
V, I |
|
|
Y181 |
C, I, V |
I47 |
V, A |
185 |
V |
|
V75 |
M, T, A, S |
|
|
Y188 |
L, C, H |
G48 |
V, M |
N88 |
D, S |
|
F77 |
L |
|
|
G190 |
A, S, E |
I50 |
V, L |
L90 |
M |
|
Y115 |
F |
|
|
P225 |
H |
F53 |
F, Y |
|
|
|
F116 |
Y |
|
|
M230 |
L |
I54 |
V, L, M, T, A, S |
|
|
|
________ *Bennett DE, Camacho RJ, Otelea D, et al. Drug Resistance Mutations for Surveillance of Transmitted HIV-1 Drug-Resistance: 2009 Update, PLoS One 2009; 4:e4724 |
|||||||||
4.3. Исследования по мониторингу приобретенной
резистентности ВИЧ к APB-препаратам среди пациентов,
получающих APT первой линии
Более ранние рекомендации ВОЗ предписывали, что в это исследование должна быть вовлечена когорта, в которую набирается около 130 пациентов последовательно и впервые включающиеся в APT первого ряда в одном выбранном ЛПО. Рекомендуемым методом был обсервационный когортный анализ с определением вирусной нагрузки, резистентности и субтипов ВИЧ до начала лечения, на 12-й, 24-й, 36-й месяц лечения, в момент перехода на АРВ второго ряда или отмены терапии. Определение резистентности необходимо проводить в когорте только среди пациентов с определяемой вирусной нагрузкой (более 1000 копий/мл) через 12 месяцев после начала APT, в момент перехода на АРВ второго ряда или прерывания терапии. Дополнительно должна быть собрана эпидемиологическая, демографическая, клиническая информация, включая опыт применения различных APB-препаратов с разными целями. Такой метод можно продолжать использовать и в настоящее время, но он требует значительных временных и финансовых затрат. Фактически первые результаты этого исследования можно полущить с задержкой как минимум в 1,5 - 2,0 года. Поэтому ВОЗ предложил разделить это исследования на два компонента, упростить подходы и тем самым сократить сроки получения результатов исследования.
Новый подход предполагает использование методики выборочного кросс-секционного исследования пациентов с неэффективной APT в дозорных ЛИО. Этот подход предполагает, что одномоментно в нескольких ЛПО, предоставляющих APT, будут отобраны и изучены пациенты с вирусной нагрузкой (более 1000 копий/мл) через 12 - 15 месяцев и 24 - 36 месяцев после начала APT. Изучаемые группы в одном ЛПО могут быть значительно меньше (30 - 70 пациентов), в исследование могут быть вовлечены как взрослые, так и дети. За короткий срок этот подход позволяет определить долю пациентов с подавленной вирусной нагрузкой и выработавшейся резистентностью ВИЧ через 12 - 15 и 24 - 36 месяцев после начала APT среди взрослого населения и в детской популяции. При таком подходе возможно обеспечить репрезентативную для страны выборку.
Цель: мониторинг эффективности программы лечения ВИЧ-инфекции и оценка частоты возникновения резистентности у пациентов, получающих APT первой линии.
Задачи: определить долю пациентов с неэффективностью APT первого ряда через 12 месяцев после ее начала. Изучение частоты возникновения резистентности у пациентов, получающих APT первого ряда, в дозорных участках (специально отобранных территориальных центрах СПИД). Определить структуру выявленных мутаций резистентности ВИЧ. Дополнительной задачей является определение распространенности различных типов и субтипов ВИЧ среди инфицированных ВИЧ, получающих терапию.
Целевая группа: пациенты, нуждающиеся в APT и впервые начавшие получать APT первого ряда 12, 24 и 36 месяцев назад, в том числе дети в возрасте менее 18 месяцев. Не имеет значения, получали ли пациенты, ранее APB-препараты с целью химиопрофилактики. Но принципиальным является отсутствие изменения схемы терапии и прерывания терапии в течение установленных сроков: 12, 24 и 36 месяцев.
Дизайн исследования: кросс-секционное выборочное исследование с определением вирусной нагрузки, резистентности и субтипов ВИЧ на 12-й (желательно и на 24-й, 36-й) месяц после начала лечения.
Объекты проведения исследования: дозорными участками являются территориальные центры по профилактике и борьбе со СПИД, осуществляющие лечение АРВП не менее 500 пациентов с ВИЧ-инфекцией.
Диагностическая проба: 0,5 - 1,0 мл плазмы крови, отобранной для исследования или другой клинической цели, например определения CD4 и вирусной нагрузки. Образец крови должен быть забран обязательно до начала приема APB-препаратов. Каждый образец должен сопровождаться направлением на определение лекарственной резистентности ВИЧ (прилож. 3) и информированным согласием на участие в исследовании (прилож. 2).
Количество тестов: размер выборки определяется с учетом количества получающих APT в регионе (минимально 30 - 70 человек по одному ЛПО и всего 300 - 500 пациентов по стране). Для пациентов определяется: CD4, вирусная нагрузка и резистентность, субтип ВИЧ на 12-й и 24-й, 36-й месяц лечения.
Все обнаруженные мутации определяются согласно классификации Stanford HIV DR Database (высокий, средний и низкий уровень резистентности ВИЧ).
4.4. Исследования по мониторингу резистентности
ВИЧ
перед началом АРВ-терапии
Этот вид исследования представляет собой упрощенный подход к проведению второго компонента исследования по мониторингу приобретенной резистентности ВИЧ к APB-препаратам среди пациентов, получающих APT первой линии. Это информация может быть собрана при проведении когортных исследований, а в некоторых странах стандартным подходом является проведение анализа на резистентность ВИЧ для всех ВИЧ-инфицированных перед началом APT. Наименее затратным и более соответствующим текущим потребностям в Российской Федерации является альтернативный вариант - проведение кросс-секционного выборочного исследования среди пациентов, впервые начинающих APT.
Цель: оценка эффективности программы лечения ВИЧ-инфекции на популяционном уровне и оценка распространенности резистентности у пациентов до начала APT первой линии.
Задачи: определить долю пациентов, имеющих резистентность перед началом APT первой линии. Определить структуру выявленных мутаций резистентности ВИЧ. Дополнительной задачей является определение распространенности различных типов и субтипов ВИЧ среди инфицированных ВИЧ, получающих терапию.
Целевая группа: пациенты, нуждающиеся в APT и впервые начавшие получать APT первого ряда, в том числе дети в возрасте менее 18 месяцев. Не имеет значения получал ли пациент ранее АРВ-препараты с целью химиопрофилактики.
Дизайн исследования: кросс-секционное выборочное исследование с определением вирусной нагрузки, резистентности и субтипов ВИЧ до начала лечения.
Объекты проведения исследования: дозорными участками являются территориальные центры по профилактике и борьбе со СПИД, осуществляющие лечение АРВП не менее 500 пациентов с ВИЧ-инфекцией.
Диагностическая проба: 0,5 - 1,0 мл плазмы крови, забранной специально для исследования или другой клинической цели, например определения CD4 и вирусной нагрузки. Каждый образец должен сопровождаться направлением на определение лекарственной резистентности ВИЧ (прилож. 3) и информированным согласием на участие в исследовании (прилож. 2).
Количество тестов: в рамках данного исследования размер выборки определяется с учетом количества получающих APT в регионе (минимально 30 - 70 человек по одному ЛПО и всего 300 - 500 пациентов по стране). Для пациентов определяется: CD4, вирусная нагрузка и резистентность, субтип ВИЧ до начала лечения.
5. Общие принципы методов для определения
лекарственной
устойчивости ВИЧ на основе секвенирования
В настоящее время при исследовании на лекарственную устойчивость ВИЧ анализируются следующие гены: ген протеазы, ген обратной транскриптазы, ген интегразы и ген белка gp120, так как именно они являются основными генами-мишенями для действия основных схем антиретровирусной терапии.
Стандартная методика для выявления резистентности ВИЧ к АРВП на основе генотипирования включает следующие стадии:
- приготовление проб - выделение РНК;
- обратная транскрипция;
- полимеразная цепная реакция (ПЦР);
- автоматическое детектирование нуклеотидной последовательности (реакция секвенирования);
- анализ с помощью программного обеспечения (получение консенсусной последовательности);
- интерпретация полученных результатов (виртуальное фенотипирование).
Для проведения исследования по определению устойчивости ВИЧ к APB-препаратам используется плазма крови. Для исследования требуется не менее 0,5 - 1,0 мл плазмы.
Суть реакции секвенирования сводится к проведению реакции амплификации, в состав реакционной смеси которой введены в небольшом количестве терминирующие дидезоксинуклеотидтрифосфаты ddNTP (проводятся 4 реакции, каждая с определенным типом ddNTP или одна реакция, в которую вводится 4 типа ddNTP, но каждый тип имеет свою флуоресцентную метку). В ходе реакции ddNTP случайным образом обрывают синтез цепи, при этом остановка осуществляется ddNTP того типа, который комплементарен последней букве до обрыва. В результате такой реакции образуются фрагменты различной длины, последний нуклеотид в которой известен. Далее проводится электрофорез с разрешением в один нуклеотид. По последовательности фрагментов и исходя из знания терминального нуклеотида восстанавливается вся последовательность. В современном оборудовании определение последовательности проводится автоматически.
В соответствии с требованиями по точности во всех тест-системах на каждый анализируемый образец получается несколько электрофореграмм (от 4 до 8) с перекрывающимися последовательностями.
При помощи специального программного обеспечения осуществляется конструирование общей (консенсусной) нуклеотидной последовательности. В соответствии с требованиями ВОЗ полученный результат должен быть пересмотрен оператором.
При организации лаборатории следует учитывать, что реакция секвенирования осуществляется в зоне учета результатов лаборатории, при этом последняя должна быть разделена на две подзоны для проведения:
- электрофореза;
- подготовительных этапов перед секвенированием (очистка ампликонов), постановки непосредственно реакции секвенирования и детекции результатов методом электрофореза высокого разрешения.
5.1. Основные правила формирования консенсусной
(результирующей) нуклеотидной последовательности
На каждый участок анализируемого фрагмента должно быть получено не менее двух электрофореграмм, в противном случае результат анализа участка считается недостоверным.
Консенсусная последовательность должна быть проверена во всех точках, где автоматическая интерпретация указала на наличие полиморфизма - более одного нуклеотида на позицию указывается специализированным буквенным кодом IUРАС, а также в кодонах, ассоциированных с мутациями устойчивости.
Буквенный код IUРАС для обозначения полиморфных позиций
|
K |
G/T |
W |
А/Т |
Н |
А/Т/С |
|
М |
А/С |
Y |
С/Т |
V |
A/G/C |
|
R |
A/G |
В |
C/T/G |
N |
A/C/G/T |
|
S |
C/G |
D |
A/T/G |
X |
Для проверки рекомендуется придерживаться следующих правил.
1. Если в двух электрофореграммах для позиции наряду с четкими пиками присутствуют одинаковые подпики, необходимо ввести в позицию вырождение. Если подпик присутствует лишь в одной электрофореграмме, ввести в консенсусную позицию нуклеотид, соответствующий основному пику.
2. Если на одной из электрофореграмм в анализируемой позиции присутствует несколько слабовыраженных пиков одновременно, а на другой электрофореграмме четкий пик, соответствующий какому-либо из нуклеотидов, то в общей последовательности вместо вырождения в анализируемой позиции следует поставить четко интерпретируемый нуклеотид.
3. Если на одной из электрофореграмм в анализируемой позиции присутствует несколько четких пиков одновременно, а на другой электрофореграмме один четкий пик, соответствующий какому-либо из нуклеотидов, то в общей последовательности данную позицию следует считать вырожденной.
4. Если присутствует эффект смещения (соседние пики накладываются друг на друга), то в общей нуклеотидной последовательности следует указать основание, присутствующее на второй электрофореграмме.
5. Если присутствует эффект истощения краски (пики с малой амплитудой), то участок электрофореграммы следует исключить из анализа.
Слабовыраженный пик - пик, высота которого меньше или равна 1/3 средней высоте пиков в электрофореграмме. Четкий пик - пик, высота которого больше 1/3 средней пиков в электрофореграмме.
Полученная общая нуклеотидная последовательность должна быть проанализирована на наличие:
- стоп-кодонов;
- делеций/инсерций;
- нетипичных оснований;
- сдвигов рамок считывания;
- присутствие в смеси нескольких штаммов.
Идентификация каждой мутации должна быть заверена дважды. После получения анализа консенсусной нуклеотидной последовательности в случае обнаружения мутаций резистентности необходимо вернуться к рассмотрению электрофореграмм на позиции аминокислоты, в которой была обнаружена мутация резистентности, и пересмотреть полученные данные (непосредственно пики электрофореграмм).
Для каждой обнаруженной мутации должна быть оценена достоверность ее идентификации. Результаты анализа должны быть заверены ответственным лицом после экспертного пересмотра данных.
5.2. Основные правила интерпретации результатов
Результатом исследования лекарственной устойчивости ВИЧ является список выявленных мутаций вируса, приводящих к фенотипическим изменениям, выражающихся в способности к репликации в присутствии APB-препарата. Выявленные мутации принято обозначать кодом «аминокислота-кодон-аминокислота», отражающим характер замены. Аминокислоты обозначаются однобуквенными кодами; кодон обозначается номером, по сути, указывающим номер аминокислоты в белке (обратной транскриптазе, протеазе, интегразе). Так как нумерация в каждом белке начинается с единицы, следует всегда указывать, о каком белке (гене) идет речь.
|
А |
Аланин |
G |
Глицин |
М |
Метионин |
S |
Серин |
|
С |
Цитозин |
Н |
Гистидин |
N |
Аспарагин |
T |
Треонин |
|
D |
Аспарагиновая кислота |
I |
Изолейцин |
Р |
Пролин |
V |
Валин |
|
Е |
Глутаминовая кислота |
K |
Лизин |
Q |
Глутамин |
W |
Триптофан |
|
F |
Фенилаланин |
L |
Лейцин |
R |
Аргинин |
Y |
Тирозин |
Например, мутация устойчивости к ламивудину M184V в гене обратной транскриптазы обозначает замену метионина на валин в позиции 184 аминокислоты.
Для проведения интерпретации используют списки известных мутаций резистентности или формализованные алгоритмы виртуального фенотипирования. Данные алгоритмы могут быть включены в программное обеспечение коммерческих тестов для определения лекарственной устойчивости ВИЧ. Однако ввиду постоянного пополнения баз данных мутаций устойчивости ВИЧ и усовершенствования алгоритмов интерпретации рекомендуется использовать международные открытые базы данных, размещенные в сети интернет. Для интерпретации результатов ВОЗ рекомендует использование баз данных и алгоритмы Стэнфордского университета, адрес в интернет (http://www.hivdb.stanford.edu/). Зеркало алгоритма интерпретации результатов Стэнфордского университета на русском языке реализовано во «Всероссийской базе данных устойчивости ВИЧ к антиретровирусным препаратам», адрес в интернет (http://www.hivresist.pcr.ru). На обоих ресурсах возможна интерпретация как введенной в специализированное окно нуклеотидной последовательности ВИЧ, так и загруженных файлов с последовательностями fasta. Результаты интерпретации представлены в таком виде, что для каждого препарата из группы ингибиторов протеазы и обратной транскриптазы указывается степень устойчивости ВИЧ по шкале чувствительности к препарату (устойчивость низкой, средней или высокой степени). Наличие устойчивости высокой степени является строгим показанием к замене препарата, устойчивости средней и низкой степени допускает сохранение препарата при введении в схему других препаратов, к которым вирус полностью чувствителен (актуально при мультирезистентности).
5.3. Мутации резистентности ВИЧ к нуклеозидным
ингибиторам
обратной транскриптазы (НИОТ), (Stanford HIV Drug Resistance
Database summary June 22, 2013)
|
|
|
|
не-АТ |
|
|
|
|
АТ |
|
|
МЛУ |
||
|
Cons |
184 М |
65 K |
70 K |
74 L |
115 Y |
41 М |
67 D |
70 K |
210 L |
215 Т |
219 K |
69 Т |
151 Q |
|
3ТС |
VI |
R |
Е |
|
|
|
|
|
|
|
|
Ins |
M |
|
FTC |
VI |
R |
Е |
|
|
|
|
|
|
|
|
Ins |
M |
|
АВС |
VI |
R |
Е |
VI |
F |
L |
|
|
W |
YF |
|
Ins |
M |
|
ddl |
VI |
R |
Е |
VI |
|
L |
|
|
W |
YF |
|
Ins |
M |
|
TDF |
*** |
R |
Е |
|
F |
L |
|
R |
W |
YF |
|
Ins |
M |
|
d4T |
*** |
R |
Е |
|
|
L |
N |
R |
W |
YF |
QE |
Ins |
M |
|
ZDV |
*** |
*** |
* |
* |
|
L |
N |
R |
W |
YF |
QE |
Ins |
M |
|
Жирный/подчеркнутый: высокий уровень снижения чувствительности к антиретровирусным препаратам или вирусологического ответа. Жирный: снижены чувствительность или вирусологический ответ. Не выделенный текст: снижение чувствительности только в сочетании с другими мутациями. *: увеличение чувствительности. АТ: мутации к аналогам тимидина. не-АТ: другие мутации НИОТ. МЛУ: Множественная лекарственная устойчивость. Добавочные мутации: K65N, K65R, K70GQ, K70Е, T69D, V75MT, T215SCDEIV, T215YF, E40F, E44DA, D67GE, V118I, K219NR, K65R, Q151M, K65R |
|||||||||||||
5.4. Мутации резистентности ВИЧ к ненуклеозидным
аналогам
ингибиторов обратной транскриптазы (ННИОТ)
(Stanford HIV Drug Resistance Database summary June 22, 2013)
|
|
100 |
101 |
103 |
106 |
138 |
179 |
181 |
188 |
190 |
227 |
230 |
|
Cons |
L |
K |
K |
V |
Е |
V |
Y |
Y |
G |
F |
M |
|
NVP |
I |
РЕН |
NS |
AM |
|
DEF |
CIV |
LCH |
ASEQ |
LC |
L |
|
EFV |
I |
РЕН |
NS |
AM |
|
DEF |
C |
LCH |
ASEQ |
LC |
L |
|
ETR |
I |
РЕН |
|
|
KAGQ |
DEF |
CIV |
|
ASEQ |
C |
L |
|
RPV |
I |
РЕН |
|
|
KAGQ |
DEF |
CIV |
L |
ASEQ |
C |
L |
|
Жирный/подчеркнутый: высокий уровень снижения чувствительности к антиретровирусным препаратам или вирусологического ответа. Жирный: снижены чувствительность или вирусологический ответ. Невыделенный текст: снижение чувствительности только в сочетании с другими мутациями. Добавочные мутации: V90I (ETR), A98G (NVP, EFV, ETR, RPV), V108I, V179T (ETR), V179L (RPV), Р225Н (EFV), K238Т (NVP, EFV), L318F (NVP) |
|||||||||||
5.5. Мутации резистентности ВИЧ к ингибиторам
протеазы (ИП)
(Stanford HIV Drug Resistance Database summary June 22, 2013)
|
Cons |
24 L |
30 D |
32 V |
33 L |
46 M |
47 I |
48 G |
50 I |
54 I |
76 L |
82 V |
84 I |
88 N |
90 L |
|
ATV/r |
|
|
I |
F |
IL |
V |
VM |
L |
VTAM |
|
ATSF |
V |
S |
M |
|
DRV/r |
|
|
I |
F |
|
VA |
|
V |
LM |
V |
F |
V |
|
|
|
FPV/r |
|
|
I |
F |
IL |
VA |
|
V |
VTALM |
V |
ATSF |
V |
|
M |
|
IDV/r |
I |
|
I |
|
IL |
VA |
|
|
VTALM |
V |
ATSF |
V |
S |
M |
|
LPV/r |
I |
|
I |
F |
IL |
VA |
VM |
V |
VTALM |
V |
ATSF |
V |
|
M |
|
NFV |
|
N |
|
F |
IL |
VA |
VM |
|
VTALM |
|
ATSF |
V |
DS |
M |
|
SQV/r |
|
|
|
|
|
|
VM |
|
VTAM |
|
ATS |
V |
S |
M |
|
TPV/r |
|
|
I |
F |
IL |
VA |
|
|
VTAM |
|
TSL |
V |
|
|
|
Жирный/подчеркнутый: высокий уровень снижения чувствительности к антиретровирусным препаратам или вирусологического ответа. Жирный: снижена чувствительность или вирусологический ответ. Невыделенный текст: снижение чувствительности только в сочетании с другими мутациями. Добавочные мутации: L10F, V111, K20TV, L23I, K43Т, F53L, Q58E, A71IL, G73STCA, Т74Р, N83D, L89V, L10RY, V11L, L24F, M46V, G48ASTLQ, F53Y, I54S, V82CM, I84AC, N88TG |
||||||||||||||
5.6. Мутации резистентности ВИЧ к ингибиторам
интегразы
(Stanford HIV Drug Resistance Database summary June 22, 2013)
|
|
66 |
92 |
138 |
140 |
143 |
147 |
148 |
155 |
|
Cons |
Т |
Е |
E |
G |
Y |
S |
Q |
N |
|
Raltegravir (RAL) |
А |
Q |
KA |
SAC |
CRH |
|
HRK |
H |
|
Elvitegravir (EVG) |
IAK |
Q |
KA |
SAC |
|
G |
HRK HRK |
H |
|
Dolutegravir (DTG) |
|
Q |
KA |
SAC |
|
|
||
|
Жирный/подчеркнутый: высокий уровень снижения чувствительности к антиретровирусным препаратам или вирусологического ответа. Жирный: снижены чувствительность или вирусологический ответ. Невыделенный текст: снижение чувствительности только в сочетании с другими мутациями. Добавочные мутации: Н51Y, L74M, Т97А, S153YF, G163RK, S230R, R263K, E92GV, G118R, F121Y, Y143KSGA, P145S, Q146P, N155ST |
||||||||
6. Современные тест-системы для выявления
лекарственной устойчивости ВИЧ
Для проведения молекулярных лабораторных исследований могут быть использованы зарегистрированные на территории Российской Федерации тест-системы или применены рекомендованные Министерством здравоохранения Российской Федерации методики. Исследования могут осуществляться в лабораториях, имеющих лицензию на соответствующий вид деятельности.
6.1. Основные характеристики современных тест-систем
на основе
секвенирования для выявления лекарственной устойчивости ВИЧ
В Российской Федерации в 2013 г. были зарегистрированы 3 коммерческих набора реагентов для определения мутаций устойчивости ВИЧ, принцип работы которых различается способом определения нуклеиновых последовательностей.
Общий принцип секвенирования состоит в том, что терминирующие дидезоксинуклеотидтрифосфаты ddNTP останавливают удлинение цепи ДНК. По окончании реакции циклического секвенирования фрагменты ДНК различной длины регистрируются путем капиллярного электрофореза или с помощью электрофореза в полиакриламидном геле.
Первым способом определения нуклеотидных последовательностей является секвенирование, где в реакции присутствуют все четыре дидезоксинуклеотидтрифосфата ddNTP, помеченные различными красителями. В одной пробирке присутствует только один праймер, используемый для удлинения цепи. Регистрируя длину фрагмента ДНК и ddNTP, находящегося на конце фрагмента, программное обеспечение прибора определяет нуклеотидную последовательность.
Второй способ определения нуклеотидных последовательностей (CLIP-секвенирование) отличается от первого тем, что в одной пробирке находятся только один немеченый краской дидезоксинуклеотидтрифосфат ddNTP и два помеченных разными красками праймера, используемых для удлинения цепи.
Аналитическая чувствительность большинства современных тестов для выявления устойчивости ВИЧ к АРВП составляет 500 - 1000 копий/мл. Если значение вирусной нагрузки < 1000 копий/мл, то получение результата анализа не гарантировано. Ввиду того, что уровнем эффективной супрессии репликации вируса считается нагрузка менее 50 копий/мл, существующая чувствительность тестов на резистентность не позволяет оперативно реагировать на возникновение устойчивости. В настоящее время наиболее высокая чувствительность тестов составляет 100 копий/мл при экстракции нуклеиновых кислот из 1 мл плазмы крови.
Аналитическая специфичность превышает 99 %. Тесты не дают перекрестных реакций. Лишь в редких случаях результат секвенирования указывает на наличие амплифицированной последовательности ДНК человека, которая, благодаря определению нуклеотидной последовательности, при интерпретации легко распознается и исключается из анализа.
6.2. Ограничения существующих тест-систем
для выявления лекарственной устойчивости
Тесты на резистентность выявляют только доминантные штаммы вируса. Минорные варианты (составляющие менее 20 % от общей популяции вируса в крови) и популяции, которые сохраняются в «скрытых резервуарах», могут иметь мутации устойчивости, но не обнаруживаются.
Выявляя доминирующий вариант ВИЧ, методы исследования резистентности позволяют определить устойчивость к препаратам, принимаемым на момент тестирования, либо к препаратам, прием которых был прекращен за 1 - 4 недели до тестирования. Поэтому при выборе схемы лечения важно учитывать какие APB-препараты пациент принимал в прошлом, и каковы были результаты предыдущих тестов на резистентность, так как минорные устойчивые штаммы могут продолжать циркулировать.
Следует помнить, что после отмены APT вновь проявляется и размножается вирус дикого типа (так как жизнеспособность и репликативная активность вируса дикого типа выше). Обычно восстановление популяции вируса дикого типа происходит в течение 4 недель, хотя длительность этого периода зависит от схемы APT.
Современные тесты на резистентность имеют чувствительность 500 - 1000 копий/мл, что более чем на порядок ниже чувствительности современных тестов для определения вирусной нагрузки. В связи с этим при установлении факта вирусологической неэффективности терапии (двукратное выявление РНК ВИЧ на уровне выше 50 копий/мл через 12 - 16 недель лечения или повышение более 1000 коп/мл, если до этого был достигнут неопределяемый уровень РНК ВИЧ), анализ резистентности ВИЧ бывает невозможно провести немедленно, а лишь после достижения вирусной нагрузки, соответствующей уровню аналитической чувствительности используемых тестов (100 - 1000 копий/мл.).
Чтение и интерпретация результатов секвенирования участков генома ВИЧ бывают трудны в интерпретации из-за наличия смеси штаммов ВИЧ, часто с различным профилем резистентности, что требует высокой квалификации персонала.
Тесты на резистентность указывают на антиретровирусные препараты, к которым вирус устойчив и которые не следует назначать, но не позволяют определить наиболее эффективные препараты для данного пациента.
6.3. Альтернативные методы для выявления
лекарственной устойчивости ВИЧ
В Российской Федерации доминирующее положение занимают методы, основанные на определении последовательности ВИЧ и идентификации специфических мутаций устойчивости (генотипирование). Альтернативной технологией является методика фенотипирования. Фенотипирование позволяет определить уровень функциональной устойчивости вируса к препарату. Фенотипическая резистентность определяется как способность ВИЧ реплицироваться при высоких концентрациях АРВП. Она выражается как степень увеличения 50 % подавляющей концентрации препарата (IC50) в отношении тестируемого штамма вируса по сравнению с IC50 для стандартного чувствительного штамма ВИЧ. Данная методика похожа на классическое исследование чувствительности микроорганизмов in vitro, когда микроорганизмы выращивают на средах, содержащих различные концентрации антимикробных препаратов. Преимуществами метода фенотипирования является простота интерпретации результатов, отсутствие необходимости в знании мутаций, более точная суммарная оценка уровня устойчивости, особенно в случае мультирезистентности. Существенными недостатками, препятствующими широкому распространению методики, являются высокая трудоемкость и сложность процедуры, ее длительность и чрезвычайно высокая себестоимость исследования. В странах Европы и США доступны коммерческие наборы для фенотипирования.
Современные подходы к исследованиям в области молекулярной биологии и вирусологии совершенствуются чрезвычайно быстро. Постоянно появляются новые методы, позволяющие получать и обрабатывать данные на новом качественном и количественном уровне. Таким методом является секвенирование нового поколения - массовое параллельное секвенирование (next generation sequencing, NGS). Данный метод позволят единовременно получать большой массив данных, что наиболее актуально при проведении эпидемиологических исследований по резистентности, когда единовременно требуется провести исследование большого количества образцов. Другой особенностью метода является возможность детекции квазивидов на уровне до 1 % от вирусной популяции в организме пациента. Эта особенность позволяет заблаговременно выявлять мутации лекарственной устойчивости вируса еще до их фенотипического проявления. Однако в ближайшие годы в России не ожидается широкое применение методики массового параллельного секвенирования для определения резистентности ВИЧ в связи с высокой себестоимостью этих исследований.
7. Противопоказания к назначению анализа
на выявление резистентности ВИЧ
В соответствии с ограничениями современных методов лабораторной диагностики резистентности ВИЧ перед назначением анализа на выявление резистентности ВИЧ к АРВП необходимо проводить анализ вирусной нагрузки. Анализ на определение резистентности ВИЧ к АРВП следует назначать при значениях вирусной нагрузки > 1000 копий/мл. Если значение вирусной нагрузки находится в диапазоне от 100 до 1000 копий/мл и аналитическая чувствительность теста позволяет сделать анализ, его можно провести. Если значение вирусной нагрузки < 100 копий/мл, то анализ на выявление резистентности ВИЧ к АРВП назначать не следует. Анализ на определение вирусной нагрузки должен быть выполнен не ранее, чем за две недели до анализа на выявление резистентности ВИЧ к АРВП.
Противопоказано назначать анализ на выявление резистентности ВИЧ к АРВП после перевода пациента на новую схему АРВТ, так как после назначения новой схемы антиретровирусной терапии значение вирусной нагрузки падает вплоть до недетектируемого уровня (рис. 2).
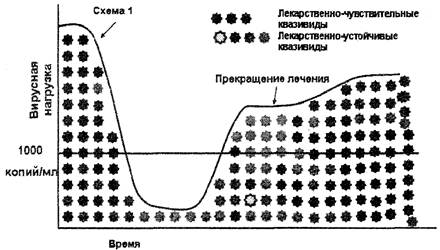
Анализ на выявление резистентности ВИЧ к АРВП не рекомендуется назначать после отмены терапии и противопоказан для пациентов, не получающих терапию более 4 недель. Следует учитывать, что после отмены селективного действия АРВП (отмена терапии, или самостоятельный перерыв пациентом в лечении - недостаточная приверженность) штаммы дикого типа вируса снова становятся доминирующими, и анализ на лекарственную устойчивость ВИЧ может не идентифицировать резистентные к АРВП штаммы ВИЧ, присутствующие в минорных количествах (рис. 3).
Рис. 2. Неэффективность антиретровирусной терапии
Рис. 3. Прекращение антиретровирусной терапии
8. Интерпретация результатов. Современные
электронные
базы данных по вопросам лекарственной устойчивости ВИЧ
8.1. База данных лекарственной устойчивости ВИЧ
Стэнфордского
университета (Stanford University HIV Drug Resistance Database)
Работа по созданию базы данных лекарственной устойчивости ВИЧ началась на кафедре инфекционных заболеваний медицинского факультета Стэнфордского университета в 1998 г. В базу данных экспортировались последовательности генома ВИЧ, полученные от пациентов с известной историей лечения. На основании этих данных было проведено множество исследований, которые позволили выявить мутации, достоверно влияющие на чувствительность ВИЧ к антиретровирусным препаратам. Был разработан алгоритм, позволяющий на основании обнаруженных мутаций делать вывод о наличии у вируса устойчивости к АРВП (виртуальное фенотипирование). Определение влияния мутации на возникновение лекарственной устойчивости ВИЧ к тому или иному препарату осуществляется путем анализа опубликованных исследований, связывающих появление данной мутации и фенотипических изменений ВИЧ. Если возникновение мутации коррелирует с формированием лекарственной устойчивости, то мутации присваивается положительный балл, величина которого пропорциональна степени корреляции. А если возникновение мутации препятствует возникновению устойчивости, то мутации присваивается отрицательный балл.
Оценка устойчивости ВИЧ к антиретровирусным препаратам для анализируемого образца к препарату осуществляется путем суммирования баллов значимости всех выявленных мутаций, ассоциированных с устойчивостью к этому препарату. В соответствии с количеством набранных баллов уровень устойчивости ВИЧ может быть отнесен к одному из следующих типов:
- 0 - 9 баллов; чувствителен; нет доказательств снижения чувствительности относительно дикого типа;
- 10 - 14 баллов; возможно возникновение устойчивости низкого уровня; вирус полностью чувствителен, однако вероятно уже подвергался воздействию препарата данного класса;
- 15 - 29 баллов; низкий уровень устойчивости; вирусы, относящиеся к данному типу, показывают снижение чувствительности к данному препарату в экспериментах in vitro и/или пациенты, инфицированные данным вирусом, несколько хуже отвечают на лечение данным препаратом по сравнению с лечением вируса дикого типа;
- 30 - 59 баллов; средний уровень устойчивости; устойчивость вируса выше, чем устойчивость низкого уровня, но ниже чем устойчивость высокого уровня;
- ≥ 60 баллов; высокий уровень устойчивости; вирусы, относящиеся к данному типу, показывают максимальное снижение чувствительности в экспериментах in vitro и/или пациенты, инфицированные данным вирусом, не отвечают или слабо отвечают на лечение данным препаратом.
В настоящее время база данных Стэндфордского университета позволяет проводить виртуальное фенотипирование нуклеотидных последовательностей генов протеазы, обратной транскриптазы н интегразы ВИЧ.
База данных регулярно пополняется новыми данными, и алгоритмы определения лекарственной устойчивости обновляются.
Интерпретация
результатов при помощи базы данных
лекарственной устойчивости ВИЧ Стэнфордского университета
(Stanford University IIIV Drug Resistance
Database)
- Зайти на сайт по ссылке http://sierra2.stanford.edu/sierra/servlet/JSierra.
- Выбрать метод анализа. Для проведения анализа нуклеотидной последовательности генов вирусного генома выбирается пункт «ANALYZIS/sequences».
![]()
- Ввод последовательности может быть осуществлен непосредственно двумя путями:
А. копирования текса последовательности в окно А;

Б. путем загрузки файла формата TXT или FASTA, содержащего последовательность, при помощи окна В.

Для этого необходимо курсором мыши кликнуть на кнопку «Обзор».
Прикрепить анализируемый файл (txt, fasta).
Нажать кнопку «ANALYZE» ![]()
Программа базы данных Стэндфордского университета автоматически анализирует нуклеотидную последовательность, и представляет отчет о выявленной степени чувствительности анализируемого образца.
Результирующий отчет базы данных Стэндфордского университета содержит общие сведения о проанализированной нуклеотидной последовательности: наименование проанализированных генов, кодонов, вероятный субтип ВИЧ, процент схожести с ближайшей референсной последовательностью.
Отчет содержит оценку качества анализируемой нуклеотидной последовательности. Оценка качества производится по трем основным параметрам, ассоциированным с ошибками во время получения и анализа последовательности:
- во-первых, позиции, содержащие стоп-кодоны или сдвиги рамки считывания;
- во-вторых, позиции, содержащие нетипичные нуклеотиды (В, D, Н, V, N);
- в-третьих, необычные мутации, не связанные с резистентностью, встречающиеся менее чем в 0,5 % последовательностей, содержащихся в базе.
Позиции, содержащие вышеуказанные ошибки, отображаются на схеме в виде длинных красных полос.

Отличия от референсной последовательности НХВ2 неассоциированные с мутациями резистентности ВИЧ к АРВП обозначаются короткими синими полосами; а мутации, ассоциированные с устойчивостью к АРВ-препаратам - длинными синими линиями.
Мутации распределяются по следующим группам:
1. Мутации гена обратной транскриптазы:
а) мутации устойчивости к нуклеозидным ингибиторам обратной транскриптазы;
b) мутации устойчивости к ненуклеозидным ингибиторам обратной транскриптазы;
c) мутации полиморфизма.
2. Мутации гена протеазы:
a) основные мутации устойчивости к ингибиторам протеазы;
b) минорные мутации устойчивости к ингибиторам протезы;
c) мутации полиморфизма.
3. Мутации гена интегразы:
a) основные мутации устойчивости к ингибиторам интегразы;
b) минорные мутации устойчивости к ингибиторам интегразы.
8.2. Российская база данных устойчивости ВИЧ
к антиретровирусным препаратам
Российская база данных устойчивости ВИЧ к АРВП создана в 2009 г. референс-центром по мониторингу ВИЧ и ВИЧ-ассоциированных инфекций ФГУН «ЦНИИ эпидемиологии» Роспотребнадзора.
Основной задачей базы данных является скоординированный сбор информации о результатах анализов на резистентность ВИЧ к АРВП, проводимых на территории Российской Федерации.
База данных представляет собой информационный портал по лекарственной устойчивости ВИЧ на территории Российской Федерации. Она позволяет проводить интерпретацию результатов анализа на лекарственную устойчивость ВИЧ, осуществлять сбор данных для эпидемиологического надзора за лекарственной устойчивостью ВИЧ на территории Российской Федерации.
Интерпретация
результатов при помощи
«Российской базы данных устойчивости ВИЧ к АРВП»
Интерпретация результатов в «Российской базе данных устойчивости ВИЧ к АРВП» происходит через автоматическую интеграцию с базой данных Стэндфордского университета. Для этого необходимо:
1. Войти на сайт «Российской базы данных устойчивости ВИЧ к АРВП» на интернет странице http://hivresist.pcr.ru/.
2. В главном меню выбрать пункт «интерпретация результатов».
3. Ввести анализируемую последовательность.
Информация о нуклеотидной последовательности может быть введена в формате FASTA или текстовом формате.
А. «Окно 1».
Предназначено для введения нуклеотидной последовательности в текстовом формате, то есть необходимо предварительно скопировать нуклеотидную последовательность и вставить в «окно 1»,
В. «Окно 2».
Предназначено для введения нуклеотидной последовательности в формате fasta.
Курсором мыши необходимо нажать кнопку «прикрепить», после чего выбрать файл с расширением fasta, содержащий анализируемую нуклеотидную последовательность, после чего, нажать кнопку «проанализировать».
База данных проводит виртуальное фенотипирование последовательности через автоматическую интеграцию с базой данных Стэндфордского университета и генерирует отчет на русском языке.
8.3. Другие электронные базы данных
по вопросам лекарственной устойчивости ВИЧ
Помимо указанных выше электронных баз данных функционируют и другие информационные ресурсы, которые могут помочь в решении задач эпидемиологического надзора за лекарственной устойчивостью ВИЧ. К наиболее актуальным из них относятся:
- hiv.lanl.gov - крупнейшая база данных нуклеотидных последовательностей ВИЧ, созданная на базе Национальной лаборатории, Лос-Аламос, США;
- Geno2pheno (geno2pheno.org) - крупный биоинформационный ресурс, созданный совместно Институтом вирусологии Кёльнского университета и Институтом молекулярной физиологии растений им. Макса Планка, позволяет определять уровни лекарственной устойчивости ВИЧ, ВГС и ВГВ, а также тропизм ВИЧ;
- Comet (COntext-based Modeling for Expeditious Typing) http://comet.retrovirology.lu/ - высокопроизводительный ресурс для осуществления субтипирования ВИЧ и ВГС;
- EuResist (euresist.org) - ресурс создан научной сетью EuResist и входит в число крупнейших баз данных генотипов ВИЧ; позволяет прогнозировать эффективность APB-терапии для пациентов.
9. Мониторинг и оценка качества исследований по
надзору
за циркуляцией генетических вариантов ВИЧ
Осуществление внешней оценки качества молекулярной лабораторной диагностики производится в соответствии с инструкциями Роспотребнадзора и Министерства здравоохранения Российской Федерации.
Все сотрудники лаборатории должны быть обучены по вопросам генетической диагностики ВИЧ-инфекции, а также внешней и внутренней оценки качества лабораторной диагностики. Персонал, принимающий участие в исследованиях но надзору, должен быть обучен методике по протоколам исследований.
Мониторинг и оценка качества мероприятий по борьбе со СПИД, в том числе данного вида мероприятий, ведется при сборе и анализе ключевых национальных индикаторов эффективности мероприятий, обеспечивающих контроль над эпидемией ВИЧ/СПИД в Российской Федерации.
Мониторинг и оценка качества проведенных исследований по надзору за циркуляцией генетических вариантов ВИЧ должны проводиться на регулярной основе по следующим направлениям:
- наличие и соответствие оказываемых услуг в учреждении/организации имеющемуся уставу и лицензии;
- наличие персонала, обученного по вопросам генетической диагностики ВИЧ-инфекции;
- наличие необходимых помещений, оборудования и нормативных материалов;
- соответствие процедур забора, обработки и утилизации биологических образцов требованиям противоэпидемического режима в лечебно-профилактических организациях;
- наличие протокола исследования, согласованного с этическим комитетом;
- соответствие участников исследования критериям отбора в исследование;
- наличие информированного согласия пациентов на участие в исследовании;
- ведение и хранение документации и отчетных материалов, включая вопросы безопасности;
- наличие адекватного финансирования данного вида деятельности.
Большинство изложенных параметров можно оценить при анализе документации.
Основным принципом тестирования больных на резистентность ВИЧ к антиретровирусным препаратам является соблюдение конфиденциальности информации о включении в исследование. Тестирование на резистентность персонифицированных образцов крови может осуществляться только с информированного согласия пациентов. Персонифицированная информация обо всех лицах, включенных в исследования, должна оставаться конфиденциальной. Персонифицированная информация о генетических исследованиях на ВИЧ может быть раскрыта только с личного согласия обследованного.
10. Представление результатов об исследованиях
по резистентности ВИЧ к APB-препаратам в целях
эпидемиологического надзора за резистентностью ВИЧ
Во исполнение приказа Роспотребнадзора № 88 от 17.03.2008 «О мерах по совершенствованию мониторинга за возбудителями инфекционных и паразитарных болезней» и в рамках реализации национального приоритетного проекта в сфере здравоохранения «Профилактика ВИЧ-инфекции, гепатитов В и С, выявление и лечение больных ВИЧ» Федеральным научно-методическим центром по профилактике и борьбе со СПИД создана специальная база данных по резистентности ВИЧ к антиретровирусным препаратам.
База данных предназначена для оперативного сбора и анализа данных о выявлении штаммов ВИЧ, резистентных к антиретровирусным препаратам, надзора за уровнем распространенности резистентности к АРВП и слежения за доминирующими и новыми появляющимися мутациями устойчивости ВИЧ к АРВП на территории страны, что позволит своевременно предпринять меры для минимизации возникновения, распространения резистентности к APB-препаратам в Российской Федерации и ограничения последствий распространения штаммов ВИЧ, резистентных к антиретровирусным препаратам.
Для обеспечения эффективной деятельности вышеуказанной базы данных Федеральным научно-методическим центром по профилактике и борьбе со СПИД разработана специальная форма «Донесение о результатах исследования по определению лекарственной резистентности ВИЧ» (прилож. 4). В целях реализации основных направлений по расширению электронного документооборота, указанных Правительством Российской Федерации и Президентом Российской Федерации, ускорения перехода на компьютерные технологии в сфере мониторинга, надзора и контроля, а также для обеспечения удобства в работе, донесения должны предоставляться в электронном виде не позднее 10-го числа следующего за отчетным месяца в соответствии с прилагаемой инструкцией (прилож. 7) на интернет-сайте «Российская база данных устойчивости ВИЧ к антиретровирусным препаратам» (http://hivresist.pcr.ru/). Кроме того, должны предоставляться «Сведения о мероприятиях по профилактике ВИЧ-инфекции, гепатитов В и С, выявлению и лечению больных ВИЧ» по разделу «Мониторинг резистентности к АРВП» (прилож. 5).
Для работы с базой данных по резистентности ВИЧ к антиретровирусным препаратам необходимо назначить ответственного исполнителя. Заявку на регистрацию на сайте «Российская база данных устойчивости ВИЧ к антиретровирусным препаратам» (прилож. 6) необходимо направить в Федеральный научно-методический центр по профилактике и борьбе со СПИД ФГУН «ЦНИИ эпидемиологии» Роспотребнадзора по электронной почте epid@hivrussia.net или по факсу 8 (495) 365-46-80.
11. Распространение результатов
Результаты о проведенных в России исследованиях по надзору за циркуляцией генетических вариантов ВИЧ должны быть представлены специалистам в области противодействия эпидемии ВИЧ-инфекции и заинтересованной общественности на интернет сайте «Российская база данных устойчивости ВИЧ к антиретровирусным препаратам» (http://hivresist.pcr.ru/, а также в виде буклетов, научных статей и презентаций.
В целях информирования всех заинтересованных в результатах исследований сторон федеральная рабочая группа по резистентности к антиретровирусным препаратам на основании данных, предоставленных регионами Российской Федерации должна ежегодно составлять и распространять отчет с анализом распространения в стране генетических вариантов ВИЧ и рекомендациями по профилактике распространения резистентности к APB-препаратам, оптимизации диагностических исследований и разработке вакцин относительно доминирующих генетических вариантов ВИЧ.
12. Обозначения и сокращения
|
АРВ |
Антиретровирусные |
|
АРВП |
Антиретровирусные препараты |
|
APT |
Антиретровирусная терапия |
|
AT |
Антигены |
|
AT |
Антитела |
|
ВААРТ |
Высокоактивная антиретровирусная терапия |
|
ВТ |
Вирусный гепатит |
|
ВИЧ |
Вирус иммунодефицита человека |
|
ВИЧ-1 |
Вирус иммунодефицита человека первого типа |
|
ВН |
Вирусная нагрузка |
|
ВОЗ |
Всемирная организация здравоохранения |
|
ГФ |
Глобальный фонд (по борьбе со спидом, туберкулезом и малярией) |
|
ДНК |
Дезоксирибонуклеиновая кислота |
|
ИП |
Ингибиторы протеазы |
|
ИБ |
Иммунный блотинг |
|
ИППП |
Инфекции, передаваемые половым путем |
|
ИРП |
Индикаторы раннего предупреждения развития резистентности ВИЧ |
|
ИФА |
Иммуноферментный анализ |
|
КСР |
Коммерческие секс-работники |
|
ЛЖВ |
Люди, живущие с ВИЧ |
|
ЛПО |
Лечебно-профилактическая организация |
|
ЛУ |
Лекарственная устойчивость, синоним резистентность |
|
МЗСР |
Министерство здравоохранения и социального развития Российской Федерации |
|
МиО |
Мониторинг и оценка |
|
МСМ |
Мужчины, имеющие сексуальные отношения с мужчинами |
|
НИОТ |
Нуклеозидные ингибиторы обратной транскриптазы ВИЧ |
|
ННИОТ |
Ненуклеозидные ингибиторы обратной транскриптазы ВИЧ |
|
ОИ |
Оппортунистические инфекции |
|
ООН |
Организация объединенных наций |
|
ПЦР |
Полимеразная цепная реакция |
|
ПИН |
Потребители инъекционных наркотиков |
|
ППМР |
Профилактика передачи от матери к ребенку |
|
РНК |
Рибонуклеиновая кислота |
|
СПИД |
Синдром приобретенного иммунодефицита |
|
CD4 |
Клетки, несущие на своей поверхности клеточный рецептор СД4 |
|
ЮНЭЙДС |
Объединенная программа ООН по ВИЧ/СПИД |
13. Список сокращений названий
лекарственных АРВ-препаратов
|
Ф-АЗТ |
Фосфазид |
|
ЗТС |
Ламивудин |
|
АВС |
Абакавир |
|
ATV |
Атазанавир |
|
d4T |
Ставудин |
|
ddI |
Диданозин |
|
DLV |
Делавирдин |
|
DRV |
Дарунавир |
|
EFV |
Эфавиренз |
|
ENF |
Энфувиртид |
|
ETR |
Этравирин |
|
FPV |
Фосампренавир |
|
FTC |
Эмтрицитабин |
|
IDV |
Индинавир |
|
LPV/r |
Лопинавир/ритонавир |
|
MVC |
Маравирок |
|
NFV |
Нелфинавир |
|
NVP |
Невирапин |
|
RAL |
Ралтегравир |
|
RPV |
Рилпивирин |
|
RTV |
Ритонавир |
|
SQV |
Саквинавир |
|
TDF |
Тенофовир |
|
TPV |
Типранавир |
|
T-20 |
Энфувиртид |
|
ZDV |
Зидовудин |
14. Список литературы
1. Федеральный закон от 30 марта 1995 г. № 38-ФЗ «О предупреждении распространения в Российской Федерации заболевания, вызываемого вирусом иммунодефицита человека (ВИЧ-инфекция)».
2. Федеральный закон от 30 марта 1999 г. № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
3. Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации».
4. Постановление Главного государственного санитарного врача Российской Федерации от 11 января 2011 г. № 1 «Об утверждении СП 3.1.5.2826-10 «Профилактика ВИЧ-инфекции».
5. Постановление Главного государственного санитарного врача Российской Федерации от 13 февраля 2012 г. № 16 «О неотложных мерах по противодействию распространения ВИЧ-инфекции в Российской Федерации».
6. Методические рекомендации Министерства здравоохранения и социального развития Российской Федерации от 6 августа 2007 г. № 5958-РХ «О проведении надзора за циркуляцией генетических вариантов вируса иммунодефицита человека, включая циркуляцию штаммов, резистентных к антиретровирусным препаратам».
7. Методические рекомендации Министерства здравоохранения и социального развития Российской Федерации от 6 августа 2007 г, № 5956-РХ «Определение чувствительности вируса иммунодефицита человека к лекарственным препаратам».
8. Shafer RW, Rhee SY, Pillay D et al. Hiv-1 protease and reverse transcriptase mutations for drug resistance surveillance. AIDS 2007; 21: 215 - 23.
9. Kuritzkes DR. HIV resistance: Frequency, testing, mechanisms. Top HIV Med 2007; 15: 150-4.
10. The Epidemiology of Transmission of Drug Resistant HIV-1 David A.M.C. van de Vijver, Annemarie M.J. Wensing, Charles A.B. Boucher, 2008, http://www.hiv.lanl.gov/content/ sequence/HIV/REVIEWS/reviews.html.
11. Little S, May S, Hecht F et al. Increase in transmitted nnrti drug resistance among recently HIV-infected patients from North America and Australia: Abstracts of the XV International Drug Resistance Workshop. Sitges, Spain, 2006.
12. Ross L, Florance A, Wine В et al. Prevalence of HIV-1 drug resistance associated mutations in a large cohort of antiretroviral therapy naive HIV-infected individuals in the United States from 200 - 2004.: Abstracts of the XV International Drug Resistance Workshop. Sitges, Spain, 2006.
13. Eshleman S, Husnik M, Hudelson S et al. Analysis of antiretroviral drug resistance and hiv-1 subtype among men who have sex with men recently infected with hiv-1 in the united states: The explore study: Abstracts of the XV International Drug Resistance Workshop. Sitges, Spain, 2006.
14. Bennett D, Smith A, McCormick L et al. Categorization of transmitted HIV drug resistance using the WHO/CDC HIV drug resistance threshold survey method: Abstracts of the XV International Drug Resistance Workshop. Sitges, Spain, 2006.
15. HIV transmission and primary drug resistance. Turner D, Wainberg MA. AIDS Rev 2006; 8: 17 - 23.
16. World Health Organization global strategy for the surveillance and monitoring of HIV drug resistance: an update. World Health Organization 2012, ISBN 978 92 4 150476 8, 24 p.
17. World Health Organization HIV Drug Resistance Global Report, July 2012; available at: http://www.who.int/hiv/pub/drugresistance/report2012/en/index.html.
18. The World Health Organization HIV Drug Resistance Assessment and Prevention Strategy: Global, Regional, and Country Progress. Michael R Jordan, Guest Editor. Clin Infect Dis. Volume 54, Supplement 4, May 2012.
19. Assessment of the HIV Drug Resistance Early Warning Indicators. Report of the Early Warning Indicator Advisory Panel, Geneva 11 - 12 August 2011. Available at: http://www.who.int/ hiv/pub/meetingreports/ewi_meeting_report/en/index.html.
20. Linda Wittkop et al. Effect of transmitted drug resistance on virological and immunological response to initial combination antiretroviral therapy for HIV (EuroCoord-CHAIN joint project): a European multicohort study. The Lancet Infectious Diseases, Volume 11, Issue 5, Pages 363 - 371, May 2011.
21. Liu TF, Shafer RW(2006). Web Resources for HIV type 1 Genotypic-Resistance Test Interpretation. Clin Infect Dis 42 (11): 1608 - 18. Epub 2006 Apr 28.
22. World Health Organization, Joint United Nations Program on HIV/AIDS, UNICEF. Global HIV/AIDS response. Epidemic update and health sector progress towards universal access. Geneva, Switzerland. World Health Organization 2011. Available at: http://www.who.int/hiv/pub/ progress_report2011/en/indec/html.
23. Bennett DE et ah, Recommendations for surveillance of transmitted HIV drug resistance in countries scaling up antiretroviral treatment. Antivir Ther 2008; 13 (Suppl 2): 25 - 36.
24. Bennett DF,, Camacho RJ, Otelea D, et al. Drug Resistance Mutations for Surveillance of Transmitted HIV-1 Drug-Resistance: 2009 Update, PLoS One 2009; 4:e4724.
Приложение 1
|
НАПРАВЛЕНИЕ НА ОПРЕДЕЛЕНИЕ Исследование по первичной резистентности Дата забора крови: «__» _______ 20__ г. Код участника: ___________________________ Фамилия*: _______________ Имя: __________ Отчество: _____________ Пол: □ М □ Ж Дата рождения: ___________ Место проживания (регион, город): ___________________ Дата 1-го ВИЧ+ иммуноблота: ____________________ Результаты предыдущего обследования на ВИЧ: □ ВИЧ- □ ВИЧ± Дата предыдущего обследования: _______, вид проведенного исследования: _________ Стадия ВИЧ-инфекции: _____ Содержание CD4+ Т-кл.: ___ кл/мкл Дата исследования: _________________ Вирусная нагрузка ВИЧ: ____ копий/мл Дата исследования: _______________________ Код обследования на ВИЧ: ___ Код заражения ВИЧ: ____ Год, месяц инфицирования ВИЧ: ________ Получал ли АРВ-препараты: □ Да □ Нет Наличие беременности: □ Да □ Нет Срок: недель _______ Если беременность сохраняется, ожидаемая дата родов: _______ Если беременность прерывается, дата: _______ Направляющая организация: __________________Тел.: __________ Факс: ___________ Email: ___________ Ф. И. О. лечащего врача: ___________ Подпись: ________________ ________ * Фамилия, имя, отчество указывается только по желанию пациента; в этом случае в дальнейшем будет возможно учесть результаты этого исследования при выборе тактики лечения. Приложение 1, коды НАПРАВЛЕНИЕ НА ОПРЕДЕЛЕНИЕ Код обследования на ВИЧ 108 - доноры (крови, биологических жидкостей, органов и тканей). 115 - медицинский персонал, работающий с больными ВИЧ-инфекцией или инфицированным материалом. 102 - больные наркоманией. 103 - гомо- и бисексуалисты. 104 - больные заболеваниями, передающимися половым путём. 112 - лица, находившиеся в местах лишения свободы. 113 - обследованные по клиническим показаниям. 109 - беременные (доноры плацентарной и абортной крови). 118 - прочие. 120 - обследованные при эпидемиологическом расследовании. 200 - иностранные граждане. Коды причин заражении ВИЧ 100 - гомосексуальная связь с гомо/бисексуальным партнером, не употребляющим наркотики. 101 - гомосексуальная связь с наркопотребителем. 104 - гетеросексуальная связь с бисексуальным партнером, не употребляющим наркотики. 105 - гетеросексуальная связь с гетеросексуальным партнером, не употребляющим наркотики. 106 - гетеросексуальная связь с инъекционным потребителем наркотиков. 108 - наркотический контакт с инфицированным ВИЧ партнёром. 107 - бытовой парентеральный контакт с ВИЧ-инфицированным. 109 - переливание крови/пересадка органов от инфицированного ВИЧ донора. 110 - пребывание в нозокомиальном очаге. 111 - заражение детей от матерей во время беременности и родов. 112 - заражение детей от матерей при грудном вскармливании. 113 - заражение матерей от детей при грудном вскармливании. 114 - другая причина, указать. |
Приложение 2
|
Цель исследования Я понимаю, что центр по профилактике и борьбе со СПИД, _____________________ _____________________________________________________________ проводит исследование по резистентности (невосприимчивости) к антиретровирусным препаратам в регионах России. Целью исследования является изучение распространенности первичной устойчивости к антиретровирусным препаратам среди людей, инфицированных ВИЧ. Для достижения этой цели у людей, недавно получивших ВИЧ-положительный результат, будет произведен забор крови, проведен анализ медицинской документации и опрос о факторах, которые способствуют заражению ВИЧ и выработке резистентности ВИЧ. Компоненты исследования Я соглашаюсь сдать анализ крови однократно. У меня будет взята кровь для анализа устойчивости к антиретровирусным препаратам и определения разновидности (субтипа) вируса. Для этих исследований потребуется порция крови объемом около 5 мл. Я разрешаю доступ исследователям к результатам моих лабораторных тестов по определению CD4 и вирусной нагрузки, а также к данным о получении мной антиретровирусных препаратов. Никакая другая информация, связанная с моим участием в исследовании, в том числе результаты анкетирования, никому кроме исследователей доступна не будет. Значение данного исследования Я понимаю, что мое участие в исследовании не связано с непосредственной пользой для моего здоровья. Если я пожелаю указать мое имя при тестировании на устойчивость к антиретровирусным препаратам, то в дальнейшем эта информация может быть использована при выборе тактики лечения для меня. Данные, полученные в процессе исследования, смогут в будущем помочь другим путем улучшения подходов к лечению, тестированию и профилактике ВИЧ-инфекции. Прекращение участия в исследовании Я понимаю, что мое решение принять участие в исследовании является добровольным. Я также понимаю, что я имею право отказаться от участия в исследовании в любой момент. Конфиденциальность Я был(а) проинформирован(а), что настоящее исследование проводится группой исследователей под непосредственным руководством ____________________________, сотрудника учреждения ______________________________________________________. Мне понятно, что все данные, собранные в течение этого исследования, будут доступны исключительно исследовательской группе. Вся информация, данная мной, является сугубо конфиденциальной. Мое имя и фамилия не будут обозначены на анкетах и никогда не будут использованы в связи с какой-либо информацией, которую я сообщу. Все анкеты будут храниться в закрытом сейфе в исследовательском офисе. Формы согласия на участие в исследовании и допуск к медицинской информации будут храниться в закрытом сейфе отдельно от основных данных. Только если я сам(а) пожелаю указать мое имя при тестировании на устойчивость к антиретровирусным препаратам, то в дальнейшем эта информация может быть использована при выборе тактики лечения ВИЧ-инфекции для меня.
Дата _____________________ |
Приложение 3
|
НАПРАВЛЕНИЕ НА ОПРЕДЕЛЕНИЕ Исследование по мониторингу резистентности к антиретровирусным препаратам Дата забора крови: «__» __________ 20__ г. Код участника: ________________________ Фамилия*: ________________Имя: __________ Отчество: ________________Пол: М Ж Дата рождения: ___________ Место проживания (регион, город): ___________________ Дата 1-го + иммуноблота: _____ Стадия ВИЧ-инфекции: __________ в фазе __________ Содержание CD4+ Т-кл.: _____ кл/мкл
Показания к направлению: ____________________________________________________ Направляющая организация: __________________ Тел.: __________Факс: ___________ Email: ___________ Ф. И. О. лечащего врача: ____________ Подпись: _______________ ________ * Фамилия, имя, отчество указывается только по желанию пациента; в этом случае в дальнейшем будет возможно учесть результаты этого исследования при выборе тактики лечения. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
Приложение 4
|
ДОНЕСЕНИЕ О РЕЗУЛЬТАТАХ ИССЛЕДОВАНИЯ Дата направления анализа: _______________________________ Дата проведения исследования на резистентность ВИЧ: ___________________________ Показание к направлению на резистентность: ____________________________________ Федеральный идентификационный номер пациента: __________________ Региональный номер пациента: ________________ Дата рождения: ________ Район места жительства (регистрация): ________ Пол: М Ж Дата 1-го ВИЧ+ иммуноблота: ____ Результаты предыдущего обследования на ВИЧ+ ВИЧ- ВИЧ± Дата предыдущего обследования: _______ Вид проведенного исследования: ______________ Код обследования на ВИЧ: _____ Код заражения ВИЧ: ______ Год, месяц инфицирования ВИЧ: _______ Получал ли АРВ-препараты: □Да □ Нет Наличие беременности: □ Да □ Нет Срок: недель _______ Если беременность сохраняется, ожидаемая дата родов: ___ Если беременность прерывается, дата: ____ Стадия ВИЧ-инфекции: ______ в фазе ____
Последовательность РНК ВИЧ (сиквенс, файл тест-системы) ___________________ ___________________________________________________________________________ Направляющая организация ________________________________________________ Должность __________________ Ф. И. О. врача, заполнившего форму _______________ Коды
для донесения о результатах исследования по определению Код показания к направлению образца на исследование 1 - Направление образца по клиническим показаниям согласно рекомендациям для назначения исследования крови на резистентность ВИЧ к АВР-препаратам. 2 - Исследования по протоколу эпидемиологического надзора за случаями передачи резистентных штаммов к АРВ-препаратам от пациента к пациенту (по первичной резистентности у сероконвертеров, не имеющих опыта получения АРВ-препаратов). 3 - Исследования по протоколу мониторинга распространенности резистентности к АРВ-препаратам среди пациентов, получающих APT первой линии. Код обследования на ВИЧ 108 - доноры (крови, биологических жидкостей органов и тканей). 115 - медицинский персонал, работающий с больными ВИЧ-инфекцией или инфицированным материалом. 102 - больные наркоманией. 103 - гомо- и бисексуалисты. 104 - больные заболеваниями, передающимися половым путём. 112 - лица, находившиеся в местах лишения свободы. 113 - обследованные по клиническим показаниям. 109 - беременные (доноры плацентарной и абортной крови). 118 - прочие. 120 - обследованные при эпидемиологическом расследовании. 200 - иностранные граждане. Коды причин заражения ВИЧ 100 - гомосексуальная связь с партнером, не употребляющим наркотики. 101 - гомосексуальная связь с наркопотребителем. 104 - гетеросексуальная связь с бисексуальным партнером, не употребляющим наркотики. 105 - гетеросексуальная связь с гетеросексуальным партнером, не употребляющим наркотики. 106 - гетеросексуальная связь с инъекционным потребителем наркотиков. 108 - наркотический контакт с инфицированным ВИЧ партнёром. 107 - бытовой парентеральный контакт с ВИЧ-инфицированным. 109 - переливание крови/пересадка органов от инфицированного ВИЧ донора. 110 - пребывание в нозокомиальном очаге. 111 - заражение детей от матерей во время беременности и родов. 112 - заражение детей от матерей при грудном вскармливании. 113 - заражение матерей от детей при грудном вскармливании. 114 - другая причина, указать. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Приложение 5
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Приложение 6
Примечание. 1. Просим направлять заявку в Роспотребнадзор и Федеральный научно-методический центр по профилактике и борьбе со СПИД по электронной почте epid@hivnassia.net или факсу 8 (495) 365-46-80. 2. Контактное лицо: Ладная Наталья Николаевна Тел.: 8 (495) 365-30-09, 366-05-18. 3. После того как будет проведена регистрация организации в Федеральном научно-методическом центре по профилактике и борьбе со СПИД, на имя и e-mail контактного лица, указанного в заявке, будет выслан индивидуальный логин и пароль. 4. Ввод индивидуального логина и пароля на сайте «Российская база данных устойчивости ВИЧ к антиретровирусным препаратам» (http://hivresist.pcr.ru/) будет расцениваться как электронная подпись назначенного ответственного исполнителя. 5. Для предотвращения несанкционированного доступа на сайт «Российская база данных устойчивости ВИЧ к антиретровирусным препаратам» просим индивидуальный логин и пароль сохранять в безопасном месте. |
Приложение 7
1. Отчетную форму «Донесение о результатах исследования по определению лекарственной резистентности ВИЧ» составляют лечебно-профилактические организации всех профилей, осуществляющие исследования по определению резистентности ВИЧ к антиретровирусным препаратам (АРВП) в Российской Федерации, независимо от их организационно-правовой формы и формы собственности.
2. Отчетную форму «Донесение о результатах исследования по определению лекарственной резистентности ВИЧ» на каждое проведенное исследование по определению резистентности ВИЧ к антиретровирусным препаратам (АРВП) в Российской Федерации представляют в следующем порядке и следующие сроки:
2.1. Лечебно-профилактические и научные учреждения всех профилей, независимо от их организационно-правовой формы и формы собственности, представляют донесение в Референс-центр по мониторингу ВИЧ и ВИЧ-ассоциированных инфекций (ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора) 10 числа месяца, следующего за отчетным.
2.2. Референс-центр по мониторингу ВИЧ и ВИЧ-ассоциированных инфекций (ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора) представляет сводный отчет «Сведения о мероприятиях по профилактике ВИЧ-инфекции, гепатитов В и С, выявлению и лечению больных ВИЧ» по разделу «Мониторинг резистентности к АРВП» (месячный, годовой) в целом по Российской Федерации и в разрезе субъектов Российской Федерации в Федеральную службу по надзору в сфере защиты прав потребителей и благополучия человека 15 числа после отчетного месяца.
3. В форму «Донесение о результатах исследования по определению лекарственной резистентности ВИЧ» собирают информацию из учетно-отчетных форм медицинской документации: № 025/у-04 «Медицинская карта амбулаторного больного», № 112/у «История развития ребенка», № 003/у «Медицинская карта стационарного больного», № 30/у-04 «Контрольная карта диспансерного наблюдения», № 266/у-88 «Оперативное донесение о лице, в крови которого методом иммунного блотинга определены антитела к ВИЧ».
4. В целях реализации основных направлений по расширению электронного делооборота, указанных Правительством и Президентом, ускорения перехода на компьютерные технологи в сфере мониторинга, надзора и контроля, а также для обеспечения удобства в работе, донесения должны предоставляться в режиме он-лайн на сайте «Российская база данных устойчивости ВИЧ к антиретровирусным препаратам» (http://hivresist.pcr.ru/).
5. Допускаются к работе с базой данных по резистентности ВИЧ к антиретровирусным препаратам назначенные руководителем учреждения ответственные исполнители, зарегистрированные в Федеральном научно-методическом центре по профилактике и борьбе со СПИД и получившие логин и пароль.
6. Ввод индивидуального логина и пароля на сайте «Российская база данных устойчивости ВИЧ к антиретровирусным препаратам» (http://hivresist.pcr.ru/) будет расценен как электронная подпись назначенного ответственного исполнителя. Для предотвращения несанкционированного доступа на сайт «Российская база данных устойчивости ВИЧ к антиретровирусным препаратам» рекомендуется индивидуальный логин и пароль сохранять в безопасном месте.
7. Заполнение формы «Донесение о результатах исследования по определению лекарственной резистентности ВИЧ» осуществляется на интернет сайте «Российская база данных устойчивости ВИЧ к антиретровирусным препаратам» (http://hivresist.pcr.ru/). Для ввода формы необходимо зайти на сайт «Российская база данных устойчивости ВИЧ к антиретровирусным препаратам» (http://hivresist.pcr.ru/), выбрать пункт «Личный кабинет», ввести логин и пароль, нажать кнопку «войти».
8. Для заполнения формы «Донесение о результатах исследования по определению лекарственной резистентности ВИЧ» необходимо выбрать пункт «ввод результатов исследования», после чего появится табличная форма для ввода данных. Заполнение формы следует начать с графы «проект исследования». В графе «проект исследования» из ниспадающего списка выбрать «диагностика». Далее графы заполняются последовательно. Графы, обязательные для заполнения, указаны звездочкой (*).
8.1. В графе «Региональный номер пациента» необходимо ввести индивидуальный номер, присвоенный пациенту в региональной базе данных. Использование в качестве регионального номера пациента фамилии или любой другой личной информации категорически не допускается.
8.2. В графе «Регион места жительства» выбрать из списка наименование субъекта Российской Федерации и города, где зарегистрирован пациент.
8.3. В графе «Дата рождения» указать число/месяц/год рождения пациента.
8.4. В графе «Пол» указать пол пациента.
8.5. В графе «Дата последнего отрицательного анализа» указать число/месяц/год последнего отрицательного анализа пациента на ВИЧ.
8.6. В графе «Дата первого ВИЧ+ иммуноблота» указать число/месяц/год, когда у пациента был получен первый положительный результат ИБ на ВИЧ.
8.7. В графе «Год, месяц инфицирования ВИЧ» указать предположительный месяц и год инфицирования ВИЧ в соответствии с картой эпидемиологического расследования случая ВИЧ-инфекции.
8.8. В графе «Код обследования на ВИЧ» из ниспадающего списка выбрать код обследования на ВИЧ в соответствии с отчетной формой федерального государственного статистического наблюдения № 4 «Сведения о результатах исследования крови на антитела к ВИЧ» или приложением «Коды для донесения о результатах исследования по определению лекарственной резистентности ВИЧ».
8.9. В графе «Код заражения ВИЧ» из ниспадающего списка выбрать код причины заражения в соответствии с картой эпидемиологического расследования случая ВИЧ-инфекции и приложением «Коды для донесения о результатах исследования по определению лекарственной резистентности ВИЧ», если причина заражения не указана в ниспадающем списке, то выбрать «другая причина», и в окне «если другая, то что именно», указать причину.
8.10. В графе «Дата предыдущего обследования» указать число/месяц/год, когда был последний раз получен отрицательный результат ИФА, ИБ, ПЦР на ВИЧ или неопределенный результат ИБ, если ранее выбран пункт «ВИЧ+/-».
8.11. В графе «Вид проведенного исследования» выбрать вид проведенного исследования: «ИФА», «ИБ», «ПЦР».
8.12. В графе «Результаты предыдущего обследования на ВИЧ» выбрать: при наличии предыдущего (последнего до положительного результата) неопределенного результата - «ВИЧ+/-», при наличии только предыдущего отрицательного результата - «ВИЧ-», при отсутствии данных о предыдущем исследовании - «неизвестно».
8.13. В графе «Стадия ВИЧ-инфекции» из ниспадающего списка выбрать стадию ВИЧ-инфекции, которая была диагностирована у пациента на момент забора образца.
8.14. В графе «Дата направления на анализ на резистентность ВИЧ» необходимо указать число/месяц/год, когда пациент был направлен на проведение анализа на резистентность ВИЧ.
8.15. В графе «Дата проведения исследования на резистентность ВИЧ» необходимо указать число/месяц/год проведения анализа на резистентность ВИЧ.
8.16. В графе «Получал ли APB-препараты» указывается, принимал ли пациент когда-либо до момента забора образца для исследования на резистентность APB-препараты по любой причине.
8.17. В графе «Наличие беременности на момент забора образца» (доступна только если пол пациента указан как «женский») указывается, была ли женщина беременна на момент забора образца для исследования на резистентность. Если да, то в графе «срок беременности (нед.)» из ниспадающего списка выбрать срок беременности на момент забора образца. В графе «Если беременность сохраняется, ожидаемая дата родов» указать число/месяц/год предполагаемых родов. В графе «если беременность прерывается, дата» указать число/месяц/год предположительного прерывания беременности.
8.18. Заполнение графы «Все применявшиеся схемы АРВ-терапии» (доступна только если в графе «Получал ли APB-препараты» указано «ДА») следует начинать с заполнения схемы 1, где необходимо указать схему терапии, применяемую в настоящий момент, или последнюю применявшуюся схему терапии. Для этого, необходимо галочками отметить применяемые (приметавшиеся) в схеме терапии препараты. Указать число/месяц/год начала применения терапии, число/месяц/год окончания применения данной схемы терапии и указать причину отмены/замены терапии. В случае применения данной схемы терапии по настоящий момент указать число/месяц/год начала применения терапии и поставить галочку рядом с графой «по настоящий момент». В случае, если пациент получал препараты до схемы 1, необходимо нажать кнопку «Добавить схему» и заполнить информацию о предыдущей схеме. Аналогичным образом ввести информацию о 5 последних схемах терапии, применявшихся у данного пациента.
8.19. В графе «Вирусная нагрузка» указать число/месяц/год и результаты анализа на вирусную нагрузку до начала текущей схемы APT, минимальный показатель во время текущей схемы APT и последний показатель, но как минимум результаты одного исследования.
8.20. В графе «Показание к направлению на резистентность» из ниспадающего списка выбрать соответствующую причину, а именно: 1. «Направление образца по клиническим показаниям», согласно рекомендациям для назначения исследования крови на резистентность ВИЧ к АВР-препаратам; 2. «Исследования по протоколу эпидемиологического надзора за случаями передачи резистентных к АРВ-препаратам штаммов от пациента к пациенту» - вид специального научного исследования по надзору за случаями передачи резистентных к АРВ-препаратам штаммов от пациента к пациенту, проводится среди людей, недавно зараженных ВИЧ, и не имевших опыта получения АРВП; 3. «Исследования по протоколу мониторинга распространенности резистентности к APB-препаратам среди пациентов, получающих APT первой линии» -вид специального научного исследования по надзору за случаями выработки резистентных штаммов у пациентов на APT первой линии. Виды исследований рекомендованы в соответствии с настоящими методическими рекомендациями. Если в ниспадающем списке причина не значится, то необходимо выбрать «другое».
8.21. В графе «Содержание CD4+ кл.» указать число/месяц/год и результат последнего анализа.
8.22. В графе «Файлы электрофореграмм» нажать кнопку «Выберите файл» и выбрать файлы электрофореграмм (файлы с расширением .abl или .scf).
8.23. В графе «Нуклеотидная последовательность» ввести полученную нуклеотидную последовательность в простом текстовом формате.
8.24. Графа «комментарии по образцу» не является обязательной для заполнения, однако остается активной в заданном режиме. Если в процессе работы с образцом возникли какие-то замечания, то их следует изложить в этой графе.
8.25. В графе «Анализируемый участок нуклеотидной последовательности» указать исследуемый участок нуклеотидной последовательности.
8.26. После завершения ввода данных следует нажать кнопку «Сохранить», после этого будет произведена проверка правильности заполнения данных. В случае обнаружения ошибок они будут отмечены и их необходимо исправить.
8.27. После введения на. сайте донесений на все проведенные исследования по определению лекарственной резистентности ВИЧ в отчетном месяце данные необходимо направить на авторизацию. При необходимости редактирование данных возможно только до того, как они будут авторизованы. Авторизация данных должна проводиться ежемесячно 10 числа после отчетного месяца. Загруженные данные направляются в Референс-центр по мониторингу ВИЧ и ВИЧ-ассоцированных инфекций только после проведения авторизации.
9. Порядок авторизации данных (подтверждение и разрешение на передачу данных): в главном меню выбрать пункт «авторизация данных». Указать период, за который происходит авторизация данных, для этого указать: с «число/месяц/год» по «число/месяц/год». Нажать кнопку «фильтровать по дате». Нажать кнопку «Авторизация данных за период».
9.1. Для отправки данных необходимо нажать кнопку «авторизовать». Должна появиться надпись «Спасибо, данные авторизованы».