 | Информационная система |  |
3.2. Профилактика паразитарных заболеваний
Методические указания МУК 4.2.735-99
"Паразитологические методы лабораторной
диагностики
гельминтозов и протозоозов"
(утв. Главным государственным санитарным врачом РФ 25 февраля 1999 г.)
Дата введения: 25 апреля 1999 г.
Введены впервые
1. Область применения и нормативные ссылки
Лабораторные исследования на гельминтозы и протозоозы проводятся клинико-диагностическими лабораториями лечебно-профилактических учреждений, ведомственными лабораториями (НИИ, вузов, военных госпиталей, частных клиник и т.п.), а также другими лабораториями, имеющими лицензии или аккредитованными в системе Госстандарта и Госсанэпиднадзора для проведения данных исследований в независимости от формы собственности.
На центры Госсанэпиднадзора возлагается организация работы по обследованию населения на гельминтозы и протозоозы, методическое руководство, контроль за качеством работы, проводимой клинико-диагностическими лабораториями лечебно-профилактических учреждений и ведомственных лабораторий, обследование населения по эпидемиологическим показаниям и с консультативной целью.
В настоящих методических указаниях использованы ссылки на:
- Санитарные правила и нормы СанПиН 3.2.569-96 "Профилактика паразитарных болезней на территории Российской Федерации". Госкомсанэпиднадзор России. - М., 1988;
- Санитарные правила СП 3.1/3.2.558-96 "Общие требования по профилактике инфекционных и паразитарных заболеваний". Госкомсанэпиднадзор России. - М., 1997;
- Инструкция по проектированию санитарно-эпидемиологических станций. СН 535-81. Госгражданстрой. - М., 1982;
- Система аккредитации испытательных лабораторий (центров) государственной санитарно-эпидемиологической службы Российской Федерации. Минздрав России и Госстандарт России, Федеральный центр Госсанэпиднадзора России. - М., 1997;
- Санитарные правила СП 1.2.731-99 "Безопасность работы с микроорганизмами III - IV групп патогенности и гельминтами". Федеральный центр госсанэпиднадзора Минздрава России. - М., 1999.
Настоящие методические указания являются обязательными при выполнении лабораторных исследований биологического материала от людей с целью обнаружения паразитирующих в организме гельминтов и простейших.
Насчитывается свыше 250 видов паразитирующих у человека гельминтов, вызывающих заболевания - гельминтозы. На территории нашей страны обнаружено около 100 видов гельминтов, из них более 20 имеют широкое, практически повсеместное распространение. К паразитарным заболеваниям относятся также протозойные инвазии, возбудителями которых являются простейшие одноклеточные организмы. В настоящее время известно около 50 видов простейших, способных вызывать у человека заболевания.
Важность качественной лабораторной диагностики паразитарных заболеваний определяется во многих случаях трудностью их клинической и эпидемиологической диагностики. Многие инвазии у людей, в т.ч. у детей, нередко протекают субклинически, латентно.
В связи с этим грамотная лабораторная диагностика инвазий приобретает неоценимое значение. Качество лабораторной диагностики и уровень выявляемости зависят от тщательного выполнения всех требований любой методики, правильного выбора материала для исследования, знания циклов развития гельминтов, простейших, а также путей выделения из организма человека, морфологического строения яиц гельминтов и различных форм простейших. На результат анализа также влияет: неправильный забор материала или длительное его хранение, а также отсутствие подготовки больного лечащим врачом перед лабораторным обследованием.
Разнообразие возбудителей, форм паразитирования, и способов выделения диагностических стадий определяет достаточно широкий спектр методов диагностики.
Методы лабораторной диагностики паразитарных заболеваний применяются:
- с диагностической целью;
- для контроля эффективности лечения паразитарных заболеваний;
- для оценки качества проведения комплекса противопаразитарных мероприятий;
- с целью выявления источников заражения;
- для установления уровня пораженности населения.
Данный документ включает паразитологические методы лабораторной диагностики наиболее распространенных паразитарных заболеваний.
2. Отбор проб и условия доставки материала в лабораторию для паразитологического исследования
Материалом для лабораторных паразитологических исследований на гельминтозы и протозоозы служит различный биологический материал от человека: дуоденальное содержимое, кал, ректальная слизь, моча, мокрота, отделяемое бронхов, кровь, биопсийные ткани и др.
2.1. Отбор проб и доставка фекалий (кала)
- Фекалии после дефекации отбирают из разных участков в количестве не менее 50 г (объем примерно от чайной до столовой ложки).
- Помещают в чистую (прокипяченную), сухую, стеклянную или пластмассовую посуду с крышками.
- Стерильная стеклянная (пластиковая) посуда требуется при заборе кала, для исследования на амебиаз.
- Кал должен быть доставлен в лабораторию и исследован в день дефекации, поэтому, как правило, доставляется утренний кал.
- Для обнаружения яиц стронгилоидеса кал доставляется и исследуется не позднее 1 ч после дефекации.
- Для обнаружения личинок стронгилоидеса, яиц анкилостомид и трихостронгилоид исследуется кал не позднее 4 ч после дефекации.
- Для обнаружения вегетативных (подвижных) форм дизентерийной амебы необходимо кал доставить и провести исследование не позднее 20 мин после дефекации или 40 мин, если это время кал сохранялся при температуре 4 °С.
- Для обнаружения вегетативных форм кишечных простейших (лямблий, диэнтамебы и др.) в жидком и полуоформленном "стуле" время от дефекации до исследования должно быть по возможности сокращено до минимума (не более 1 - 1,5 ч).
2.1.1. Отбор проб фекалий в консерванты
Используется:
- при невозможности исследования кала сразу же после дефекации или в день поступления материала в лабораторию.
Физический способ хранения фекалий:
- при низкой температуре от 0 до 4 °С не более суток.
Химические консерванты
1. Жидкость Барбагалло: раствор формалина на физиологическом растворе (3 мл формалина 40 % + 97 мл физраствора или 1 л дистиллированной воды + 30 мл формалина 40 % + 8,5 г хлорида натрия).
2. Раствор формалина 4 %-ный.
3. Смесь 4 %-ного раствора формалина с равным количеством глицерина.
4. Раствор уксусной кислоты от 3 до 10 %.
5. Растворы детергентов 1 - 1,5 %-ные - моющие средства типа "Лотос", "Экстра" (кроме биоактивных); перед приготовлением раствора из порошка удаляют влагу, выдерживая в сухожаровом шкафу при 100 °С в течение 2 ч.
Заливается кал одним из приготовленных консервантов в объеме 1:1 или 1 часть фекалий и 2 части раствора консерванта, при этом тщательно перемешивается индивидуальной палочкой.
Хранить фекалии в растворах консервантов можно от нескольких месяцев до года, при более длительном хранении возможно разрушение яиц гельминтов.
6. Для консервации простейших кишечника фекалии можно поместить в консервант Турдыева: 80,0 мл 0,2 %-ного раствора азотистокислого натрия (0,16 г NaNO2 + 80,0 мл воды дистиллированной) + 2,0 мл глицерина + 10 мл концентрированного формалина (аптечного) + 8,0 мл концентрированного раствора Люголя (см. п. 4.2.4.1).
Смешивать в соотношении: 1 часть кала и 3 части консерванта.
7. Химические консерванты для консервации и хранения взрослых гельминтов или их фрагментов:
- формалин 10 %-ный;
- спирт 70 %-ный;
- жидкость Барбагалло;
- глицерин.
8. Для консервации мышц с личинками трихинелл используется концентрированный раствор хлористого натрия (на 100 мл воды 40 - 50 г NaCl).
2.1.2. Отбор соскобов с перианальных складок
- Соскоб с перианальных складок можно забирать у обследуемого в лаборатории, или заранее выдавать пробирки с ватными тампонами, смоченными в глицерине, на шпателях или флаконы с глазными палочками, покрытыми специальным клеевым слоем (п. 4.2.3), предварительно проинструктировав обследуемого (если обследуется ребенок, то родителей ребенка) о способе забора материала и доставке его в лабораторию.
- Утром (вечером и утром обследуемому не подмываться) собрать соскоб с перианальных складок вокруг ануса методом "смыва" или "отпечатка" приготовленным ватным тампоном, смоченным в глицерине, или липкой лентой, или глазными стеклянными палочками со специальным клеевым слоем, как описано в п. 4.2.3.
- После забора соскоба шпатели вкладываются обратно в пробирку, липкая лента наклеивается на предметное стекло, а глазные палочки вкладываются в соответствующий флакон или специальный контейнер с штативами. Пробирки, флаконы, предметные стекла предварительно маркируются (при массовых обследованиях маркируются цифрами согласно списку обследуемых).
2.2. Отбор дуоденального содержимого (желчь)
- Материал доставляется в лабораторию в чистых химических или центрифужных пробирках сразу после зондирования пациента натощак.
- Доставляют все три фракции (порции "А", "В", "С") и исследуют сразу после поступления в лабораторию.
- Порцию "А" доставляют для исследования на патогенные простейшие двенадцатиперстной кишки (лямблии), личинки стронгилоидеса, трихостронгилид, анкилостомид.
- Порции "В" и "С" доставляют для исследования на яйца гельминтов, паразитирующих в протоках печени и поджелудочной железы.
2.3. Отбор проб мокроты
- Доставляется в лабораторию мокрота, выделенная при откашливании (не слюна и не слизь с носоглотки), в стерильной посуде с крышками (можно в чашках Петри).
- Исследуется сразу после поступления.
2.4. Отбор проб мочи
- Доставляется в лабораторию моча утреннего сбора в чистых стеклянных банках с крышками.
- Исследуется сразу после поступления в лабораторию.
- На шистосомоз - доставляется моча, собранная между 10 ч утра и 14 ч дня, или все порции суточной мочи; желательно собрать мочу после физической нагрузки (например, 20 - 30 приседаний).
2.5. Отбор проб эпидермиса кожи
- С участков кожи (где изменения кожи или зуд) делают несколько срезов.
- Поверхностные срезы кожи диаметром 2 - 3 мм делают бескровно, с соблюдением асептики, стерильным лезвием бритвы или глазным скальпелем, предварительно приподняв кожу кончиком стерильной иглы.
- Помещают кусочки кожи в стерильную стеклянную посуду (можно чашки Петри) с физраствором.
- Исследуют сразу после забора материала.
2.6. Биопсия мышечной ткани (поперечно полосатой мускулатуры)
- Хирургическим путем получают биопсированные кусочки двуглавой или икроножной мышц (ближе к сухожилию).
- Помещают в стерильную стеклянную посуду с физраствором.
- Исследуют сразу после биопсии.
- Если лабораторное исследование откладывается на какой то срок, пробы мышц помещают в консервант или замораживают. Консервантом может служить концентрированный раствор хлорида натрия (30 - 50 %).
2.7. Отбор проб для контроля эффективности лечения кишечных, печеночных гельминтозов и протозоозов
- После лечения геогельминтозов кишечника кал отбирается (п. 2.1) через месяц после проведенного лечения, а после лечения протозоозов кишечника кал отбирается (п. 2.1 и 2.1.1) в зависимости от выявленного заболевания: при амебиазе, балантидиазе - сразу после лечения, при лямблиозе - через неделю.
- После лечения контактных гельминтозов: при гименолепидозе кал отбирается (п. 2.1) через 1 и 6 месяцев после лечения; при энтеробиозе перианальный соскоб отбирается (п. 2.1.2) через 4 - 6 дней после лечения.
- После лечения биогельминтозов кал отбирается (п. 2.1 и 2.1.1) через 3 - 4 месяца после проведенного курса лечения.
- При первом отрицательном результате (исследования фекалий), отбор проб проводится еще двукратно с интервалом 2 - 4 дня, после чего ставится окончательный результат лабораторного анализа.
- После лечения инвазий желчевыводящих путей контроль эффективности можно проводить как при исследовании кала, так и желчи, применяя соответствующие методы лабораторного исследования.
- При стронгилоидозе контроль эффективности проводится только при исследовании желчи (даже, если паразит был обнаружен копроскопическими методами) через месяц после лечения.
3. Паразитологические методы лабораторной диагностики
Макро- и микроскопические паразитологические методы лабораторной диагностики являются прямыми методами обнаружения гельминтов, их фрагментов, яиц и личинок гельминтов; вегетативных и цистных форм патогенных простейших, при обнаружении и идентификации которых не требуются косвенные методы исследования.
Все микроскопические методы применяются по показаниям (см. описание в конце каждого метода).
При плановых и профилактических осмотрах детского контингента, а также при обследовании декретированных групп населения необходимо обследовать пациента одновременно методом перианального соскоба в сочетании с одним из копроовоскопических методов и методом нативного мазка с раствором Люголя.
При обследовании больного в направлении для лаборатории необходимо указать предварительный диагноз, что позволит лаборанту выбрать соответствующую методику для выявления или исключения данного вида возбудителя. При отсутствии в направлениях врачей четкого диагноза и затруднении в выборе эффективного метода лабораторного исследования на кишечные простейшие и гельминты больного лучше обследовать с применением "комплексного" метода исследования фекалий из консерванта или универсального метода формалин-эфирного (уксусно-эфирного) осаждения.
При применении большинства паразитологических методов лабораторной диагностики учитывается эпидемиологический анамнез пребывания обследуемого на эндемичной по тем или иным паразитарным заболеваниям территории, контакт с домашними животными, геофагия или употребление в пищу продуктов питания, которые могут явиться источником заражения, и т.д., а также результаты косвенных и клинических методов обследования больного (серологические исследования, результаты рентгеноскопии, УЗИ, результаты общего анализа крови и т.д.)
4. Исследование фекалий
4.1. Макроскопические методы
Макроскопические методы служат для обнаружения в кале целых половозрелых гельминтов или их фрагментов невооруженным глазом или с помощью ручной лупы.
4.1.1. Метод визуального осмотра фекалий с последующим последовательным промыванием фекалий
На поверхности кала после дефекации можно видеть активно ползающих остриц; иногда выделяются с калом аскариды; у больных дифиллоботриозом могут выделяться обрывки стробилы лентеца (в виде "лапши"), а у инвазированных тениидами (свиной или бычий цепень) с калом часто отходят членики гельминтов (в виде "белых обсечек"), членики бычьего цепня могут активно выползать из анального отверстия.
Фекалии сначала осматривают целиком, затем разводят дистиллированной водой до жидкой консистенции и небольшими порциями исследуют при хорошем освещении.
Для лучшего просмотра фекалий применяют способ отстаивания.
Необходимые реактивы и оборудование
1. Глицерин
2. Физиологический раствор
3. Дистиллированная вода
4. Химические стаканы
5. Чашки Петри
6. Черная бумага
7. Пинцеты
8. Препаровальные иглы
9. Предметные стекла большие (6×10; 8×12 см)
10. Лотки эмалированные
11. Лупа, микроскоп и стереоскопический микроскоп типа МБС
Ход исследования
- Размешать фекалии в большом количестве воды, в высоких стеклянных стаканах, банках и поставить отстаивать.
- Надосадочную жидкость слить, а осадок снова смешать с водой (таким образом проделывают несколько раз, пока надосадочный слой не станет прозрачным).
- Отливать отдельные небольшие порции в чашки Петри и тщательно просматривать под лупой, а лучше под стереоскопическим микроскопом МБС.
- Извлекать пинцетом или препаровальной иглой все подозрительные частицы и крупные образования на отдельное предметное стекло или чашку Петри.
- Образования, подозрительные на фрагменты гельминтов, рассматривать под лупой между двумя предметными стеклами или лучше под микроскопом МБС.
- Мелких гельминтов или сколексы цестод рассматривать в капле глицерина или физраствора под микроскопом при увеличении: окуляр ×7 или ×10, объектив ×8 или ×10.
- Микроскопия всех визуально обнаруженных в кале паразитов или фрагментов обязательна для уточнения морфологических особенностей и идентификации паразита.
Эффективность
- Эффективен для дифференциальной диагностики половозрелых гельминтов кишечника от непереваренных частиц и других включений кала и идентификации найденных паразитов.
- Достоверный метод при идентификации члеников бычьего и свиного цепня (т.к. обнаруживаемые при микроскопическом исследовании онкосферы у них идентичны, что не дает возможности дифференциальной диагностики), и наиболее эффективен в сочетании с методом опроса на отхождение у больного в момент дефекации "инородных" частиц.
Применение
- Перед методами микроскопии фекалий.
- При контроле эффективности лечения после применения лекарственных препаратов, не вызывающих деструкцию паразита.
- При идентификации зрелых паразитов или их фрагментов, например: для дифференциальной диагностики члеников цестод (бычьего, свиного цепня и широкого, чаечного лентеца).
4.2. Микроскопические методы
4.2.1. Копроовоскопия (исследование фекалий на яйца гельминтов)
4.2.1.1. Метод толстого мазка под целлофаном по Като и Миура
Толстый мазок представляет собой тонкий слой фекалий на предметном стекле под гигроскопическим целлофаном, пропитанным смесью глицерина и фенола.
Необходимые реактивы и оборудование
1. Глицерин
2. Фенол - 6 %-ный раствор (100 мл дистиллированной воды + 6 г фенола)
3. Малахитовый зеленый - 3 %-ный раствор (2,5 г малахитовой зелени + 75 мл дистиллированной воды)
4. Целлофан (гигроскопический)
5. Предметные стекла
6. Палочки стеклянные или деревянные
7. Валик или резиновая пробка
8. Микроскоп
Подготовка к работе
Приготовление рабочего раствора Като
100 мл 6 %-ного р-ра фенола + 100 мл глицерина + 1,2 мл 3 %-ного р-ра малахитового зеленого (раствор можно хранить длительное время в склянке из темного стекла с притертой крышкой).
Фенол дезинфицирует препарат; глицерин просветляет мазок; малахитовая зелень снимает напряжение глаз микроскописта.
При отсутствии фенола и малахитовой зелени можно использовать раствор глицерина (50 мл глицерина + 50 мл дистиллированной воды).
Подготовка целлофановых полосок
Нарезать полоски из гидрофильного целлофана (гидрофильный целлофан горит, в отличие от полиэтиленовой пленки, которая плавится и непригодна для исследования), чтобы их размер соответствовал размеру предметного стекла.
Полоски поместить в рабочий раствор Като не менее чем на 24 ч до проведения анализа. В 200 мл рабочего раствора можно обрабатывать до 5 тыс. новых целлофановых полосок.
Ход исследования
- На предметное стекло нанести 30 - 50 мг фекалий (размером с горошину). Растереть индивидуальной палочкой (стеклянной, деревянной).
- Фекалии накрыть целлофановой полоской, обработанной в растворе Като.
- Целлофан сверху притереть резиновой пробкой или специальным валиком, ширина которого соответствует или немного больше ширины предметного стекла, до получения тонкого, равномерного, прозрачного слоя.
- Препарат выдержать при комнатной температуре в течение 1 ч или в термостате при 40 °С в течение 20 - 30 мин.
- Микроскопировать при увеличении: объектив ×8 или ×10, окуляр ×7 или ×10 (для уточнения морфологического строения яиц гельминтов объектив ×40).
Эффективность метода
- Позволяет просмотреть в 20 - 30 раз больше фекалий, чем в нативном мазке.
- Выявляет яйца кишечных и печеночных гельминтов при высокой и средней интенсивности инвазии.
- Менее эффективен для выявления инвазий низкой интенсивности.
Применение метода
- Рекомендуется при массовых обследованиях населения на кишечные гельминтозы, например: при обследовании декретированных контингентов взрослого населения и детей организованных коллективов.
- В клинико-диагностических лабораториях, когда в направлениях врачей отсутствуют конкретные диагнозы или указания, на какие инвазии необходимо обследовать больного, что не позволяет лаборанту выбрать специальные методы лабораторной диагностики.
- Препараты, приготовленные методом Като, можно сохранять при комнатной температуре в течение длительного времени (за исключением яиц анкилостомид и карликового цепня) в качестве музейных препаратов.
4.2.1.2. Формалин-эфирный метод (седиментация)
Необходимые реактивы и оборудование
1. Раствор формалина 10 %-ный (10 мл формалина аптечного + 90 мл дистиллированной воды)
2. Этиловый эфир медицинский
3. Раствор Люголя 1 %-ный
4. Центрифужные градуированные пробирки
5. Воронки стеклянные
6. Металлическое ситечко чайное или бинт (марля)
7. Предметные и покровные стекла
8. Деревянные и стеклянные палочки
9. Пипетки
10. Резиновые пробки
11. Микроскоп
12. Центрифуга на 3000 об/мин.
Ход исследования
- В центрифужные градуированные пробирки налить 7 мл 10 %-ного раствора формалина.
- Добавить 1 г фекалий (такое количество фекалий, чтобы раствор в пробирке поднялся до 8 мл).
- Фекалии тщательно смешать при помощи палочки (индивидуальной для каждого обследуемого) с формалином до образования однородной смеси.
- Процедить через воронку с металлическим ситечком или двухслойным бинтом в другую центрифужную пробирку (чтобы в новой пробирке процеженного раствора снова было 8 мл, если меньше, то дополнительно можно сполоснуть 10 %-ным раствором формалина воронку с бинтом, через который процеживали раствор фекалий).
- Добавить в эту пробирку 2 мл эфира, т.е. до метки 10 мл, закрыть пробкой и энергично встряхивать в течение 30 с (встряхивать желательно в вытяжном шкафу, в горизонтальном положении, придерживая при этом пробку).
- Смесь центрифугируют при 3000 об/мин в течение 1 мин (или в течение 2 мин при 1500 об/мин).
- После центрифугирования в пробирке образуется 4 слоя: эфир, "каловая пробка", раствор формалина и на дне осадок, в котором будут содержаться яйца гельминтов и цисты простейших.
- "Каловую пробку" палочкой отделить от стенок пробирки и вместе с надосадочной жидкостью вылить, перевернув пробирку вверх дном, с краев пробирки убрать ватным тампоном лишнюю влагу, чтобы она не стекала на дно пробирки, перевернуть пробирку опять дном вниз.
- Осадок, оставшийся на дне пробирки, (весь) нанести на предметное стекло пипеткой или непосредственно из пробирки; капли должны быть небольшими, по 2 капли на одном предметном стекле.
- При исследовании на цисты простейших в одну из капель осадка внести каплю 1 %-ного раствора Люголя (приготовление в п. 4.2.4.1).
- Капли накрыть покровным стеклом (жидкость не должна выступать за края стекла или затекать на покровное стекло).
- Каплю с раствором Люголя исследуют на цисты и ооцисты простейших, а каплю без Люголя исследуют на яйца и личинки гельминтов.
- Микроскопировать: на яйца и личинки гельминтов при увеличении - объектив х 8 или ×10, окуляр ×7 или ×10, для уточнения морфологического строения яиц гельминтов - объектив ×40; на цисты простейших - объектив ×40.
Эффективность метода
- Эффективно выявляет инвазии с высокой, средней и низкой интенсивностью.
- Применяется для выявления яиц, личинок гельминтов кишечника и печени, цист и ооцист простейших кишечника, но практически не выявляет стадии трофозоитов.
- Не снижает эффективности при исследовании фекалий из консервантов.
Применение метода
- Применяется как универсальный метод диагностики кишечных и печеночных гельминтозов и протозоозов при диагностических и эпидемиологических обследованиях населения.
- Используется как специальный метод для диагностики трематодозов, включая описторхоз.
- Используется как количественный метод диагностики.
4.2.1.3. Уксусно-эфирный метод (седиментация)
Необходимые реактивы и оборудование
1. Водный раствор уксусной кислоты 5 %-ный (5 мл ледяной уксусной кислоты + 95 мл дистиллированной воды)
2. Раствор Люголя 1 %-ный
3. Этиловый эфир медицинский
4. Центрифужные градуированные пробирки
5. Воронки стеклянные
6. Металлическое ситечко чайное или двухслойный бинт
7. Предметные и покровные стекла
8. Палочки деревянные и стеклянные
9. Пипетки
10. Бинт (марля)
11. Резиновые пробки
12. Микроскоп
13. Центрифуга на 3000 об/мин
Ход исследования
- В центрифужные градуированные пробирки налить 5 мл 5 %-ного раствора уксусной кислоты.
- Добавить 1 г фекалий (количество фекалий, чтобы раствор в пробирке поднялся до 6 мл).
- Фекалии тщательно смешать с уксусной кислотой при помощи палочки (индивидуальной для каждого обследуемого), закрыть пробирку резиновой пробкой и интенсивно встряхнуть до образования однородной смеси и дать постоять 1 мин.
- Процедить через воронку с металлическим ситечком или двухслойным бинтом в другую центрифужную пробирку (чтобы в новой пробирке процеженного раствора снова было 6 мл, если меньше, то дополнительно можно сполоснуть 5 %-ным раствором уксусной кислоты воронку с бинтом, через который процеживали суспензию фекалий).
- Добавить в эту пробирку 4 мл эфира, т.е. до метки 10 мл, закрыть пробкой и энергично встряхивать в течение 30 с, держа при этом пробирку в горизонтальном положении (встряхивать в вытяжном шкафу, придерживая пробку), до получения эмульгированной смеси.
- Смесь центрифугируют при 3000 об/мин в течение 1 мин или в течение 2 мин при 1500 об/мин.
- После центрифугирования в пробирке различают 4 слоя: в верхней части пробирки эфирный экстракт, образовавшаяся "каловая пробка", раствор уксусной кислоты и на дне небольшой осадок.
Уксусная кислота эмульгирует фекалии, проникает в непереваренные частицы, состоящие преимущественно из клетчатки; удельный вес смеси эфира с уксусной кислотой меньше удельного веса воды, поэтому фекалии вместе с непереваренными крупными частицами клетчатки поднимаются в виде пробки в верхнюю часть пробирки, а яйца гельминтов и цисты простейших, обладающие большим удельным весом, выпадают в осадок.
- "Каловую пробку" круговым движением палочки отделить от стенок пробирки и вместе с надосадочной жидкостью вылить, при этом излишки влаги удалить ватным тампоном с края пробирки, оставив на дне осадок.
- Осадок (как правило, небольшой, бесцветный) нанести на предметные стекла пипеткой или непосредственно из пробирки, капли должны быть небольшими, по 2 капли на одном предметном стекле.
- Перед исследованием на цисты простейших в одну из капель осадка внести каплю 1 %-ного раствора Люголя.
- Обе капли накрыть покровным стеклом (осадок не должен выступать за края стекла или затекать на покровное стекло).
- Каплю с раствором Люголя исследуют на цисты и ооцисты простейших, а каплю без Люголя исследуют на яйца и личинки гельминтов.
- Микроскопировать: на яйца и личинки гельминтов при увеличении - объектив х 8 или ×10, окуляр ×7 или ×10, для уточнения морфологического строения яиц гельминтов - объектив ×40; на цисты простейших - объектив ×40.
Эффективность метода
- Эффективно выявляет инвазии с высокой, средней и низкой интенсивностью.
- Применяется для выявления яиц, личинок гельминтов кишечника и печени, цист и ооцист простейших кишечника, т.к. 5 %-ный раствор уксусной кислоты не оказывает деформирующего воздействия на цисты и ооцисты простейших (при исследовании оформленных и неоформленных фекалий), но не сохраняет стадии трофозоитов.
- Не снижает эффективности при использовании фекалий из консервантов.
Применение метода
- Применяется как универсальный метод диагностики кишечных и печеночных гельминтозов и протозоозов при диагностических и эпидемиологических обследованиях населения.
- Используется как специальный метод для диагностики трематодозов, включая описторхоз.
- Используется как количественный метод диагностики.
4.2.1.4. Химико-седиментационный метод
Необходимые реактивы и оборудование
1. Азотнокислый натрий
2. Раствор уксусной кислоты 1 %-ный
3. Раствор уксусной кислоты 10 %-ный
4. Эфир этиловый медицинский
5. Ареометр
6. Воронки стеклянные
7. Марля (бинт)
8. Центрифужные пробирки
9. Предметные и покровные стекла
10. Пипетки стеклянные
11. Стеклянные или деревянные палочки
12. Центрифуга
13. Микроскоп
Подготовка к работе
Приготовить рабочие растворы:
1) азотно-кислого натрия с удельным весом 1,15
- готовят из расчета 800 - 900 г вещества (необходимо подобрать количество индивидуально, т.к. химическое вещество из разных расфасовок может дать разный удельный вес) на 1 л горячей воды в эмалированной посуде, соль кладут в емкость с горячей водой порциями при подогревании на плите и постоянном помешивании до полного растворения;
- после остывания приготовленного раствора проводят измерение удельного веса ареометром при комнатной температуре.
Если раствор готовится заранее, необходимо приготовить с более высоким удельным весом, т.к. уже через 24 ч удельный вес начинает падать;
2) растворы уксусной кислоты 1 %-ный и 10 %-ный.
Ход исследования
- В градуированную центрифужную пробирку налить 6 мл рабочего раствора азотнокислого натрия.
- В другую пробирку налить 7 мл 1 %-ного раствора уксусной кислоты.
- В пробирку с уксусной кислотой внести пробу фекалий 0,5 - 1 г (до отметки 7,5 - 8 мл).
- Тщательно перемешать фекалии стеклянной палочкой.
- Процедить через воронку с одним слоем марли (бинта) в пробирку с азотно-кислым натрием.
- Центрифугировать при 1500 - 2000 об/мин в течение 5 мин.
- Слить надосадочную жидкость из пробирки.
- В пробирку с осадком добавить 3 - 4 мл 10 %-ного раствора уксусной кислоты и 0,5 мл эфира.
- Закрыть резиновой пробкой и, придерживая пробку, энергично встряхнуть (в вытяжном шкафу).
- Провести повторное центрифугирование в течение 1 мин.
- Слить надосадочную жидкость.
- Осадок перенести на предметное стекло пипеткой.
- Каплю (или несколько капель) осадка накрыть предметным стеклом.
- Микроскопировать при увеличении: объектив ×8 или ×10, окуляр ×7 или ×10; для уточнения морфологического строения яиц гельминтов - объектив ×40.
Эффективность метода
- После дополнительной обработки осадка химреактивами в нем остаются только яйца гельминтов, что облегчает их выявление.
- По эффективности выявления примерно одинаков с уксусно-эфирным осаждением, но более трудоемок.
Применение метода
Применяется для выявления яиц гельминтов кишечника, печени.
Примечание. В основе методов седиментации (осаждения), описанных в п. п. 4.2.1.2, 4.2.1.3, 4.2.1.4 лежит разность удельного веса используемых химреактивов и яиц гельминтов, когда удельный вес яиц большой и они концентрируются в осадке.
В основе методов флотации (всплывания) лежит разность удельного веса флотационного раствора и яиц гельминтов, удельный вес флотационного раствора выше, в результате яйца гельминтов всплывают на поверхность жидкости и обнаруживаются в поверхностной пленке.
Необходимые реактивы и оборудование
1. Один из флотационных растворов
2. Ареометр
3. Проволочная петля (из нескольких круглых петель диаметром от 0,5 до 1 см)
4. Предметные стекла (обезжиренные)
5. Пипетки стеклянные
6. Химические стаканчики емкостью 30 - 50 мл
7. Кюветы эмалированные
8. Чашки Петри
9. Стеклянные или деревянные палочки
10. Спиртовка
Подготовка к работе
Приготовление флотационного раствора (по одной из нижеописанных прописей).
1. Раствор нитрата аммония NH4NO3 (гранулированной или обычной селитры) плотностью 1,3 готовят из расчета 1500 г вещества на 1 л горячей воды.
2. Раствор нитрата натрия NaNO3 или азотнокислого натрия (предложенный автором Калантарян) с плотностью 1,38 - 1,4 готовят из расчета 1000 г вещества на 1 л горячей воды.
3. Раствор тиосульфата натрия Na2S2O3 × 5H2O (гипосульфита натрия) с плотностью 1,4 готовят из расчета 1750 г вещества на 1 л горячей воды.
А. Раствор сульфата натрия Na2SO4 или английской соли с плотностью 1,26 - 1,28 готовят из расчета 920 г вещества на 1 л горячей воды.
5. Насыщенный раствор хлорида натрия NaCl (поваренной соли) с плотностью 1,18 - 1,2 (предложенный автором Фюллеборном) готовят из расчета 400 - 420 г соли на 1 л кипящей воды.
Любую из выше предложенных солей растворяют в горячей воде в эмалированной посуде, причем кладут соль в емкость с горячей водой порциями при подогревании на плите и постоянном перемешивании до полного растворения.
Удельный вес флотационных растворов измеряется ареометром только после остывания раствора при комнатной температуре.
Измерение удельного веса флотационного раствора ареометром строго обязательно, т.к. приготовление раствора по прописи не гарантирует получение нужного удельного веса (например, когда используемая соль недостаточно химически чистая).
Фильтровать приготовленные растворы не обязательно. Если раствор приготовлен в большом количестве, то в последующие дни перед исследованием его подогревают с размешиванием осадка и после остывания раствора снова измеряют ареометром удельный вес.
Подготовка предметных стекол: предметные стекла обязательно обезжирить, например в смеси Никифорова (равные части этилового спирта и эфира).
Ход исследования
- В химический стаканчик объемом 30 - 50 мл налить немного одного из выше описанных флотационных растворов (стаканчик лучше предварительно поставить в чашку Петри).
- Поместить в стаканчик 2,5 г фекалий (объем с большой "боб").
- Тщательно размешать палочкой (индивидуальной для каждого обследуемого).
- Удалить сразу же после размешивания всплывшие крупные частицы палочкой (или ложечкой с дырочками).
- Одновременно добавлять постепенно солевой раствор до 50 мл.
- При снятии поверхностной пленки предметным стеклом, стекло должно соприкасаться с жидкостью, поэтому стаканчик накрывается предметным стеклом, а флотационный раствор добавляется пипеткой до полного соприкосновения с предметным стеклом.
- Оставить взвесь на несколько мин, экспозиция зависит от того какой флотационный раствор применяется: при применении прописи №№ 1 и 5 - экспозиция 30 - 60 мин; №№ 2, 3, 4 - 30 мин.
- После вышеуказанной экспозиции снять предметное стекло с химического стаканчика, перевернув кверху ту его поверхность, которой оно соприкасалось с жидкостью, и положить сухой поверхностью на стекло большего размера.
- Микроскопировать без покровного стекла при увеличении: объектив ×8, ×10, окуляр ×7, ×10, уточнение морфологического строения - окуляр ×40.
- При снятии поверхностной пленки проволочной петлей (лучше использовать петли с несколькими ячейками) целесообразно исследовать не менее 8 капель. Микроскопировать под покровным стеклом (можно и без покровного стекла, предварительно на предметное стекло нанеся каплю глицерина, в которой размазывают каплю с петли).
- Петли перед и после исследования обжигать на пламени спиртовой горелки.
Примечание. Целесообразнее использовать для снятия пленки предметные стекла, т.к. это наиболее просто в применении и площадь снятия поверхностной пленки значительно увеличивается.
Эффективность метода
- Наиболее эффективны методы флотации для обнаружения яиц нематод и цестод.
- Наиболее эффективно использование флотационного раствора с удельным весом 1,38 - 1,40 (всплывают и неоплодотворенные яйца аскарид).
- Неэффективен для выявления яиц трематод.
Применение метода
- Для обнаружения яиц гельминтов кишечника.
4.2.2. Копроларвоскопия (исследование фекалии на личинки гельминтов)
4.2.2.1. Метод Бермана (метод основан на положительном термо- и гидротаксисе личинок)
Необходимое оборудование
1. Штатив
2. Стеклянная воронка (диаметром 10 см)
3. Металлическое сито или сетка "мельничный газ"
4. Резиновая трубка с зажимом
5. Предметные стекла
6. Стеклянные или деревянные палочки
7. Чашки Петри
8. Центрифуга
9. Микроскоп
Подготовка к работе
Собрать аппарат Бермана, для чего закрепить в штативе стеклянную воронку с металлическим ситом. На нижний конец воронки надеть резиновую трубку с зажимом.
Ход исследования
- Пробу фекалий 20 - 50 г поместить на металлическое сито или мелкоячеистую металлическую сетку, или сетку "мельничный газ".
- Сетку с пробой фекалий приподнять и в воронку налить нагретую до 40 - 50 °С воду таким образом, чтобы нижняя часть сетки с калом была погружена в воду.
- Через 2 - 4 ч зажим на резиновой трубке быстро открыть и жидкость спустить в центрифужную пробирку.
- Полученную жидкость центрифугировать 1 - 2 мин.
- Надосадочную жидкость быстро слить.
Осадок нанести на предметное стекло или в чашку Петри.
Микроскопировать при увеличении: объектив ×8 или ×10, окуляр ×7 или ×10 (можно использовать стереоскопический микроскоп МБС), уточнение морфологического строения при увеличении: объектив ×40, окуляр ×10.
Эффективность метода
- Является эффективным методом выявления рабдитовидных личинок стронгилоидес.
- Эффективность методики возрастает при увеличении экспозиции фекалий в воде.
Применение метода
- Применяется как специальный метод для диагностики стронгилоидоза.
4.2.2.2. Метод Бермана в модификации Супряги
Необходимые реактивы и оборудование
1. Дистиллированная вода
2. Химические стаканчики
3. Стеклянные палочки
4. Чашки Петри
5. Пробирки центрифужные
6. Стереоскопический микроскоп МБС
Ход исследования
- В химический стаканчик положить порцию фекалий 10 - 15 г (величиной с орех).
- Залить теплой (40 °С) дистиллированной водой, чтобы фекалии были полностью покрыты.
- Через 20 - 30 мин слить жидкость в центрифужные пробирки.
- Отстаивают 10 - 15 мин или центрифугируют 1 мин при 1500 об/мин.
- Слить осторожно надосадочную жидкость, осадок поместить в чашку Петри.
- Исследовать осадок в чашке Петри под бинокулярным стереоскопическим микроскопом МБС (с нижней подсветкой) объектив ×2, окуляр ×12, ×14; обращая внимание на подвижных, слабоподвижных и неподвижных личинок.
- Неподвижные личинки микроскопируют с увеличением: объектив ×8, ×10 и ×40; окуляр ×10.
Эффективность метода
- Эффективен при высокой и средней интенсивности инвазии и менее эффективен при низкой интенсивности инвазии.
- Рекомендуется сочетать с исследованием дуоденального содержимого.
Применение метода
- Чаще используется для диагностики стронгилоидоза при массовых обследованиях.
- Данная методика может быть использована для диагностики простейших - балантидий, при экспозиции фекалий в воде до 1,5 - 2 ч (п. 4.2.4.3).
4.2.2.3. Метод культивирования личинок на фильтровальной бумаге (метод Харада-Мори в модификации Маруашвили)
Необходимое оборудование
1. Фильтровальная бумага (размером 16×3,5 см)
2. Стеклянная банка (0,7 - 0,8 л)
3. Полиэтиленовая пленка
4. Термостат
5. Центрифуга
6. Водяная баня
Ход исследования
- На фильтровальную бумагу нанести свежевыделенные фекалии в виде мазка, оставляя края фильтровальной бумаги свободными.
- Смочить стенки банки водой, опустить в банку фильтровальную бумагу и поверхностью без фекалий зафиксировать ее на стенках банки.
- Налить в банку воды так, чтобы в нее был погружен нижний конец бумаги без фекалий.
- Верх банки закрыть полиэтиленовой пленкой или чашкой Петри.
- Банку поставить в термостат при температуре 28 °С на 5 - 6 дней (в теплое время года банку можно оставлять при комнатной температуре, увеличив экспозицию до 8 - 10 дней).
- Часть личинок может подняться вверх по фильтровальной бумаге, поэтому работа должна проводиться с соблюдением техники безопасности.
- Для безопасности можно предварительно убить личинки, поместив пробирку в водяную баню при температуре 50 °С на 15 мин.
Эффективность метода
- Эффективен для обнаружения и идентификации личинок анкилостомид.
Применение
- Для диагностики анкилостомидозов.
4.2.3. Исследование перианальных соскобов
Необходимые реактивы и оборудование
Кроме микроскопа, необходимое оборудование зависит от способа получения соскоба: деревянный шпатель, шпатель с ватным тампоном, предметные и покровные стекла, полоски прозрачной липкой ленты, глазные палочки со специальным клеевым слоем и др.
Подготовка к работе
При массовых обследованиях населения (в основном детского) заранее подготовить шпатели с тампонами и пробирки, или предметные стекла с липкой лентой, флаконы, или специальные штативы с глазными палочками, покрытыми клеевым слоем. Промаркировать предметные стекла, пробирки или флаконы, либо маркировать во время забора материала у обследуемых, согласно номеру по списку. Методы отбора соскобов с перианальных складок см. п. 2.1.2.
Ход исследования: зависит от способа отбора материала.
4.2.3.1. Метод перианального соскоба липкой лентой по Грэхем
Примечание. Пригодна полиэтиленовая прозрачная пленка с липким слоем для детского технического творчества, но лучше использовать операционную пленку ЛПО-1, ЛПО-2.
- Подготовить отрезок липкой ленты длиной 8 - 10 см, предварительно наклеить его на предметное стекло.
- Перед взятием соскоба отклеить полоску липкой ленты от предметного стекла, держа полоску за концы, плотно прижать всей липкой поверхностью к анусу и перианальным складкам, стараясь пальцами рук не касаться перианальной области.
- Отклеить полоску от кожи перианальной области и перенести на предметное стекло липким слоем вниз, приклеить к стеклу равномерно для избежания образования воздушных пузырей, мешающих микроскопии.
- Концы ленты, выходящие за края стекла, отрезать.
- Микроскопировать при увеличении: объектив ×8 или ×10, окуляр ×7 или ×10.
Примечание. Метод применяется как для индивидуального, так и для массового обследования.
4.2.3.2. Метод перианального соскоба с применением стеклянных глазных палочек с клеевым слоем по Рабиновичу
Пропись клея: клеол - 10 мл, касторовое масло - 2,5 мл, этиловый эфир - 5 мл, этиловый спирт 96,5 %-ный - 2,5 мл (хранение во флаконе по 20,0 мл с плотно притертой пробкой).
- Подготовить стеклянные глазные палочки (лучше с широкими лопаточками): промыть, обезжирить и простерилизовать (кипячением или автоклавированием), высушить; сухую лопаточку глазной палочки обмакнуть в клей; просушить не менее 2 - 4 ч (глазная палочка при этом должна находиться лопаточкой вверх для стекания избытка клея и образования равномерной пленки).
- Клей, обтекая лопаточку, образует прозрачную клейкую пленку, сохраняющуюся после высыхания не менее недели (что позволяет готовить палочки заранее).
- Установить глазные палочки в специальный штатив, где каждая ячейка имеет свой номер, или использовать пронумерованные пенициллиновые флаконы, предварительно закрепив ручку глазной палочки в резиновой пробке от этого пузырька.
- Взять соскоб путем соприкосновения или "отпечатка" плоской частью лопаточки обеих сторон с кожей перианальных складок.
- Снова укрепить палочку в штативе или пенициллиновых пузырьках (промаркированных соответственно номеру, присвоенному обследуемому по списку, или регистрационному номеру в журнале) для доставки в лабораторию.
- Укрепить глазную палочку в специальном держателе для просмотра под микроскопом.
- Микроскопировать непосредственно плоскую поверхность лопаточки поочередно с обеих сторон при увеличении: окуляр ×7 или ×10, объектив ×8 или ×10.
- Использованные палочки дезинфицировать кипячением в мыльном растворе, тщательно промыть, прополоскать, обезжирить в смеси Никифорова, просушить в сухожаровом шкафу. Штатив и кассеты обработать 70 %-ным спиртом и промыть мыльно-содовым раствором. Пенициллиновые пузырьки и резиновые пробки дезинфицировать кипячением или автоклавированием.
Примечание. Метод гигиеничен и достаточно прост в применении, применяется как для индивидуального, так и для массового обследования.
4.2.3.3. Метод перианального соскоба по Торгушину
- Ватный тампон, накрученный на деревянном или стеклянном шпателе, смочить в растворе глицерина.
- Обтереть тампоном перианальные складки вокруг ануса.
- На предметное стекло поместить каплю глицерина.
- Слегка ударяя по предметному стеклу, обмыть тампон в капле глицерина.
- Полученный препарат микроскопировать без покровного стекла; увеличение: объектив ×8 или ×10, окуляр ×7 или ×10.
Примечание. Недостаток метода: часть яиц остается на ватном тампоне - неудобен при массовых обследованиях.
4.2.3.4. Метод перианального соскоба по Кеворковой
- Налить в центрифужную пробирку около 5 мл кипяченой или дистиллированной воды.
- Поместить в него шпатель (палочку) с ватным тампоном.
- Перед забором соскоба слегка отжать тампон о внутреннюю стенку пробирки.
- Обтереть тампоном перианальные складки.
- Вложить шпатель с тампоном в пробирку с водой.
- Тщательно прополоскать тампон в пробирке с водой и удалить шпатель с тампоном из пробирки.
- Полученный смыв центрифугировать в течение 3 мин при 1500 об/мин.
- Слить надосадочную жидкость.
- Осадок перенести на предметное стекло, покрыть покровным стеклом.
- Микроскопировать при увеличении: объектив ×8 или ×10, окуляр ×7 или ×10.
Примечание. Недостаток метода: неудобен при массовых обследованиях.
Эффективность методов соскоба
- Эффективны для выявления яиц гельминтов, находящихся на перианальных складках: яйца остриц и онкосферы тениид.
Применение метода
- Методы перианального соскоба применяются для диагностики энтеробиоза, тениаринхоза и тениоза при индивидуальной диагностике или массовом обследовании детского и взрослого населения.
4.2.4. Копропротозооскопия (исследование фекалий на кишечные простейшие)
4.2.4.1. Метод нативного мазка с физраствором и раствором Люголя
Необходимые реактивы и оборудование
1. Физиологический раствор
2. Раствор Люголя 1 %-ный
3. Буферный раствор метиленового синего
4. Уксусно-кислый спиртовой раствор йода
5. Предметные и покровные стекла
6. Деревянные палочки
7. Стеклянные пипетки
8. Стерильная стеклянная или пластиковая посуда (для забора фекалий)
9. Микроскоп
Подготовка к работе
Для исследования выбирают в первую очередь неоформленные фекалии, участки слизи или прожилки крови в кале.
Фекалии исследуют теплыми, т.е. не позднее 15 - 20 мин после дефекации, когда возможно обнаружение подвижных вегетативных форм (трофозоитов) простейших (время можно увеличить до 45 мин и до 1 ч, если фекалии сохранялись это время в холодильнике при температуре 4 - 5 °С).
Физиологический раствор подогреть до 36 - 37 °С.
Приготовление маточного 5 %-ного раствора Люголя: 10 г иодида калия растворить в 30 мл дистиллированной воды + 5 г кристаллического йода, размешать до полного растворения и долить до 100 мл дистиллированной водой. Хранить после приготовления в склянке из темного стекла.
Приготовление рабочего 1 %-ного раствора Люголя: 5 мл маточного 5 %-ного раствора Люголя соединить с 20 мл физиологического раствора, хорошо перемешать. Хранить в склянке из темного стекла не более 14 дней.
Приготовление буферного метиленового синего: 50 мл дистиллированной воды + 46,3 мл раствора уксусной кислоты (1,2 мл ледяной уксусной кислоты + 98,8 мл дистиллированной воды) + 3,7 мл раствора уксуснокислого натрия (1,6 г уксуснокислого натрия + 100 мл дистиллированной воды) + 0,5 г метиленового синего. Приготовленный раствор хорошо перемешивается, настаивается 15 мин и фильтруется.
Приготовление уксусно-кислого спиртового раствора йода: 10 мл спиртового раствора Люголя (40 мл 70 %-ного этилового спирта + несколько кристаллов йода, хорошо перемешать, раствор должен иметь цвет "крепкого чая") + 10 мл 25 %-ного раствора уксусной кислоты.
Ход исследования
- Нанести на предметное стекло 1 каплю изотонического теплого (36 - 37 °С) раствора в левой половине и 1 каплю 1 %-ного раствора Люголя в правой половине предметного стекла.
- Выбрать из пробы фекалий деревянной палочкой патологические примеси или немного фекалий (с булавочную головку) и перенести в каплю физраствора и растереть до получения равномерной негустой эмульсии, а затем поместить в каплю с Люголем и также растереть.
- Накрыть капли покровным стеклом (через правильно приготовленный мазок можно видеть газетный шрифт).
- Микроскопировать при увеличении: сначала - объектив ×8 или ×10, окуляр ×10, затем объектив ×40, в т.ч. для дифференциальной диагностики амеб и жгутиковых, включая лямблии и диэнтамебу.
Примечания.
1. Для дифференциальной диагностики трофозоитов дизентерийной амебы с непатогенными амебами необходимо приготовить препарат с буферным раствором метиленового синего: нанести на предметное стекло большую каплю буферного раствора метиленового синего, в нее внести деревянной палочкой небольшое количество слизи, фекалий с прожилками крови, накрыть покровным стеклом, дать постоять 5 - 10 мин, чтобы краска проникла в трофозоиты, и сразу микроскопировать для исключения перекрашивания трофозоитов.
Результат окрашивания: трофозоиты амеб окрашиваются в разные оттенки синего - ядро синее, цитоплазма голубая, эритроциты синие. Цисты амеб, трофозоиты, цисты жгутиковых и ооцисты кокцидий не окрашиваются.
2. Для выявления ооцист кокцидий: при выполнении вышеописанной методики приготовления нативного мазка с физраствором и 1 %-ным раствором Люголя, в одну из капель вместо 1 %-ного р-ра Люголя вносится капля уксусно-кислого спиртового раствора йода. Палочкой внести небольшое количество фекалий, растереть, накрыть покровным стеклом; микроскопировать при тех же увеличениях. Ооцисты изоспоры выявляются, благодаря хорошей окраске ядер.
Эффективность метода
- Позволяет выявлять вегетативные формы патогенных простейших и комменсалов, анализировать тип их движения (что имеет важное значение при видовой идентификации простейших, особенно жгутиковых).
- Диагностика амебиаза эффективна только при строгом соблюдении стерильного забора фекалий и микроскопического исследования не позднее 15 - 20 мин после дефекации.
- Позволяет определять видовые признаки цист амеб и жгутиковых, ооцист кокцидий, благодаря эффективной окраске йодом ядер, жгутикового аппарата, гликогена.
Применение метода
- Применяется для диагностики кишечных протозоозов: лямблиоза, балантидиаза, амебиаза, кокцидиоза (изоспороза).
- Для исследования на кишечные простейшие, в т.ч. на лямблии используются также методы: формалин-эфирного (уксусно-эфирного) осаждения и исследование дуоденального содержимого (см. описание методик в п. 4.2.1.2, 4.2.1.3, 5.1).
Примечание. В нативных препаратах с физиологическим раствором при интенсивной инвазии также можно обнаружить яйца гельминтов и личинки стронгилоидеса.
4.2.4.2. Комплексный метод исследования фекалий на кишечные простейшие и гельминты из консерванта
Универсальный метод диагностики кишечных паразитозов, вызываемых простейшими (амебы, жгутиковые, в т.ч. диентамеба, балантидии и кокцидий) и гельминтами (нематоды, трематоды и цестоды).
В основе метода лежит "диагностическая система" КТ-ФЭО-МЦН: консервант Турдыева, формалин-эфирное обогащение, модифицированный метод окраски Циля-Нильсена.
Принцип метода: отбор проб фекалий производят в консервант Турдыева (п. 2.1.1), где паразиты фиксируются, и морфологические признаки простейших, яиц и личинок гельминтов сохраняются неизменными длительное время, это обеспечивает дальнейшее исследование материала из единой пробы:
- методом влажного мазка из консерванта;
- методом мазка из осадка после эфир-формалинового обогащения консервированного материала;
- модифицированным методом окрашивания по Цилю-Нильсену мазка из осадка после обогащения материала из консерванта.
Эффективность комплексного метода
- Выявляет весь спектр кишечных паразитов, в т.ч. редко диагностируемых простейших (диэнтамеба, изоспора), яиц и личинок гельминтов, не требующих специальных методов исследования (например, культивирования и т.п.) включая возбудителей оппортунистических инвазий (кокцидий, стронгилоидес).
- Повышается выявляемость сочетанных инвазий.
Условия отбора материала: максимально быстро после дефекации с помощью деревянной палочки фекалии переносят в стерильный флакон с консервантом Турдыева (п. 2.1.1), если фекалии оформленные, то количество должно быть в объеме с лесной орех, если жидкие - объемом с чайную (столовую) ложку. Соблюдая соотношение: 3 части консерванта и 1 часть фекалий. Флакон закрывают крышкой, предварительно тщательно размешав фекалии деревянной палочкой до гомогенной суспензии.
4.2.4.2.1. Метод влажного мазка из консерванта
Необходимое оборудование и реактивы
1. Консервант Турдыева
2. Раствор Люголя 1 %-ный
3. Предметные и покровные стекла
4. Деревянные палочки
5. Микроскоп
Ход исследования
- На предметном стекле готовятся два препарата: пипеткой из консерванта с фекалиями, очень осторожно, не взбалтывая содержимое флакона, нанести две капли придонного осадка (в правой и левой части стекла).
- Растереть деревянной палочкой.
- В одну из капель добавить каплю раствора Люголя 1 %-ного.
- Каждую каплю накрывают покровным стеклом (покровные стекла можно окантовать вазелином для предотвращения высыхания и смещения покровного стекла).
- Микроскопируют при увеличении: объектив ×8 или ×10, окуляр ×7 или ×10, затем объектив ×40 (в отдельных случаях, например для криптоспоридий, применяют увеличение объектива ×90 или ×100 и микроскопируют с масляной иммерсией).
Эффективность метода
- Эффективен для выявления цист и трофозоитов простейших, включая редко выявляемую диентамебу, а также яиц и личинок гельминтов.
Применение метода
- Для диагностики кишечных протозоозов.
Примечание. Ооцисты при достаточном количестве обнаруживаются в верхнем слое мазка непосредственно под покровным стеклом по эффекту негативного окрашивания раствором Люголя.
4.2.4.2.2. Метод исследования материала из консерванта формалин-эфирным обогащением
Необходимое оборудование и реактивы
1. Физиологический раствор
2. Раствор Люголя 1 %-ный
3. Этиловый эфир
4. Раствор формалина 10 %-ный нейтральный (для нейтрализации - во флакон темного стекла с раствором формалина на дно слоем в 1 - 2 см насыпать порошкообразный углекислый кальций)
5. Палочки деревянные
6. Центрифужные градуированные пробирки
7. Воронки стеклянные
8. Бинт (марля)
9. Стекла предметные и покровные
10. Пипетки стеклянные
11. Пробки резиновые
12. Центрифуга
13. Микроскоп
Ход исследования
- Перенести пипеткой в центрифужную пробирку осадок фекалий со дна флакона с консервантом в объеме 1,5 - 2 мл.
- Добавить 6 - 7 мл 10 %-ного нейтрального формалина.
- Закрыть пробирку резиновой пробкой и тщательно перемешать, энергично встряхивая пробирку в течение 5 с.
- Полученную взвесь перелить в другую центрифужную пробирку через стеклянную воронку с двухслойным бинтом (марлей).
- Добавить 2 - 3 мл этилового эфира.
- Закрыть пробирку пробкой и энергично встряхивать в течение 30 с.
- Убрать пробку и дать постоять пробирке в течение 2 мин в вытяжном шкафу.
- Затем центрифугировать 2 мин при 1500 об/мин или 1 - 1,5 мин при 3000 об/мин.
- Отделить палочкой образовавшуюся "каловую пробку" от стенок пробирки.
- Перевернуть пробирку дном вверх и вылить содержимое (можно ватным тампоном обтереть стенки пробирки, чтобы жидкость не стекала на дно и не увеличивала объем осадка), пробирку поставить в штатив.
- На предметное стекло по обе стороны от центра нанести по капле физиологического раствора и раствора Люголя.
- Перенести в каждую каплю осадок из центрифужной пробирки, размешать деревянной палочкой и накрыть каждую каплю покровным стеклом.
- Микроскопировать при увеличении: объектив ×8 или ×10, окуляр ×7 или ×10, затем с объективом ×40 (при необходимости использовать окуляр ×90 или ×100 с масляной иммерсией).
Применение метода
- Для диагностики цист кишечных простейших и яиц гельминтов.
Необходимые реактивы и оборудование
1. Смесь Никифорова
2. Серная кислота 10 %-ная
3. Фуксин основной
4. Фенол
5. Палочки деревянные
6. Предметные стекла
7. Химические стаканчики или "мостики" для окрашивания мазков
8. Стеклянные пипетки
9. Кюветы эмалированные
10. Микроскоп
Ход исследования
- На предметное стекло нанести пипеткой каплю осадка из центрифужной пробирки после обогащения (п. 4.2.4.2.2) и круговым движением палочки приготовить мазок (можно добавить каплю физиологического раствора, чтобы мазок не был густым).
- Высушить на воздухе (тщательно).
- Фиксировать мазок в смеси Никифорова в течение 20 - 30 мин.
- После фиксации мазок высушить на воздухе.
- Окрашивать мазок в растворе карболового фуксина (приготовление в п. 4.2.4.4), поместив мазок в химический стаканчик с этой краской на 45 мин!
- Промыть мазок проточной водой.
- Обесцветить мазок в 10 %-ном растворе серной кислоты до прекращения отхождения розовых "облачков" красителя.
Промыть тщательно проточной водой.
- Подкрасить мазок 5 %-ным раствором малахитового зеленого, приготовленного на 10 %-ном этиловом спирте в течение 2 - 5 мин.
- Промыть мазок в воде.
- Высушить мазок на воздухе.
- Микроскопировать при увеличении: окуляр ×10, объектив ×90 или ×100 с масляной иммерсией.
Применение метода
- Для выявления ооцист кокцидий, включая криптоспоридии и изоспоры.
Эффективность
- Предварительная фиксация в консерванте и обогащение осаждением повышает выявляемость ооцист по сравнению со стандартной методикой диагностики ооцист кокцидий, включая криптоспоридии и изоспоры.
4.2.4.3. Метод Бермана в модификации для исследования на балантидиаз
Необходимые реактивы и оборудование
1. Дистиллированная вода
2. Химические стаканчики
3. Палочки деревянные
4. Чашки Петри
5. Пробирки центрифужные
6. Центрифуга
7. Микроскоп
Ход исследования
- В химический стаканчик или в чашку Петри положить порцию фекалий 10 - 15 г (величиной с орех), предварительно перемешав фекалии.
- Залить теплой (45 °С) дистиллированной водой, чтобы фекалии были полностью покрыты.
- Через 1,5 - 2 ч слить жидкость в центрифужные пробирки.
- Центрифугировать 2 мин при 1500 об/мин.
- Надосадочную жидкость слить, осадок с помощью стелянной пипетки перенести на предметное стекло (по 2 капли на каждое стекло), накрыть покровными стеклами.
- Микроскопировать при увеличении: объектив ×10, окуляр ×10; для уточнения морфологических особенностей: объектив ×40; окуляр ×10.
Эффективность метода
- Позволяет выявлять трофозоиты балантидий при низкой интенсивности инвазии.
Применение метода
- Для диагностики балантидиаза.
4.2.4.4. Методы окрашенных мазков на криптоспоридиоз (по Цилю-Нильсену; Романовскому-Гимзе)
Необходимые реактивы и оборудование
1. Реактивы: фуксин основной, этиловый спирт, фенол, раствор серной кислоты 7 %-ный (5 - 10 %-ный), раствор малахитовой зелени 5 %-ный в 10 %-ном этиловом спирте, водный раствор метиленового синего 0,2 %-ный, раствор малахитового зеленого 5 %-ный, азур-эозин по Романовскому-Гимзе 10 %-ный раствор, флотационные растворы
2. Предметные стекла
3. Стеклянные или деревянные палочки
4. Горелка (спиртовка)
5. Кюветы эмалированные
6. Мостики стеклянные или "контейнеры" для окраски мазков
7. Пипетки, стеклянные капилляры
8. Груши резиновые
9. Химические стаканчики
10. Центрифужные пробирки объемом 15 мл
11. Металлические петли
12. Центрифуга
13. Микроскоп
Подготовка к работе
Приготовление рабочего раствора краски по Цилю-Нильсену
- Фуксина основного 2 г растворить в 12 мл спирта 96°-ного.
- Фенола 5 г растворить в 50 мл дистиллированной воды.
- Слить вместе растворы фуксина и фенола, долить дистиллированной воды до 100 мл, перемешать.
Подготовка материала для исследования
Из фекалий приготовить мазок одним из следующих способов.
А) Нативный мазок
- Нанести на предметное стекло небольшое количество фекалий
- Растереть фекалии тонким слоем (при необходимости к комочку фекалий добавляют 1 - 2 капли физиологического раствора или воды)
- Тщательно высушить мазок на воздухе (не менее 30 мин)
Б) Обогащение флотационным методом
- Приготовить флотационный раствор (в качестве флотационного раствора использовать насыщенный раствор хлористого натрия или насыщенный раствор сульфата цинка - 331 г сульфата цинка на 1 л водопроводной воды)
- Разбавить фекалии водой, размешать
- Процедить разбавленные фекалии через 2-слойный бинт в центрифужную пробирку
- Центрифугировать при 1500 об/мин в течение 3 - 4 мин
- Удалить супернатант (объем оставшегося осадка не должен превышать 1 мл)
- Добавить флотационную жидкость до половины объема пробирки
- Размешать содержимое пробирки стеклянной палочкой
- Добавить флотационную жидкость до верхнего края пробирки
- Центрифугировать при 1500 об/мин в течение 3 - 4 мин
Собрать поверхностную пленку металлической петлей или стеклянным капилляром и поместить на предметное стекло
В) Обогащение методом седиментации
- Поместить в пробирку 0,5 - 1 г фекалий
- Залить 10 - 12 мл изотонического раствора хлорида натрия
- Перемешать содержимое пробирки до образования однородной суспензии
- Процедить суспензию через двойной слой марли в другую пробирку
- Центрифугировать
- Слить надосадочную жидкость
- Повторно залить осадок изотоническим раствором хлорида натрия
- Центрифугировать
- Слить надосадочную жидкость
- Перенести осадок пипеткой на предметное стекло
- Приготовить из осадка мазок
Ход исследования
Высушить мазки на воздухе (мазки, приготовленные одним из способов, описанных в п.п. А, Б, В).
- Фиксировать мазки в смеси Никифорова в течение 10 - 15 мин.
- Высушить на воздухе.
- Фиксированные и высушенные мазки быстро провести 3 - 5 раз над пламенем горелки.
- Поместить мазок в рабочий раствор карбол-фуксина на 5 - 10 мин.
- Промыть мазок водопроводной водой.
- Обесцветить мазок 7 %-ным раствором серной кислоты в течение 20 - 60 с.
- Промыть в воде.
- Подкрасить в течение 5 мин 5 %-ным раствором малахитовой зелени.
- Промыть в воде.
- Высушить на воздухе.
- Микроскопировать при увеличении: окуляр ×10, объектив ×90 или ×100 с масляной иммерсией.
Эффективность метода
- Метод окраски фиксированных мазков по Цилю-Нильсену считается одним из наиболее надежных для выявления ооцист криптоспоридий.
Результат: ооцисты криптоспоридий окрашиваются в разные оттенки ярко-красного цвета и имеют вид округлых образований диаметром около 5 мкм. Оболочка ооцист окрашивается фуксином неравномерно. Сопутствующая микрофлора окрашивается в зеленые цвета.
Применение метода
- Применяется для диагностики криптоспоридиоза.
Примечание. Для окрашивания фиксированных мазков можно применять и другие красители, например: Азур-эозином по Романовскому-Гимзе окрашивать от 10 до 30 - 45 мин в 10 %-ном растворе красителя при этом ооцисты не окрашиваются или слабо окрашиваются и имеют вид округлых образований, внутри ооцист (по периферии) могут быть в виде бледно-голубых удлиненных и слегка изогнутых телец (спорозоиты) с красноватыми гранулами внутри.
4.2.5. Количественные копроовоскопические методы
Количественными методами определяют число яиц гельминтов в 1 г или 1 мл фекалий. Данные методы дают ориентировочное представление об интенсивности инвазии, позволяют судить об эффективности лечения гельминтозов при частичном паразитологическом излечении.
4.2.5.1. Метод толстого мазка под целлофаном по Като-Кац (количественная модификация метода Като и Миура)
Необходимые реактивы и оборудование
1. Раствор Като (см. п. 4.2.1.1)
2. Целлофан гидрофильный
3. Предметные стекла
4. Валик или резиновая пробка
5. Микроскоп
6. Пластинка размером 40×30 мм (из пластмассы или металла) с отверстием в центре диаметром 6 мм
Ход исследования
- На предметное стекло поместить пластинку с отверстием.
- Произвольную навеску фекалий поместить на отверстие пластинки.
- Прокатать резиновой пробкой или пластмассовой разовой палочкой материал так, чтобы через отверстие в пластинке на стекло выдавилась стандартная навеска.
- Пластинку убрать.
- Препарат обработать по стандартной методике Като (см. п. 4.2.1.1).
- При микроскопии просматривается весь мазок и ведется подсчет обнаруженных яиц гельминтов.
- Чтобы определить количество яиц в 1 г фекалий: число яиц, обнаруженных в данном препарате, следует умножить на коэффициент, равный 24.
Применение метода
- Применяется для определения интенсивности инвазии при клинико-диагностических обследованиях и при массовых обследованиях для определения напряженности очага инвазии.
4.2.5.2. Методы формалин-эфирного и уксусно-эфирного осаждения
Методы основаны на исследовании 1 г фекалий (количество фекалий, внесенное в пробирку и вызвавшее подъем жидкости на 1 мл, равно 1 г). При просмотре всего осадка полностью методы дают возможность провести количественный учет обнаруженных яиц, т.к. количество яиц в осадке соответствует нахождению их в 1 г фекалий.
Описание методов см. п. 4.2.1.2 и 4.2.1.3.
5. Микроскопическое исследование дуоденального содержимого, мокроты и мочи
5.1. Исследования дуоденального содержимого
Необходимые реактивы и оборудование
1. Этиловый эфир
2. Центрифуга
3. Центрифужные пробирки
4. Предметные стекла
5. Пипетки
6. Чашки Петри
7. Палочки стеклянные или деревянные
8. Микроскоп
Подготовка к работе
Желчь в лабораторию должна быть доставлена сразу после зондирования. При подозрении на лямблиоз, стронгилоидоз, анкилостомоз, трихостронгилез тщательно исследуют порцию "А", исследование порций "Б" и "С" более информативно на печеночные трематодозы.
В желчи, исследуемой сразу после зондирования, обычно обнаруживаются вегетативные подвижные формы лямблий и подвижные личинки стронгилоидеса. При исследовании желчи через несколько часов после зондирования (но в день забора материала) обычно подвижность личинок стронгилоидеса и вегетативных форм лямблий не наблюдается.
Ход исследования
5.1.1. Исследования нативного мазка желчи
- Выбрать сгустки слизи, волокон, патологические примеси.
- Палочкой стеклянной или деревянной (можно пипеткой) нанести тонким слоем желчь на предметное стекло (мазок не должен стекать с предметного стекла).
- При исследовании в чашке Петри налить желчь тонким слоем на дно чашки.
- Микроскопировать без покровного стекла при увеличении: объектив ×8 или ×10, окуляр ×10; для уточнения морфологии яиц гельминтов и для исследования на простейших - объектив ×40.
Для обнаружения подвижных личинок стронгилоидеса можно микроскопировать в чашках Петри под стереомикроскопом МБС (окуляр ×2; объектив ×12,5 - 14).
5.1.2. Исследования желчи с центрифугированием
- При наличии в желчи большого количества слизи или гноя взболтать все порции с равным количеством эфира.
- Центрифугировать в центрифужных пробирках все порции дуоденального содержимого не менее 20 мин при 1500 - 2000 об/мин.
- Надосадочную часть желчи слить в отдельную емкость.
- Осадок перенести пипеткой или прямо из пробирки на предметное стекло.
- Микроскопировать без покровного стекла при увеличении: объектив ×8 или ×10, окуляр ×10; и для уточнения морфологии яиц гельминтов и для исследования на простейших - объектив ×40.
Для обнаружения подвижных личинок стронгилоидеса можно микроскопировать в чашках Петри под стереомикроскопом МБС (окуляр ×2; объектив ×12,5 - 14).
Эффективность метода
- Наиболее эффективно сочетание исследования желчи нативно и с центрифугированием.
- Исследование желчи на яйца трематод эффективно только при центрифугировании.
Применение метода
Для выявления яиц трематод (описторхиса, клонорха, фасциол, дикроцелий), вегетативных и цистных форм простейших - лямблий, личинок стронгилоидеса, трихостронгилид и анкилостомид.
5.2. Исследование мокроты, промывных вод бронхов, лаважной жидкости
5.2.1. Исследование мокроты
Необходимые реактивы и оборудование
1. Раствор NaOH или КОН 0,5 %-ный
2. Центрифужные пробирки
3. Предметные стекла, большие предметные стекла
4. Центрифуга
5. Микроскоп
Подготовка к работе
Мокроту, представляющую собой патологический секрет дыхательных путей вместе с отделяемым носоглотки и полости рта, собрать в стерильную (можно прокипяченную) стеклянную емкость с крышкой и исследовать сразу после доставки в лабораторию.
Исследуется мокрота, выделенная при откашливании (не слюна и не слизь с носоглотки).
При слизисто-гнойной мокроте для лучшего растворения слизи, гноя:
- мокроту смешать с равным объемом 0,5 %-ного раствора едкой щелочи;
- слегка подогреть пробирку на водяной бане;
- пробирку энергично встряхивать в течение 5 мин.
5.2.1.1. Исследование нативного мазка мокроты
Ход исследования
- Мокроту из стеклянной емкости пипеткой переносят на предметное стекло (лучше большое).
- Приготовить мазок путем равномерного растирания между двумя предметными стеклами или нанесения и равномерного растирания палочкой на большом предметном стекле.
- Микроскопировать при увеличении: объектив ×8 или ×10, окуляр ×10, для уточнения морфологических особенностей окуляр ×40.
5.2.1.2. Исследование мокроты с центрифугированием
Ход исследования
- Перелить мокроту в центрифужные пробирки.
- Центрифугировать в течение 3 - 5 мин при 1500 об/мин.
- Слить надосадочную жидкость.
- Перенести осадок пипеткой или сразу из пробирки на предметное стекло.
- Микроскопировать при увеличении: объектив ×8 или ×10, окуляр ×10, для уточнения морфологических особенностей окуляр ×40.
Эффективность метода
- Эффективен для выявления яиц гельминтов, паразитирующих в легких, бронхах (яйца парагонимуса, томинкса), иногда яиц шистосом.
- Менее эффективен при диагностике личиночных стадий кишечных нематод в период миграции через легкие (личинки аскарид, анкилостомид, стронгилоидеса).
- Иногда можно обнаружить личиночные стадии эхинококков (сколексы эхинококка, альвеококка) при поражении легких и прорыве пузырей в бронх.
Применение метода
- Для диагностики легочных гельминтозов.
5.2.1.3. Исследование окрашенных мазков на пневмоцистоз
Необходимые реактивы и оборудование
Химреактивы
1. Для приготовления мазков - муколитики (0,3 %-ный дитиотреитол в 0,02 М ЭДТА, рН = 7,0) или ацетилцистеин, или 4 %-ный р-р NaOH; формалин, спирт.
2. Для окраски мазков по Романовскому-Гимзе - смесь Никифорова; сульфатно-уксусный реагент (45 мл ледяной уксусной кислоты и 15 мл концентрированной серной кислоты) - 10 %-ная краска Романовского-Гимзы в фосфатном буфере рН = 7,2.
3. Для окраски мазков толуидиновым синим - толуидиновый синий 0,15 %-ный (75 мг толуидинового синего + 15 мл дистиллированной воды + 0,5 мл концентрированной соляной кислоты + 35 мл абсолютного спирта); водный метиловый желтый 0,25 %-ный.
4. Для окраски по Гомори-Грохотту - формалин 10 %-ный; дистиллированная вода; раствор хромовой кислоты (5 г хромовокислого оксида + 95 мл дистиллированной воды), 1 %-ный раствор метабисульфита калия (или натрия); рабочий раствор серебра (100 мл водного 3 %-ного раствора метенамина или уротропина + 5 мл водного 5 %-ного нитрата серебра) - готовится непосредственно перед употреблением; 5 %-ный водный тетраборат натрия (бура); диметилсульфоксид; раствор хлорного золота 0,2 %-ный; водный раствор тиосульфата соды 2 %-ный; лихтгрюн (0,02 г лихтгрюна + 100 мл дистиллированной воды + 5 капель ледяной уксусной кислоты).
5. Для окраски акридиновым оранжевым - маточный раствор: 100 мл акридина оранжевого растворяют в 100 мл дистиллированной воды, рабочий раствор готовится при разведении маточного раствора в 10 - 100 раз физиологическим раствором, абсолютный метанол (получают обезвоживанием с помощью окиси кальция с последующей дистилляцией).
Оборудование
1. Центрифужные пробирки
2. Стеклянные палочки
3. Предметные стекла
4. Термостат
5. Центрифуга
6. Микроскоп
Подготовка к работе
- Мокроту или другой материал рекомендуется исследовать немедленно. В исключительных случаях возможно временное сохранение лаважной жидкости с помощью консервации:
а) лаважную жидкость слить в стоящую во льду посуду с 50 мл раствора Хенкса коммерческого, рН = 7,2 - 7,4;
б) лаважную жидкость заморозить до -4 °С.
Подготовка предметных стекол: желательно использовать альбуминизированные стекла.
Ход исследования
Приготовление мазков мокроты
- Поместить мокроту в центрифужную пробирку.
- Добавить равное количество муколитика.
- Полученную смесь быстро перемешать.
- Поместить в термостат при температуре 37 °С на 5 - 15 мин.
- Развести смесью формалина и спирта (1:1).
- Центрифугировать 10 мин при 1500 об/мин.
- Слить надосадочную жидкость.
- Осадок перенести на 4 - 8 предметных стекол.
- Осадок нанести на стекло в виде тонкого мазка.
- Мазок высушить на воздухе.
Приготовление мазков лаважной жидкости
- Поместить лаважную жидкость в центрифужную пробирку.
- Добавить равное количество 50°-ного спирта и перемешать.
- Центрифугировать 20 мин при 2500 об/мин.
- Слить надосадочную жидкость.
- Осадок перенести на 4 - 8 предметных стекол.
- Осадок нанести на стекло в виде тонкого мазка.
- Мазок высушить на воздухе.
Окраска мазков
A) Скрининговая окраска по Романовскому-Гимзе
- Высушенный мазок фиксируют в смеси Никифорова в течение 10 - 15 мин.
- Опустить мазок в сульфатно-уксусный реагент на 10 мин.
- Промывать проточной водой в течение 5 мин.
- Высушить мазок на воздухе.
- Окрашивать 10 %-ной краской Романовского-Гимзы в течение 30 мин.
Результат: цитоплазма трофозоитов голубоватая, ядро - розовое, внутрицистные тельца имеют фиолетовое ядро.
Б) Окончательная или специфическая окраска толуидиновым синим
- Высушенный мазок фиксируют в 10 %-ном растворе формалина.
- Промыть дистиллированной водой.
- Опустить мазок в сульфатно-уксусный реагент на 5 мин.
- Реагент перемешать стеклянной палочкой.
- Оставить мазок в сульфатно-уксусном реагенте еще на 10 мин.
- Промыть проточной водой.
- Высушить мазок на воздухе.
- Окрашивать 0,15 %-ным толуидиновым синим в течение 3 мин.
- Промыть проточной водой.
- Высушить мазок на воздухе.
- Докрашивать в 0,25 %-ном растворе водного метанилового желтого в течение 2 мин.
- Промыть водой.
Результат: четко дифференцируется стенка пневмоцист, но не дает представления о клеточном содержимом; цисты сине-фиолетовые, тканевые элементы и фон - зелено-желтые.
B) Окончательная или специфическая окраска по Гомори-Грохоту
- Высушенные мазки фиксируют в 10 %-ном растворе формалина в течение 5 - 10 мин.
- Промыть дистиллированной водой.
- Быстро подогреть раствор хромовой кислоты в стакане до 65 °С.
- В нагретый раствор быстро погрузить мазки на 1 мин.
- Промыть дистиллированной водой.
- Опустить мазки в 1 %-ный раствор метабисульфита калия на 1 мин.
- Приготовить раствор: 25 мл рабочего раствора серебра + 25 мл дистиллированной воды + 2 мл 5 %-ного водного тетрабората натрия + 15 мл диметилсульфоксида.
- Опустить мазки в приготовленный раствор.
- Подогреть до 90 - 95 °С, пока мазки не станут темно-коричневыми, а раствор светло-серым.
- Прополоскать мазки в трех сменах дистиллированной воды.
- Опустить мазки в 0,2 %-ный водный раствор тиосульфата соды на 1 мин.
- Промыть дистиллированной водой.
- Окрашивать лихтгрюном в течение 5 мин.
- Промыть дистиллированной водой.
Результат: цисты светло- или темно-коричневые (цвет зависит от толщины мазка), округлой или чашеобразной формы, окружающий фон и тканевые элементы зелено-желтые.
Г) Окраска акридином оранжевым.
- Высушенные мазки фиксируют в абсолютном метаноле в течение 2 мин.
- Окрасить рабочим раствором акридина оранжевого 10 мин.
- Промыть дистиллированной водой.
- Высушить окрашенные мазки на воздухе.
- Микроскопировать под масляной иммерсией при увеличении: объектив ×90 или ×100, окуляр ×7 или ×10.
Эффективность метода
- Метод эффективен при условии немедленного исследования материала и использования двух вариантов окрашивания параллельно.
Применение метода
- Метод применяют для диагностики пневмоцистоза.
- Другой материал на пневмоцистоз (слизь из горла и гортани, аспираты из бронхов, биоптаты и мазки-отпечатки легочной ткани) исследуется так же, как и мокрота.
5.3. Микроскопические исследования мочи
Необходимое оборудование
1. Центрифужные пробирки
2. Стеклянные палочки
3. Пипетки
4. Предметные стекла
5. Центрифуга
6. Микроскоп
5.3.1. Метод концентрации
Ход исследования
- Всю разовую порцию мочи отстаивать в высоких банках или цилиндрах в течение 30 - 45 мин.
- Слить верхнюю часть, оставив 10 - 15 мл осадка, который перелить в центрифужные пробирки.
- Оставшуюся часть центрифугировать в течение 5 мин при 1500 об/мин, или 1 - 2 мин при 3000 об/мин.
- Слить надосадочную жидкость.
- Осадок перенести пипеткой на предметное стекло.
- Микроскопировать без покровного стекла: объектив ×8 или ×10, окуляр ×10.
Эффективность метода
- Эффективен при диагностике мочеполового шистосомоза и редко встречаемой инвазии почечных лоханок: диоктофимозе.
- Иногда у девочек и женщин в моче можно обнаружить яйца остриц (смываемые мочой с промежности).
Применение метода
- Чаще применяется как специальный метод диагностики мочеполового шистосомоза.
5.3.2. Метод фильтрации
Ход исследования
5 - 10 мл мочи от порции, собранной с 11 ч утра до 15 ч дня, или все порции суточной мочи смешивают с равным количеством детергента - типола.
- Фильтруют под вакуумом через фильтровальную бумагу (или фильтры № 1).
- На увлажненных фильтрах обнаруживают яйца и личинки гельминтов при микроскопии.
- Микроскопируют при увеличении: объектив ×8 или ×10, окуляр ×10.
Эффективность метода
- Эффективен при слабой шистосомозной инвазии.
Применение метода
- Для диагностики мочеполового шистосомоза.
6. Ларвоскопическое исследование эпидермиса кожи
Необходимые реактивы и оборудование
1. Физиологический раствор
2. Стерильные иглы
3. Стерильное лезвие бритвы или глазной скальпель
4. Стерильные чашки Петри
5. Физиологический раствор
6. Предметные и покровные стекла
7. Микроскоп
Подготовка к работе
- Кончиком иглы приподнимают эпидермис кожи и лезвием бритвы или острым глазным скальпелем срезают кусочек кожи диаметром 2 - 3 мм (бескровно, соблюдая правила асептики).
- Делают одновременно несколько срезов, главным образом с тех участков, на которых заметны изменения кожи и отмечается зуд (чаще в области гребешков подвздошной кости, боковых поверхностей грудной клетки).
- Помещают в стерильную чашку Петри с физраствором.
6.1. Метод исследования нативного препарата
Ход исследования
- Биоптат эпидермиса кожи помещают на предметное стекло в каплю изотонического раствора хлорида натрия.
- Микроскопируют сразу после приготовления препарата при увеличении: объектив ×8 или ×10, окуляр ×10.
Примечание. Из положительных препаратов можно приготовить постоянные препараты: высушить, зафиксировать метанолом, окрасить по Романовскому-Гимзе.
6.2. Метод "обогащенного" препарата
Ход исследования
- Срезы кожи помещают в пробирку с физраствором или средой с коллагеназой и оставляют при температуре 24 - 37 °С на 24 - 36 ч.
- Надосадочную жидкость сливают.
- Осадок переносят на предметное стекло и микроскопируют при увеличении: объектив ×8 или ×10, окуляр ×10.
Эффективность метода
- Эффективен при диагностике онхоцеркоза, кожного дипеталонематоза (стрептоцеркоза).
- Менее эффективен при кожных поражениях типа линейного дерматита, вызываемых мигрирующими личинками нематод, шистосом и др.
Применение метода
- При диагностике онхоцеркоза, кожного дипеталонематоза (стрептоцеркоза).
7. Ларвоскопическое исследование мышечной ткани для обнаружения личинок трихинелл
7.1. Метод трихинеллоскопии
Материал на исследование: поперечно-полосатая мышечная ткань, кроме мышцы сердца.
Необходимое оборудование
1. Стеклянный компрессорий или предметные стекла (размером 12×6 или 15×8 см)
2. Стереоскопический микроскоп МБС
3. Препаравальные иглы
4. Термостат
5. Ножницы, скальпель
6. Измельчитель ткани
7. Эмалированные кюветы
8. Химические стаканчики
9. Чашки Петри
10. Пипетки
7.1.1. Компрессорная трихинеллоскопия
Ход исследования
- Каждую пробу мышц перед исследованием помещают в чашки Петри, расположенные на эмалированных кюветах, куда помещают и необходимый инструментарий (ножницы, пинцеты, препаровальные иглы), предметные стекла. Работа проводится в перчатках с соблюдением правил техники безопасности.
- Из каждой пробы мышц (от одного больного) ножницами делают срезы строго вдоль мышечных волокон, величиной с "овсяное зерно". Всего из разных участков пробы делают 24 среза, а при отрицательных результатах в 3 - 4 раза больше.
- Каждый срез помещают на отдельный квадрат нижнего стекла компрессория (всего в компрессории 24 квадрата) и сдавливают верхним стеклом, путем завинчивания закрепляющих винтов компрессория. При отсутствии компрессория срезы помещают на большое предметное стекло, причем на значительном расстоянии друг от друга, чтобы во время сдавливания они не сливались. Накрывают сверху покровным стеклом меньших размеров и сдавливают до толщины папиросной бумаги.
- Микроскопируют все срезы (каждый срез в отдельности) применяя стереоскопический микроскоп МБС с увеличением: объектив ×2 или ×4, окуляр ×12; ×14; ×14,5.
- При обнаружении в мышцах хотя бы одной личинки трихинелл все пробы мышц утилизируют, перед этим засыпаются или заливаются дезинфектантами: 10 %-ным раствором лизола А, сухой хлорной известью или белильной термостойкой известью, или применяют водяной насыщенный пар под давлением 1,5 кГс/см2 (0,15 МПа) 126 +- 2 °С. Инструментарий и лабораторная посуда обезвреживается кипячением в течение 60 мин (с момента закипания), или автоклавируются (при вышеуказанном режиме).
Диагностика личинок трихинелл бывает затруднена, если срезы толстые или кусочки мышц подсохли, или в срезах обильные включения жира, или пробы мышц фиксированы формалином, или личинки находятся в обызвествленных капсулах.
В этих случаях:
- можно поместить срезы мышц в 5 %-ный раствор едкой щелочи и выдержать в течение 1 ч при комнатной температуре или 10 мин в термостате при температуре 45 °С;
- срезы с обызвествленными капсулами, где личинки не видны, помещают предварительно в 5 - 10 %-ный раствор соляной кислоты на 1 - 2 ч, чтобы растворить известь, затем помещают в глицерин или молочную кислоту для просветления.
Результат микроскопирования: инкапсулированная личинка трихинелл в мышцах представляет собой капсулу личинки лимоновидной или овальной формы; размеры 0,5 - 0,7×0,2 - 0,3 мм; внутри капсулы одна, реже две или три спиралевидно свернутых личинки. При бескапсульном варианте обнаруживаются только спиралевидно свернутые личинки (см. приложение 5).
7.1.2. Трихинеллоскопия методом переваривания в искусственном желудочном соке
Реактивы:
- Соляная кислота концентрированная (или 1 %-ная для 2-го варианта прописи)
- Медицинский пепсин кристаллический (или 3 %-ный для 2-го варианта прописи)
- Дистиллированная вода
Подготовка к работе
- Мышечную ткань измельчают до состояния фарша.
- Готовят раствор искусственного желудочного сока по одной из прописей:
1) 1 л дистиллированной воды + 7 мл 1 %-ного раствора соляной кислоты + 5 мл 3 %-ного раствора пепсина;
2) 1 л дистиллированной воды + 7 мл концентрированной соляной кислоты + 5 - 7 г пепсина кристаллического.
Ход исследования
- Количество искусственного желудочного сока на мышечную массу рассчитывается из расчета: на 10 частей искусственного желудочного сока - 1 часть мышечной массы (например: на 100 мл желудочного сока - 10 г мышечного фарша).
- В химический стакан с желудочным соком помещают мышечную массу и тщательно размешивают.
- Помещают в термостат при температуре 37 °С на 16 - 18 ч, периодически помешивая стеклянной палочкой.
- После переваривания всю массу помещают в аппарат Бермана, на сито из мельничного газа (№ 26).
- Через 1,5 - 2 ч все личинки оседают на дно пробирки, пробирку снимают, отсасывают верхний надосадочный слой пипеткой.
Осадок переносят в чашку Петри или предметные стекла и микроскопируют под стереоскопическим микроскопом МБС, увеличение: объектив ×2 или ×4, окуляр ×12 или ×14.
При использовании 2-го варианта прописи желудочного сока реакция ускоряется и ход проведения методики меняется.
- Фарш помещают в пробирку с желудочным соком (в соотношении 1:25 или 1:50) и ставят в термостат при температуре 42 - 47 °С на 3,5 ч.
- Личинки осаждают в химическом стаканчике емкостью 50 мл в течение 20 - 30 мин.
- Надосадочную жидкость сливают.
- Осадок микроскопируют в чашке Петри с использованием стереоскопического микроскопа МБС, увеличение: окуляр ×12, ×14, ×14,5; объектив ×2, ×4.
- Непереваренные мышечные волокна можно окрасить 0,25 %-ным раствором бриллиантового зеленого, в результате хорошо видны недекапсулированные личинки трихинелл.
Эффективность метода
- Метод компрессионной трихинеллоскопии эффективен при высокой и средней интенсивности трихинеллезной инвазии.
- Для повышения эффективности обнаружения личинок трихинелл следует увеличить количество исследуемых мышечных срезов в 3 - 4 раза, т.е. вместо 24 исследовать 72 - 96 срезов.
- При низкой интенсивности инвазии более эффективен метод переваривания в искусственном желудочном соке.
Применение метода
Применяется как метод прямой диагностики для обнаружения личинок трихинелл в мышечной ткани.
8. Микроскопическое исследование костного мозга, содержимого кожных язв и бугорков на лейшмании
Материал на исследование: костный мозг, язвенный краевой инфильтрат, содержимое кожных бугорков.
8.1. Метод мазка из кожного инфильтрата
Отбор материала на исследование
- Бугорок или участок инфильтрата протирают ватным спиртовым тампоном.
- Стерильным скальпелем делают поверхностный надрез кожи (при этом сдавливают пальцами бугорок для обескровливания).
- Со дна и краев надреза этим же скальпелем берется соскоб пораженной ткани (в случае появления крови при разрезе, ее удаляют стерильным марлевым тампоном).
Ход исследования
- Соскоб со скальпеля быстро перенести на предметное стекло и равномерно растереть (готовят несколько мазков).
- Приготовленный мазок высушить на воздухе.
- Фиксировать метанолом или в смеси Никифорова.
- Окрашивать по Романовскому (как мазки крови на малярию).
- Микроскопировать с масляной иммерсией: объектив ×90 или ×100; окуляр ×7 или ×10.
Результат
1) Лейшмании обнаруживаются в макрофагах, а также вне клеток в виде округлых, овальных или удлиненных телец размером 3 - 5 мкм; цитоплазма лейшманий светло-голубого или синеватого цвета, ядра - красно-фиолетовые; кинетопласт - окрашен интенсивнее ядра.
2) В правильно приготовленном препарате хорошо различимы клетки инфильтрата (макрофаги, эндотелиальные, плазматические, лимфоидные клетки, фибробласты и небольшая примесь клеток периферической крови).
- Наличие в препарате эпителиальных клеток, а также бесструктурных глыбок, окрашивающихся в равномерно сиреневый цвет, означает, что соскоб был взят слишком поверхностно и должен быть повторен.
- Лейшмании легко обнаруживаются в бугорках и в краевом инфильтрате язвы на начальных стадиях изъязвления; в гнойном отделяемом язвы могут быть обнаружены лишь деформированные и разрушающиеся лейшмании (по которым трудно поставить диагноз); на стадии заживления в пораженных тканях лейшмании обнаруживаются редко; при туберкулоидном лейшманиозе в бугорках обнаруживаются с трудом.
Применение метода
- Для диагностики кожного лейшманиоза.
8.2. Метод мазка костного мозга
Ход исследования
- Материал, полученный при пункции костного мозга, немедленно после взятия переносят на предметное стекло.
- Очень осторожно, чтобы не деформировать клетки, распределить при помощи шлифовального стекла тонким слоем.
- Если пунктат плотный, то мазок можно сделать по принципу "отпечатков", держа комочек пунктата пинцетом или иглой, или прикасаясь к нему предметным стеклом.
- Мазок высушить на воздухе.
- Фиксировать: в абсолютном этиловом спирте или в смеси Никифорова 30 мин, или в метиловом спирте 5 мин.
- Высушить на воздухе.
- Окрашивать краской по Романовскому (рабочий раствор готовится непосредственно перед окраской и на буферном растворе рН = 6,9 - 7,1) 30 - 50 мин.
- Промыть дистиллированной водой.
- Высушить на воздухе.
- Микроскопировать с масляной иммерсией: объектив ×90 или ×100, окуляр ×7 или ×10.
Результат: лейшмании обнаруживаются в макрофагах или внеклеточно; они имеют вид округлых, овальных или рисовидных телец диаметром 3 - 5 мкм; цитоплазма окрашена в серовато-голубой цвет, ядро в красно-фиолетовый; в цитоплазме имеется кинетопласт в виде округлого или палочковидного образования и окрашивается более интенсивно, чем ядро. Иногда принимают за лейшмании кровяные пластинки или "осколки" клеток (комочки цитоплазмы, содержащие ядерное вещество). В редких случаях источником ошибки при микроскопии могут служить посторонние микроорганизмы (дрожжевые грибки, одноклеточные водоросли), которые могут попасть со стенок посуды - в мазке они окрашиваются более интенсивно (темно-синяя цитоплазма, ярко-малиновое ядро) и кинетопласт отсутствует.
Применение метода
- Для диагностики висцерального (внутреннего) лейшманиоза.
Примечание. При висцеральном лейшманиозе есть вероятность обнаружения паразитов и в периферической крови; в отдельных случаях для диагностики висцерального лейшманиоза исследуют пунктаты селезенки, печени и лимфатических узлов.
9. Особенности техники микроскопирования при исследовании на яйца, личинки гельминтов и цисты простейших
1. Важным условием успешного микроскопирования является регулирование света с помощью конденсора и других приспособлений светорегуляции: например, полностью опущенный конденсор обеспечивает максимальную контрастность, полностью поднятый конденсор обеспечивает максимальную яркость изображения. При исследовании на яйца гельминтов желательна большая контрастность, при исследованиях на простейшие необходимо обеспечить достаточную яркость изображения.
2. Поле зрения микроскопа при малом увеличении не должно быть слишком ярким (конденсор опустить вниз или уменьшить освещение), т.к. яйца гельминтов с прозрачной оболочкой могут остаться незамеченными. Это касается и простейших.
3. Во время просмотра препаратов при малом увеличении конденсор микроскопа опускают вниз, что уменьшает освещенность поля зрения и повышает четкость исследуемого материала. Переводя объектив на большое увеличение (×40), конденсор поднимают, что усиливает освещенность поля зрения.
4. Яйца и личинки в препарате могут находиться внизу, на поверхности и в толще капли (мазка), поэтому препарат просматривают по вертикали на всех уровнях. При этом очень важно отработать определенный автоматизм: одной рукой фиксировать и передвигать предметное стекло, а другой постоянно, плавно вращать винт макро- и микронаводки то в одну, то в другую сторону, чтобы исследовать всю толщину препарата.
5. Начинают исследовать препарат с правого или левого края предметного стекла, зигзагообразно, как при исследовании мазка крови, при этом препарат перемещают на одно поле зрения. Микропрепарат просматривают полностью, даже если были находки уже в первых полях зрения, т.к. может быть смешанная инвазия.
6. При гельминтоовоскопии лучше использовать объектив ×8, ×10 и ×40, окуляр ×7 и ×10 (поиск яиц ведется при малом увеличении, морфологическое строение и идентификация проводятся при большом увеличении); при протозооскопии работают с объективом ×40 и окуляром ×10.
7. При работе с микроскопом "БИОЛАМ" лучше пользоваться дневным естественным освещением или светом от ламп дневного освещения (настенных, настольных). В микроскопах "БИМАМ" (или импортных марок типа "Leica", "Zeiss") используется свет от вмонтированного электрического осветителя, при этом матовое стекло должно быть вставлено перед конденсором микроскопа.
8. Лаборанту начинать микроскопировать необходимо на микроскопе одной и той же марки, где он изучает не только морфологическое строение яиц гельминтов, но и учится визуально без измерительных приборов соизмерять величину обнаруженных объектов (яиц гельминтов, цист простейших и т.д.). При использовании одних и тех же увеличений микроскопы разных марок (разных фирм-производителей) дают разные размеры объектов, что может привести к диагностическим ошибкам.
9. Для исследования на личинки гельминтов можно использовать микроскоп стереоскопический системы МБС (увеличения: объектив ×12, ×14, окуляр ×2).
10. При идентификации яиц и личинок гельминтов, а также протозойных объектов можно использовать микрометрический метод диагностики. Измерения яиц гельминтов под микроскопом можно проводить с помощью окуляр-микрометра, но предварительно для каждого микроскопа и для тех увеличений, с которыми работает исследователь, нужно определить значение одного деления окулярной линейки в микронах.
10. Микрометрический метод протозоо- и гельминтоскопии
Необходимое оборудование
1. Микроскоп с необходимым набором окуляров и объективов
2. Окуляр-микрометр со шкалой, разделенной на миллиметровые интервалы с дополнительными делениями - штрихами
3. Объект-микрометр (линейка на стекле длиной 1 мм, значение величины одного деления 0,01 мм или 10 мкм)
Подготовка к работе
Определить до начала наблюдения значение цены одного деления шкалы окуляр-микрометра для каждой применяемой комбинации объектив-окуляр*.
- Поместить объект-микрометр на предметный столик микроскопа и сфокусировать окуляр на линейке объект-микрометра так, чтобы шкала делений стала резкой.
- Заменить простой окуляр на окуляр-микрометр, с которым предстоит выполнять измерения объекта, и удостовериться, что деление линеек окуляра и объект-микрометра расположены в одной плоскости.
- При малом увеличении объектива совместить шкалы линеек окуляр-микрометра и объект-микрометра параллельно друг под другом.
- Выделить (найти) такое положение линеек, где определенное число делений окуляр-микрометра полностью совпадает с целым числом делений объект-микрометра.
- Определить цену одного деления окуляр-микрометра: число интервалов на линейке объект-микрометра (У), строго соответствующих целому числу делений окуляр-микрометра, умножить на 10 мкм и затем разделить на число совпадающих делений шкалы окуляр-микрометра (X), т.е. цена одного деления шкалы окуляр-микрометра в данной оптической системе определяется по формуле (10×У:X).
- Аналогичным образом определить цену деления шкалы окуляр-микрометра для всех объективов микроскопа, с которыми предполагается проводить микрометрические исследования.
- При особо ответственных исследованиях проверять цену деления окуляр-микрометра при смене объективов даже в пределах одного типа.
_________________
* Следует помнить, что величина деления окуляр-микрометра меняется в зависимости от длины тубуса и увеличения окуляра и объектива используемого микроскопа.
Ход измерения объекта
- Выбрать соответствующий окуляр и объектив для работы**.
- Сфокусировать систему объектив - окуляр на объекте, который должен быть измерен.
- Заменить простой окуляр на окуляр-микрометр.
- Определить число делений (интервалов) шкалы окуляр-микрометра, покрывающих длину и (или) ширину измеряемого объекта.
Определить действительный размер объекта путем умножения полученного числа на значение цены деления шкалы окуляр-микрометра при данной системе объектива и окуляра.
_________________
** Измерение протозойных объектов, также как и яиц гельминтов, для получения более точных данных следует проводить при увеличении в 300 - 400 раз.
Примечание. Во избежание необходимости при каждом измерении умножать полученное число на значение цены одного деления окуляр-микрометра можно заранее составить таблицу, в которой вычислены значения 1, 2, 3 и т.д. делений окуляр-микрометра.
Эффективность метода
Метод позволяет осуществлять проведение прямых измерений величины объекта, не требует сложных расчетов, дорогой аппаратуры, доступен для лабораторий разного уровня.
Применение метода
- Для уточнения видовой принадлежности паразитарных объектов на основе размера - одного из основных морфофункциональных критериев видовой характеристики паразита.
- Дифференциальная диагностика псевдопаразитарных образований.
Приложение 1
Информативность паразитологических методов исследований
|
Материал для исследования |
Метод исследования |
Применяется для диагностики заболеваний |
|
Фекалии |
толстый мазок по Като и Миура |
описторхоз, клонорхоз, фасциолез, дикроцелиоз, метагонимоз, нанофиетоз, дифиллоботриоз, гименолепидоз, аскаридоз, трихоцефалез, анкилостомидозы, дипилидиоз |
|
седиментации |
описторхоз, клонорхоз, фасциолез, дикроцелиоз, метагонимоз, нанофиетоз, дифиллоботриоз, гименолепидоз, аскаридоз, трихоцефалез, анкилостомидозы, стронгилоидоз, трихостронгилез, некатороз, шистосомоз, кишечные протозоозы (лямблиоз, криптоспоридиоз, изоспороз) |
|
|
флотации |
аскаридоз, трихоцефалез, анкилостомидозы, трихостронгилез, некатороз, гименолепидоз, дифиллоботриоз, тениидозы |
|
|
Бермана и его модификации |
стронгилоидоз, трихостронгилез, анкилостомидоз, некатороз, балантидиаз |
|
|
нативный мазок с физраствором и раствором Люголя |
лямблиоз, балантидиаз, амебиаз, инфекции вызванные диентамебой, бластоцистоз |
|
|
окрашенный мазок по Романовскому и др. |
криптоспоридиоз |
|
|
Перианальный соскоб |
Торгушина, Кеворковой, Грэхэм, Рабиновича |
тениаринхоз, тениоз, энтеробиоз |
|
Дуоденальное содержимое |
микроскопия осадка |
описторхоз, клонорхоз, фасциолез, дикроцелиоз, стронгилоидоз, трихостронгилез, анкилостомидоз, некатороз, лямблиоз, изоспороз, криптоспоридиоз |
|
Моча |
микроскопия осадка |
шистосомоз, диоктофимоз |
|
Мокрота |
микроскопия осадка |
парагонимоз, томинксоз |
|
микроскопия окрашенных мазков по Цилю-Нильсену и др. |
пневмоцистоз, криптоспоридиоз |
|
|
Кровь |
микроскопия окрашенных "тонких" мазков |
малярия, филяриитозы, трипаносомозы |
|
микроскопия "толстой" капли |
малярия |
|
|
Послеоперационный материал, пунктаты, срезы кожи и патматериал |
|
личиночные стадии: эхинококкозы, трихинеллез, цистицеркоз, филяриетозы, амебиаз, балантидиаз |
|
Спинно-мозговая жидкость, костный мозг |
|
трипаносомозы, лейшманиозы |
|
Биопсированная поперечно-полосатая мускулатура |
трихинеллоскопия |
трихинеллез |
Информативность серологических методов* исследования на паразитарные заболевания
|
Сыворотки крови |
ИФА |
описторхоз, клонорхоз, фасциолез, эхинококкоз, альвеококкоз, цистицеркоз, трихинеллез, токсокароз, криптоспоридиоз, пневмоцистоз, лямблиоз, амебиаз |
|
РНГА |
описторхоз, эхинококкоз, альвеококкоз, трихинеллез, амебиаз |
|
|
РЛА |
эхинококкоз, альвеококкоз |
|
|
РКП |
цистицеркоз, трихинеллез |
|
|
РИФ |
малярия, амебиаз, лямблиоз |
_______________
* Серологические методы относятся к косвенным методам исследования, которые направлены на определение антител или антигенов в сыворотке крови или фекалиях, поэтому в данные методические указания не вошли. Следует при использовании тест-систем и диагностикумов для определения паразитарных заболеваний руководствоваться инструкциями к их применению, утвержденными Минздравом России.
Приложение 2
Организация работы паразитологической лаборатории
Возбудители гельминтозов и протозоозов относятся к "патогенным биологическим агентам" (ПБА) III и IV групп патогенности, что определяет режим работы паразитологических лабораторий (подразделений), выполняющих диагностические, производственные или экспериментальные работы с патогенными биологическими агентами.
1. Общие положения
1.1. Паразитологические исследования биологического материала от людей на паразитарные заболевания, санитарно-паразитологические исследования объектов внешней среды и пищевых продуктов на цисты патогенных простейших, яйца и личиночные формы гельминтов проводятся в лабораториях (подразделениях), лицензированных или аккредитованных в установленном порядке на данный вид деятельности.
1.2. При отсутствии аккредитации и лицензии паразитологические исследования проводятся по договорам с лабораториями других организаций и учреждений, аккредитованными в установленном порядке.
1.3. Для проведения лабораторных паразитологических исследований допускаются метрологически аттестованные методики, соответствующие НТД, ГОСТам, а также методики, утвержденные или допущенные к применению Госстандартом России, Минздравом и госсанэпидслужбой России.
1.4. Отбор проб для паразитологических исследований проводится в соответствии с требованиями государственных стандартов; методических указаний, утвержденных Департаментом госсанэпиднадзора Минздрава России.
1.5. Работа с возбудителями III - IV групп патогенности и биологическим материалом (кровь, другие жидкости и экскреты организма), подозрительным на содержание патогенных простейших, гельминтов и их личинок проводится только в лабораториях, имеющих разрешение, выданное в установленном порядке Комиссией за соблюдением требований биологической безопасности центров Госсанэпиднадзора административных территорий сроком до 5 лет.
2. Основные требования к размещению, набору помещений, оборудованию паразитологических лабораторий
2.1. Паразитологическая лаборатория может быть расположена в отдельно стоящем здании или специально приспособленной части здания. Допускается размещение на первом этаже в изолированной части жилого здания с отдельным входом.
2.2. Должно быть два входа: для сотрудников и для доставки материала на исследование, но допускается и наличие одного входа при условии передачи материала через передаточное окно.
2.3. Лаборатории должны размещаться в хорошо освещенных комнатах. Не допускается размещение в цокольных и подвальных этажах. На первом этаже нельзя размещать, если имеется затемнение перед окнами деревьями или постройками. При ориентации окон рабочих комнат на юг необходимо обеспечить защиту рабочих столов и оптики от прямого попадания солнечного света путем использования жалюзи из материала, устойчивого к дезинфицирущим средствам.
2.4. Лаборатория должна иметь вентиляцию, канализацию, отопление, водопровод, искусственное и естественное освещение (в соответствии с действующими нормативными документами).
2.5. Площадь рабочей комнаты принимается из расчета на бригаду (не менее 2 рабочих мест) и оборудование, т.е. не менее 16 - 18 м2.
2.6. Лаборатория должна иметь набор рабочих комнат, в соответствии с производственной мощностью и номенклатурой исследований. Выделяются отдельные лабораторные комнаты для работы с биологическим материалом, для санитарно- паразитологических исследований и серологических исследований.
В отдельных случаях допускается совмещение в одной лабораторной комнате исследований биологического материала и санитарно-паразитологических исследований, но при условии организации рабочих мест на каждый вид исследований и соблюдения норм площади на каждое рабочее место. А также разделение движения инвазионного и чистого материала во времени.
2.7. В лаборатории должна обеспечиваться "поточность", т.е. деление на "чистую" (врачебная, гардероб, кладовая, комната приема пищи и другие подсобные помещения) и "заразную" (приема материала, подготовки проб, моечная, стерилизационная или автоклавная для обеззараживания, термостатная, комнаты для проведения исследований) половины.
2.8. Если паразитологическая лаборатория размещена отдельно, то моечная может быть совмещена со стерилизационной и комнатой пробоподготовки.
2.9. Комнаты пробоподготовки, приготовления химреактивов, варки солевых растворов должны быть оборудованы вытяжной вентиляцией (приточно-вытяжного, или вытяжного типа через общую вытяжную сеть или индивидуально через окно, с выводной трубой выше здания). Вследствие использования при выполнении методик летучих и легко воспламеняющихся веществ (эфир, кислоты и т.п.) не разрешается совмещение вентиляции паразитологических лабораторий с лабораториями, где используется обжиг или муфельные печи.
2.10. При размещении в одном блоке нескольких профильных лабораторий общими для них могут быть: гардеробная, комната приема материала, моечная, стерилизационная, автоклавная, врачебные комнаты, комната приема пищи и другие подсобные помещения. При этом площадь помещений должна быть увеличена. Например: нормы моечной комнаты в баклаборатории 12 м2 (СНиП 535-81), а при совмещении с моечной паразитологической лаборатории площадь увеличивается на 8 м2 и составит 20 м2.
2.11. Лабораторные комнаты оборудуются раковинами для мытья рук, в моечной - для мытья посуды.
2.12. Стены облицовывают на 1,5 метра от пола кафельной плиткой или другими современными строительными материалами, которые поддаются мойке и дезинфекции, или окрашиваются масляной краской.
2.13. Полы покрываются линолеумом, релином или плиткой для пола (не должны быть скользкими).
2.14. Лабораторные столы используются с пластиковым покрытием или другим покрытием, легко поддающимся дезинфекционной обработке.
3. Режим и правила работы с инвазионным материалом
3.1. Работу с ПБА III - IV групп патогенности выполняют специалисты с высшим и средним специальным образованием, прошедшие специализацию по лабораторной диагностике гельминтозов и протозоозов. Для центров госсанэпиднадзора и некоторых ведомственных (производственных) лабораторий необходима специализация по санитарно-паразитологическим исследованиям пищевых продуктов и объектов окружающей среды.
3.2. Персонал лаборатории допускается к работе после проведения инструктажа по соблюдению требований биологической безопасности.
3.3. Приборы, оборудование и средства измерения в лаборатории должны быть аттестованы, технически исправны, проходить метрологический контроль в установленные сроки и иметь технический паспорт. Количество оборудования в лаборатории определяется объемами и характером проводимых и планируемых (согласно номенклатуре) паразитологических исследований.
3.4. Обеззараживание материала и дезинфекция помещений.
3.4.1. Банки с фекалиями, желчью, мокротой и т.п. помещают в эмалированные кюветы или на отдельные столы стационарные или передвижные (с пластиковым или другим легко поддающимся дезинфекции покрытием).
3.4.2. Пробирки с кровью устанавливают в штативы, помещенные в эмалированные, пластиковые кюветы.
3.4.3. При отсутствии пластикового покрытия на столах для микроскопии используют легко поддающиеся дезинфекции стеклянные, металлические, пластиковые пластины или эмалированные кюветы, где раскладывают мазки, препараты, материал для исследования.
3.4.4. Отработанные предметные стекла, пипетки, пробки, пробирки, стеклянные палочки, химические стаканчики и т.п. складывают в течение рабочего дня в емкости с дезинфицирующим раствором до полного вертикального погружения (отечественные: 10 %-ный хлорамин, "Велтолен", "Аламинаг", или импортные дезсредства типа "Септодор", "Дианокс", "Виркон" и т.д., допущенные к применению в установленном порядке) для предварительного обеззараживания.
3.4.5. Заключительное обеззараживание лабораторной посуды проводится путем кипячения в воде (с момента закипания не менее 30 мин) с добавлением хозяйственного мыла или жидкого моющего средства. При соответствующих условиях можно использовать автоклавирование. После дезинфекции посуда допускается для мытья и стерилизации.
3.4.6. Ватно-марлевый материал, бумажные фильтры и разовые деревянные палочки уничтожаются путем сжигания или выброса в контейнер для мусора после экспозиции в одном из дезинфицирующих растворов, или предварительно засыпаются сухим порошком хлорной извести или хлорамина.
3.4.7. Пробы фекалий, мокроты, желчи, мочи засыпаются сухой хлорной известью или белильной термостойкой известью, или хлорамином перед выбросом в контейнеры или сливом в общую канализационную систему (при соответствующих условиях для обезвреживания используют автоклавирование).
3.4.8. Полистироловые планшеты, наконечники, микропробирки, пробирки, пипетки и др., используемые при работе с кровью или сывороткой крови, обеззараживаются в 6 %-ном растворе перекиси водорода с экспозицией 3 ч в термостате при 50 °С. После этого промывают под проточной водой, затем промывают 3 - 5 мин в дистиллированной воде и высушивают в термостате при 50 °С в течение 15 мин.
3.4.9. Сгустки крови и сыворотку крови перед утилизацией в общую канализационную сеть обезвреживают только с применением дезинфицирующих растворов (в соответствии с действующими инструкциями по обеззараживанию).
3.4.10. Рабочие поверхности лабораторных столов обеззараживают 70 %-ным спиртом, с последующим фламбированием.
3.4.11. Дезинфекционная обработка оборудования (центрифуги, микроскопы, холодильники и др.) проводится раствором 70 %-ного спирта или с применением соответствующих дезсредств.
3.4.12. Дезинфекция халатов и полотенец проводится методом кипячения.
3.4.13. Текущая уборка лабораторных помещений проводится ежедневно после окончания рабочего дня влажным способом с применением дезинфицирующих средств, в "чистой" зоне - с применением моющих средств.
3.4.14. Для мусора используются ведра с педальным приспособлением для поднятия крышек и разовые полиэтиленовые пакеты для мусора.
3.4.15. Для дезинфекции воздуха лабораторного помещения и поверхностей используются бактерицидные лампы или аэрозольные дезинфицирующие вещества.
Личная гигиена лаборанта:
- работа с фекалиями, желчью, мокротой, кровью и другим биологическим материалом от людей проводится обязательно в резиновых перчатках, особенно в период подготовки материала и проведения методик;
- обработка рук после работы с инвазионным материалом заключается в предварительном мытье рук с мылом под проточной водой, затем обработка ватным тампоном с 70 %-ным спиртом (можно использовать дезсредства для гигиенической и хирургической обработки рук, например: "Велтосепт", "Асептинол С" и т.п.);
- при длительной микроскопии лаборанту для профилактики утомляемости глаз необходимо делать зарядку: попеременно прикрывая рукой (руки перед этим тщательно вымыть!) один глаз, при этом другим смотреть вдаль - на деревья, строения, дома; прикрыть глаза, положить пальцы рук на веки и слегка надавить, преодолевая сопротивление пальцев, посмотреть вверх, вниз, направо и налево (повторить до 6 - 8 раз); быстро, быстро поморгать; потянуться нижней губой к носу для лучшего оттока венозной крови из глаз; очень мягко, осторожно подушечками пальцев круговыми движениями помассируйте глазные яблоки через веки, дотроньтесь до слезных косточек у переносицы и помассируйте, как будто моете, переместите пальцы к наружным уголкам глаз и "промойте" их тоже; посидите так около минуты; сожмите кулаки, напрягите плечи, руки, потянитесь всем телом, отряхнитесь и снова можно приступить к микроскопированию (работа на микроскопе должна у лаборанта занимать не более 60 % рабочего времени в день);
- перед выходом из лабораторного помещения снимать лабораторные халаты; иметь шкафы для халатов, сменной обуви и хранить отдельно от личной одежды.
Соблюдение правил дезинфекции, техники безопасности при работе с инвазионным и подозрительным на содержание возбудителей паразитарных болезней материалом как части противоэпидемического режима лабораторий, обязательно для всех сотрудников лаборатории. Текущий контроль за выполнением требований техники безопасности осуществляет руководитель лаборатории.
Приложение 3
Морфологическое строение яиц гельминтов
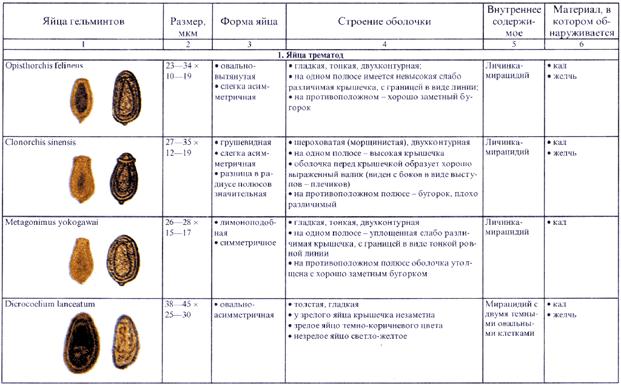



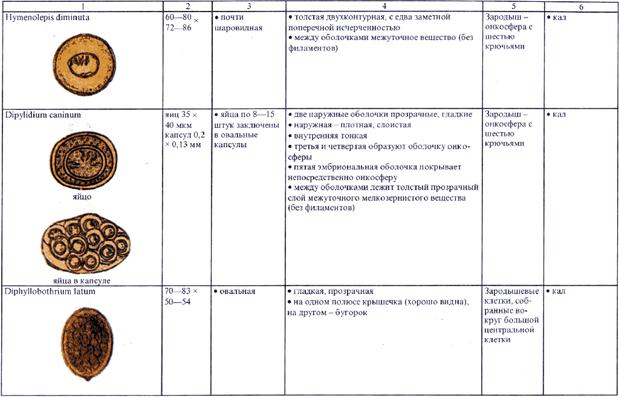
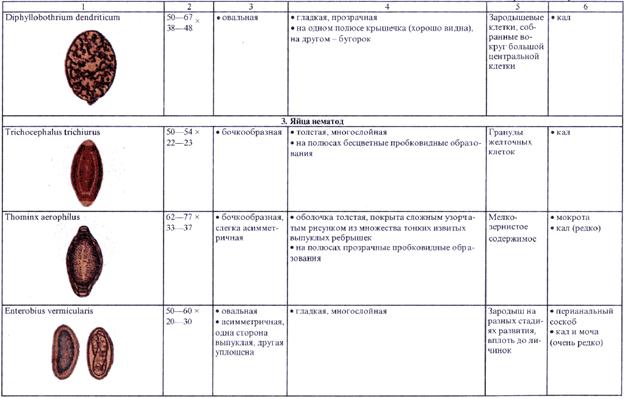

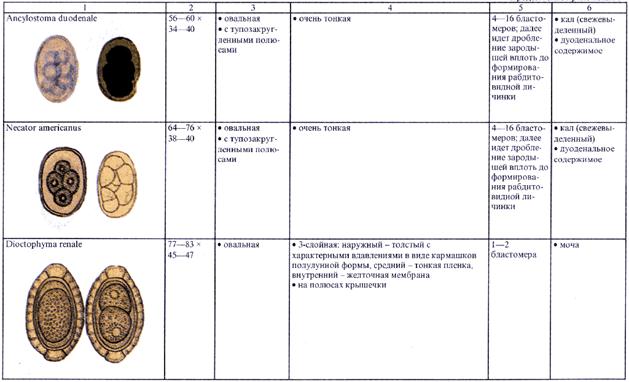
Приложение 4
Морфологическое строение кишечных простейших
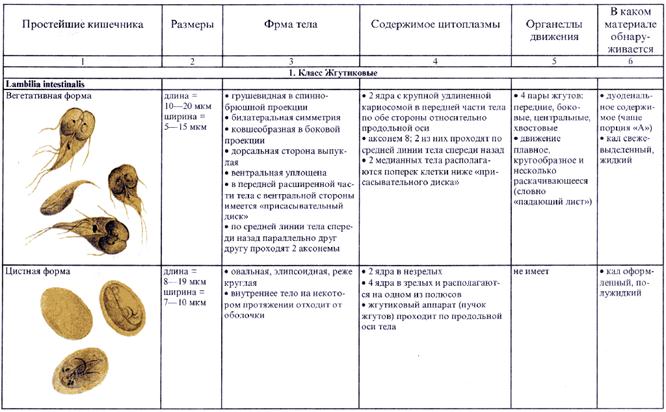
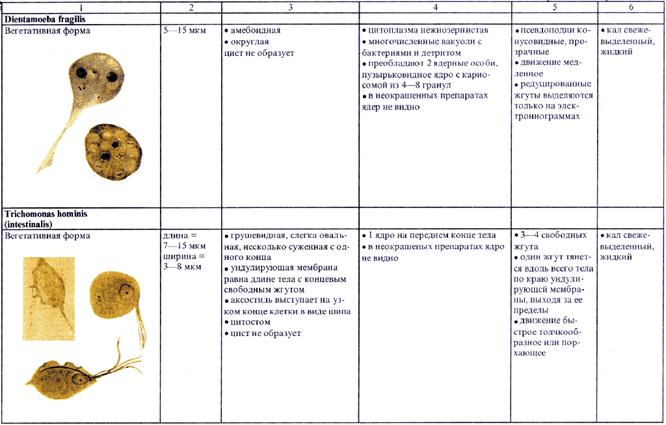
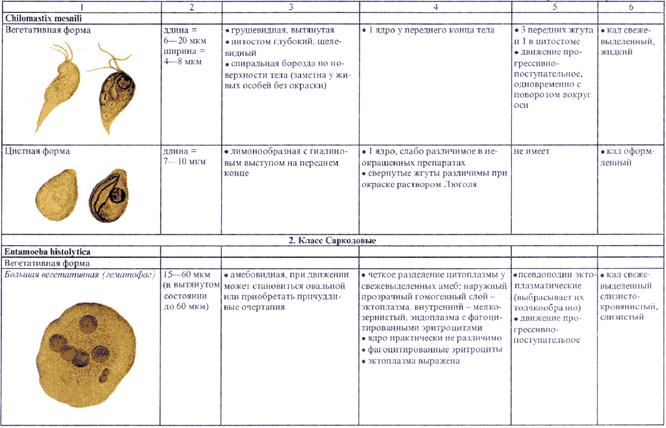




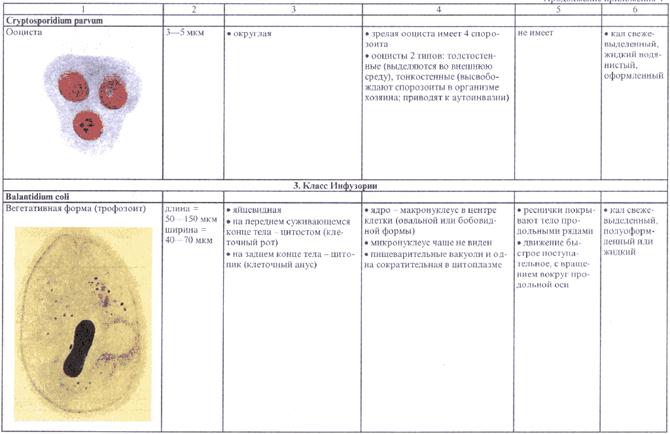

Приложение 5
Морфология некоторых личинок нематод


Приложение 6
Морфологическое строение зрелых члеников цветод
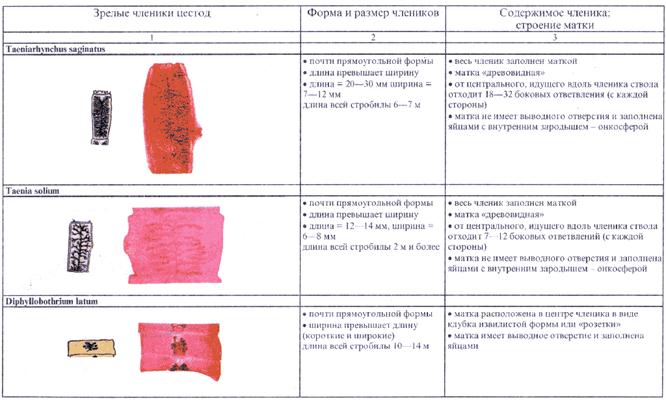
|
Главный
государственный санитарный врач |
Г.Г. Онищенко |
СОДЕРЖАНИЕ