| Информационная система |  |
Государственное санитарно-эпидемиологическое нормирование
Российской Федерации
___________________________________________________________________________
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ ФАКТОРЫ
Идентификация сырьевого состава
мясной продукции
Методические рекомендации
MP 4.2.0019-11
Москва
2011
1. Разработаны: НИИ питания РАМН (В.А. Тутельян, В.К. Мазо, О.Н. Чернышева, О.В. Анисимова, Ю.В. Устинова, Е.В. Песчаницкая, Е.А. Лашенкова); ГНУ ВНИИ мясной промышленности им. В.М. Горбатова Россельхозакадемии (А.Б. Лисицын, М.Ю. Минаев, О.А. Кузнецова, Т.А. Фомина); Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека Министерства здравоохранения и социального развития Российской Федерации (Л.В. Чикина); Управлением Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека по городу Москве (Н.Н. Филатов); ООО «Компания Стайлаб» (А.В. Галкин).
2. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 18 апреля 2011 г.
3. Введены в действие с момента утверждения.
СОДЕРЖАНИЕ
|
|
УТВЕРЖДАЮ Руководитель
Федеральной службы Г.Г. Онищенко 18 апреля 2011 г. Дата введения с момента утверждения. |
|
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ ФАКТОРЫ Идентификация сырьевого состава мясной продукции Методические рекомендации MP 4.2.0019-11 |
|
1. Область применения
1.1. Настоящие методические рекомендации распространяются на методы качественного определения видовой принадлежности продуктов убоя сельскохозяйственных животных, птицы, а также ДНК растений. Методы позволяют производить детекцию следующих видов мяса: говядины, свинины, баранины, козлятины, оленины, конины, курицы, индейки, гуся, утки, индоутки, а также ДНК сои.
1.2. Методические рекомендации определяют методы подтверждения подлинности продуктов убоя сельскохозяйственных животных и птицы.
1.3. Методические рекомендации предназначены для специалистов, органов и организаций Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, осуществляющих контроль качества и безопасности продовольственного сырья и пищевых продуктов, находящихся в обращении на территории Российской Федерации, государственных научно-исследовательских организаций отраслевого и гигиенического профиля.
Настоящие методические рекомендации могут быть использованы лабораторными центрами, аккредитованными в установленном порядке, в т.ч. при проведении производственного контроля продовольственного сырья и пищевых продуктов.
2. Нормативные ссылки
2.1. Федеральный закон от 2.01.2000 № 29-ФЗ «О качестве и безопасности пищевых продуктов».
2.2. Федеральный Закон от 7.02.1992 № 2300-1 «О защите прав потребителей».
2.3. Федеральный Закон от 23.09.1992 № 3520-1 «О товарных знаках, знаках обслуживания и наименованиях мест происхождения товаров».
2.4. Федеральный закон от 27.12.2002 № 184-ФЗ «О техническом регулировании».
2.5. Постановление Правительства Российской Федерации от 22 ноября 2000 г. № 883 «Об организации и проведении мониторинга качества, безопасности пищевых продуктов и здоровья населения».
2.6. Постановление Правительства Российской Федерации от 21 декабря 2000 г. № 987 «О государственном надзоре и контроле в области обеспечения качества и безопасности пищевых продуктов».
2.7. СанПиН 2.3.2.1078-01 «Гигиенические требования к качеству и безопасности продовольственного сырья и пищевых продуктов» с дополнениями и изменениями.
2.8. СанПиН 2.3.2.1293-03 «Гигиенические требования по применению пищевых добавок» с дополнениями и изменениями.
2.9. ГОСТ Р 52427-2005 «Промышленность мясная. Продукты пищевые. Термины и определения».
2.10. ГОСТ Р 52313-2005 «Птицеперерабатывающая промышленность. Продукты пищевые. Термины и определения».
2.11. ГОСТ Р 51447-99 «Мясо и мясные продукты. Методы отбора проб».
2.12. ГОСТ 26668-85 «Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов».
2.13. ГОСТ Р 52723-2007 «Продукты пищевые и корма. Экспресс-метод определения сырьевого состава (молекулярный)».
2.14. ГОСТ Р 52173-2003 «Сырье и продукты пищевые. Методы идентификации генетически модифицированных источников (ГМИ) растительного происхождения».
2.15. МУ 1.3.1888-04 «Организация работы при исследованиях методом ПЦР материала, инфицированного патогенными биологическими агентами III - IV групп патогенности».
3. Термины, определения и сокращения
3.1. Термины и определения
Для целей настоящих методических рекомендаций используются следующие термины и определения:
3.1.1. Видовая подлинность (или аутентичность) продуктов убоя сельскохозяйственных животных и птицы - неотъемлемая составная часть качества пищевой продукции, определяемая биологическими показателями, абсолютные количественные значения и интервалы которых обоснованы природными свойствами сырья.
3.1.2. Видовая фальсификация продуктов убоя сельскохозяйственных животных и птицы - разновидность ассортиментной фальсификации, которая осуществляется путем полной или частичной подмены товара его заменителем, а именно - одного вида сельскохозяйственных животных или птицы другим, с сохранением сходства одного или нескольких признаков. Включает в себя способ частичной подмены продукта путем введения в его состав пищевых добавок животного и/или растительного происхождения, содержащих ДНК.
3.1.3. Видовая идентификация продуктов убоя сельскохозяйственных животных и птицы - это установление соответствия пищевой продукции их заявленному видовому наименованию путем исследования тождественности показателей аутентичным образцам и/или их описанию, опубликованным в соответствующих документах, и информации, содержащейся в сопроводительных документах и потребительских этикетках, с применением аналитических и органолептических методов.
3.1.4. Видоспецифичная ДНК – дезоксирибонуклеиновая кислота, однозначно принадлежащая определенному виду растений или животных.
3.1.5. Несоответствие - наличие отклонений от нормативного документа на данный продукт (сырье, ингредиент и т.п.) в показателях качества и безопасности, а также сырьевого и компонентного состава.
3.2. Сокращения, использующиеся в документе
3.2.1. ДНК - дезоксирибонуклеиновая кислота.
3.2.2. ИФА - иммуноферментный анализ.
3.2.3. МПМО - мясо птицы механической обвалки.
3.2.4. ОП - оптическая плотность.
3.2.5. ПЦР - полимеразная цепная реакция.
4. Средства измерения, оборудование, лабораторная посуда, материалы и реактивы
4.1. Оборудование и средства измерения*:
_________________
* Допускается применение приборов и оборудования с техническими и средств измерения с метрологическими характеристиками не ниже указанных в настоящих MP.
• амплификатор типа «Thermocycler Biometra Т196» - температурный диапазон - 3 - 99 °С, максимальная скорость нагревания 4 °С/с, максимальная скорость охлаждения 3 °С/с или аналог;
• амплификатор с детекцией результатов в режиме реального времени (типа «АВ1 Prism серии 7***», «Perkin Elmer Thermo Cycler 9700», или AHK-32) или аналог;
• анализатор потенциометрический, погрешность измерений рН ±0,01 по ГОСТ 19881-74;
• аппарат для встряхивания типа «Вортекс», скорость вращения 250 - 3000 мин-1;
• весы аналитические по ГОСТ 24104-2001;
• весы лабораторные общего назначения 2-го класса точности с наибольшим пределом взвешивания 200 г по ГОСТ 24104-2001;
• восьмиканальный автоматический дозатор типа «Эппендорф» с переменным объемом дозирования 30 - 300 мм3 или аналог;
• дозаторы с переменным объёмом дозирования:
- 0,2 - 2,0 мм3 с шагом 0,01 мм3, с точностью ±1,2 %;
- 0,5 - 10,0 мм3 с шагом 0,01 мм3, с точностью ±0,8 %;
- 2 - 20 мм3 с шагом 0,01 мм3, с точностью ±0,8 %;
- 20 - 200 мм3 с шагом 0,1 мм3, с точностью ±0,6 %;
- 100 - 1000 мм3 с шагом 1 мм3, с точностью ±3 %;
- 2 - 10 см3 с шагом 0,1 см3, с точностью ±0,5 %;
• камера морозильная, обеспечивающая температуру - 20 °С;
• лабораторный таймер;
• микропланшетный ридер типа «Anthos 2020» - рабочий диапазон длин волн 400 - 750 нм, диапазон измерения 0,000 - 3,000 ед. ОП или аналог;
• микроцентрифуга настольная типа «Эппендорф» (частота вращения не менее 13000 об./мин) или аналог;
• облучатель бактерицидный настенный ОБН-150 или других видов по ТУ 16-535-84;
• пинцет медицинский по ГОСТ 21241-89;
• скальпели одноразовые, ножи, ножницы, самоклеящаяся пленка;
• термостат типа «TERMO 24 - 15» под пробирки типа «Эппендорф» вместимостью 0,5 и 1,5 см3, диапазон температур от 15 °С до 120 °C, количество гнезд - не менее 20 каждого типа, точность поддержания температуры - 0,2 °С, разность температур между соседними ячейками - не более ±0,5 °С или аналог;
• термошейкер типа «ELMI ST-3М» - скорость вращения платформы 1 - 1300 об./мин, диапазон устанавливаемой температуры платформы - комнатная от 3 до 60 °С или аналог;
• шпатели одноразовые.
4.2. Лабораторная посуда и материалы:
• бумага фильтровальная лабораторная по ГОСТ 12026-76;
• воронки стеклянные по ГОСТ 25336-82;
• колбы конические со шлифом вместимостью 250 см3 по ГОСТ 8682-93;
• колбы стеклянные мерные плоскодонные конические вместимостью 25, 50, 100, 200, 1000 см3 по ГОСТ 12738-77;
• наконечники с фильтром для дозаторов с переменным объёмом дозирования до: 10, 20, 200, 1000 мм3, 10 см3.
• пробирки микроцентрифужные типа «Эппендорф» вместимостью 0,2, 0,5, 1,5 см3;
• фарфоровые ступки и пестики по ГОСТ 9147-80;
• цилиндры стеклянные мерные лабораторные вместимостью 25, 100, 1000 см3 по ГОСТ 1770-74.
4.3. Реактивы*:
_________________
* Допустимо использование реактивов с аналогичными техническими характеристиками.
• вода дистиллированная по ГОСТ 6709-72;
• видоспецифичные зонды к набору Sure Food® Animal-ID, позволяющие производить детекцию следующих видов мяса: говядины, свинины, баранины, козлятины, оленины, курицы, индейки, гуся, утки, индоутки;
• вода деионизированная по ОСТ 11.029.003-80;
• гексадецилтриметиламмониум бромид (СТАВ) корпорация «Сигма Алдрич» (Sigma), кат. № Н 5882 или аналог;
• кислота соляная хч по ГОСТ 3118-77;
• набор SureFood® Animal-ID;
• натрий хлористый хч по ГОСТ 4233-77;
• натрия гидроокись чда по ГОСТ 4328-77;
• спирт изопропиловый по ГОСТ 9805-84;
• спирт этиловый 96 % по ГОСТ Р 51652-2000;
• трис (оксиметил) аминометан хч по ТУ 6-09-4292-76;
• хлороформ хч по ГОСТ 20015-88;
• этилендиаминтетрауксусная кислота хч по ТУ 6-09-11-1721-83.
_________________
* Набор SureFood® Animal-ID испытывался производителями с Taq-полимеразой марки Platinum Taq DNA - производства фирмы Invitrogen life technologies (кат. № 10966-026/250U) и с ДНК-полимеразой для горячего старта марки НОТ-FlREPol® - производства фирмы Solis BioDyne.
4.4. Состав набора SureFood® Animal-ID для определения видовой специфичности ДНК животного происхождения**
_________________
* Допустимо использование реактивов с аналогичными техническими характеристиками.
Состав набора SureFood® Animal-ID для определения видовой специфичности ДНК животного происхождения
4.5. Реактивы метода Species IdentRT*
Таблица 2
Реактивы метода (тест-система) Species Ident RT**
________________
* Разработан ГНУ ВНИИ РАСХН мясной промышленности на основе ГОСТ Р 52723-2007. Продукты пищевые и корма. Экспресс-метод определения сырьевого состава (молекулярный).
** Допустимо использование реактивов с аналогичными техническими характеристиками.
*** Тест-система позволяет дифференцировать мясо КРС, в т.ч. и от мяса яков и буйволов.
5. Принцип метода
5.1. Метод определения видовой специфичности ДНК животного происхождения с помощью набора SureFood® Animal-ID CONGEN Biotechnologie GmbH, Германия
Набор SureFood® Animal-ID предназначен для идентификации видоспецифичной ДНК различных животных. Принцип исследования основан на методе ПЦР-амплификации и ИФА-детекции. Предварительно выделенная из образца ДНК подвергается амплификации с использованием биотинилированной пары праймеров, затем осуществляется гибридизация в лунках ИФА-планшета с применением специально подобранных видоспецифичных гибридизационных зондов и последующая детекция по разности оптических плотностей, определяемых при 450 и 620 нм в ИФА-анализаторе.
5.2. Метод определения видовой специфичности ДНК животного и растительного происхождения с помощью тест-системы Species Ident RT, Россия
Тест-система Species Ident RT предназначена для идентификации видоспецифичной ДНК биологических объектов животного и растительного происхождения методом ПЦР в реальном времени (Real Time PCR). Данная методика основана на использовании 5'-экзонуклеазной активности полимеразы. В этом варианте к смеси праймеров добавляют еще один компонент - зонд. Это фрагмент ДНК, содержащий флуоресцентный краситель и гаситель его флуоресценции, расположенные по 5' и 3' концам олигонуклеоида соответственно. Зонд комплементарен одной из цепей внутри ампликона и в ходе копирования полимеразой заданного праймером фрагмента ДНК зонд расщепляется за счёт 5' - 3' экзонуклеазной активности полимеразы. Краситель и гаситель флуоресценции расходятся в пространстве и флуоресценция разгорается. Таким образом, появление одного ампликона сопряжено с разгоранием одной молекулы свободного (незагашенного) флуорофора.
6. Отбор образцов, их транспортирование и хранение
6.1. Отбор образцов продуктов убоя сельскохозяйственных животных
На всех этапах отбора проб должны быть обеспечены условия, предотвращающие загрязнение, изменение состава и состояния отобранных проб.
Из партии туш, полутуш, четвертин и отрубов осмотру подлежит 10 % единиц продукции. В спорных случаях при невозможности установить видовую принадлежность мяса по морфологическим и анатомическим признакам производят отбор образцов не менее чем от трех единиц продукции.
От туши, полутуши или четвертины вырезают кусок мышечной ткани размером 5×5×5 см. Образцы замороженного мяса отбираются с помощью специальных пробоотборников.
От отрубов массой более 1,5 кг вне зависимости от типа упаковки отделяют кусок массой 100 - 200 г. Отруба массой менее 1,5 кг отбирают целиком.
Из партии мясных блоков отбирают 3 единицы упаковки и из разных точек блока вырезают образцы общей массой 100 - 200 г на единицу упаковки.
Из партии мяса механической обвалки отбирают образцы массой 200 - 300 г от трех единиц транспортной упаковки.
6.1.2. Отбор образцов пищевых субпродуктов
Из партии пищевых субпродуктов осмотру подлежит 10 % единиц продукции. В спорных случаях при невозможности установить видовую принадлежность субпродуктов по морфологическим и анатомическим признакам производят отбор образцов не менее чем от трех единиц продукции.
6.1.3. Отбор образцов кишок
Из партии кишок в транспортной упаковке отбирают образцы не менее чем из трех единиц тары (бочка, лоток). Масса образца от одной единицы тары составляет 50 г.
6.1.4. Отбор образцов жира-сырца
Из партии жира-сырца в транспортной упаковке отбирают не менее трех упаковок. Масса образца от одной упаковки составляет 200 г.
6.1.5. Отбор образцов крови пищевой
Из партии крови пищевой в транспортной упаковке отбирают не менее пяти упаковок. Масса образца из одной отобранной упаковки составляет 100 г.
6.2. Отбор образцов продуктов убоя птицы
6.2.1. От попавших в выборку единиц транспортной тары (не менее двух единиц тары) с групповой упаковкой продукции случайным образом отбирают в зависимости от массы единицы продукции следующие минимальные количества точечных проб:
• групповая упаковка с тушками птицы одной весовой категории:
- три тушки массой более 900 г (для тушек массой более 2,5 кг допускается отбор точечных проб в виде трех полутушек, полученных разделкой трех тушек вдоль позвонка и киля грудной кости на две половины, при этом на одной половине может оставаться киль грудной кости, позвоночника и гузка птицы);
- четыре тушки массой от. 400 до 900 г;
- шесть тушек массой менее 400 г, общая масса съедобной части в отобранных тушках должна быть не менее 300 г;
• групповая упаковка с тушками птицы разной весовой категории:
- одну тушку массой более 900 г и три тушки массой менее 900 г;
- если в групповой упаковке содержатся тушки массой менее 900 г, то отбирают две тушки массой от 400 до 900 г и три тушки массой менее 400 г.
Части тушек отбирают таким образом, чтобы общая масса съедобной части в отобранной объединенной пробе составляла не менее 500 г (в любом случае отбирают не менее пяти единиц частей тушек).
6.2.2. От попавших в выборку разных единиц транспортной тары с потребительской упаковкой мяса птицы отбирают случайным образом не менее трех единиц потребительской тары и направляют в лабораторию.
6.2.3. Точечные пробы в виде частей тушек, отдельных органов или кусков мышечных тканей отбирают не менее чем от трех тушек или пяти частей тушек.
Пробы в виде кусков мякотных тканей вырезают на всю глубину мышц с минимальным повреждением мышечных тканей.
Жировую ткань отбирают отделением подкожного и/или брюшного жира, масса объединенной пробы должна быть не менее 100 г.
6.2.4. Точечные пробы охлажденного мяса птицы механической обвалки (МПМО) отбирают не менее чем из трех мест на разной глубине тары. Масса объединенной пробы должна быть не менее 1000 г.
При отборе проб от замороженного в блоках МПМО для получения представительной пробы ее отбирают вырезанием куска МПМО на всю толщину блока.
Точечные пробы отбирают не менее чем от двух блоков МПМО. Масса объединенной пробы МПМО должна быть не менее 1000 г. В случае значительной неоднородности состояния поверхности МПМО количество отбираемых точечных проб увеличивают.
6.2.5. Субпродукты из транспортной тары с групповой упаковкой отбирают в виде трех точечных проб из разных мест каждой из двух или более единиц транспортной тары, попавших в выборку. Масса объединенной пробы субпродуктов должна быть не менее 1000 г.
Точечные пробы субпродуктов, содержащих кости, отбирают с учетом содержания в них съедобной части, общая масса которой в объединенной пробе должна быть не меньше 300 г (ноги) или 600 г (шеи).
В случае если в одной групповой упаковке находятся субпродукты разного наименования и необходимы их отдельные испытания, то массу отбираемых точечных проб увеличивают с учетом соотношения разных субпродуктов в упаковке. При этом в объединенной пробе субпродукты одного наименования должны содержаться в указанных выше количествах.
6.2.6. Из каждой попавшей в выборку транспортной тары с потребительской упаковкой субпродуктов случайным образом отбирают одну единицу потребительской тары. Если масса субпродуктов в одной потребительской таре не превышает 1000 г, то не менее трех отобранных единиц потребительской тары с субпродуктами направляют в лабораторию.
Если масса субпродуктов в одной потребительской таре превышает 1000 г, то не менее чем из трех отобранных единиц потребительской тары отбирают точечные пробы.
6.2.7. Отбор точечных проб субпродуктов проводят ложкой, половником, пинцетом или другим инструментом, в зависимости от вида субпродукта.
Отобранные образцы помещают в одноразовую пластиковую посуду или пакеты и маркируют соответственно п. 6.3 и опечатывают (при необходимости). При направлении в лабораторию образцы сопровождаются документом (актом отбора) с указанием: даты и места отбора образцов, вида скота, номера туши, присвоенного при приемке, причины и цели испытания, подписи отправителя.
6.3. Транспортирование и хранение
Каждый отобранный образец маркируют этикетками с указанием наименования продукта, предприятия-изготовителя, номера партии, даты отбора, цели исследования, подписей лиц, осуществивших отбор.
Транспортирование образцов осуществляют при температуре, рекомендованной для их хранения. При невозможности своевременной доставки образцов в лабораторию их подвергают замораживанию.
Условия отбора, оборудование и тара, используемые для отбора проб, упаковка, транспортирование и хранение проб должны соответствовать требованиям, установленным в ГОСТ 26668-85 и ГОСТ Р 51447-99.
7. Определение видовой специфичности ДНК животного происхождения с помощью набора SUREFOOD® ANIMAL-ID
7.1. Подготовка к анализу
7.1.1. Приготовление растворов, необходимых для выделения ДНК методом СТАВ
• Приготовление 1М ТРИС-НСl (рН 7,5): в мерной колбе на 100 см3 растворяют 12,11 г Трис (оксиметил) аминометана в 80 см3 дистиллированной воды, доводят рН концентрированной соляной кислотой до 7,5, затем доводят объем раствора до метки деионизированной водой, перемешивают, хранят при температуре -20 °С не более года.
• Приготовление 5М NaCl: растворяют 29,22 г натрия хлористого в 100 см3 дистиллированной воды, перемешивают, хранят в колбе с притертой пробкой при комнатной температуре до 1 года.
• Приготовление 1,2М NaCl: растворяют 7,02 г натрия хлористого в 100 см3 дистиллированной воды, перемешивают, хранят в колбе с притертой пробкой.
• Приготовление 30 % NaOH: растворяют 3 г натрия гидроокиси в 7 см3 дистиллированной воды.
• Приготовление 0,5М ЭДТА (рН 8,0): в мерной колбе на 100 см3 растворяют 18,62 г этилендиаминтетрауксусной кислоты в 80 см3 дистиллированной воды. Раствором 30 % NaOH доводят рН до 8,0, дистиллированной водой доводят объем раствора до метки, перемешивают. Хранят в колбе с притертой пробкой при комнатной температуре до 1 года.
• Приготовление хлороформа, насыщенного водой: смешивают 100 см3 хлороформа с 20 см3 деионизированной воды, оставляют на 24 ч для насыщения. Хранят при температуре от 4 до 5 °С не более 6 месяцев.
• Приготовление 70 %-го раствора этилового ректификованного спирта: смешивают 70 см3 96 %-го этилового ректификованного спирта с 26 см3 деионизированной воды. Хранят при температуре от 4 до 5 °С не более 2 месяцев.
• Приготовление лизирующего буфера СТАВ (2 %-го): растворяют 0,5 г гексадецилтриметиламмония бромида в 10 см3 деионизированной воды (при плохом растворении подогревают на водяной бане), добавляют 2,5 см3 1М Трис-HCl, 7 см3 5М NaCl, 1 см3 0,5М ЭДТА, доводят объем раствора деионизированной водой до 25 см3, перемешивают. Хранят при температуре от 4 °С до 5 °С не более 6 месяцев, допустимо образование осадка.
• Приготовление 0,1М NaOH: растворяют 0,4 г натрия гидроокиси в 100 см3 дистиллированной воды, перемешивают.
• Приготовление осаждающего буфера СТАВ: в мерную колбу на 200 см3 вносят 1 г гексадецилтриметиламмония бромида, 0,5 г NaCl, добавляют 100 см3 деионизированной воды. Доводят рН раствора до 8,0 0,1М NaOH. Доводят объем раствора деионизированной водой до 200 см3, перемешивают. Хранят при температуре от 4 до 5 °С не более 6 месяцев.
7.1.2. Подготовка реактивов, лабораторной посуды и приборов к анализу
7.1.2.1. Раствор лизирующего буфера СТАВ перед использованием подогревают в термостате при температуре 65 °С до полного растворения осадка. Непосредственно перед использованием в приготовленный лизирующий буфер вносят меркаптоэтанол из расчета 4 мм3 на 1 см3 лизирующего буфера и перемешивают.
7.1.2.2. Посуду для гомогенизации проб обрабатывают хромовой смесью с последующей стерилизацией в автоклаве.
7.1.2.3. Инкубирующий лабораторный встряхиватель устанавливают на температуру 50 °С перед выполнением исследования, чтобы избежать ненужного ожидания перед стадией инкубации растворов (п. 7.4.2.8).
7.1.2.4. При выполнении исследований реагенты для ПЦР, контрольные растворы и зонды, входящие в состав набора SureFood® Animal-ID, содержат при температуре 4 °С.
7.1.2.5. Буферные растворы, входящие в состав набора SureFood® Animal-ID, выдерживают при комнатной температуре и перемешивают перед использованием.
7.1.3. Подготовка проб к анализу
7.1.3.1. При исследовании материалов плотной консистенции от поступившего на исследование образца с помощью стерильного ножа или ножниц отбирают около 1 г пробы из глубоких слоев и помещают ее в фарфоровую ступку для гомогенизации пестиком без добавления жидкости. 50 мг гомогенизированной пробы помещают в одноразовую микроцентрифужную пробирку типа «Эппендорф» вместимостью 1,5 см3, маркируют и используют для выделения ДНК.
7.1.3.2. При исследовании материалов пастообразной или жидкой консистенции от поступившего на исследование образца отбирают около 50 мг пробы и помещают в одноразовую микроцентрифужную пробирку типа «Эппендорф» вместимостью 1,5 см3, маркируют и используют для выделения ДНК.
7.1.3.3. Средняя проба не формируется. Исследованию подлежит каждая отобранная проба.
7.1.3.4. После получения лабораторных проб пробирки (контейнеры) с первичными образцами помещают на хранение в течение 1 месяца при -20 °С.
7.2. Выделение ДНК
7.2.1. Выделение ДНК методом СТАВ (с использованием буфера гексадецилтриметиламмониум бромид (СТАВ)
7.2.1.1. Помещают навеску исследуемого продукта массой (100 ± 5) мг в пробирку типа «Эппендорф» вместимостью 1,5 см3.
7.2.1.2. Добавляют 300 мм3 деионизированной воды. Перемешивают на аппарате для встряхивания типа «Вортекс» в течение 30 с. Добавляют 500 мм3 лизирующего буфера СТАВ (п. 7.1.1). Перемешают на аппарате для встряхивания типа «Вортекс» в течение 30 с.
7.2.1.3. Инкубируют в термостате при температуре 65 °С в течение 90 мин, каждые 10 - 15 мин перемешивая на аппарате для встряхивания типа «Вортекс» в течение 30 с.
7.2.1.4. Центрифугируют 10 мин на настольной микроцентрифуге типа «Эппендорф» при частоте вращения 13000 об./мин. Переносят супернатант в чистую пробирку типа «Эппендорф» вместимостью 1,5 см3. Добавляют 500 мм3 хлороформа, предварительно насыщенного водой (п. 7.1.1). Перемешивают на аппарате для встряхивания типа «Вортекс» в течение 30 с до образования суспензии.
7.2.1.5. Центрифугируют 10 мин на настольной микроцентрифуге типа «Эппендорф» при частоте вращения 13000 об./мин. Переносят супернатант в чистую пробирку типа «Эппендорф» вместимостью 1,5 см3. Добавляют 500 мм3 хлороформа, предварительно насыщенного водой (п. 7.1.1). Перемешивают на аппарате для встряхивания типа «Вортекс» в течение 30 с.
7.2.1.6. Центрифугируют 5 мин на настольной микроцентрифуге типа «Эппендорф» при частоте вращения 13000 об./мин. Переносят верхнюю фракцию в чистую пробирку типа «Эппендорф» вместимостью 1,5 см3. Добавляют 2 объема осаждающего буфера СТАВ (п. 7.1.1). Перемешивают на аппарате для встряхивания типа «Вортекс» в течение 30 с.
7.2.1.7. Инкубируют при комнатной температуре в течение 60 мин.
7.2.1.8. Центрифугируют 5 мин на настольной микроцентрифуге типа «Эппендорф» при частоте вращения 13000 об./мин. Удаляют верхнюю фракцию. Осадок растворяют в 350 мм3 1,2М NaCl (п. 7.1.1). Перемешивают на аппарате для встряхивания типа «Вортекс» в течение 30 с. Добавляют 350 мм3 хлороформа, предварительно насыщенного водой (п. 7.1.1). Перемешивают на аппарате для встряхивания типа «Вортекс» в течение 30 с.
7.2.1.9. Центрифугируют 10 мин на настольной микроцентрифуге типа «Эппендорф» при частоте вращения 13000 об./мин. Переносят верхнюю фракцию в чистую пробирку типа «Эппендорф» вместимостью 1,5 см3. Добавляют 0,6 объема изопропилового спирта, взятого из морозильной камеры (-20 °С). Перемешивают на аппарате для встряхивания типа «Вортекс» в течение 30 с.
7.2.1.10. Центрифугируют 10 мин на настольной микроцентрифуге типа «Эппендорф» при частоте вращения 13 000 об./мин. Удаляют тщательно супернатант. Добавляют к осадку 500 мм3 70 %-го этилового спирта (п. 7.1.1).
7.2.1.11. Центрифугируют 10 мин на настольной микроцентрифуге типа «Эппендорф» при частоте вращения 13000 об./мин. Тщательно до последней капли удаляют супернатант.
7.2.1.12. Подсушивают осадок в термостате в течение 5 мин при 65 °С для удаления капель спирта. Добавляют 100 мм3 деионизированной воды, осторожно встряхивая.
7.2.1.13. Полученный раствор ДНК готов для проведения ПЦР.
7.2.2. Выделение ДНК другими методами
7.2.2.1. Выделение ДНК по ГОСТ Р 52173-2003.
7.2.2.2. Выделение ДНК сорбционным методом по ГОСТ Р 52723-2007.
7.2.2.3. Выделение ДНК с использованием наборов SureFood® PREP Animal или SureFood® PREP Animal X.
7.2.2.4. Возможно использование других методов выделения и очистки ДНК, утвержденных в установленном порядке.
7.3. Амплификация выделенной ДНК методом ПЦР
7.3.1. Выделенную из образца ДНК исследуют дважды: на наличие видоспецифичного фрагмента и на присутствие ингибирующего эффекта.
Количество реакции (N) = 2 × количество проб + 2 контроля ПЦР + Z1 + ... + Zn где
Z1…n - дополнительное количество реакций («опыт» в табл. 3) для пробы 1 (...n), необходимое в случае, если в п. 7.4.2.1 на пробу 1 (...n) требуется более 5 лунок.
Наличие в пробе веществ, ингибирующих ПЦР, оценивают путем добавления к реакционной смеси референес-ДНК, как внутреннего контроля.
7.3.2. Для проведения одной реакции необходимо: 18 мм3 смеси для ПЦР (код G) и 0,1 мм3 taq-полимеразы.
В общей пробирке типа «Эппендорф» вместимостью 0,2 или 0,5 см3 (в зависимости от количества ПЦР-смеси «master-mix») готовят ПЦР-смесь «master-mix»: вносят 18×N мм3 смеси для ПЦР (код G) и 0,1×N мм3 taq-полимеразы. Перемешивают на аппарате для встряхивания типа «Вортекс» в течение 15 с.
Из-за потерь реагентов, обычно возникающих при пипетировании, готовят ПЦР-смесь «master-mix» с небольшим запасом: одну резервную дозу на каждые 10 реакций и 4 дополнительно на каждые 50 реакций.
7.3.3. Готовят необходимое количество пробирок типа «Эппендорф» для ПЦР вместимостью 0,2 см3, маркируют и размещают их в штативе. В каждую пробирку вносят 18 мм3 ПЦР-смеси «master-mix» из общей пробирки (п. 7.3.2).
7.3.4. Согласно табл. 3 добавляют в соответствующие пробирки по 2 мм3 контрольной ДНК (код D), выделенной ДНК из образцов и раствора без ДНК-мишени (код Е).
Пример приготовления амплификационной смеси
7.3.5. Условия амплификации:
7.3.5.1. Условия для проведения ПЦР при использовании Taq-полимеразы марки Platinum. Taq DNA (апробировано разработчиками набора SureFood® Animal-ID на амплификаторе Perkin Elmer Thermo Cycler 9700) представлены в табл. 4.
Условия амплификации при использовании taq-полимеразы марки Platinum
|
Стадия |
τ |
t, °C |
Количество циклов |
|
Начальная денатурация |
1 мин |
95 |
1 |
|
Денатурация |
20 с |
95 |
35 |
|
Отжиг |
20 с |
48 |
|
|
Элонгация |
30 с |
72 |
|
|
Окончательная элонгация |
3 мин |
72 |
1 |
|
Выдержка |
|
4 |
1 |
7.3.5.2. Условия для проведения ПЦР при использовании ДНК-полимеразы марки НОТ FIREPol® (апробировано разработчиками набора SureFood® Animal-ID на амплификаторе Eppendorf Mastercycler personal) представлены в табл. 5.
Условия амплификации при использовании ДНК-полимеразы марки НОТ FIREPol®
|
Стадия |
τ |
t, °С |
Количество циклов |
|
Термозпуск |
14 мин |
95 |
1 |
|
Начальная денатурация |
1 мин |
95 |
1 |
|
Денатурация |
20 с |
95 |
35 |
|
Отжиг |
20 с |
48 |
|
|
Элонгация |
30 с |
72 |
|
|
Окончательная элонгация |
3 мин |
72 |
1 |
|
Выдержка |
|
4 |
1 |
7.3.6. По окончании ПЦР допустимо приостановление исследования, в таком случае продукты ПЦР хранят в течение 24 ч при температуре 4 °С или в течение 6 недель при температуре -20 °С.
7.4. Проведение иммуноферментного анализа для детекции продуктов ПЦР
7.4.1. Подготовка реактивов к проведению детекции продуктов ПЦР
7.4.1.1. Разбавляют гибридизационные зонды (коды А, В, С) гибридизирующим буфером (код 4) в отношении 1:100 в количестве, необходимом для проведения исследования.
7.4.1.2. Разбавляют препарат антител (код Н) буферным раствором для коньюгата (код 6) в отношении 1:200 в количестве, необходимом для исследования.
7.4.2. Гибридизация продуктов ПЦР
7.4.2.1. Перед началом гибридизации продуктов ПЦР следует составить схему исследования, в соответствии со схемой, приведенной в прилож. А настоящих методических рекомендаций, и рассчитать количество лунок, необходимых для гибридизации:
количество лунок (М) = 2 контроля гибридизации + 2 контроля ПЦР + X, где
X - количество лунок для проб. На каждую пробу, для идентификации одного вида животного в ее составе, необходимо 2 лунки (соответствуют «опыту» и «ингибированию» в табл. 3). Для дополнительной идентификации других видов животных в той же пробе необходимо еще по 1 лунке на каждый последующий идентифицируемый вид.
7.4.2.2. Помещают необходимое количество лунок в рамку.
7.4.2.3. Добавляют по 100 мм3 связывающего ПЦР буфера (код 1) в каждую лунку, покрытую стрептавидином. Отбирают буфер многоканальной пипеткой и выбивают из лунок остатки жидкости путем постукивания рамкой по столу, накрытому фильтровальной бумагой. При выбивании жидкости из лунок стрипы придерживают рукой.
7.4.2.4. Добавляют по 100 мм3 связывающего ПЦР буфера (код 1) в каждую лунку.
7.4.2.5. Добавляют по 5 мм3 продуктов ПЦР в соответствующие лунки («для проб», для «положительного контроля ПЦР» и «отрицательного контроля ПЦР»). В лунки для контроля гибридизации продукты ПЦР не добавляют.
7.4.2.6. Добавляют по 5 мм3 раствора для контроля гибридизации (код F) в 2 лунки для контроля гибридизации (для «положительного контроля гибридизации» и «отрицательного контроля гибридизации»).
7.4.2.7. Закрывают планшет самоклеющейся пленкой.
7.4.2.8. Инкубируют планшет в течение 15 мин при 50 °С в термошейкере при непрерывном встряхивании с орбитальной скоростью 300 об./мин.
7.4.2.9. Снимают пленку с планшета, удаляют из лунок буферный раствор с помощью многоканальной пипетки и выбивают планшет путем постукивания рамкой по столу, накрытому фильтровальной бумагой; при выбивании жидкости из лунок стрипы придерживают рукой.
7.4.3. Денатурация ампликонов ДНК
7.4.3.1. Добавляют в каждую лунку по 50 мм3 денатурирующего буфера (код 2).
7.4.3.2. Инкубируют планшет при комнатной температуре в течение 5 мин.
7.4.3.3. Удаляют из лунок буферный раствор с помощью многоканальной пипетки и выбивают планшет путем постукивания рамкой по столу, накрытому фильтровальной бумагой. При выбивании жидкости из лунок стрипы придерживают рукой.
7.4.3.4. Добавляют в каждую лунку 50 мм3 моющего ПЦР-буфера (код 3). Удаляют из лунок моющий ПЦР-буфер с помощью многоканальной пипетки и выбивают планшет (путем постукивания рамкой по столу, накрытому фильтровальной бумагой; при выбивании жидкости из лунок стрипы придерживают рукой).
7.4.3.5. Повторяют п. 7.4.3.4.
7.4.4. Гибридизция ДНК-зондов
7.4.4.1. В каждую лунку, содержащую продукты ПЦР и контроли ПЦР, вносят 50 мм3 определенного (в зависимости от идентифицируемого в пробе животного) разведенного зонда А для детекции одного вида животного; в лунку с отрицательным контролем гибридизации - 50 мм3 разведенного зонда В; в лунку с положительным контролем гибридизации - 50 мм3 разведенного зонда С. В табл. 6 показан план внесения гибридизационных зондов в соответствующие лунки планшета (прилож. А).
План дозирования гибридизационных зондов
|
Разбавленные гибридизационные зонды |
Контроль гибридизации |
Контроль ПЦР |
Пробы |
|||
|
|
Кгибр+ |
Кгибр- |
Кпцр+ |
Кпцр- |
опыт |
ингиб. |
|
Зонд А (ida-probe) |
- |
- |
50 |
50 |
50 |
50 |
|
Зонд В (hyb-probe minus (-)) |
- |
50 |
- |
- |
- |
- |
|
Зонд С (hyb-probe plus (+)) |
50 |
- |
- |
- |
- |
- |
|
Ожидаемый результат |
+ |
- |
+ |
- |
± |
+ |
7.4.4.2. Закрывают планшет самоклеющейся пленкой. Инкубируют планшет в течение 15 мин при 50 °С в термошейкере при непрерывном встряхивании с орбитальной скоростью 300 об./мин.
7.4.4.3. Удаляют из лунок буферный раствор с помощью многоканальной пипетки и выбивают планшет путем постукивания рамкой по столу, накрытому фильтровальной бумагой; при выбивании жидкости из лунок стрипы придерживают рукой.
7.4.4.4. Добавляют 50 мм3 закрепляющего буфера (код 5) в каждую лунку. Удаляют из лунок буферный раствор с помощью многоканальной пипетки и выбивают планшет путем постукивания рамкой по столу, накрытому фильтровальной бумагой; при выбивании жидкости из лунок стрипы придерживают рукой.
7.4.4.5. Добавляют еще раз 50 мм3 закрепляющего буфера (код 5) в каждую лунку.
7.4.4.6. Закрывают планшет самоклеющейся пленкой. Инкубируют планшет в течение 5 мин при 50 °С в термошейкере при непрерывном встряхивании с орбитальной скоростью 300 об./мин. Удаляют из лунок буферный раствор с помощью многоканальной пипетки и выбивают планшет путем постукивания рамкой по столу, накрытому фильтровальной бумагой; при выбивании жидкости из лунок стрипы придерживают рукой.
7.4.4.7. Повторяют п.п. 7.4.4.5. и 7.4.4.6.
7.4.4.8. Добавляют 50 мм3 моющего буфера для антител (код 7) в каждую лунку. Удаляют из лунок буферный раствор с помощью многоканальной пипетки, и выбивают планшет путем постукивания рамкой по столу, накрытому фильтровальной бумагой; при выбивании жидкости из лунок стрипы придерживают рукой.
7.4.4.9. Добавляют 50 мм3 разбавленного препарата антител в каждую лунку.
7.4.4.10. Закрывают планшет самоклеющейся пленкой. Инкубируют планшет при комнатной температуре в течение 15 мин.
7.4.4.11. Удаляют из лунок буферный раствор с помощью многоканальной пипетки и выбивают планшет путем постукивания рамкой по столу, накрытому фильтровальной бумагой; при выбивании жидкости из лунок стрипы придерживают рукой.
7.4.4.12. Добавляют 50 мм3 моющего буфера для антител (код 7) в каждую лунку. Удаляют из лунок буферный раствор с помощью многоканальной пипетки и выбивают планшет путем постукивания рамкой по столу, накрытому фильтровальной бумагой; при выбивании жидкости из лунок стрипы придерживают рукой.
7.4.4.13. Повторяют п. 7.4.4.12 еще два раза.
7.4.4.14. Добавляют 50 мм3 субстрата (код 8) в каждую лунку планшета.
7.4.4.15. Закрывают планшет самоклеющейся пленкой. Инкубируют планшет при комнатной температуре в течение 10 мин.
7.4.4.16. Добавляют 50 мм3 стоп-раствора (код 9) в каждую лунку планшета - цвет растворов меняется с голубого на желтый.
7.4.4.17. Измерения оптической плотности выполняют немедленно после остановки цветной реакции с помощью ИФА-анализатора (ридера) в лунках планшета при длине волны 450 нм и 620 нм.
7.5. Интерпретация результатов исследования
7.5.1. Для интерпретации используют величину оптической плотности (ОП) раствора в лунке, вычисляемую по формуле:
ОП = ОП450 - ОП620, где
ОП450 - оптическая плотность раствора в лунке при длине волны 450 нм;
ОП620 - оптическая плотность раствора в лунке при длине волны 620 нм.
7.5.2. На первом этапе интерпретации оценивают результаты контроля ПЦР (Кпцр+, Кпцр-):
7.5.2.1. Результат контрольной реакции (Кпцр- контроль контаминации по раствору без ДНК-мишени) оценивают как отрицательный, если величина ОП в лунке меньше или равна 0,2.
7.5.2.2. Результат контрольной реакции (Кпцр+ контроль эффективности ПЦР (по контрольной ДНК) оценивают как положительный, если величина ОП в лунке больше 0,2 и по крайней мере вдвое больше ОП отрицательного контроля (п. 7.5.2.1).
7.5.3. На втором этапе интерпретации оценивают результаты контроля гибридизации (Кгибр+, Кгибр-)
7.5.3.1. Результат контрольной реакции (Кгибр- отрицательный контроль гибридизации) оценивают как отрицательный, если величина ОП в лунке меньше или равна 0,2.
7.5.3.2. Результат контрольной реакции (Кгибр+ положительный контроль гибридизации) оценивают как положительный, если величина ОП в лунке больше 0,2 и по крайней мере вдвое больше ОП отрицательного контроля гибридизации (п. 7.5.3.1).
7.5.4. На третьем этапе интерпретации оценивают результаты исследования.
7.5.4.1. Если величина ОП в лунке с пробой (опыт) больше 0,2 и как минимум вдвое превышает отрицательный контроль ПЦР (п. 7.5.2.1), то результат исследования можно интерпретировать как положительный в том случае, если при этом величина ОП в лунке с контролем ингибирования пробы больше 0,2 и как минимум вдвое превышает отрицательный контроль ПЦР (п. 7.5.2.1).
7.5.4.2. Если величина ОП в лунке с пробой (опыт) меньше или равна 0,2, то результат исследования можно интерпретировать как отрицательный в том случае, если при этом величина ОП в лунке ингибирования пробы составляет как минимум 50 % от величины ОП в лунке с положительным контролем ПЦР (п. 7.5.2.2).
7.5.4.3. Иные результаты исследования (отличные от п.п. 7.5.4.1 и 7.5.4.2) интерпретации не подлежат. В этом случае необходимо повторить анализ, изменив условия/метод выделения ДНК.
Чувствительность метода идентификации ДНК животного происхождения с помощью набора SureFood® Animal-ID находится в пределах от 0,1 до 0,5 % в зависимости от исследуемого сырья согласно инструкции, прилагаемой к набору.
8. Определение видовой принадлежности выделенной ДНК с помощью наборов Species Ident RT
8.1. Выделение ДНК
Основной принцип выделения ДНК заключается в экстрагировании ДНК, присутствующей в образце, а затем одновременной или последующей очистке ДНК от ингибиторов ПЦР.
Выделение/очистку ДНК проводят по ГОСТ Р 52173-2003.
8.2. Подготовка к проведению реакции Real Time ПЦР
8.2.1. Непосредственно перед применением размораживают необходимое количество пробирок с готовой реакционной смесью из расчета 2 × N + 4, где N - количество исследуемых образцов, экстрагированную из исследуемого материала ДНК, а также отрицательные и положительные контрольные образцы, затем перемешивают на аппарате для встряхивания (п. 6.1) в течение 3 - 5 с и откручивают для сброса капель.
8.2.2. Помещают пробирки с реакционной смесью в штатив. Маркируют пробирки в соответствии с протоколом исследования в верхней части стенки пробирки. Не следует наносить маркировку на крышку пробирок.
8.2.3. Вносят последовательно в пробирки по 2 мм3 «ОК», экстракта ДНК каждого из исследуемых образцов и в последнюю очередь «ПК» в соответствии с маркировкой. Содержимое пробирок кратковременно перемешивают на аппарате для встряхивания (п. 6.1) и центрифугируют 10 - 30 с.
8.2.4. Помещают пробирки в амплификатор в соответствии с порядком исследования, изложенным в табл. 7.
Порядок исследования образцов*
_______________
* В случае исследования многокомпонентных продуктов число пробирок на одну пробу, а также число пробирок для отрицательных и положительных контрольных образцов рассчитывать исходя из того, какое число видов ДНК планируется идентифицировать.
8.3. Проведение реакции Real Time ПЦР
Включают прибор для проведения Real Time ПЦР в соответствии с инструкцией по эксплуатации и задают программу амплификации:
|
Стадия 1 |
Стадия 2 |
|
|
Reps (Повторов) - 1 |
Reps (Повторов) - 35 |
|
|
95 °С - 5:00 |
95 °С - 0:20 |
60 °С - 0:40 |
Объем смеси - 30 мм3.
Измерение сигнала - стадия 2, шаг 2.
Параметры детектора: краситель - FAM; гаситель - None.
Пассивный свидетель - ROX (для амплификаторов ABI Prism серии 7***).
По окончании программы амплификации отработанные пробирки утилизируют в соответствии с рекомендациями по организации ПЦР лаборатории.
8.4. Интерпретация результатов
8.4.1. Реакция на «ПК»: пороговый цикл Ct (FAM) «ПК» должен быть менее 30 циклов. Получение пороговых циклов для «ПК» больше указанных свидетельствует об ухудшении качества реактивов или неправильной подготовке к проведению реакции.
8.4.2. Реакция на «ОК»: результат должен быть отрицательным. В случае получения положительной реакции для «ОК» результаты определения образцов считаются недействительными.
Результаты анализа исследуемых образцов применяются для анализа только при выполнении ВСЕХ вышеперечисленных условий для контрольных образцов.
8.4.3. Исследуемые образцы: результат считают положительным, если пороговый цикл Ct (FAM) образца не превышает 33 цикла. В случае отсутствия реакции результат считают отрицательным.
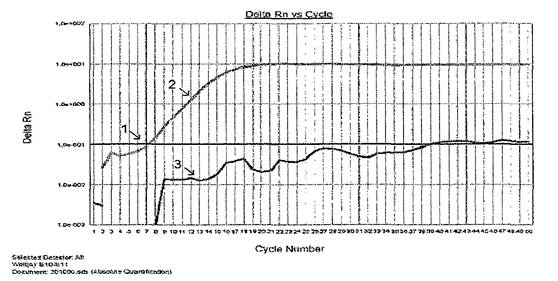
Пример кинетических кривых на рис. 1.
Рис. 1. Кривая флуоресценции накопленных продуктов ПЦР,
полученная в ходе ПЦР в реальном времени:
1 - точка начала log-фазы ПЦР и соответствующее ей количество
выполненных циклов; 2 - кривая амплификации, свидетельствующая
о наличии искомой видоспецифической ДНК; 3 - кривая
амплификации, свидетельствующая об отсутствии искомой
видоспецифической ДНК
При выявлении несоответствия видового состава исследованного продукта заявленному на этикетке необходимо проведение экспертной оценки факта фальсификации в организациях, уполномоченных на проведение подобных экспертиз.
Чувствительность метода идентификации ДНК животного происхождения с помощью набора Species Ident RT находится в пределах от 0,1 до 0,5 % в зависимости от исследуемого сырья согласно инструкции, прилагаемой к набору.
9. Требования биологической безопасности при выполнении работ
Требования биологический безопасности определяются в соответствии с МУ 1.3.1888-04 «Организация работы при исследованиях методом ПЦР материала, инфицированного патогенными биологическими агентами III - IV групп патогенности».
Приложение A
Пример проведения расчетов при идентификации сырьевого состава мясной продукции методом ПЦР-ИФА с использованием набора SureFood® Animal-ID
Исследовали 3 пробы пищевой продукции (многокомпонентные мясные изделия):
- в пробе № 1 - проводится идентификация 1 вида животного (индейки);
- в пробе № 2 - 2 видов животных (курицы и утки);
- в пробе № 3 - 6 видов животных (говядины, свинины, баранины, козлятины, курицы и утки).
1. Амплификация выделенной ДНК методом ПЦР
1.1. Рассчитывали количество реакций:
Количество реакции (N) = 2 × 3 проб + 2 контроля ПЦР + 1 = 9
![]()
Z3 = 1, дополнительная реакция для пробы № 3, т.к. по п. 7.4.2.1 настоящих MP для пробы № 3 потребовалось 7 лунок.
1.2. В общей пробирке типа «Эппендорф» вместимостью 0,5 мл готовили ПЦР-смесь «master-mix»: вносили 18 × 9 = 162 мкл смеси для ПЦР (код G) и 0,1 × 9 = 0,9 мкл Taq-полимеразы. Перемешивали на аппарате для встряхивания типа «Вортекс». Резервную дозу не готовили, т.к. общее количество реакции N меньше 10.
1.3. Приготовили 9 пробирок типа «Эппендорф» для ПЦР вместимость 0,2 мл и разместили их в штативе. В каждую пробирку добавляли 18 мкл ПЦР-смеси «master-mix» из общей пробирки.
1.4. Добавляли в соответствующие пробирки по 2 мкл контрольной ДНК (код D), выделенной ДНК из образцов и раствора без ДНК-мишени (код Е) (табл. 8).
1.5. Амплификацию проводили согласно условиям, представленным в табл. 4 настоящих MP.
2. Проведение иммуноферментного анализа для детекции продуктов ПЦР
2.1. Подготовка реактивов к проведению детекции продуктов ПЦР.
2.1.1. Рассчитывали количество гибридизационных зондов (табл. 10) в зависимости от их использования по п. 7.4.4.1 настоящих MP.
Приготовление реакционной смеси
|
Реактивы |
Контроль ПЦР |
Проба № 1 |
Проба № 2 |
Проба № 3 |
|||||
|
Кпцр+ |
Кпцр- |
ингиб. |
опыт |
ингиб. |
опыт |
ингиб. |
опыт |
опыт (доп.) |
|
|
ПЦР-смесь «master-mix» |
18 |
18 |
18 |
18 |
18 |
18 |
18 |
18 |
18 |
|
Контрольная ДНК (код D) |
2 |
- |
2 |
- |
2 |
- |
2 |
- |
- |
|
ДНК, выделенная из образца |
- |
- |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
|
Раствор без ДНК (код Е) |
- |
2 |
- |
- |
- |
- |
- |
- |
- |
|
|
Контроль эффективности ПЦР |
Контроль контаминации |
Контроль ингибирования |
ДНК, выделенная из образца |
Контроль ингибирования |
ДНК, выделенная из образца |
Контроль ингибирования |
ДНК, выделенная из образца |
ДНК, выделенная из образца, дополнительная реакция |
|
Номер пробирки |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
2.1.2. Разбавили гибридизационные зонды А, В, С гибридизирующим буфером (код 4) в отношении 1:100 согласно табл. 9.
Разбавление гибридизационных зондов гибридизирующим буфером
|
Зонд А (индейка), мм3 |
2 |
|
|
|
|
|
|
|
|
|
Зонд А (курица), мм3 |
|
1,5 |
|
|
|
|
|
|
|
|
Зонд А (утка), мм3 |
|
|
1 |
|
|
|
|
|
|
|
Зонд А (говядина), мм3 |
|
|
|
1 |
|
|
|
|
|
|
Зонд А (свинина), мм3 |
|
|
|
|
0,5 |
|
|
|
|
|
Зонд А (баранина), мм3 |
|
|
|
|
|
0,5 |
|
|
|
|
Зонд А (козлятина), мм3 |
|
|
|
|
|
|
0,5 |
|
|
|
Зонд В, мм3 |
|
|
|
|
|
|
|
0,5 |
|
|
Зонд С, мм3 |
|
|
|
|
|
|
|
|
0,5 |
|
Гибридизир. буфер (код 4), мм3 |
200 |
150 |
100 |
100 |
50 |
50 |
50 |
50 |
50 |
|
Всего, мм3 |
202 |
151,5 |
101 |
101 |
50,5 |
50,5 |
50,5 |
50,5 |
50,5 |
Количество гибридизационных зондов, необходимое для проведения исследования
|
|
Контроль гибридизации |
Контроль ПЦР |
Проба № 1 |
Проба № 2 |
Проба № 3 |
Всего зонда, мм3 |
|||||||||||
|
|
Кгибр+ |
Кгибр- |
Кпцр+ |
Кпцр- |
ингиб. |
опыт 1 |
ингиб. |
опыт 1 |
опыт 2 |
ингиб. |
опыт 1 |
опыт 2 |
опыт 3 |
опыт 4 |
опыт 5 |
опыт 6 |
|
|
Зонд А (индейка), мм3 |
|
|
50 |
50 |
50 |
50 |
|
|
|
|
|
|
|
|
|
|
200 |
|
Зонд А (курица), мм3 |
|
|
|
|
|
|
50 |
50 |
|
|
|
|
|
|
50 |
|
150 |
|
Зонд А (утка), мм3 |
|
|
|
|
|
|
|
|
50 |
|
|
|
|
|
|
50 |
100 |
|
Зонд А (говядина), мм3 |
|
|
|
|
|
|
|
|
|
50 |
50 |
|
|
|
|
|
100 |
|
Зонд А (свинина), мм3 |
|
|
|
|
|
|
|
|
|
|
|
50 |
|
|
|
|
50 |
|
Зонд А (баранина), мм3 |
|
|
|
|
|
|
|
|
|
|
|
|
50 |
|
|
|
50 |
|
Зонд А (козлятина), мм3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
50 |
|
|
50 |
|
Зонд В, мм3 |
|
50 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
50 |
|
Зонд С, мм3 |
50 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
50 |
2.2. Гибридизация продуктов ПЦР.
2.2.1. Перед началом гибридизации ПЦР-продуктов составили схему исследования и рассчитали количество лунок, необходимое для гибридизации:
Количество лунок (М) = 2 контроля гибридизации + 2 контроля ПЦР + X, где
X - количество лунок для проб.
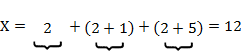
Проба № 1 Проба № 2 Проба № 3
Количество лунок (М) = 2 контроля гибридизации + 2 контроля ПЦР + 12 = 16.
Поместили необходимое количество (16) лунок в рамку.
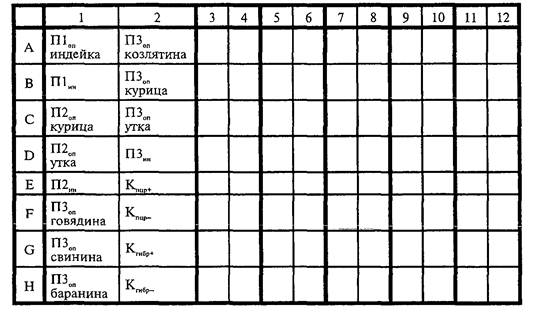
2.2.2. Схема ИФА-планшета представлена на рис. 1.
Рис. 1. Схема ИФА-планшета
|
Кгибр+ |
- положительный контроль гибридизации; |
|
Кгибр- |
- отрицательный контроль гибридизации; |
|
Кпцр+ |
- положительный контроль ПЦР; |
|
Кпцр- |
- отрицательный контроль ПЦР; |
|
П1оп |
- проба № 1 опыт (идентификация одного вида животного); |
|
П1ин |
|
|
П2оп |
- проба № 2 опыт (идентификация одного вида животного); |
|
П2ин |
- проба № 2 контроль ингибирования; |
|
П3оп |
- проба № 3 опыт (идентификация одного вида животного); |
|
П3ин |
- проба № 3 контроль ингибирования; |
2.2.3. Добавляли по 100 мкл связывающего ПЦР буфера (код 1) в каждую лунку (А1-Н2). Отбирали буфер многоканальной пипеткой и выбивали из лунок остатки жидкости, путем постукивания рамкой по столу, накрытому фильтровальной бумагой. При выбивании жидкости из лунок придерживали стрипы рукой. Добавляли по 100 мкл связывающего ПЦР буфера (код 1) в каждую лунку (А1 - Н2).
2.2.4. Добавляли по 5 мкл продуктов ПЦР: из пробирок (табл. 8) 3 - 9 в лунки «для проб» A1-D2; из пробирки 1 (табл. 8) в лунку для «положительного контроля ПЦР» Е2; из пробирки 2 (табл. 8) в лунку для «отрицательного контроля ПЦР» F2. В 2 лунки для контроля гибридизации (G2 и Н2) продукты ПЦР не добавляли.
2.2.5. Добавляли по 5 мкл раствора для контроля гибридизации (код F) в 2 лунки для контроля гибридизации для «положительного контроля гибридизации» (G2) и для «отрицательного контроля гибридизации» (Н2).
2.2.6. Далее проводили исследование по п.п. 7.4.2.7 - 7.4.3.5 настоящих MP.
2.3. Гибридизция ДНК-зондов.
2.3.1. Добавляли разбавленные зонды А, В, С согласно схеме, представленной на рис. 1: по 50 мм3 разведенного зонда А для детекции индейки вносили в лунки А1, В1. Е2, F2; по 50 мм3 разведенного зонда А для детекции утки вносили в лунки D1, С2; по 50 мм3 разведенного зонда А для детекции курицы вносили в лунки С1, Е1, В2; по 50 мм3 разведенного зонда А для детекции говядины вносили в лунки F1, D2; 50 мм3 разведенного зонда А для детекции свинины вносили в лунку П1; 50 мм3 разведенного зонда А для детекции баранины вносили в лунку Н1; 50 мм3 разведенного зонда А для детекции козлятины вносили в лунку А2; 50 мм3 разведенного зонда В вносили в лунку Н2; 50 мм3 разведенного зонда С вносили в лунку G2.
2.3.2. Проводили п.п. 7.4.4.2 - 7.4.4.17.
2.4. Результаты измерений оптических плотностей (ОП).
Результаты измерений представлены в табл. 11, верхняя цифра в ячейке соответствует оптической плотности раствора, измеренной при 450 нм, нижняя цифра - при 620 нм.
Результаты измерений
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
А |
1,471 0,035 |
0,106 0,041 |
|
|
|
|
|
|
|
|
|
|
|
В |
1,21 0,054 |
1,424 0,038 |
|
|
|
|
|
|
|
|
|
|
|
С |
0,135 0,058 |
0,065 0,041 |
|
|
|
|
|
|
|
|
|
|
|
D |
1,276 0,039 |
0,969 0,037 |
|
|
|
|
|
|
|
|
|
|
|
Е |
0,571 0,051 |
1,281 0,036 |
|
|
|
|
|
|
|
|
|
|
|
F |
1,541 0,038 |
0,073 0,051 |
|
|
|
|
|
|
|
|
|
|
|
G |
1,234 0,046 |
1,579 0,04 |
|
|
|
|
|
|
|
|
|
|
|
Н |
0,055 0,036 |
0,05 0,034 |
|
|
|
|
|
|
|
|
|
|
3. Интерпретация результатов
3.1. Рассчитывали величину ОП по п. 7.5.1 настоящих MP. Результаты представлены в табл. 12.
Результаты расчета величины ОП
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
А |
1,436 |
0,065 |
|
|
|
|
|
|
|
|
|
|
|
В |
1,156 |
1,386 |
|
|
|
|
|
|
|
|
|
|
|
С |
0,077 |
0,024 |
|
|
|
|
|
|
|
|
|
|
|
D |
1,237 |
0,932 |
|
|
|
|
|
|
|
|
|
|
|
Е |
0,52 |
1,245 |
|
|
|
|
|
|
|
|
|
|
|
F |
1,503 |
0,022 |
|
|
|
|
|
|
|
|
|
|
|
G |
1,188 |
1,539 |
|
|
|
|
|
|
|
|
|
|
|
Н |
0,019 |
0,016 |
|
|
|
|
|
|
|
|
|
|
3.4. Оценивали результаты исследований.
3.2. Оценивали результаты контроля ПЦР (Кпцр+ - лунка Е2; Кпцр- - лунка F2): величина ОП в лунке F2 меньше 0,2, следовательно, результат контрольной реакции Кпцр- отрицательный; величина ОП в лунке Е2 больше 0,2 и более чем в два раза превышает величину ОП в лунке F2 (Кпцр-), следовательно, результат контрольной реакции Кпцр+ положительный.
3.3. Оценивали результаты контроля гибридизации (Кгибр+ - лунка G2, Кгибр- - лунка Н2): величина ОП в лунке Н2 меньше 0,2, следовательно, результат контрольной реакции Кгибр- - отрицательный; величина ОП в лунке G2 больше 0,2 и более чем в два раза превышает величину ОП в лунке Н2 (Кгибр-), следовательно, результат контрольной реакции Кгибр+ положительный.
3.4.1. Проба № 1 (лунки А1, В1): величина ОП в лунке А1 больше 0,2 и более чем в два раза превышает величину ОП в лунке F2 (Кпцр-), а т.к. величина ОП в лунке с контролем ингибирования В1 больше 0,2 и более чем в два раза превышает величину ОП в лунке F2 (Кпцр-), то результат исследования пробы № 1 на наличие в ее составе ДНК индейки можно считать положительным.
3.4.2. Проба № 2 (лунки C1, D1, Е1): величина ОП в лунке С1 меньше 0,2, но величина ОП в лунке с контролем ингибирования Е1 составляет менее 50 % от величины ОП в лунке Е2 (Кпцр+), следовательно, результаты исследования пробы № 2 интерпретировать нельзя, необходимо изменить условия/метод выделения ДНК.
3.4.3. Проба № 3 (лунки F1, G1, H1, А2, В2, С2, D2): величины ОП в лунках Р1, G1, В2 больше 0,2 и более чем в два раза превышают величину ОП в лунке F2 (Кпцр-), а т.к. величина ОП в лунке с контролем ингибирования D2 больше 0,2 и более чем в два раза превышает величину ОП в лунке F2 (Кпцр-), следовательно, результаты исследования пробы № 3 на наличие в ее составе ДНК говядины, свинины и курицы можно считать положительными; величины ОП в лунках Н1, А2, С2 меньше 0,2 и величина ОП в лунке с контролем ингибирования D2 составляет более 50 % от величины ОП в лунке Е2 (Кпцр+), следовательно, результаты исследования пробы № 3 на наличие в ее составе ДНК баранины, козлятины, утки можно считать отрицательными.