| Информационная система |  |
Государственное
санитарно-эпидемиологическое нормирование
Российской Федерации
4.2. МЕТОДЫ КОНТРОЛЯ.
БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Лабораторная диагностика сапа
Методические указания
МУ 4.2.2831-11
Москва • 2011
1. Методические указания разработаны Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Ю.В. Демина, Н.Д. Пакскина); ФГУЗ «Волгоградский научно-исследовательский противочумный институт» Роспотребнадзора (В.И. Илюхин, В.В. Алексеев, Н.П. Храпова, В.А. Антонов, Т.В. Сенина).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека.
3. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 14 января 2011 г.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель Федеральной службы Г.Г. Онищенко 14 января 2011 г. Дата введения: с момента утверждения |
4.2. МЕТОДЫ КОНТРОЛЯ.
БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Лабораторная диагностика сапа
Методические указания
МУ 4.2.2831-11
1. Область применения
1.1. Методические указания предназначены для специалистов как в системе органов, осуществляющих государственный санитарно-эпидемиологический надзор, так и в системе лечебно-профилактических организаций независимо от их организационно-правовой формы и формы собственности.
1.2. В методических указаниях определены порядок забора, транспортирования и выполнения лабораторных исследований биологического материала от больных и умерших людей, животных с подозрением на сап, материала из объектов окружающей среды, подозрительного на контаминацию возбудителем данного заболевания.
2. Нормативные ссылки
2.1. Санитарно-эпидемиологические правила СП 1.3.1285-03 «Безопасность работы с микроорганизмами I - II групп патогенности (опасности)». М., 2003.
2.2. Санитарные правила СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности». М., 1996.
2.3. МУ 1.3.1794-03 «Организация работы при исследованиях методом ПЦР материала, инфицированного микроорганизмами I - II групп патогенности». М., 2004.
2.4. МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам». М., 2004.
2.5. МУ 3.5.5.1034-01 «Обеззараживание биологического материала и объектов внешней среды, зараженных бактериями I - IV групп патогенности, при исследованиях методом ПЦР». М., 2001.
2.6. Методические рекомендации «Лабораторная диагностика, лечение и профилактика сапа». Волгоград, 1995.
2.7. Практическое руководство «Специфическая индикация патогенных биологических агентов». М., 2006.
2.8. Практическое руководство «Лабораторная диагностика опасных инфекционных болезней». М., «Медицина», «Шико», 2009.
Список сокращений
3. Общие сведения
Сап - зоонозная инфекция, протекающая у человека в острой септической и хронической формах со специфическими поражениями кожи, слизистых оболочек, мышц, суставов и внутренних органов.
Основным резервуаром инфекции в естественных условиях являются преимущественно однокопытные - лошади, ослы, мулы, а также верблюды и дикие хищники семейства кошачьих. В настоящее время сап у лошадей отмечается в Монголии, Турции, Иране, Ираке, Китае, Индии, Индонезии и на Филиппинах. В России существует опасность заноса инфекции из-за рубежа.
Источником инфекции для людей служат животные, обычно лошади. Заражение происходит через выделения больного животного: носовой секрет и отделяемое кожных язв, реже содержимое кишечника, моча, молоко. Восприимчивость людей к сапу оценивается неоднозначно. С одной стороны, в начале прошлого века количественное соотношение больных лошадей и имевших к ним отношение людей измерялось как 200 - 400 к 1, на основании чего делался вывод о высокой видовой устойчивости человека к этой инфекции. С другой стороны, соотношение хронических и острых форм заболевания у лошадей составляет 9:1, а среди людей - 1:1, что предполагает более высокую чувствительность людей к сапу. Основной путь заражения в естественных условиях - контактный (80 % случаев) через кожу верхних и нижних конечностей, лица и шеи, значительно реже через слизистые оболочки верхних дыхательных путей и конъюнктиву глаз. Фактически сап является профессиональной болезнью. В прошлом сапом заболевали конюхи, ветеринары, работники конских боен.
Описаны случаи внутрилабораторных заражений ветеринарных и медицинских работников, известны случаи заболевания после повреждения кожи при вскрытии трупов больных сапом. Считается, что аэрозоли культур высоко инфекциозны для человека. Большинство описанных случаев заражения сапом в лабораторных условиях связано с проникновением возбудителя через дыхательные пути. При анализе профессиональных случаев заболеваний микробиологов, работающих с особо опасными инфекциями, В. mallei ставят в один ряд с возбудителями чумы и туляремии. В последнее время описаны 2 случая внутрилабораторного заражения (по одному в США и в России), в одном случае заболевание закончилось летальным исходом, в другом - потребовало длительного комплексного лечения химиопрепаратами. Передача от человека к человеку спорна, хотя в литературных источниках начала XX века описаны отдельные случаи таких заражений - при уходе за больными людьми и животными без специальных мер предосторожности.
Возбудитель сапа Burkholderia mallei относится к патогенным представителям рода Burkholderia (выделен в автономную таксономическую единицу в 1992 г. из представителей 2-й группы рРНК-ДНК гомологии обширного таксономически аморфного рода Pseudomonas), вызывает тяжелое инфекционное заболевание у человека и довольно широкого круга животных. В экспериментальных условиях наиболее чувствительными к сапу животными являются кошки, золотистые хомячки и морские свинки. Кролики мало восприимчивы к сапу. Белые мыши и крысы - высокорезистентны.
Возбудитель сапа - неподвижная (атрих) тонкая полиморфная палочка, прямая или несколько изогнутая, с закругленными концами, размером 0,4´3 - 5 мкм. Наряду с типичными клетками могут встречаться очень короткие коккобациллярные (в молодых культурах), булавовидные и ветвящиеся формы (в старых культурах). Спор и капсул возбудитель сапа не образует.
В. mallei относительно устойчива во внешней среде: в подсохших выделениях больных микроб сохраняет жизнеспособность до трех месяцев, в воде и различных гниющих субстратах - до месяца. При нагревании взвеси чистой культуры возбудитель сапа погибает при 60 °C через 2 ч и более, при кипячении - в течение нескольких минут. Хлорная известь (2 % раствор) вызывает гибель В. mallei через несколько мин, 1 % едкий натр - через 1 ч.
Возбудитель сапа обладает устойчивостью к пенициллинам, полимиксинам, ванкомицину, хиноксидину и диоксидину, что используется в качестве дифференциального теста.
4. Материал для исследования, отбор и транспортирование проб
Вся работа с исследуемым материалом, подозрительным на зараженность возбудителем мелиоидоза, проводится в соответствии с требованиями по безопасности работы с микроорганизмами I - II групп патогенности (санитарными правилами СП 1.3.1285-03 «Безопасность работы с микроорганизмами I - II групп патогенности (опасности)» и СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности», а также методическими указаниями МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности»).
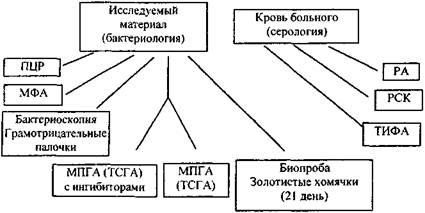
Идентификация возбудителя сапа предусматривает выделение возбудителя (или антигенов) из объектов исследования и определения специфических антител в крови людей и животных. Схема и последовательность бактериологических и иммунологических этапов представлены ниже (рис. 1).
Рис. 1. Этапы идентификации Burkholderia mallei
Примечание: Постановка, оценка реакций и расшифровка сокращений по тексту.
Исследование на сап начинается одновременно бактериологическим, биологическим и серологическим методами. С момента поступления материала проводят бактериоскопию мазков в световом и люминесцентном микроскопах, бактериологическое исследование, направленное на выделение культуры сапного микроба, биологическое исследование, как дополнительное для выделения «чистой» культуры, и серологическое исследование нативного материала для выявления видоспецифического антигена или специфических антител.
Материалом для исследования от людей и животных с подозрением на сап могут быть выделения из носа, отделяемое язв, пунктаты лимфоузлов, мокрота, испражнения. Материал по возможности должен быть исследован до начала лечения химиотерапевтическими препаратами.
При вскрытии трупов животных берут для анализа кусочки органов (селезенка, печень, легкое), лимфатических узлов, кровь, костный мозг.
При длительном транспортировании в стационарные бактериологические лаборатории рекомендуется пользоваться средами с ингибиторами (п. 5.1).
Заключение бактериолога дается на основании бактериоскопического, бактериологического и серологического исследования.
5. Методы исследования материала
5.1. Бактериологический метод
Для выделения возбудителя сапа используют мясопептонный агар и бульон pH 6,8 - 7,0 с 4 % глицерина (МПГА, МПГБ). Можно использовать агар на основе гидролизата казеина, а также питательный агар и триптиказосоевый агар (Difco, США).
При использовании «загрязненного» материала (что подтверждается микроскопией) используют среду с ингибиторами:
|
пептон |
6,0 г |
|
дрожжевой экстракт |
3,0 г |
|
NaCl |
5,0 г |
|
ванкомицин |
0,01 г |
|
глицерин |
40,0 г |
|
полимиксин B |
0,01 г |
|
кристаллвиолет |
0,002 г |
|
агар |
12,0 г |
|
мясная вода pH 6,8 |
до 1 л |
Исследуемый материал высевают на три чашки агаровой среды и 3 пробирки бульона с последующим высевом на плотную среду, инкубируют в течение 48 - 72 ч при температуре 37 °C. Учет производят ежедневно. Возбудитель сапа вырастает в виде слабовыпуклых колоний с ровным краем, серого цвета (RS-вариант). В отличие от В. pseudomallei для В. mallei морфологическая диссоциация не характерна, хотя отдельные колонии бывают сморщенные (R-) или слизистые (M-).
5.2. Биологический метод
Биологический метод эффективен для диагностики острого сапа, выделить же возбудитель этим методом при хроническом течении сапа чаще всего не удается. В данном случае более эффективным могут быть иммунологические исследования и выделение L-форм возбудителя сапа.
Для постановки биопробы при диагностике сапа используют золотистых хомячков или морских свинок.
Кусочки органов животных или людей измельчают в физиологическом растворе. Экстракт в объеме 0,5 мл вводят подкожно в область бедра биопробным животным. При исследовании «чистого» материала (подозрительные колонии на МПГА) животных можно заражать внутрибрюшинно. Срок наблюдения за биопробными животными до 21 сут., в типичных случаях падеж и выделение «чистой» культуры происходят в первые 10 сут. после инфицирования.
Для интраперитонеального заражения желательно брать самцов, у которых развивается феномен Штрауса. Этот феномен может быть ориентиром для вскрытия животных. Однако следует иметь ввиду, что наблюдаемый гнойный периорхит не специфичен и может быть вызван другими микроорганизмами.
Павших или забитых больных животных вскрывают и исследуют бактериологически для выделения «чистой» культуры. С этой целью из их органов делают высевы на обычные питательные среды и параллельно на среду с ингибиторами.
5.3. Иммунологические методы исследования
Специфическая индикация сапа
Метод флуоресцирующих антител (МФА). МФА - широко используемый метод экспресс-обнаружения возбудителя сапа в различных объектах исследования. Он позволяет получать предварительный ответ в течение 1 - 2 ч от момента начала исследования, а также идентифицировать возбудитель сапа на этапах ускоренного и классического лабораторного анализа биологически обогащенного материала.
Для выявления возбудителя сапа с помощью МФА используют иммуноглобулины диагностические флуоресцирующие сапные моноклональные сухие. Препарат в рабочем разведении взаимодействует только с бактериями сапа и не окрашивает клетки близкородственного возбудителя мелиоидоза. При работе с чистыми культурами типичных штаммов возбудителя сапа он позволяет выявлять 5 - 104 м.к./мл, в бактериальных смесях - 5 · 104 - 1 · 105 м.к./мл, в объектах внешней среды - 5 · 104 - 5 · 105 м.к./мл в зависимости от характера исследуемого объекта, его обсемененности посторонней микрофлорой.
На этапе экспресс-анализа используют МФА с контрастированием неспецифического свечения микрообъектов. При идентификации чистых культур микроорганизмов контрастирование не требуется.
Мазки из проб внешней среды и из материала от больных и умерших людей и животных (до и после концентрирования) готовят на тонких обезжиренных предметных стеклах, высушивают на воздухе и фиксируют в 96 %-м этиловом спирте в течение 30 мин. Окрашивание мазков-препаратов проводят смесью равных объемов флуоресцирующих сапных моноклональных антител и альбумина, меченного родамином, содержащей каждый из ингредиентов в рабочих разведениях, указанных на ампулах.
Результаты взаимодействия поверхностно локализованных антигенов возбудителя сапа с антителами, меченными флуоресцеинизотиоцианатом, регистрируют с помощью люминесцентного микроскопа, оценивая яркость свечения и его цвет по общепринятой шкале регистрации результатов МФА, а также форму, размеры и локализацию флуоресцирующего объекта исследования.
В мазках-препаратах из объектов внешней среды и смывах с поверхности питательных сред, на которых производили накопление микроорганизмов, бактерии сапа, окрашенные специфическими иммуноглобулинами, расположены хаотично, в виде изолированных прямых или изогнутых ярко светящихся палочек, изредка соединенных в цепочки, состоящие из 4 - 8 фрагментов. Вследствие характерного для возбудителя сапа полиморфизма возможно обнаружение длинных, средних, коротких палочек, кокко- или нитеподобных форм бактерий. В мазках-отпечатках из органов и тканей животных короткие толстые палочки расположены беспорядочно, иногда группами внеклеточно, редко внутри лейкоцитов, клеток паренхиматозных органов или соединительной ткани.
На этапе экспресс-анализа нативного материала обнаружение единичных (не менее 10) клеток в 25 - 30 полях зрения, обладающих специфическим свечением, является основанием для выдачи ориентировочного положительного ответа. Отрицательный результат МФА свидетельствует либо об отсутствии возбудителя сапа в исследуемом объекте, либо о том, что концентрация бактерий в данной пробе ниже улавливаемой с помощью МФА.
Твердофазный иммуноферментный метод (ТИФМ). ТИФМ - один из наиболее чувствительных методов обнаружения возбудителя сапа в различных объектах исследования. В отличие от МФА он позволяет выявлять как бактерии, так и растворимые антигены возбудителя сапа. По чувствительности ТИФМ в 10 - 20 раз превосходит МФА, в 30 раз - РНГА.
При использовании ТИФМ для поиска возбудителя сапа обязательным является этап предварительного обеззараживания проб 1 % формалином.
Перспективным является дот-вариант ИФА, варианты которого применяют как для обнаружения возбудителя сапа (1 · 104 - 1 · 106 м.к./мл), так и выявления специфических антител в исследуемых сыворотках.
Реакция непрямой гемагглютинации (РНГА). При поиске сапных бактерий и их антигенов объектами исследования являются все перечисленные выше образцы проб. Особенности подготовительного этапа заключаются в том, что все пробы переводят в жидкую фазу в соответствии с общепринятыми методиками. Исследуемые образцы обеззараживают нейтральным формалином, добавляя его в пробы до 4 % концентрации (0,2 мл на 2 мл пробы). Затем пробы прогревают при 56 °C в течение 30 мин. В пробирки с инактивированным материалом вносят 50 % взвесь формалинизированных эритроцитов из расчета 0,05 мл на 1 мл пробы для истощения материала и устранения возможных неспецифических взаимодействий ингредиентов РНГА. Смесь тщательно встряхивают, выдерживают при 37 °C в течение 15 мин и центрифугируют при 2000 - 3000 об./мин в течение 10 мин.
Надосадочную жидкость используют для постановки РНГА с диагностикумом эритроцитарным сапным и мелиоидозным иммуноглобулиновым сухим на основе поликлональных антител или диагностикумом эритроцитарным сапным и мелиоидозным моноклональным сухим на основе моноклональных иммуноглобулинов. РНГА с иммуноглобулиновым ЭД применяют на этапах экспресс- и ускоренного анализа проб и идентификации чистых культур.
Учет результатов РНГА производят через 1,5 - 2,0 ч и 24 ч. Предварительный ответ о наличии искомого антигена может быть дан через 1,5 - 2,0 ч от момента постановки реакции.
Серодиагностика сапа
Обнаружение специфических антител имеет существенное значение для постановки правильного диагноза и начала своевременного лечения. Поиск антител в сыворотках больных сапом людей и животных желательно осуществлять в парных сыворотках, полученных с интервалом 2 - 3 недели. Нарастание титров специфических антител подтверждает правильность предварительного диагноза.
Основными методами выявления сывороточных антител являются РНГА и ТИФМ.
Реакция непрямой гемагглютинации (РНГА). Постановку РНГА осуществляют с использованием диагностикума эритроцитарного для выявления антител к возбудителям мелиоидоза и сапа антигенного жидкого.
С помощью РНГА с сапным антигенным ЭД возможно обнаружение специфических антител в сыворотках крови больных животных. Антигенный эритроцитарный диагностикум взаимодействует также с антителами сывороток больных мелиоидозом людей.
С целью подтверждения специфичности РНГА одновременно с ней ставят реакцию торможения непрямой гемагглютинации (РТНГА). Специфичным считают результат РНГА, если различия в титрах РНГА и РТНГА достигают 16 - 32 и более раз.
Для выявления антител можно применять трехкомпонентную реакцию нейтрализации антигена (РНАг) с иммуноглобулиновым эритроцитарным диагностикумом. Выбор гемагглютинационного теста зависит от цели конкретного этапа работы и от наличия соответствующего эритроцитарного диагностикума (ЭД).
Твердофазный иммуноферментный метод (ТИФМ). Необходимый набор реагентов для выполнения анализа:
• полистироловый планшет разборный для иммуноферментного анализа однократного применения;
• сапной антиген для сенсибилизации планшетов;
• 0,05 М карбонатно-бикарбонатный буфер, pH 9,5 (КББ);
• 1 %-й раствор бычьего сывороточного альбумина (БСА) в 0,05 М КББ, pH 9,5 для блокирования свободных сайтов неспецифического связывания на пластике;
• 0,1 М фосфатно-солевой буферный раствор pH 7,2 (ФБР), на основе которого готовят раствор для отмывания пластин, раствор для приготовления разведений исследуемых сывороток и раствор рабочего разведения конъюгата, добавляя детергент Твин-20 до 0,05 % по объему;
• антивидовой иммунопероксидазный конъюгат (ИПК) или препарат на основе протеина A;
• цитратно-фосфатный буферный раствор pH 5,0 (ЦФБР);
• хромоген тетраметилбензидин (ТМБ), 10 мг, растворяют в 1 мл диметилсульфоксида (ДМСО);
• 3 %-й раствор перекиси водорода, приготовленный ex tempore;
• субстратно-индикаторная смесь (ЦФБР + ТМБ + Н2О2): ТМБ, растворенный в ДМСО, используют для приготовления раствора 1:100 в ЦФБР, затем добавляют 3 %-й раствор перекиси водорода в соотношении 1:100, приготовленная ex tempore;
• 0,2 М раствор серной кислоты (стоп-реагент);
• заведомо положительная контрольная сыворотка (К+);
• отрицательная контрольная сыворотка (К-).
Непрямой вариант метода
Для выполнения исследования сыворотки используют непрямой вариант ТИФМ.
Объем реагентов на всех этапах постановки реакции составляет 100 мкл.
В лунки планшета вносят приготовленный раствор антигена с концентрацей 10 мкг/мл (по белку) в 0,05 М КББ, pH 9,5. Сенсибилизацию планшета антигеном проводят в холодильнике при 4 °C в течение 18 - 24 ч. Затем раствор антигена удаляют, планшет подсушивают в течение 1 - 2 мин и трехкратно промывают ФБР + Т. Свободные сайты неспецифического связывания на пластике блокируют с помощью 1 %-го раствора бычьего сывороточного альбумина (БСА) в 0,05 М КББ, pH 9,5 в течение 30 мин при 37 °C и вновь отмывают планшет.
В лунки твердой фазы вносят подготовленные разведения исследуемой сыворотки (1:400, 1:800 и т.д.) в ФБР + Т. Инкубацию проводят при 37 °C в течение 1 ч.
После трехкратного отмывания несвязавшихся компонентов реакции в лунки пластины вносят антивидовой конъюгат в рабочем разведении, планшет помещают в термостат при 37 °C на 45 - 60 мин. После этого планшет промывают 4 - 5 раз и в лунки вносят субстратно-индикаторную смесь.
Пластины выдерживают при комнатной температуре в темном месте в течение (25 ± 5) мин. Появление голубого окрашивания содержимого лунок различной интенсивности свидетельствует о прохождении реакции фермент-субстрат.
Реакцию останавливают с помощью стоп-реагента, внося во все лунки планшета по 100 мкл 0,2 М раствора серной кислоты. Окраска хромогена меняется с голубой на желтую. Интенсивность окрашивания в лунках пластины пропорциональна содержанию специфических антител в лунке.
Результаты учитывают на микропланшетном фотометре для иммуноферментного анализа при длине волны 450 нм.
Титром антител считают то наибольшее разведение пробы, значение ОП450 которого равно или превышает значения 2 · ОП контроля конъюгата (КК). При этом ОП450 в лунках контроля субстратной смеси (КС) не должна превышать 0,2.
Необходимые контроли:
• реакция с заведомо положительной сывороткой с известным титром антител (К+);
• контроль неспецифической сорбции конъюгата (КК-): в сенсибилизированные антигеном лунки (две лунки) вносят только ИПК в рабочем разведении и проявляют субстратом;
• контроль субстрата (КС-): в сенсибилизированные антигеном лунки (две лунки) вносят только рабочий раствор субстратной смеси, содержимое лунки должно оставаться без изменений.
Дот-вариант иммуноферментного анализа. В качестве твердой фазы реакции используют нитроцеллюлозные мембраны (НЦМ) с диаметром пор 0,22 или 0,45 мкм.
На мембрану наносят взвесь формалинизированных клеток возбудителя сапа в концентрации 1 · 109 м.к/мл в 0,1 М трис-HCl буфере (pH 8,0), затем чашку Петри с НЦМ перемещают в холодильник при 4 °C на 18 - 24 ч. Перед использованием НЦМ подсушивают и обрабатывают 3 - 5 % раствором БСА в течение 40 - 45 мин при 37 °C. Отмывают на шуттеле двукратно по 3 мин ФБ-Т или 0,85 % раствором NaCl.
Исследуемую сыворотку наносят в центр расчерченных квадратов. Необходимые разведения готовят на 0,1 М трис-HCl буфере (pH 8,0) с Твином-20. Инкубируют 45 - 60 мин при 37 °C. Отмывают по 2 мин двукратно. После этого НЦМ погружают в рабочий раствор антивидового ИПК на 1 ч при 37 °C. Заключительное отмывание проводят 4 раза по 2 мин.
Для проявления реакции в качестве субстратной смеси используют раствор О-дианизидина: 10 мл 0,1 М трис-HCl буфера, pH 8,0, 1 мл 0,1 % О-дианизидина на метиловом спирте плюс 0,1 мл 0,3 % перекиси водорода.
Результаты учитывают визуально через 15 - 20 мин. При положительном результате на полоске НЦМ проявляются коричневые пятна.
Метод флуоресцирующих антител (МФА). Для обнаружения специфических антител в сыворотках крови больных сапом возможно использование непрямого МФА в одном из двух вариантов: 1) Уиллера и Кунса; 2) Гольдвассера и Шепарда с добавлением комплемента. Основным ограничением для его воспроизведения в практических лабораториях является отсутствие стандартных мазков-препаратов референтного штамма возбудителя сапа.
Реакция агглютинации (РА). РА используют при серологическом обследовании больных или подозреваемых в заболевании сапом лошадей, а также лиц, по роду своей деятельности контактирующих с ними.
Методика постановки РА традиционна. При этом учитывают, что РА не позволяет дифференцировать сап и мелиоидоз. По значимости РА является методом выбора в диагностике острых форм заболевания. Ограничением для ее широкого применения является отсутствие стандартных коммерческих образцов антигенов возбудителя сапа, необходимых для получения сопоставимых результатов в различных лабораториях.
Реакция связывания комплемента. Основным методом серодиагностики, особенно в ветеринарной практике, считают РСК. В РСК используют стандартный антиген (ГОСТ 17405-72). Схема постановки реакции традиционная. Диагностическим титром считают 1:20 и более. Дифференциация сапа и мелиоидоза по результатам РСК невозможна.
Оценивая состояние дел в вопросе серодиагностики сапа и перспективы ее совершенствования следует отметить, что она затруднена из-за значительного количества ложноположительных и ложноотрицательных результатов в международно рекомендованных тестах. Основную проблему этого явления можно связать с низкой чувствительностью и специфичностью РСК и ТИФМ, апробированных с обычно используемыми антигенами, т.е. с препаратами грубой очистки из целых микробных клеток. Дальнейшая перспектива разработки и совершенствования серологических тестовых наборов связана с хорошо охарактеризованными индивидуальными антигенами, обсуждаемыми в свете последних достижений молекулярной биологии в части В. mallei и близкородственного возбудителя мелиоидоза.
5.4. Молекулярно-генетические методы исследования
В качестве альтернативных способов выявления и идентификации возбудителя сапа в последнее время все более активно используют молекулярно-генетические методы, в первую очередь реакцию амплификации (ПЦР, полимеразную цепную реакцию). ПЦР используют для экспресс-диагностики при исследовании биологического материала, взятого от человека с целью выявления у него ДНК В. mallei и ее количественной оценки; для специфической индикации возбудителя сапа в объектах окружающей среды и пищевых продуктах; в качестве ускоренного предварительного теста при выполнении культурального и биологического методов исследования и для идентификации культур; для генотипирования штаммов с целью определения их происхождения, а также определения эпидемиологической значимости изолятов на основании выявления генетических маркеров патогенности, антибиотикоустойчивости, прогнозирования течения инфекционного заболевания и оценки эффективности проводимой терапии.
Обеззараживание проб для исследования методом ПЦР. Обработка исследуемого материала, инфицированного (подозрительного на инфицирование) возбудителем сапа, проводится следующим способом: к исследуемому образцу добавляют мертиолат натрия до конечной концентрации 1:10000 (0,01 %) и прогревают его при 56 °C в течение 30 мин. Затем 100 мкл образца переносят в микроцентрифужные пробирки объемом 1,5 мл, добавляют лизирующий раствор, приготовленный на основе 6 М гуанидинизотиоцианата и инкубируют 15 мин при 65 °C.
Обработанные таким образом пробы считаются обеззараженными и всю последующую работу проводят, как с незаразным материалом.
Выделение ДНК. ДНК из проб материала выделяют с помощью коммерческих наборов для выделения ДНК в строгом соответствии с прилагаемой инструкцией. Работу проводят согласно требованиям противоэпидемического режима, используя одноразовую пластиковую посуду в боксах II - III классов биологической безопасности. ПЦР осуществляют с помощью амплификационных тест-систем, зарегистрированных в установленном порядке в соответствии с прилагаемыми инструкциями, полученные амплификаты (при использовании классического варианта ПЦР) анализируют электрофоретически или на детекторе флуоресценции (при использовании гибридизационно-флуоресцентного варианта ПЦР), в т.ч. ПЦР в формате реального времени.
Выделение ДНК из проб почвы и воды проводится путем гуанидинтиоцианат-фенол-хлороформной депротеинизации с последующей очисткой ДНК методом нуклеосорбции (в соответствии с прилагаемыми инструкциями к коммерческим наборам).
Для выделения ДНК возбудителя сапа из крови используют метод выделения такой же, как и для экстракции и очистки ДНК из почвы. За исключением того, что перед этапом подсушивания осадок ДНК дополнительно промывают ацетоном.
При исследовании секционного материала часть биоптата (печень, селезенка, легкое, сердце) массой около 30 мг гомогенизируют в лизирующем растворе на основе 6 М гуанидинизотиоцианата и инкубируют 15 мин при 65 °C, затем добавляют 300 мкл фенола, забуференного Tris-HCl, pH 8,0. После перемешивания на вортексе инкубируют в течение 30 мин при температуре 65 °C.
Обработанные таким образом пробы считаются обеззараженными и всю последующую работу проводят, как с незаразным материалом.
Проведение ПЦР для специфической индикации и идентификации возбудителя сапа. Выявление ДНК возбудителя сапа методом полимеразной цепной реакции проводят классическим способом с электрофоретическим учетом результатов реакции амплификации в агарозном геле, а также флуоресцентной детекцией в режиме реального времени или по «конечной точке». При использовании ПЦР в реальном времени (Real-Time PCR) учет и анализ результатов проводится в процессе амплификации, согласно инструкции к приборам.
Работу проводят в соответствии с инструкциями к диагностическим тест-системам, зарегистрированными в установленном порядке.
Генотипирование штаммов возбудителя сапа проводят с помощью пульс-электрофореза, амплификации с произвольными праймерами и метода, основанного на мультилокусном анализе вариабельности тандемных повторов (MLVA).
5.5. Идентификация культур
Выделенные бактериологическим и биологическим методами микроорганизмы исследуют на принадлежность к возбудителю сапа, используя стандартные бактериологические тесты (табл. 1).
Возбудитель сапа неподвижен, не растет при температуре 42 °C и на среде с гентамицином, окисляет, но не ферментирует глюкозу, обладает цитохромоксидазной и каталазной активностями, обладает аргининдигидролазой, тесты на лизин- и орнитиндекарбоксилазы отрицательны.
Резистентность к полимиксину B является таксономическим признаком, использующимся при дифференциации его от бактерий родов Pseudomonas и Acinetobacter.
Коммерческие идентификационные системы типа API 20E или 20NE не позволяют достоверно определять видовую принадлежность сапных культур, вероятно вследствие замедленного роста на используемых в системах средах и вариабельности проявления на них биохимических свойств возбудителя. При проверке на этих наборах типичных штаммов В. mallei под выявляемыми кодами значатся различные виды бактерий родов Acinetobacter или Pseudomonas.
Выделение и идентификация L-форм В. mallei. Наличие скрытых форм сапа подтверждается при обследовании лошадей с помощью аллергической пробы с маллеином, при этом выявляются группы животных с положительной пробой, но без клинических проявлений. Выделить возбудитель без введения провоцирующих агентов обычно не удается.
Таблица 1
Дифференциальные признаки В. mallei и других видов буркхольдерий и псевдомонад
Развитие острых форм инфекции у таких животных во многом зависит от условия их содержания, эксплуатации и питания. Можно вызвать провокацию инфекции путем введение внутривенно маллеина или других препаратов, снижающих резистентность макроорганизма.
Таким образом, сап характеризуется способностью протекать в скрытых латентных формах с сохранением потенциальной возможности развития активного процесса.
Исследование способности возбудителя сапа к L-трансформации показало, что формирование латентных форм инфекции сопровождается морфологической трансформацией клеток возбудителя. Персистенция в виде L-форм, не вызывая видимых патологических проявлений, обеспечивает при развитии иммунодефицитного состояния полное восстановление биологических свойств возбудителя и, следовательно, манифестацию инфекции. Возможность формирования латентной инфекции во многом определяется состоянием макроорганизма, в частности, его иммунной системы и дозы инфекта. Формированию латентных форм инфекции у экспериментальных животных также способствует химиотерапия лекарственными препаратами (рифампицин, сульфаметоксазол и др.).
Введение экспериментальным животным с латентной формой сапной инфекции иммунодепрессанта (циклофосфана) приводит к манифестации инфекции в острой форме с последующим выделением бактериальной формы возбудителя.
Для выделения L-форм необходимо производить посев исследуемого материала на специальные высокопитательные стабилизированные полужидкие среды. Состав одной из таких сред (ССС):
|
сердечно-мозговой экстракт |
37,0 г |
|
дрожжевой экстракт |
10,0 г |
|
нормальная лошадиная сыворотка (НЛС) |
100,0 мл |
|
сахароза |
100,0 г |
|
агар-агар |
3,0 г |
|
дистиллированная вода |
1 л |
Стерилизуется при 1,5 атм 15 мин. В охлажденную до 50 °C среду добавляют НЛС, предварительно простерилизованную фильтрацией, и разливают по 5 мл в пробирки. Для выделения L-форм пригодна также среда типа PPLO, применяющаяся для культивирования микоплазм.
Посевы инкубируют при 37 °C до 20 сут. в условиях, исключающих высыхание сред.
Если в посевном материале будет присутствовать бактериальная форма возбудителя, то на вторые сутки обнаруживается обильный рост в толще и на поверхности полужидкой среды. Нестабильные L-формы (легко восстанавливающие клеточную стенку) могут обеспечить обильный рост также в ближайшие 3 - 4 сут. Стабильные L-формы на 6 - 10 сут. образуют рост в виде слабого помутнения полужидкой среды в месте внесения исследуемого материала.
Идентификация бактериальной формы возбудителя и нестабильных L-форм не представляет трудностей после пересева на обычные питательные среды. Стабильные L-формы при пассажах на полужидкой среде ССС сохраняют жизнеспособность в течение 3 - 4 пассажей, поэтому необходимо проводить их идентификацию из первичного посева. С этой целью можно использовать классический метод иммунофлуоресценции, подготовив мазки непосредственно из питательной среды с явлениями роста L-форм. Морфологическую характеристику L-форм проводят на основании фазовоконтрастной микроскопии.
Достаточно надежная идентификация обеспечивается также методом генетической трансформации. В качестве реципиента при этом используется ауксотрофный штамм возбудителя мелиоидоза - близкородственный вид, обладающий равноценной взаимной трансформабельностью с возбудителем сапа. С этой целью 0,1 мл суспензии штамма В. pseudomallei VPA (авирулентный пуринзависимый мутант с уровнем вероятной реверсии к прототрофности < 1´10-10) в концентрации 109 м.к./мл высевают газоном на минимальную среду. На засеянную и предварительно высушенную поверхность агаровой пластинки наносят бляшками идентифицируемые культуры L-форм в объеме 0,05 - 0,1 мл. Посевы инкубируют при 37 °C в течение 2 - 3 сут. Результат считается положительным, если в месте нанесения проб выявляется рост прототрофных колоний возбудителя мелиоидоза.
6. Дезинфекция при работе с возбудителем сапа
Для обеззараживания объектов (различные поверхности, жесткая мебель, санитарно-техническое оборудование, белье, посуда, изделия медицинского назначения), контаминированных возбудителем сапа, рекомендованы преимущественно композиции на основе четвертично-аммониевых соединений, дополнительно содержащие полигексаметилен гуанидин, метасиликат натрия, спирт, глиоксаль и другие компоненты (Биодез-Экстра, Велтогран, Лизоформин-3000, Новодез-Форте, РИК-Д, Септодор-Форте, Эффект-Форте), а также хлорсодержащее средство - двуосновная соль гипохлорита кальция (ДСГК). Данные препараты по токсикологической характеристике относятся к III - IV классам опасности и имеют сроки хранения в пределах 3 - 5 лет. При времени экспозиции от 60 до 120 мин рабочие концентрации препаратов в зависимости от вида обрабатываемого объекта и состава средства варьируют от 0,2 % до 5,0 %. Содержащие глутаровый альдегид средства (Лизоформин - 3000, Новодез-Форте) более токсичны, но вызывают гибель возбудителя сапа при низких концентрациях и коротких экспозициях. Хлорсодержащие растворы средства ДСГК, содержащие 0,15 - 0,44 % активного хлора, эффективны против возбудителя сапа на обеззараживаемых объектах при 60 - 120 мин экспозиции.
7. Экстренная профилактика сапа при аварии в лаборатории
В случае регистрации аварии проводят мероприятия в соответствии с действующими нормативными и методическими документами по работе с возбудителями I - II групп патогенности.