| Информационная система |  |
Государственное
санитарно-эпидемиологическое нормирование
Российской Федерации
Федеральная
служба по надзору в сфере зашиты прав потребителей
и благополучия человека
4.2.
МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ
И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Лабораторная диагностика мелиоидоза
Методические указания
МУ 4.2.2787-10
Москва 2011
1. Методические указания разработаны Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека; (Ю.В. Демина, Н.Д. Пакскина); ФГУЗ «Волгоградский научно-исследовательский противочумный институт» Роспотребнадзора (В.И. Илюхин, В.В. Алексеев, Н.П. Храпова, В.А. Антонов, Т.В. Сенина, В.Н. Андрус, Н.И. Погасий, Г.А. Ткаченко, В.В. Алексеева, С.С. Савченко, Е.В. Шубникова, Т.В. Булатова, Ю.И. Сорокина).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека.
3. Утверждены и введены в действие Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 6 декабря 2010 г.
4. Введены впервые.
СОДЕРЖАНИЕ
Список сокращений
|
Аг |
антиген |
|
А-ПХ |
авидин-пероксидаза хрена |
|
Ат |
антитело |
|
АСК |
аминосалициловая кислота |
|
БСА |
бычий сывороточный альбумин |
|
Г+Ц |
гуаниновые и цитидиновые нуклеотиды |
|
ДТСГК |
двутретьосновная соль гипохлорита кальция |
|
ДХЦК |
дихлоризоциануровая кислота |
|
ЕД |
единица действия |
|
ЖМАС |
жидкая минимальная среда с антибиотиками |
|
ИПК |
иммунопероксидазный коньюгат |
|
ИФА |
иммуноферментный анализ |
|
КББ |
карбонатно-бикарбонатный буфер |
|
МПГА (МПГБ) |
мясо-пептонный агар (бульон) с глицерином |
|
МПК |
минимальная подавляющая концентрация |
|
МФА |
метод флуоресцирующих антител |
|
НГК |
нейтральный гипохлорит кальция |
|
НКС |
нормальная кроличья сыворотка |
|
HЛC |
нормальная лошадиная сыворотка |
|
НЦМ (НЦФ) |
нитроцеллюлозная мембрана (фильтр) |
|
ППН |
показатель повреждения нейтрофилов |
|
ПЦР |
полимеразная цепная реакция |
|
РА |
реакция агглютинации |
|
РИА |
радиоиммунный анализ |
|
РКоА |
реакция коагглютинации |
|
РНГА |
реакция непрямой гемагглютинации |
|
РСК |
реакция связывания комплемента |
|
РТГА |
реакция торможения непрямой гемагглютинации |
|
ТИФА (М) |
твердофазный иммуноферментный анализ (метод) |
|
ТМБ |
тетраметилбензидин |
|
ТСА (ТСБ) |
триптиказосоевый агар (бульон) |
|
ЦФБР |
цитратно-фосфатный буферный раствор |
|
|
УТВЕРЖДАЮ Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации Г.Г. Онищенко 6 декабря 2010 г. Дата введения: 2010 г. |
4.2.
МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Лабораторная диагностика мелиоидоза
Методические указания
МУ 4.2.2787-11
1. Область применения
1.1. Методические указания предназначены для специалистов лабораторного звена как в системе органов, осуществляющих государственный санитарно-эпидемиологический надзор, так и в системе лечебно-профилактических учреждений независимо от форм собственности.
1.2. В методических указаниях определены порядок забора, транспортирования и выполнения лабораторных исследований биологического материала от больных и умерших людей, животных с подозрением на мелиоидоз, материала из объектов окружающей среды, подозрительного на контаминацию возбудителем данного заболевания.
2. Нормативные ссылки
2.1. Безопасность работы с микроорганизмами I - II групп патогенности (опасности): СП 1.3.1285-03. М., 2003.
2.2. Порядок учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности: СП 1.2.036-95. М., 1996.
2.3. Организация работы при исследованиях методом ПЦР материала, инфицированного микроорганизмами I - II групп патогенности: МУ 1.3.1794-03. М., 2004.
2.4. Определение чувствительности микроорганизмов к антибактериальным препаратам: МУК 4.2.1890-04. М., 2004.
2.5. Обеззараживание биологического материала и объектов внешней среды, зараженных бактериями I - IV групп патогенности, при исследованиях методом ПЦР: МУ 3.5.5.1034-01. М., 2001.
2.6. Методические рекомендации «Лабораторная диагностика, лечение и профилактика мелиоидоза». Волгоград, 1994.
2.7. Методическое пособие для проведения практических занятий по лабораторной диагностике мелиоидоза с использованием штамма-имитатора Burkholderia thailandensis КМ-161. Волгоград, 2008.
2.8. Методические рекомендации по проведению профилактических и противоэпидемических мероприятий в завозных очагах мелиоидоза. Волгоград, 1982.
2.9. Специфическая индикация патогенных биологических агентов: Практическое руководство. М., 2006.
2.10. Лабораторная диагностика опасных инфекционных болезней: Практическое руководство. М., «Медицина», «Шико», 2009.
3. Общие сведения
Мелиоидоз - тропический бактериоз, протекающий с явлениями сепсиса и образованием абсцессов в органах и тканях.
Длительное время существовало твердое убеждение, что мелиоидоз эндемичен лишь для влажных субтропиков стран Юго-Восточной Азии. Заболевание мелиоидозом людей и животных и выделение культур В. pseudomallei из внешней среды в Австралии, Чили, Сальвадоре, Франции, Италии и других странах показали всю серьезность проблемы диагностики, лечения при почти непредсказуемых последствиях завоза возбудителя в страны с умеренным климатом. Практически во всех странах Западной Европы, включая Скандинавию, за последние годы зарегистрированы случаи мелиоидоза среди лиц, побывавших в качестве туристов или специалистов в эндемичных зонах.
Естественным резервуаром возбудителя являются домашние животные (козы, овцы, свиньи, коровы, лошади, собаки, кошки и др.), среди которых могут возникать эпизоотии, а также некоторые виды грызунов. Инфицированные животные, выделяя возбудителя с естественными жидкостями и экссудатом раневых поверхностей, обсеменяют объекты окружающей среды. В. pseudomallei длительно сохраняется в воде и почве, активно участвуя в процессах денитрификации.
Основной механизм заражения человека - контактный, реализуется при контакте поврежденной кожи или слизистых оболочек с инфицированными почвой и водой (например, при работе на рисовых плантациях, купанием в стоячих водоемах).
В России, как и в других странах бывшего СССР, не было зарегистрировано до сих пор ни одного достоверного случая мелиоидоза, но существование эндемичных очагов на сопредельных территориях (Иран, Турция, Китай) и наличие обширных экономических и культурных контактов со странами Юго-Восточной Азии, Центральной Америки и Африки диктуют необходимость настороженности со стороны медицинской и ветеринарной служб нашей страны к возможным случаям появления этого заболевания.
Необходимость разработки мероприятий по индикации дополнительно усиливается сведениями о возможности использования возбудителя мелиоидоза в качестве агента биотерроризма.
Возбудитель мелиоидоза В. pseudomallei относится к роду Burkholderia. Это палочка с закругленными концами размером (0,5 - 0,8)·(2,0 - 6,0) мкм, однако могут встречаться также коккобациллярные и нитевидные формы. Подвижен за счет наличия нескольких жгутиков на одном конце клетки (лофотрих).
В. pseudomallei - факультативный аэроб, растет при температуре 37 °С на простых питательных средах. Добавление глицерина (1 - 5 %) улучшает ростовые качества сред. Может размножаться в анаэробных условиях в присутствии нитрата. В отличие от возбудителя сапа растет при температуре 42 °С. В бульоне дает помутнение с образованием к концу первых суток нежной слизистой пленки с более толстым пристеночным ободком. Быстро утолщаясь (до 1 мм), пленка приобретает серовато-желтый цвет. При старении культуры на дне пробирки образуется слизистый осадок.
На плотных питательных средах отмечается морфологическая диссоциация колоний. S-форма - колонии вначале круглые, прозрачные, выпуклые, с ровными краями, к 48 ч они достигают диаметра 1 - 3 мм и начинают диссоциировать (теряют прозрачность, становятся серовато-белыми с металлическим блеском, поверхность - шероховатая). В отдельных случаях появляются мукоидные колонии. При сливном росте наблюдается гладкий, слизистый, блестящий, непрозрачный налет, приподнимающийся над поверхностью агара. R-форма - серовато-желтые непрозрачные колонии диаметром 2 - 4 мм с морщинистой поверхностью и неровным зубчатым краем. На скошенном агаре образуется морщинистый, сухой, непрозрачный налет серовато-белого цвета. При выращивании на среде Эшдауна мелиоидозные колонии приобретают темно-красный цвет за счет сорбции из среды нейтрального красного, вокруг колоний наблюдается просветление среды.
Все известные штаммы В. pseudomailei, выделенные из клинического материала и внешней среды, резистентны к полимиксину В и гентамицину, МПК более 50 и 4 мкг/мл, соответственно.
Антигенная структура возбудителя мелиоидоза достаточно сложна. В настоящее время у микроба выявлены жгутиковый (Н), соматический (О), капсульный (К) и слизистый (М) антигены. В составе соматических (липополисахаридных) О-антигенов имеются компоненты, близкородственные антигенам возбудителя сапа.
В. pseudomallei патогенен для человека, обезьян, диких грызунов (хомяков, хорьков, крыс, мышей) и лабораторных животных (кроликов, морских свинок, белых крыс и мышей). При внутрибрюшинном заражении самцов лабораторных животных может наблюдаться феномен Штрауса (скротальная реакция).
Возбудитель мелиоидоза термолабилен: при температуре 58 °С погибает в течение 15 мин, на холоде (при температуре 4 °С) отмирает в течение 2 - 3 недель. Устойчив к высушиванию. В гниющих материалах остается жизнеспособным от 8 до 27 дней, в воде - до 44 дней. Дезинфек-танты (3 - 5 % фенол, 5 % формалин) убивают возбудителя мелиоидоза в течение суток. По морфологическим, биологическим и особенно антигенным свойствам возбудитель мелиоидоза сходен с бактериями сапа. Для их дифференциации используют совокупность фенотипических признаков и серологические реакции.
4. Материал для исследования, отбор и транспортирование проб
Вся работа с исследуемым материалом, подозрительным на зараженность возбудителем мелиоидоза, проводится в соответствии с требованиями по безопасности работы с микроорганизмами I - II групп патогенности (санитарными правилами СП 1.3.1285-03 «Безопасность работы с микроорганизмами I - II групп патогенности (опасности)» и СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности», а также методическими указаниями МУ 1.3. 2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности»).
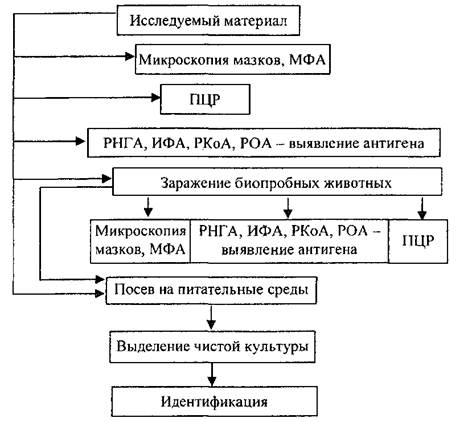
Идентификация возбудителя мелиоидоза предусматривает выделение возбудителя (или выявление его антигенов) из объектов исследования и определение специфических антител в крови людей и животных. Схема лабораторной диагностики мелиоидоза (рис. 1).
У больных животных и человека возбудитель мелиоидоза может быть выделен из содержимого абсцессов, мокроты, гнойного отделяемого язв, рвотных масс. При острой септической форме возбудитель обнаруживается в крови, моче, цереброспинальной жидкости и в полостных экссудатах.
В пробы, отобранные для бактериологического исследования, с целью подавления роста посторонней микрофлоры добавляют полимиксин В (50 мкг/мл) и гентамицин (4 мкг/мл). До начала исследования материал следует хранить при комнатной температуре. Пробы изучают параллельно согласно представленной ниже схеме бактериологическими и серологическими методами (рис. 1).
Рис. 1. Схема исследования материала на наличие в нем В. Pseudomailei
Забор проб воды и почвы в эндемичных районах проводят в хорошо прогреваемых сырых местах, вблизи водопоев скота, навозохранилищ и жижесборников, на полях орошения. Воду с поверхности луж, рисовых полей, мелких водоемов и искусственных емкостей отбирают в стерильные флаконы в объеме 50 - 100 мл. Почву в количестве 5 - 10 г забирают с глубины 20 - 40 см в пробирки.
При необходимости пересылки (транспортировки) материала для исследования используют жидкую минимальную среду с антибиотиками (см. раздел 5.1). Контейнеры с объектами содержат при комнатной температуре, патогенные буркхольдерин при низких температурах (≤ 4 °С) отмирают в течение недели. Температурный режим необходимо учитывать и при пересылке чистых культур на плотных питательных средах для окончательной идентификации.
5. Методы исследования материала
5.1. Бактериологический метод
Асептически полученную кровь, цереброспинальную жидкость, экссудат и прочий материал для исследований засевают в мясо-пептонный бульон с 4 % глицерина (МПГБ), одновременно делая посев на мясо-пептонный агар с 4 % глицерина (МПГА) и селективную среду Эшдауна (триптиказосоевый агар, содержащий 4 мг/л гентамицина, 5 мг/л кристаллвиолета и 50 мг/л нейтрального красного). В. pseudomallei хорошо растет и на минимальной среде с соответствующими добавками. Состав среды:
|
(NH4)2SО4 |
- 2,0 г |
|
NaH2PО4·H2О |
- 0,5 г |
|
К2НРО4 |
- 0,5 г |
|
MgSO4·7Н2О |
- 0,2 г |
|
СаСl2·2Н2О |
- 0,1 г |
|
дистиллированная вода до 1 000 мл |
|
Добавление к этой среде в конечной концентрации 0,03 М различных С-содержащих соединений свидетельствует о наличии большой адаптационной возможности возбудителя мелиоидоза, способного усваивать обширный набор углеводородов. На этапах идентификации к данной среде добавляют 0,03 М β-аланин (жидкая минимальная среда), а также полимиксин В (50 мкг/мл) и гентамицин (4 мкг/мл) - так называемая жидкая минимальная среда с антибиотиками (ЖМАС). Дополнительных факторов роста (аминокислоты, витамины) природные штаммы не требуют, так как они прототрофы.
Посевы из внутренних органов умерших людей и павших животных в зависимости от степени загрязнения посторонней микрофлорой осуществляют методом мазков-отпечатков с последующим рассевом петлей на плотные среды: МПГА, Мак Конки или Эшдауна. Кусочки органов (печень, селезенка, почки, легкие) объемом 1 см помещают в МПГБ или жидкую минимальную среду с антибиотиками и ведут анализ так же, как при обследовании объектов внешней среды.
Воду высевают по 0,2 мл на плотную селективную среду Эшдауна. С целью обогащения 2 мл исследуемой воды заливают в 10 мл жидкой минимальной среды с антибиотиками. Пробирки с ЖМАС выдерживают при температуре 37 °С в течение сут, после чего петлей делают посев с поверхности среды на среду Эшдауна и инкубируют в течение суток.
Из образцов почвы предварительно готовят суспензии. Для этого 1 г почвы вносят в 10 мл стерильной дистиллированной воды и встряхивают 10 мин. Суспензии дают отстояться в течение 10 - 30 мин. Жидкость над осадком высевают по 0,1 мл на чашки со средой Эшдауна, а для обогащения по 1 мл переносят в пробирки с ЖМАС, которые инкубируют в течение 1 сут. при температуре 37 °С, после чего делают высев петлей на среду Эшдауна. Чашки инкубируют при температуре 37 °С не менее 8 сут.
При посеве на МПГА возбудитель мелиоидоза через сутки формирует полупрозрачные сероватого цвета колонии с округлым ровным краем и гладкой выпуклой поверхностью. Под малым увеличением часть колоний однородна, гомогенна, у других можно заметить начинающуюся складчатость. Через 48 ч наблюдается морфологическая диссоциация колоний - одни из них блестящие, гладкие, выпуклые, с ровным краем (S-форма); другие имеют шероховатую или складчатую поверхность с неровным зубчатым краем (R-форма). В отдельных случаях выявляются мукоидные колонии. При выращивании на среде Эшдауна мелиоидозные колонии приобретают темно-красный цвет за счет сорбции из среды нейтрального красного, вокруг колоний наблюдается просветление среды.
Окраска по Граму. В мазках при окраске по Граму клетки выглядят в форме палочек розового цвета.
Флагелляция. Наличие, тип и количество жгутиков определяют специальным окрашиванием для электронной или световой микроскопии. Для этих целей культуры выращивают на полноценной плотной среде при комнатной температуре в течение 18 - 20 ч. Смыв и обработка культур должны быть максимально шадящими. При подготовке к световой микроскопии используют окраску по Грею. Приготовление мазка для окраски жгутиков по этому методу производится с некоторыми особенностями. Платиновой петлей прикасаются к поверхности агара, затем петлю вносят в пробирку с 2 - 3 мл стерильной водопроводной воды и, не взбалтывая, держат ее неподвижно в воде 1 - 2 мин. Вынув петлю, пробирку оставляют стоять 15 мин для более равномерного распределения микробов в воде. Каплю полученной суспензии наносят на предметное стекло. На высохший мазок наливают протраву, которая готовится из двух растворов. Первый: 5 мл насыщенного водного раствора калийных квасцов, 2 мл 20 % танина и 2 мл насыщенного водного раствора двухлористой ртути. Второй: 0,4 мл насыщенного спиртового раствора основного фуксина. Оба раствора смешивают не менее чем за 24 ч до употребления. Протравливают 4 - 10 мин, затем споласкивают препарат водой и окрашивают карболовым фуксином 5 - 10 мин с подогреванием. В. pseudomallei обладает полярными жгутиками (лофотрих). Молодые бульонные культуры бывают монотрихами.
5.2. Биологический метод
В качестве биопробных животных используют золотистых хомячков. Кровь, цереброспинальную жидкость, экссудат из серозных полостей вводят в объеме 0,5 - 1,0 мл 2 - 5 золотистым хомячкам подкожно. Материал из абсцессов, отделяемого ран, рвотных масс, измельченные кусочки внутренних органов (печень, селезенка, почки, легкие) суспендируют в 2 - 3 мл 0,85 % раствора NaCl и после отстаивания надосадоч-ную жидкость вводят двум животным подкожно по 0,5 - 1,0 мл.
Исследуемую воду вводят по 2,0 мл внутрибрюшинно 5 золотистым хомячкам. При анализе сильно загрязненной воды и почвы (надосадочная жидкость) объем инъекции составляет 1,0 мл, заражение проводят подкожно. Мелиоидоз у золотистых хомячков протекает в острой септицемической форме, заканчивающейся к 4 - 5 дню летально. При посевах из внутренних органов павших животных (легкие, селезенка, печень) на чашках с МПГА выделяют чистую культуру возбудителя мелиоидоза. За выжившими животными наблюдают не менее 20 сут., после чего их забивают, вскрывают и исследуют бактериологически (посев из паренхиматозных органов и крови на МПГА). Отбор подозрительных колоний производят через 36 - 72 ч инкубации при температуре 37 °С. При отсутствии золотистых хомячков возможна постановка биопробы на менее чувствительных к мелиоидозу лабораторных животных - морских свинках или белых мышах. Усиление эффекта достигается обработкой биопробных животных гидрокортизоном или циклофосфаном (250 и 200 мг/кг, соответственно).
5.3 Иммунологические методы исследования
Метод флуоресцирующих антител (МФА). Для обнаружения антигенов возбудителя мелиоидоза используют МФА с иммуноглобулинами диагностическими флуоресцирующими мелиоидозными моноклональными. В рабочем разведении эти иммуноглобулины взаимодействуют только с бактериями мелиоидоза и не окрашивают клетки близкородственного возбудителя сапа. При работе с чистыми культурами типичных штаммов возбудителя мелиоидоза они позволяют выявлять 5·104 м.к./мл, в бактериальных смесях - 5·105 - 1·106 м.к./мл, в объектах внешней среды - 5·105 - 5·106 м.к./мл, в зависимости от характера исследуемого объекта, его обсемененности посторонней микрофлорой.
На этапе экспресс-анализа используют МФА с контрастированием неспецифического свечения микрообъектов. При идентификации чистых культур микроорганизмов контрастирование не применяют.
Мазки-препараты из проб внешней среды и материала от больных и умерших людей и животных (до и после концентрирования) готовят на тонких обезжиренных предметных стеклах, высушивают на воздухе и фиксируют в 96° этиловом спирте в течение 30 мин. Мазки обрабатывают смесью равных объемов флуорохромированных мелиоидозных антител и альбумина, меченного родамином, содержащей каждый из ингредиентов в концентрации, равной их рабочим разведениям.
Специфическим считают изумрудно-зеленое свечение по периферии клеток бактерий (феномен Кунса) с яркостью 4+ или 3+ по общепринятой шкале регистрации результатов МФА.
На этапе экспресс-анализа нативного материала обнаружение единичных (не менее 10) клеток в 25 - 30 полях зрения, обладающих специфическим свечением, является основанием для выдачи предварительного положительного ответа. Отрицательный результат МФА свидетельствует: 1) об отсутствии возбудителя мелиоидоза в исследуемом материале или 2) о том, что концентрация бактерий в данной пробе ниже улавливаемой с помощью МФА (< n·105 м.к./мл).
В мазках-препаратах из объектов внешней среды и смывах с поверхности питательных сред, на которых производили накопление микроорганизмов, бактерии мелиоидоза. окрашенные специфическими иммуноглобулинами, расположены хаотично, в виде изолированных ярко светящихся палочек, изредка соединенных в короткие цепочки. Вследствие характерного для возбудителя мелиоидоза полиморфизма возможно обнаружение кокко- или нитеподобных форм бактерий. В мазках-отпечатках из органов и тканей животных короткие толстые палочки расположены группами внеклеточно, редко внутри лейкоцитов или клеток паренхиматозных органов.
Твердофазный иммуноферментный метод (ТИФМ) позволяет выявлять как бактерии, так и растворимые антигены возбудителя мелиоидоза. По чувствительности ТИФМ в 10 - 20 раз превосходит МФА, в 30 раз - РИГА.
Предварительно перед исследованием материала пробы обязательно обеззараживают 1 % формалином.
С помощью ТИФМ исследуют все объекты, перечисленные выше, за исключением проб почвы. Анализ проб почвы в ТИФМ затруднен из-за их неспецифической сорбции на пластинах и наличия эндогенной пероксидазы в клетках микроорганизмов - представителей сопутствующей микрофлоры.
Повышение чувствительности ТИФМ в 10 и более раз достигается за счет перехода на хемилюминесцентную систему детекции результатов анализа (ХЛИА), а также при использовании авидин-биотиновой системы.
Перспективным является дот-вариант ИФА, используемый как для обнаружения возбудителя мелиоидоза (1·104 - 1·106 м.к./мл), так и выявления специфических антител в сыворотках животных.
Применение сэндвич-варианта ТИФМ для обнаружения антигенов. Необходимый набор реагентов для выполнения анализа:
• полистироловый планшет разборный для иммуноферментного анализа однократного применения;
• иммуноглобулины (ИГ) мелиоидозные для сенсибилизации планшетов;
• 0,05М карбонатно-бикарбонатный буфер, рН 9,5 (КББ);
• 1 % раствор бычьего сывороточного альбумина (БСА) в 0,05М КББ, рН 9,5 для блокирования свободных сайтов неспецифического связывания на пластике;
• 0,1М фосфатно-солевой буферный раствор рН 7,2 (ФБР), на основе которого готовят раствор для отмывания пластин, раствор для приготовления разведений исследуемых проб и раствор рабочего разведения конъюгата, добавляя детергент твин-20 до 0,05 % по объему;
• детергент твин-20;
• антибактериальный иммунопероксидазный конъюгат (ИПК);
• цитратно-фосфатный буферный раствор рН 5,0 (ЦФБР);
• хромоген тетраметилбензидин (ТМБ), 10 мг, растворяют в 1 мл диметилсупьфоксида (ДМСО);
• 3 % раствор перекиси водорода, приготовленная ex tempore;
• субстратно-индикаторная смесь (ЦФБР + ТМБ + Н2О2): ТМБ, растворенный в ДМСО, используют для приготовления раствора 1:100 в ЦФБР, затем добавляют 3 % раствор перекиси водорода в соотношении 1:100, приготовленная ex tempore;
• 0,2М раствор серной кислоты (стоп-реагент);
• заведомо положительный контрольный образец антигена (К+);
• отрицательный контрольный образец (К-).
Методика проведения исследования с помощью сэндвич-варианта ТИФМ. Объем реагентов на всех этапах постановки реакции составляет 100 мкл. Для сенсибилизации планшет готовят предварительно подобранное оптимальное разведение ИГ мелиоидозных в 0,05М КББ рН 9,5, определяемое заранее для каждой серии данного ингредиента реакции. Время инкубации иммуноглобулинов с твердой фазой составляет 16 - 18 ч в условиях холодильника при 4 - 8 °С.
Несорбированные ИГ удаляют из лунок трехкратным промыванием раствором ФБР + Т. Затем во все лунки вносят 1 % раствора БСА в 0,05М КББ рН 9,5. Пластины инкубируют 30 мин при 37 °С и 3 раза промывают раствором ФБР + Т. На этом, этап подготовки твердой фазы реакции завершается.
Исследуемые пробы титруют 2-кратным шагом в растворе ФБР + Т + БСА. Время инкубации - 1 ч при 37 °С. Удаляют содержимое лунок сильным встряхиванием и пластину вновь трехкратно промывают раствором ФБР + Т.
Вносят иммунопероксидазный конъюгат (ИПК) в рабочем разведении. Время инкубации - 1 ч при 37 °С, затем 4 - 5-кратное промывание пластин и внесение во все лунки субстртной смеси ЦФБР + ТМБ + Н2О2. Пластины выдерживают при комнатной температуре в темном месте в течение (25 ± 5) мин. Появление голубого окрашивания содержимого лунок различной интенсивности свидетельствует о прохождении реакции фермент-субстрат.
Реакцию останавливают с помощью стоп-реагента, внося во все лунки планшета по 100 мкл 0,2М раствора серной кислоты. Окраска хромогена меняется с голубой на желтую. Интенсивность окрашивания в лунках пластины пропорциональна содержанию искомого вещества в лунке.
На каждой пластине помимо лунок с исследуемым материалом по две лунки используют для постановки следующих контролей:
1) К+ - реакция с заведомо положительным мелиоидозным антигеном;
2) К- - реакция с гетерологичным антигеном (подтверждение специфичности реакции, выполняемой с данным набором ингредиентов для ТИФМ);
3) КК- - контроль конъюгата для подтверждения отсутствия его неспецифической сорбции на твердой фазе (в лунки пластины внесен только ИПК и на заключительном этапе - субстратная смесь);
4) КС- - контроль субстратной смеси: в лунки подготовленной пластины вносят индикаторную смесь для подтверждения отсутствие влияния твердой фазы на изменение ее цвета.
Результаты учитывают на микропланшетном фотометре для иммуноферментного анализа при длине волны 450 нм. Анализ полученных данных начинают с оценки контрольных реакций.
Положительным результатом являются значения ОП450, равные или превышающие значения 2·ОП контроля конъюгата (КК). ОП450 в лунках контроля субстратной смеси (КС) не должна превышать 0,2.
Реакция непрямой гемагглютинации (РНГА). Наиболее доступным гемагглютинационным тестом является РНГА с иммуноглобулиновым ЭД. Диагностикум эритроцитарный иммуноглобулиновый сапной и мелиоидозный (на основе поли- или моноклональных антител) является группоспецифическим препаратом.
В РНГА диагностикум эритроцитарный иммуноглобулиновый сапной и мелиоидозный взаимодействует как с мелиоидозными, так и сапными клеточными и растворимыми антигенами, обеспечивая обнаружение не менее 1·105 м.к./мл.
При поиске мелиоидозных бактерий и их антигенов объектами исследования являются все перечисленные выше образцы проб. Особенности подготовительного этапа заключаются в том, что все пробы переводят в жидкую фазу в соответствии с общепринятыми методиками. Исследуемые образцы обеззараживают нейтральным формалином, добавляя его в пробы до 4 % концентрации (0,2 мл на 2 мл пробы) и прогревают при 56 °С в течение 30 мин. При исследовании кусочков органов их тщательно измельчают ножницами и суспендируют в 0,85 % растворе NaCl в соотношении 1:5. Суспензию кипятят не менее 30 мин и при необходимости осветляют фильтрацией через ватный тампон с помощью шприца. При работе с чистыми культурами взвесь бактерий в концентрации 1·109 м.к./мл кипятят 10 мин и разводят этим же раствором 1:10. Затем в пробирки с инактивированным материалом добавляют 50 % взвесь формалинизированных эритроцитов из расчета 1 капля на 1 мл пробы во избежание неспецифических результатов РНГА. Смесь тщательно встряхивают, выдерживают при температуре 37 °С в течение 15 мин и центрифугируют при 2000 - 3000 об/мин 5 мин. Надосадочную жидкость используют для постановки РНГА (макро- или микровариант).
Макровариант РНГА. В 8 - 10 лунок полистиролового планшета вносят по 0,5 мл разводящей жидкости (0,85 % раствор NaCl рН 7,0 - 7,2 с 1 % нормальной кроличьей сыворотки (НКС)). В первую лунку вносят 0,5 мл исследуемой пробы и титруют двукратным шагом, из последней лунки 0,5 мл удаляют. Во все лунки добавляют по 0,05 мл 2,5 % взвеси ЭД.
Учет результатов проводят визуально. При наличии в исследуемых пробах мелиоидозного микроба эритроциты оседают на дно лунки в виде «зонтика», при отрицательном результате - в виде «пуговки» или узкого колечка с ровным краем. Реакция сопровождается следующими контролями:
• 0,5 мл разводящей жидкости + 0,05 мл контрольных эритроцитов;
• 0,5 мл разводящей жидкости + 0,05 мл диагностикума;
• 0,5 мл АГ + 0,05 мл контрольных эритроцитов.
Результаты всех контрольных реакций должны быть отрицательными.
Для подтверждения специфичности РНГА одновременно с ней ставят реакцию торможения непрямой гемагглютинации (РТНГА) в 6 - 10 лунках с использованием агглютинирующей диагностической мелиоидозной сыворотки. Специфичным считают результат РНГА, если различия в титрах РНГА и РТНГА достигают 16 - 32 и более раз.
В лунки, содержащие последовательные разведения исследуемого материала на разводящей жидкости (как и при постановке РНГА), но в объеме 0,25 мл, добавляется по 0,25 мл мелиоидозной агглютинирующей сыворотки, обеспечивающей связывание не менее 20 - 40 гемагглютинирующих единиц (ГЕ), что ориентировочно соответствует разведению агглютинирующей сыворотки 1:100 - 1:200. Планшеты выдерживают 1 ч при комнатной температуре. Во все лунки добавляют по 0,05 мл 2,5 % взвеси антительного диагностикума.
РНГА с иммуноглобулиновым ЭД применяют на этапах экспресс- и ускоренного анализа проб и идентификации чистых культур. При этом следует помнить о том, что РНГА с коммерческим ЭД не позволяет дифференцировать два близкородственных вида буркхольдрий.
Учет результатов РНГА осуществляют через 1,5 - 2,0 ч и 24 ч. Предварительный ответ о наличии искомого антигена может быть дан через 1,5 - 2,0 ч от момента постановки реакции.
Реакция коагглютинации (РКоА). В настоящее время наряду с РНГА с иммуноглобулиновым ЭД для внедрения в практику рекомендована объемная реакция типа РНГА - реакция коагглютинации (РКоА). Для РКоА готовят диагностикумы, в которых биологическим носителем мелиоидозных иммуноглобулинов являются клетки стафилококка штамма Cowan 1. РКоА ставят на стекле на этапе идентификации чистых культур. Ее чувствительность колеблется в пределах 1·106 - 1·109 м.к./мл в зависимости от особенностей тестируемых штаммов возбудителя мелиоидоза. Достоинством РКоА является простота постановки реакции и быстрота получения ответа (10 - 15 мин).
Серодиагностика мелиоидоза. Основными методами серодиагностики мелиоидоза являются РНГА и ТИФМ. При поиске специфических антител в сыворотках больных мелиоидозом людей и животных желательно исследовать парные сыворотки. Нарастание титров специфических антител свидетельствует о правильности предварительного диагноза.
Реакция непрямой гемагглютинации. При поиске специфических антител в сыворотках больных людей и животных чаще всего используют РНГА с диагностикумом эритроцитарным антигенным.
Необходимыми ингредиентами для постановки РНГА являются:
• диагностикум эритроцитарный для выявления антител к возбудителям сапа и мелиоидоза антигенный, представляющий собой формалинизированные эритроциты барана, сенсибилизированные мелиоидозным и сапным антигенами;
• контрольные эритроциты к антигенному диагностикуму (эритроциты барана, обработанные формалином, но не сенсибилизированные);
• взвесь 50 % формалинизированных эритроцитов барана, которая применяется для удаления из исследуемой сыворотки гетерологичных антител, способных вызвать неспецифическую гемагглютинацию;
• нормальная кроличья сыворотка, инактивированная в течение 30 мин при 56 °С, для приготовления 1 % раствора - стабилизатора реакции.
Диагностическим титром считают ≥ 1:40. Нарастание титра антител в случае исследования парных сывороток расценивают как свидетельство прогрессирования заболевания. Относительно невысокие, но сохраняющиеся в течение времени титры антител трактуют как ретроспективное подтверждение факта инфицирования возбудителем мелиоидоза.
Реакции нейтрализации антигена. Специфические антитела в сыворотках больных людей и животных можно выявить с помощью трехкомпонентной реакции нейтрализации антигена (РНАг) с диагностикумом эритроцитарным иммуноглобулиновым сапным и мелиоидозным. В основе этой реакции также лежит феномен склеивания эритроцитарного диагностикума (гемагглютинации) вследствие образования комплекса антиген-антитело. Визуально через 1,5 - 2,0 ч после постановки реакции регистрируют образование «зонтика» на дне лунки.
Выбор гемагглютинационного теста зависит от цели конкретного этапа исследования и от наличия соответствующего эритроцитарного диагностикума (ЭД).
Твердофазный иммуноферментный метод (ТИФМ). Необходимый набор реагентов для выполнения анализа:
• полистироловый планшет разборный для иммуноферментного анализа однократного применения,
• мелиоидозный антиген для сенсибилизациии планшетов (антиген 8, гликопротеин 200 kDa);
• 0,05М карбонатно-бикарбонатный буфер, рН 9,5 (КББ),
• 1 % раствор бычьего сывороточного альбумина (БСА) в 0,05М КББ, рН 9,5 для блокирования свободных сайтов неспецифического связывания на пластике.
• 0,1М фосфатно-солевой буферный раствор рН 7,2 (ФБР), на основе которого готовят раствор для отмывания пластин, раствор для приготовления разведений исследуемых сывороток и раствор рабочего разведения конъюгата, добавляя детергент твин-20 до 0,05 % по объему,
• детергент твин-20,
• антивидовой иммунопероксидазный конъюгат (ИПК) или препарат на основе протеина А,
• цитратно-фосфатный буферный раствор рН 5,0 (ЦФБР),
• хромоген тетраметилбензидин (ТМБ), 10 мг, растворяют в 1 мл диметилсульфоксида (ДМСО),
• 3 % раствор перекиси водорода, приготовленная ex tempore,
• субстратно-индикаторная смесь (ЦФБР + ТМБ + Н2О2): ТМБ, растворенный в ДМСО, используют для приготовления раствора 1:100 в ЦФБР, затем добавляют 3 % раствор перекиси водорода в соотношении 1:100, приготовленная extempore,
• 0,2М раствор серной кислоты (стоп-реагент),
• заведомо положительная контрольная сыворотка (К+),
• отрицательная контрольная сыворотка (К-).
Непрямой вариант ТИФМ. Для сенсибилизации планшетов используют непрямой вариант ТИФМ.
Объем реагентов на всех этапах постановки реакции составляет 100 мкл. В лунки планшета вносят приготовленный раствор антигена с концентрацей 10 мкг /мл в 0,05М КББ, рН 9,5. Сенсибилизацию планшета антигеном проводят в холодильнике при 4 °С в течение 18 - 24 ч. Затем раствор антигена удаляют, планшет подсушивают в течение 1 - 2 мин и трехкратно промывают ФБР + Т. Свободные сайты неспецифического связывания на пластике блокируют с помощью 1 % раствора бычьего сывороточного альбумина (БСА) в 0,05М КББ, рН 9,5 в течение 30 мин при 37 °С и вновь отмывают планшет.
В лунки твердой фазы вносят подготовленные разведения исследуемой сыворотки (1:400, 1:800 и т. д.) в ФБР + Т. Инкубацию проводят при 37 °С в течение 1 ч.
После трехкратного отмывания несвязавшихся компонентов реакции в лунки пластины вносят антивидовой конъюгат в рабочем разведении, планшет помещают в термостат при 37 °С на 45 - 60 мин. После этого планшет промывают 4 - 5 раз и в лунки вносят субстратно-индикаторную смесь.
Пластины выдерживают при комнатной температуре в темном месте в течение (25 ± 5) мин. Появление голубого окрашивания содержимого лунок различной интенсивности свидетельствует о прохождении реакции фермент-субстрат.
Реакцию останавливают с помощью стоп-реагента, внося во все лунки планшета по 100 мкл 0,2М раствора серной кислоты. Окраска хромогена меняется с голубой на желтую. Интенсивность окрашивания в лунках пластины пропорциональна содержанию специфических антител в лунке.
Результаты учитывают на микропланшетном фотометре для иммуноферментного анализа при длине волны 450 нм.
Титром антител считают то наибольшее разведение пробы, значение ОП450 которого равно или превышает значения 2·ОП контроля конъюгата (КК). При этом ОП450 в лунках контроля субстратной смеси (КС) не должна превышать 0,2.
Необходимые контроли:
• реакция с заведомо положительной сывороткой с известным титром антител (К+),
• контроль неспецифической сорбции конъюгата (КК-): в сенсибилизированные лунки (две лунки) вносят только рабочее разведение ИПК и проявляют субстратом;
• контроль субстрата (КС-): в сенсибилизированные лунки (две лунки) вносят только рабочий раствор субстрата, содержимое лунки должно оставаться без изменений.
Дот-иммуноанализ. В качестве твердой фазы реакции используют нитроцеллюлозные мембраны (НЦМ) с диаметром пор 0,22 или 0,45 мкм.
На фильтр наносят взвесь формалинизированных клеток возбудителя мелиоидоза в концентрации 1·109 м.к/мл в 0,1М трис-HCl буфере (рН 8,0). Фильтр оставляют в чашке Петри в холодильнике при 4 °С на 18 - 24 ч. Перед использованием НЦМ подсушивают и обрабатывают 3 - 5 % раствором БСА в течение 40 - 45 мин при 37 °С. Отмывают на шуттеле двукратно по 3 мин ФБ-Т или 0,85 % раствором NaCl.
Исследуемую сыворотку наносят в центр расчерченных квадратов. Необходимые разведения готовят на 0,1М трис-HCl буфере (рН 8,0) с твином-20. Инкубируют 45 - 60 мин при 37 °С. Отмывают по 2 мин двукратно. После этого НЦМ погружают в антивидовой ИПК на 1 ч при 37 °С. Заключительное отмывание проводят 4 раза по 2 мин.
Для проявления реакции в качестве субстратной смеси используют раствор О-дианизидина: 10 мл 0,1М трис-HCl буфера, рН 8,0, 1 мл 0,1 % О-дианизидина на метиловом спирте, 0,1 мл 0,3 % перекиси водорода.
Результаты учитывают визуально через 15 - 20 мин. При положительном результате на полоске НЦМ проявляются коричневые пятна.
Аллергодиагностика мелиоидоза. Для выявления аллергической перестройки у больных людей рекомендуются пробы in vitro. При этом используется показатель повреждения нейтрофилов (ППН).
Необходимые реактивы и оборудование:
• 5 % раствор цитрата Na;
• раствор периодата;
• реактив Шифа;
• сернистая вода;
• гематоксилин Эрлиха;
• формалин 40 %;
• спектрофотометр.
Реагенты, необходимые для постановки реакции ППН, а также технику окраски мазков для учета результатов реакции готовят по методике В.А. Фрадкина (1985).
Свежую кровь стерильной пипеткой переносят в две пробирки по 0,08 мл. Одна пробирка (опытная) содержит 0,02 мл раствора водорастворимого аллергена (маллеина) на 5 % цитрате Na, другая пробирка (контрольная) - 0,02 мл 5 % цитрата Na.
Пробы инкубируют в термостате при 37 °С в течение 2 ч. Из опытной и контрольной пробирок готовят мазки и фиксируют по методике Шабадаша: пропускают через три порции 96° спирта по 10 мин, ополаскивают в дистиллированной воде и помещают в реактив Шиффа на 20 мин. Затем стекла с мазками промывают в трех сменах сернистой воды по 3 мин и прополаскивают в дистиллированной воде. Мазки окрашивают в течение 5 мин гематоксилином, промывают 10 % HCl. Затем ополаскивают в чистой водопроводной воде и подсушивают при комнатной температуре. Для учета реакции в опытных и контрольных мазках с помощью микроскопа под иммерсией подсчитывают по 100 нейтрофилов, учитывая поврежденные, разрушенные и амебовидные.
Показатель повреждения нейтрофилов подсчитывают по формуле 1:
|
ППН = (N0 - NK)/l00, где |
(1) |
N0 - число поврежденных клеток в опыте;
NK - число поврежденных клеток в контроле.
Реакция считается положительной при показателях индексов 0,1 и выше. У здоровых людей этот показатель обычно не превышает 0,04 - 0,07.
5.4 Молекулярно-генетические методы исследования
В основе лабораторной диагностики мелиоидоза лежит принцип полифазного подхода, при котором к традиционной лабораторной диагностике, направленной на выделение чистой культуры возбудителя, добавлены молекулярно-генетические методы, в первую очередь, реакция амплификации. Методы амплификации нуклеиновых кислот используют для экспресс-диагностики при исследовании биологического материала, взятого от человека с целью выявления у него ДНК В. pseudomallei и ее количественной оценки; для специфической индикации возбудителя мелиоидоза в объектах окружающей среды и пищевых продуктах; в качестве ускоренного предварительного теста при выполнении культу-рального и биологического методов исследования и для идентификации культур; для определения эпидемиологической значимости изолятов на основании выявления генетических маркеров вирулентности и патогенности, антибиотикоустойчивости; для таксономической характеристики штаммов на основании выявления специфических видовых, родовых и других маркеров; для генотипирования штаммов с целью определения их происхождения, а также для прогнозирования течения инфекционного заболевания и оценки эффективности проводимой терапии.
Исследование материала, содержащего (подозрительного на содержание) В. pseudomallei, методами амплификации нуклеиновых кислот (сигнала), связано с необходимостью одновременного обеспечения и соблюдения персоналом правил биологической безопасности и требований к организации и проведению данных работ с целью предотвращения контаминации нуклеиновыми кислотами и (или) ампликонами исследуемых проб помещений и оборудования.
Исследования методом ПЦР должны проводиться в специализированных лабораториях квалифицированными специалистами, имеющими опыт работы с особо опасными инфекциями. Для предотвращения возможной контаминации работают только в одноразовых перчатках, используют и меняют при каждой операции одноразовые наконечники для автоматических пипеток с аэрозольным барьером.
Забор проб для молекулярно-генетического исследования. Забор, предварительная обработка, хранение и перевозка материала на исследование проводится в соответствии с МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности».
Для получения плазмы забор крови производят натощак или через 3 ч после приема пищи из локтевой вены одноразовой иглой (диаметр 0,8 - 1,1 мм) в специальную вакуумную систему (сиреневые крышки - 6 % ЭДТА) или одноразовым шприцем в пластиковые пробирки с цитратом натрия (3,8 % цитрата Na в соотношении 1:9). Пробирку закрывают крышкой и аккуратно переворачивают несколько раз вверх дном, чтобы кровь в пробирке тщательно перемешалась с антикоагулянтом (в противном случае кровь свернется, и выделение ДНК/РНК станет невозможным). Гепарин в качестве антикоагулянта использовать нельзя!
После центрифугирования отбирают лейкоцитарное кольцо вместе с плазмой. Хранят плазму крови при температуре от 2 до 8 °С не более 3 сут. при температуре не выше минус 16 °С - в течение 1 месяца, при температуре не выше минус 68 °С - в течение 1 года. Допускается только однократное замораживание-оттаивание материала. При замораживании клинического материала его транспортировка должна проводиться также в замороженном состоянии.
Забор секционного материала при вскрытии умерших от мелиоидоза, а также подозрительных на данную инфекцию проводит патологоанатом или судмедэксперт в присутствии специалиста по особо опасным инфекциям.
Из внутренних органов (сердце, печень, легкие, селезенка, почки, головной мозг) стерильно вырезают кусочек ткани размерами 2 - 3 см. Стерильным шприцем с длинной иглой или стерильной пастеровской пипеткой с резиновой грушей забирают 8 - 10 мл крови из сердца, предварительно обеззаразив участок с помощью раскаленного скальпеля. Следует забирать материал из нескольких участков, подвергшихся изменениям, и из участка рядом расположенной ткани, которая выглядит неизмененной. При наличии распада ткани основное внимание обращают на пограничную зону. Забор секционного материала необходимо производить, как можно быстрее после смерти больного (не позднее 20 ч при комнатной температуре). Забранный материал помещают в стерильные пластиковые пробирки с плотно закрывающимися (завинчивающимися) пробками, этикетируют.
Если материал может быть доставлен в лабораторию в течение 2 - 4 ч, то его транспортируют в термосе со льдом. Если время доставки материала превышает 4 ч, его замораживают и доставляют в лабораторию в сосудах Дьюара с жидким азотом или в термоконтейнерах с сухим льдом. Цельную кровь замораживанию не подвергают.
Обеззараживание проб для исследования методом ПЦР. При обработке исследуемого материала, инфицированного (подозрительного на инфицирование) возбудителем мелиоидоза, к исследуемому образцу добавляют мертиолят натрия до конечной концентрации 1:10000 (0,01 %) и прогревают его при 56 °С в течение 30 мин. Затем 100 мкл образца переносят в микроцентрифужные пробирки объемом 1,5 мл, добавляют лизирующий раствор, приготовленный на основе 6М гуанидинизотиоцианата, в объеме указанном в инструкции по применению к набору реагентов и инкубируют 15 мин при 65 °С.
Обработанные таким образом пробы считаются обеззараженными и всю последующую работу проводят как с незаразным материалом.
Выделение ДНК. ДНК из проб материала выделяют с помощью коммерческих наборов для выделения ДНК в строгом соответствии с прилагаемой инструкцией. Работу проводят согласно требованиям противоэпидемического режима, используя одноразовую пластиковую посуду в боксах II - III классов биологической безопасности.
При работе с чистыми культурами микроорганизмов В. Pseudomallei и инфицированными пробами воды экстракцию ДНК проводят методом нуклеосорбции на силикагеле в присутствии гуанидинизотиоцианата.
Выделение ДНК из объектов окружающей среды (пробы почвы, пищевых продуктов) проводится путем гуанидинизотиоцианат-фенол-хлороформной депротеинизации с последующей очисткой ДНК методом нуклеосорбции. Подготовленные пробы из объектов окружающей среды в объеме 100 мкл смешивают с лизирующим буфером, содержащим 300 мкл 6М гуанидинтиоцианата натрия и 300 мкл фенола, забуференного Tris-HCl, рН 8,0, лизис клеток проводят при 60 °С в течение 10 мин. После этого образец центрифугируют на микроцентрифуге при 12000 об/мин в течение 10 с для осаждения конденсата. Затем к пробе добавляют 300 мкл хлороформа, перемешивают и центрифугируют на микроцентрифуге при 12000 об/мин в течение 5 мин, после чего верхнюю водную фазу переносят в чистую микроцентрифужную пробирку и экстрагируют равным объемом хлороформа, этот этап повторяют 2 раза. Центрифугируют в течение 5 мин при 12000 об/мин. Далее верхнюю водную фазу переносят в чистую микроцентрифужную пробирку и добавляют 20 мкл раствора сорбента, содержащего 10 мМ Трис, 2 мМ ЭДТА, рН 8,0 и 10 мкг сорбента SiО2, который предварительно тщательно перемешивают на вортексе. Пробы инкубируют при температуре 60 °С в течение 10 мин, периодически встряхивая на вортексе для лучшей сорбции ДНК. Затем пробы центрифугируют при 12000 об/мин на микроцентрифуге в течение 30 с, отбирают супернатант, а к осадку добавляют 100 мкл 4М раствора гуанидинизотиоцианата натрия. Содержимое перемешивают до гомогенного состояния в течение 10 - 20 с на вортексе, центрифугируют на микроцентрифуге в том же режиме и отбирают супернатант. К осадку добавляют 500 мкл раствора для отмывки, содержащего 10 мМ Трис, 50 мМ NaCl и 70 % этанола, перемешивают на вортексе и центрифугируют при 12000 об/мин на микроцентрифуге в течение 30 с. Процедуру отмывки повторяют, после чего осадок высушивают при температуре 60 °С в течение 10 мин. Для растворения ДНК к осадку добавляют 100 мкл ТЕ-буфера, выдерживают при температуре 60 °С в течение 10 мин, периодически встряхивая на вортексе. По окончании процедуры десорбции взвесь центрифугируют при 12000 об/мин на микроцентрифуге в течение 1 - 2 мин и отбирают супернатант для проведения ПЦР.
Для выделения ДНК возбудителя мелиоидоза из крови используют метод выделения такой же, как и для экстракции и очистки ДНК из почвы. За исключением того, что перед этапом подсушивания осадок ДНК дополнительно промывают 500 мкл ацетона, перемешивают на вортексе и центрифугируют 12000 об/мин на микроцентрифуге в течение 30 с, после чего высушивают при температуре 60 °С в течение 10 мин и растворяют в 100 мкл ТЕ-буфера.
При исследовании секционного материала часть биоптата (печень, селезенка, легкое, сердце) массой около 30 мг растирают тефлоновым гомогенизатором в микроцентрифужной пробирке объемом 1,5 мл с 300 мкл 6М гуанидинизотиоцианата натрия, затем добавляют 300 мкл фенола, забуференного Tris-HCl, рН 8,0. После перемешивания на вортексе, инкубируют в течение 30 мин при температуре 65 °С. Далее выделение ДНК проводят также, как и с пробами крови.
Проведение ПЦР для специфической индикации и идентификации возбудителя мелиоидоза. Выявление ДНК возбудителя мелиоидоза методом полимеразной цепной реакции проводят классическим способом с электрофоретическим учетом результата реакции в агарозном геле или флуоресцентной детекцией в режиме реального времени или по «конечной точке». При использовании ПЦР в реальном времени (Real-Time PCR) учет и анализ результатов проводится в процессе амплификации, согласно инструкции к приборам.
Работу проводят в соответствии с инструкциями к диагностическим тест-системам.
Для индикации и идентификации возбудителя мелиоидоза можно использовать праймеры, предназначенные для выявления нуклеотидных последовательностей генов 16S рРНК, 23S рРНК, III типа секреции (TTSI) и флагеллярного гена fliC. Детекцию В. pseudomallei целесообразнее проводить методом ПЦР с двумя ДНК-мишенями с последующим секвенированием ампликонов.
Генотипирование штаммов возбудителя мелиоидоза можно проводить с помощью пульс-электрофореза, амплификации с произвольными праймерами, мультилокусного сиквенс-типирования (MLST), метода, основанного на анализе вариабельных ампликонов (VAT) и метода мультилокусного анализа вариабельности тандемных повторов (MLVA).
5.5. Идентификация культур
Возбудитель мелиоидоза В. pseudomallei представляет собой бактерии в виде грамогрицательной палочки размером (0,3 - 0,6) × (2,0 - 5,0) мкм, которые подвижны в висячей капле; способны расти в анаэробных условиях в присутствии нитрата; окисляют, но не ферментируют глюкозу; обладают аргининдигидролазной активностью; устойчивы к 50 мкг/мл полимиксина В и 4 мкг/мл гентамицина; агглютинируются диагностической мелиоидозной агглютинирующей сывороткой; в отличие от близкородственной апатогенной В. thailandensis не усваивают в качестве источника углерода и энергии L-арабинозу.
Типичные штаммы возбудителя мелиоидоза вызывают гибель золотистых хомячков после внутрибрюшинного заражения в дозе менее 102 м.к. в течение ближайших 7 сут. с выделением из органов (селезенка, печень, легкие) павших животных «чистой» культуры.
Идентификацию культур, подозрительных на принадлежность к виду В. pseudomallei, проводят в два этапа, последовательно определяющих род и вид исследуемой культуры бактерий.
Реакция агглютинации (РА). Несмотря на общеизвестные недостатки РА имеет наибольшее значение для ориентировочной идентификации культур в момент исследования колоний, выросших на плотных питательных средах. Показано, что абсолютно все живые культуры В. pseudomallei, видовая принадлежность которых доказана по характеристикам фено- и генотипа, агглютинируются диагностическими сыворотками в титрах не менее, чем 1:200. В ориентировочной (на стекле) РА используют мелиоидозную диагностическую агглютинирующую сыворотку в рабочем разведении 1:100. Объемную РА ставят в бактериологических пробирках со взвесью суточной агаровой культуры В. pseudomallei. В объеме 0,5 мл готовят двукратные разведения агглютинирующей мелиоидозной сыворотки с 1:50 до титра, затем в каждую пробирку добавляют по 0,5 мл взвеси исследуемой культуры с концентрацией 1·109 м.к./мл. Одновременно ставят контроль антигена (0,5 мл взвеси культуры +0,5 мл 0,85 % раствора NaCl) й контроль сыворотки (0,5 мл сыворотки в разведении 1:50 + 0,5 мл 0,85 % раствора NaCl). Пробирки встряхивают и выдерживают 2 ч при 37 °С, после чего производят предварительный учет результатов. Окончательный учет осуществляют по общепринятой методике через 18 - 20 ч экспозиции при комнатной температуре. Реакцию считают положительной при наличии четкой агглютинации в разведении 1:200 и выше. РА не позволяет дифференцировать В. pseudomallei от В. mallei и В. thailandensis.
Установление родовой принадлежности. Культуры, подозрительные на принадлежность к роду Burkholderia, засевают на МПГА или триптиказосоевый агар (ТСА). Посевы просматривают и отмечают колонии, подлежащие дальнейшему изучению по основным родовым свойствам (табл. 1). Постановка методик бактериологического исследования традиционна для всех глюкозунеферментирующих грамотрица-тельных бактерий.
Родовые признаки буркхольдерий
|
Свойства |
Проявление у В. pseudomallei |
|
Окраска по Граму |
(-) грамотрицательные палочки |
|
Флагелляция |
(+) подвижны, жгутики - полярные |
|
Содержание Г + Ц в ДНК |
68 - 70 моль % |
|
Каталазная активность |
(+) выделение пузырьков газа в течение 3-х мин |
|
Цитохромоксидазная активность |
(+) посинение колоний через 1 - 3 мин |
|
Окисление/ферментация глюкозы |
(+/-) только окисление, ферментация исключается |
|
Устойчивость к полимиксину В |
(+) МПК > 300 мкг/мл |
Окраска по Граму. В мазках при окраске по Граму клетки выглядят в форме палочек розового цвета.
Флагелляция. В. pseudomallei обладает полярными жгутиками (лофотрих). Молодые бульонные культуры бывают монотрихами.
Морфология колоний. Через 24 - 48 ч на МПГА вырастают колонии нескольких типов. Колонии большинства видов буркольдерий и псевдомонад - блестящие, выпуклые с гладким ровным краем. Из всех известных представителей этих родов только у P. stutzeri колонии в R-форме, а у В. pseudomallei наблюдают явление морфологической диссоциации колоний.
Определение каталазной активности. Для определения каталазы на поверхность микробной культуры, выращенной на скошенном в пробирке МПГА, наносят 1 - 2 капли 3 % раствора перекиси водорода. Для возбудителя мелиоидоза характерно появление пузырьков образующегося кислорода в результате расщепления перекиси водорода.
Определение цитохромоксидазной активности. Исследуемую культуру выращивают на плотных питательных средах (МПА, ТСА), не содержащих углеводные добавки, которые могут привести к ложноотрицательным результатам. На изолированную колонию 1 - 2 сут культуры наносят последовательно петлей по 1 капле 1 % спиртового раствора альфа-нафтола и 1 % водного раствора аминодиметиланилина - наличие цитохрома С характеризуется покраснением, а затем и потемнением колонии (пурпурный цвет).
Окисление-ферментация глюкозы. Способность и характер усвоения глюкозы оценивают по стандартной методике Хью-Лейфсона на полужидкой среде. В две пробирки с 5,0 мл среды уколом засевают петлю исследуемой суточной агаровой культуры. Затем на среду в первой пробирке наслаивают стерильное вазелиновое масло высотой 2 см. Посевы инкубируют при 37 °С в течение 48 ч, после чего учитывают результат. Все виды буркхольдерий, включая и В. pseudomallei глюкозу окисляют, но не ферментируют.
Окисление других Сахаров (ксилоза, лактоза, мальтоза, фруктоза) изучают на той же среде, но в одной пробирке и без вазелинового масла, ферментация исключается a priori.
Установление видовой принадлежности. Набор тестов и их проявления у В. pseudomallei и филогенетически близких видов буркхольдерий и P. aeruginosa представлены в табл. 2.
Диффундирующий пигмент. Для выявления пигмента используют среды, применяемые для выявления у псевдомонад пиоцианина и флуоресцеина. Возбудитель мелиоидоза истинный диффундирующий в среду пигмент не образует.
Декарбоксилирование аминокислот. Декарбоксилирование аминокислот (аргинин, лизин, орнитин) исследуют на питательной среде следующего состава:
|
пептон - 5,0 г |
конечный рН 6,0, |
|
мясной экстракт - 5,0 г |
зона перехода |
|
глюкоза - 0,5 г |
окраски 5,2 - 6,8 |
|
пиридоксаль - 0,005 г |
(кислая - желтая, щелочная - пурпурная) |
|
бромкрезол пурпурный - 0,01 г |
|
|
крезол красный - 0,005 г |
|
|
дистиллированная вода до 1000 мл |
|
Среду стерилизуют при 120 °С в течение 10 мин. Перед разливом в среду добавляют L-аминокислоты до конечной концентрации 1 %. При использовании DL-аминокислот их концентрацию повышают вдвое. Растворы аминокислот предварительно стерилизуют на водяной бане в течение 15 мин.
В пробирки с 4,0 мл среды, засевают полную петлю суточной агаровой культуры. В качестве контроля используют ту же среду, но без аминокислоты. Наслаивают по 0,5 - 1,0 мл стерильного вазелинового масла, включая контрольную среду без аминокислот. Посевы инкубируют при 32 °С. При положительной реакции из аргинина образуется путресцин, из лизина - кадаверин. Среда защелачивается и приобретает пурпурный или фиолетовый цвет.
Гидролиз желатина. В пробирке, содержащей 0,5 мл 0,85 % NaCl, готовят густую суспензию из исследуемых бактерий. Опускают в нее кусочек засвеченной фотографической пленки так, чтобы она была погружена наполовину, и инкубируют при 37 °С 2 сут. При положительной реакции суспензия приобретает серо-черный цвет, а основа пленки становится прозрачной.
Дифференциальные признаки В. pseudomallei
|
Тесты |
В. pseudomallei |
В. thailan-densis |
В. mallei |
В. cepacia |
P. aeruginosa |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Окисление: глюкозы |
+ |
+ |
+ |
+ |
+ |
|
фруктозы |
+ |
+ |
+ |
+ |
+ |
|
ксилозы |
+ |
+ |
- |
+ |
+ |
|
лактозы |
+ |
+ |
+ |
+ |
- |
|
мальтозы |
+ |
+ |
+ |
+ |
- |
|
Аргининдигиаролаза |
+ |
+ |
+ |
- |
+ |
|
Лизиндекарбоксилаза |
- |
- |
- |
+ |
- |
|
Орнитиндекарбоксилаза |
- |
- |
- |
± |
- |
|
Желатиназа |
+ |
+ |
+ |
± |
+ |
|
Денитрификация |
+ |
+ |
+ |
- |
± |
|
Гидролиз эскулина |
± |
± |
- |
- |
- |
|
Число жгутиков |
>1 |
>1 |
- |
>1 |
1 |
|
Рост при 42° С |
+ |
+ |
- |
± |
+ |
|
Полимиксин |
R |
R |
R |
R |
S |
|
Гентамицин |
R |
R |
S |
R |
S |
|
Рост при 2,5 % NaCl |
- |
- |
- |
+ |
+ |
|
Ассимиляция L-арабинозы |
- |
+ |
- |
+ |
- |
|
Наличие пигмента |
- |
- |
- |
± |
+ |
|
Г + Ц моль % |
69 |
68 |
69 |
67 |
67 |
|
R-колонии на агаре |
± |
- |
- |
- |
- |
|
Вирулентность для з/х |
+ |
- |
+ |
- |
- |
|
Примечание: (+) и (-) наличие или отсутствие признака у 90 % и более штаммов данного вида. |
|||||
Гидролиз эскулина. Для постановки теста используют ТСА с 0,1 % эскулина и 0,05 % лимонно-кислого железа. На чашки со средой бляшками засевают суточную агаровую культуру. Результат учитывают через 24 ч. Положительный тест - появление коричневато-черной окраски среды вокруг колоний.
Рост при различных температурах. Для дифференциации бурк-хольдерий учитывают рост в мясо-пептонном бульоне при 4 и 42 °С через 48 - 72 ч. Наибольшее значение имеет выращивание при температуре 42 °С, по устойчивости к которой дифференцируют В. pseudomallei от В. mallei. Для выделения культур В. pseudomallei из загрязненного материала селективные среды предпочтительнее инкубировать при 42 °С, а не при 32 - 37 °С.
Рост на средах с высоким содержанием NaCl. Рост на средах с 2,5 - 6,5 % содержанием NaCl характерен для галофильных (морских) псевдомонад. Большинство видов, имеющих медицинское значение, на ТСА с 6,5 % NaCl не растет, а В. pseudomallei не выдерживает и концентрации 2,5 % NaCl.
Ассимиляция L-арабинозы. Принципиальное значение для идентификации возбудителя мелиоидоза имеет тест на ассимиляцию L-арабинозы, которую вирулентные клинические штаммы В. pseudomallei не усваивают в отличие от непатогенных культур близкородственного сапробиотического вида В. thailandensis, а также В. cepacia.
Тест на денитрификацию. Состав среды:
мясной экстракт - 3,0 г,
пептон - 5,0 г,
KNO3 - 1,0 г,
агар - 12,0 г,
дистиллированная вода - до 1000 мл.
Посев осуществляют на скошенный агар штрихом и уколом в столбик агара, инкубируют при 37 °С 48 ч. Выделение пузырьков газа и разрыв столбика агара - показатель денитрификации с образованием азотистых газообразных продуктов. Покраснение среды при добавлении на участки роста поочередно по две капли 0,8 % сульфациловой кислоты и 0,5 % α-нафтола в 5М уксусной кислоте свидетельствует о переходе нитрата в нитрит без образования газообразных продуктов. Штаммы В. pseudomallei могут давать оба типа положительной реакции на денитрификацию.
6. Дезинфекция при работе с возбудителем мелиоидоза
Возбудитель мелиоидоза относительно устойчив к воздействию факторов (химических, физических, биологических) внешней среды, хорошо выживает и размножается в водопроводной, речной и морской воде. В почве сохраняется более трех месяцев, в фекалиях - месяц и более, в моче и трупах - до трех недель. Кипячение, а тем более автоклавирование объектов при 1,5 атм (125 °С) приводят через несколько секунд к гибели возбудителя. Прогревание при 56 °С - через 10 мин.
По устойчивости к различным химическим соединениям В. pseudomallei мало отличается от других грамотрицательных неспорообразующих микроорганизмов. Он погибает через 30 мин при воздействии растворов 1 - 3 % перекиси водорода, 10 - 20 % хлорной извести, 1 - 5 % хлорамина, 1 - 10 % формалина, 1 % сулемы, 70 % этилового спирта, 0,01 % нейтрального гипохлорида кальция (НГК) и сульфохлорантина, 0,02 - 0,05 % дезама и хлордезина, а также 0,01 % ДП-2, 0,1 % амфолана и ниртана (препараты на основе трихлоризоциануровой кислоты), 0,5 % метафора и 15 % альдофора (препараты на основе формальдегидсодержащих отходов химической промышленности) и т.д.
В бактериологической лаборатории добавление мертиолата натрия (1:10000) и последующее прогревание в течение 30 мин при 56 °С стерилизует сыворотки от больных любыми формами мелиоидоза. Если по воздействию дезинфектантов возбудитель мелиоидоза существенно не отличается от других грамотрицательных микроорганизмов, то уровень устойчивости его к антибиотикам значительно выше и спектр уже, чем у других бактерий.
Устойчивость возбудителя мелиоидоза к ряду красителей (нейтральный красный, кристалл фиолетовый, бромтимоловый синий) и антибиотикам (пенициллин, полимиксин, гентамицин) используется при изготовлении селективных и дифференциально-диагностических сред.
Перечень средств, рекомендованных для обеззараживания вегетативных форм возбудителей особо опасных инфекций бактериальной природы регламентирован прилож. 2 к СП 1.3.1285-03 «Безопасность работы с микроорганизмами I - II групп патогенности (опасности)» (М., 2003), а также индивидуальными для каждого из новых препаратов федеральными инструкциями или методическими указаниями по их использованию для целей дезинфекции.
Для обеззараживания объектов (различные поверхности, жесткая мебель, санитарно-техническое оборудование, белье, посуда, изделия медицинского назначения), контаминированных возбудителем мелиоидоза, рекомендованы преимущественно композиции на основе четвертично-аммониевых соединений, дополнительно содержащие полигекса-метилен гуанидин, метасиликат натрия, спирт, глиоксаль и другие компоненты, а также хлорсодержащее средство - двуосновная соль гипо-хлорита кальция (ДСГК). Данные препараты по токсикологической характеристике относятся к 3 - 4 классу опасности и имеют сроки хранения в пределах 3 - 5 лет. При времени экспозиции от 60 до 120 мин рабочие концентрации препаратов в зависимости от вида обрабатываемого объекта и состава средства варьируют от 0,2 до 5,0 %. Содержащие глутаровый альдегид средства (Лизоформин - 3000, Новодез-форте) более токсичны, но вызывают гибель возбудителя мелиоидоза при низких концентрациях и коротких экспозициях. Хлорсодержащие растворы средства ДСГК, содержащие 0,15 - 0,44 % активного хлора, эффективны против возбудителя мелиоидоза на обеззараживаемых объектах при 60 - 120 мин экспозиции.
В случае выделения культуры В. pseudomallei, подтвержденной в дальнейшем в специализированном учреждении, сотрудники клинической лаборатории, имевшие контакт с возбудителем мелиоидоза, для исключения вероятности внутрилабораторного заражения, подлежат медицинскому наблюдению в течение 1 месяца с обязательными серологическими исследованиями и ежедневной термометрией.
7. Экстренная профилактика мелиоидоза при аварии в лаборатории
В случае регистрации аварии проводят мероприятия в соответствии с действующими нормативными методическими документами по работе с возбудителями I - II групп патогенности.