 | Информационная система |  |
4.2. Методы контроля. Биологические и микробиологические факторы
Методические указания МУК 4.2.2747-10
Методы санитарно-паразитологической экспертизы мяса и мясной продукции
(утв. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека 11 октября 2010 г.)
Введены впервые
1. Область применения
1.1. Настоящие методические указания устанавливают методы санитарно-паразитологической экспертизы мяса и продуктов его переработки (далее по тексту - мясопродукция) в отношении их эпидемической безопасности в соответствии с СанПиН 3.2.1333-03 "Профилактика паразитарных болезней на территории Российской Федерации", СанПиН 2.3.2.1078-01 "Гигиенические требования к безопасности и пищевой ценности пищевых продуктов".
1.2. Методические указания предназначены для органов и учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (далее - Роспотребнадзора), осуществляющих контроль качества и безопасности продовольственного сырья и пищевых продуктов, в том числе импортируемых в Российскую Федерацию, а также лабораторную диагностику заболеваний с пищевым путем передачи. Методические указания могут быть использованы другими лабораторными центрами, осуществляющими контроль качества и безопасности пищевых продуктов и аккредитованными в установленном порядке.
2. Нормативные ссылки
2.1. Федеральный закон от 22 июля 1993 г. № 5487-I "Основы законодательства Российской Федерации об охране здоровья граждан".
2.2. Федеральный закон от 30 марта 1999 г. № 52-ФЗ "О санитарно-эпидемиологическом благополучии населения".
2.3. Федеральный закон от 2 января 2000 г. № 29-ФЗ "О качестве и безопасности пищевых продуктов".
2.4. Федеральный закон от 26 декабря 2008 г. № 294-ФЗ "О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля".
2.5. Постановление Правительства Российской Федерации от 2 декабря 2009 г. № 984 "О перечне платных услуг, оказываемых организациями в целях предоставления федеральными органами исполнительной власти государственных услуг".
2.6. Постановление Правительства Российской Федерации от 14 декабря 2009 г. № 1009 "О порядке совместного осуществления Министерством здравоохранения и социального развития Российской Федерации и Министерством сельского хозяйства Российской Федерации функций по нормативно-правовому регулированию в сфере контроля за качеством и безопасностью пищевых продуктов и по организации такого контроля".
2.7. Приказ Роспотребнадзора от 19.07.2007 № 224 "О санитарно-эпидемиологических экспертизах, обследованиях, исследованиях, испытаниях токсикологических, гигиенических и иных видах оценок".
2.8. СанПиН 2.3.2.1078-01 "Гигиенические требования к безопасности и пищевой ценности пищевых продуктов".
2.9. СанПиН 3.2.1333-03 "Профилактика паразитарных болезней на территории Российской Федерации".
2.10. СП 1.3.2322-08 "Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней" и СП 1.3.2518-09 "Дополнения и изменения № 1 к СП 1.3.2322-08".
2.11. МУ 3.2.1756-03 "Эпидемиологический надзор за паразитарными болезнями".
2.12. МУК 4.2.735-99 "Паразитологические методы лабораторной диагностики гельминтозов и протозоозов".
3. Общие положения
3.1. Санитарно-эпидемиологическая экспертиза за продукцией - деятельность Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека и прочих служб по установлению соответствия (несоответствия) продукции государственным санитарно-эпидемиологическим правилам и нормативам.
3.2. Среди возбудителей гельминтозов, встречающихся в мясе и мясопродуктах, опасными для здоровья человека являются личиночные стадии возбудителей трихинеллеза и тениидозов (тениаринхоза и тениоза).
3.3. Трихинеллез - вызывается возбудителями двух видов: Trihinella spiralis с вариететами T.s. spiralis, T.s. nativa, T.s. nelsoni и Trihinella pseudospiralis. Заражение человека происходит при употреблении инвазированного личинками трихинелл. Весь цикл развития проходит в организме одного хозяина: половозрелая стадия паразита локализуется в кишечнике, а личиночная - в мышечной ткани (Т. spiralis в капсульной форме, T. pseudospiralis - в бескапсульной).
3.4. Тениаринхоз вызывается бычьим цепнем - Taeniarhynchus saginatus. Заражение человека происходит при употреблении инвазированного мяса крупного рогатого скота (КРС), который является промежуточным хозяином возбудителя тениаринхоза. В мышечной ткани КРС формируется инвазионная личинка (финна) - Cysticercus bovis. Промежуточным хозяином бычьего цепня на ряде территорий Российской Федерации является также северный олень, у которого инвазионные личинки (Cysticercus bovis) локализуются в головном мозге.
3.5. Тениоз вызывается свиным цепнем - Taenia solium. Заражение человека происходит при употреблении инвазированного мяса свиней, которые являются промежуточными хозяевами возбудителя тениоза. В межмышечной соединительной ткани этих животных формируются инвазионные личинки - цистицерки (Cysticercus cellulosae).
4. Отбор проб
Контрольный отбор проб мяса и готовой мясной продукции осуществляется у граждан, в торговых точках и организациях общественного питания (также при неблагополучной эпидситуации, при расшифровке вспышки) для санитарно-паразитологического исследования (в т.ч. изъятых остатков мяса, мясопродуктов для выявления источников инвазии при подтверждении клинических и серологических анализов на наличие антител к антигенам трихинелл).
Исследования проводят в аккредитованных паразитологических лабораториях центров гигиены и эпидемиологии Роспотребнадзора, центров индикации и референс-центров (по ларвальным гельминтозам и биогельминтозам).
Нормативно-правовое регулирование в сфере контроля за безопасностью пищевых продуктов (мяса) и организация такого контроля осуществляются: Министерством здравоохранения и социального развития Российской Федерации и Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека и Министерством сельского хозяйства Российской Федерации и Федеральной службой по ветеринарному и фитосанитарному надзору.
4.1. Отбор проб для исследования на наличие личинок трихинелл
4.1.1. Отбор материала для исследования осуществляется от каждой туши животного (в том числе от поросят с 3-х недельного возраста). Для исследования отбирают пробы мышечной ткани из ножек диафрагмы (на границе перехода мышечной ткани в сухожилие), при их отсутствии берут части межреберных, шейных, жевательных, поясничных, икроножных мышц, сгибателей и разгибателей пясти, а также мышцы языка, пищевода и гортани; от туш морских млекопитающих - мышцы глаз и кончика языка.
4.1.2. Пробы шпига соленого, копченого (при наличии прирези или прослоек мышечной ткани) отбирают от каждого куска, масса, пробы должна быть не менее 25 г.
4.1.3. Пробу копченостей отбирают от 3 % упаковочных единиц, делая по 10 - 15 выемок из каждой, составляя объединенную пробу.
4.1.4. Образцы свиных субпродуктов (языки, головы, ножки, хвосты) отбирают от 3 % упаковочных единиц, делая по 10 - 15 выемок из каждой, составляя объединенную пробу.
4.1.5. Свинину импортную (в тушах, полутушах) берут для мониторингового исследования не менее 10 % от партии мяса, пробы отбирают из остатков ножек диафрагмы или межреберных мышц. Масса пробы мышц от туши, полутуши должна составлять не менее 25 г. Свинину импортную в блоках берут для исследования в количестве не менее 1 % от партии мясных блоков. Осуществляют 25 выемок (1 г каждая) от блока, общей массой не менее 25 г.
4.1.6. Количество проб и вес объединенной пробы готовой мясной продукции при контрольных отборах в торговых точках, организациях общественного питания для санитарно-паразитологического исследования на наличие личинок трихинелл представлены в таблице.
Таблица
Виды готовой продукции и объем отбираемых проб для исследования на наличие личинок трихинелл
|
Вид мясной продукции |
Вид мяса |
Количество проб |
Вес объединенной пробы |
Цель исследования |
|
1 |
2 |
3 |
4 |
5 |
|
Готовая продукция и кулинарные изделия полуфабрикаты, сырье |
Мясо домашних и диких животных потенциально опасных в заражении трихинеллезом |
2 пробы из разных мест потребительской тары или весь изъятый с реализации потребительский продукт |
120 г - 150 г, 2 - 3 кусочка, или филейчика, или вакуумной упаковки |
По эпидпоказаниям и очагах |
|
Готовая продукция и кулинарные изделия полуфабрикаты, сырье |
Мясо домашних и диких животных потенциально опасных в заражении трихинеллезом |
2 пробы одноименной продукции из разных мест потребительской тары или весь изъятый с реализации продукт |
120 г - 150 г, 2 - 3 кусочка, филейчика, или вакуумной упаковки (не более 200 г) или весь изъятый с реализации продукт |
По эпидпоказаниям и очагах |
|
Готовая продукция и кулинарные изделия полуфабрикаты, сырье |
Мясо домашних и диких животных потенциально опасных в заражении трихинеллезом |
2 - 3 пробы из разных мест потребительской тары |
150 г - 200 г, 2 - 3 кусочка, филейчика, или вакуумной упаковки (не более 200 г) |
Выборочно с целью санитарно-паразитологического контроля |
|
Готовая продукция и кулинарные изделия полуфабрикаты, сырье |
Свинина, медвежатина, мясо кабана и др. животных, потенциально-опасных в заражении трихинеллезом |
2 - 3 пробы из разных мест потребительской тары |
120 г - 150 г, 2 - 3 кусочка, филейчика или вакуумной упаковки (не более 200 г) |
_____________
* Цитируется по МУ 3.2.1756-03 "Эпиднадзор за паразитарными болезнями".
4.2. Отбор проб для исследования на наличие цистицерков (финн)
4.2.1. Перед отбором проб на наличие цистицерков (финн) проводится визуальный осмотр туш крупного рогатого скота и свиней.
4.2.2. Для исследования на наличие цистицерков крупного рогатого скота и свиней забор проб мышечной ткани осуществляется путем разрезов мышц головы и сердца.
4.2.3. При обнаружении цистицерков (финн) дополнительно исследуют мышцы шеи, лопатко-локтевые, спинные, тазовой конечности и диафрагмы.
4.2.4. При обнаружении цистицерков (финн) производят отбор материала в объеме не менее 0,5 кг из мест наибольшего их скопления.
4.3. Отобранные пробы доставляют в лабораторию.
5. Хранение проб и условия доставки
5.1. Пробы следует упаковывать во влагонепроницаемую тару. Их нумеруют и с сопроводительными документами (акт отбора, направление) доставляют в лабораторию в контейнере в день отбора проб.
5.2. Пробы хранят до момента исследования в холодильнике (при температуре 2 - 4 °С не более 3 суток).
5.3. При необходимости хранения проб более 3-х суток их консервируют насыщенным раствором натрия хлорида или 3 % раствором формалина, содержащим 1 % натрия хлорида и другими методами, в том числе замораживанием образцов при температуре минус 10 °С.
6. Оборудование и материалы, реактивы
Оборудование:
1. Аппарат Бермана
2. Весы лабораторные общего назначения - ГОСТ 24104-80 (или весы электронные)
3. Измельчитель мышечной ткани
4. Компрессорий МИС - 7
5. Крючок для оттягивания мышц
6. Кюветы металлические
7. Ножницы Купера изогнутые
8. Мешалка магнитная
9. Микроскоп стереоскопический
10. Термостат электрический (ТСО - 1/80 СПУ)
11. Трихинеллоскоп проекционный
12. Центрифуга лабораторная медицинская ОС-6м с ротором РК4Х750
13. Центрифуга лабораторная клиническая "ЭЛЕКОН" - ЦЛМН-Р10-01
Лабораторная посуда и материалы:
1. Банки стеклянные с притертой крышкой (0,1; 0,25; 0,5 л)
2. Воронки стеклянные разных размеров - ГОСТ 25336-82
3. Груши резиновые разного объема
4. Маркер по стеклу и фарфору (70 мм) - ТУ 2389-007-03987647-97
5. Пробирки центрифужные градуированные - ПЦГ (10,0 мл) - ГОСТ 1770-64
6. Сито из мельничного газа № 13
7. Стаканы химические (0,5 - 1,0 л) - ГОСТ 10394-63
8. Стаканы центрифужные (250,0 мл)
9. Стекла предметные 25 × 75 мм - ГОСТ 9284-85
10. Стекла покровные 18×18,24×24 мм - ГОСТ 6672-85
11. Цилиндры мерные (0,25, 0,5; 1,0 л) - ГОСТ 1770-74
12. Чашки бактериологические (Петри) - ГОСТ 23932-90
13. Штативы лабораторные - ТУ 64-1-707-80
Реактивы:
1. Глицерин - ГОСТ 6259-75
2. Желчь медицинская
3. Калия гидроокись (КОН) - - ГОСТ 24363-80
4. Кислота молочная - ГОСТ 490-79
5. Кислота соляная (HCl) - ГОСТ 3118-77
6. Кислота уксусная ледяная - ГОСТ 61-75
7. Метиленовый синий сухой, хч - ТУ 2463-044-0501520
8. Натрия гидроокись (NaOH) - ГОСТ 4328-77
9. Пепсин свиной (активность 100000 ед.) ТУ 9219-964-00419779-2000
10. Спирт этиловый ректифицированный - ГОСТ 5962-67
11. Фуксин основной ТУ 6-09-4119-75
7. Методы паразитологического исследования мяса и мясопродуктов
7.1. Методы санитарно-паразитологического исследования мяса и мясо продукции на наличие личинок трихинелл
7.1.1. Метод компрессорной трихинеллоскопии
От каждой пробы мышц изогнутыми ножницами Купера следует делать 24 среза (по ходу мышечных волокон) величиной с овсяное зерно, стараясь брать пробу вблизи сухожилия. При расследовании вспышек трихинеллёза необходимо количество просматриваемых срезов увеличить до 72. Ножницы держат вогнутой стороной к мясу, срез остается на их выпуклой стороне. Срезы берут из разных мест и раскладывают в середине клеток нижнего стекла компрессория, накрывают верхним стеклом и, завинчивая винты, раздавливают срезы так, чтобы через них можно было читать газетный текст. Срезы просматривают под малым увеличением микроскопа или трихинеллоскопа (10×4; 10×10).
Для приготовления препарата из шпика требуется брать мышечные прослойки. Делают 24 среза от каждого куска, помещают в 10 %-й раствор фуксина в 5 %-м растворе едкого натра на 5 - 8 мин. и просматривают в компрессории. Трихинеллы могут локализоваться в подкожных жировых отложениях, в которых макроскопически не видно мышечных прослоек. Шпик без видимых мышечных прослоек разрезают на всю толщину и срезы берут с внутренней поверхности шпика по линии его расслоения (такие линии образуются в местах атрофированных мышц). Делают не менее 5 срезов толщиной около 0,5 мм и погружают в раствор, указанный выше. При микроскопическом исследовании на фоне неокрашенных жировых клеток резко выделяются трихинеллы в виде светло-красных или желто-красных включений. Оболочка трихинелл при этом ясно выражена.
При исследовании консервированной (мороженой, соленой) свинины ее сначала оттаивают. Толщина срезов не должна превышать 1,5 мм. После размещения срезов на нижнем стекле компрессория их слегка раздавливают верхним стеклом. Затем нижнее стекло снимают и на каждый срез наносят пипеткой каплю 0,5 %-ного раствора соляной кислоты или раствора метиленового синего (5 мл насыщенного спиртового раствора и 195 мл дистиллированной воды). Продолжительность обработки срезов - 1 мин. После этого вновь накладывают верхнее стекло и срезы исследуют в обычном порядке. Обработанные соляной кислотой мышечные срезы становятся прозрачными или сероватого цвета. Капсула имеет вид серебристого ободка, жидкость внутри полости трихинеллы - нежно-голубого цвета, личинка гельминта не окрашивается и становится хорошо видимой. Если мясо вследствие длительного хранения потеряло часть влаги, полость трихинеллы окрашивается в более темные тона, чем мышечные волокна.
Мышечные срезы из солонины делают в 2 раза тоньше, чем при трихинеллоскопии консервированной свинины. Их также следует слегка раздавить верхним стеклом компрессория, после чего на каждый срез наносят каплю глицерина, разведенного пополам с водой, или 5 %-ного раствора молочной кислоты (для просветления срезов). Время обработки и порядок исследования такие же, как и мороженой свинины.
Иногда встречаются обызвествленные капсулы, в которых личинки трудно рассмотреть. Для их просветления срезы мышц следует поместить в чашку Петри с 5 - 10 %-ным раствором соляной кислоты и поставить в термостат при 37 °С на 20 - 30 мин. Затем срезы мышц переносят в компрессорий и микроскопируют.
Для дифференциации обызвествленных трихинелл от обызвествленных саркоцист и конкрементов нетрихинеллезной природы проводят окраску срезов по методу П.Я. Ямщикова (цитируется по Житенко П.В., 1980)
Метод этот применим для исследования соленого и мороженого мяса. Срезы расплющивают между стеклами компрессория, затем снимают и погружают на 1 - 2 мин. в 1 %-ный раствор риванола (или камалы, акрихина, трипафлавина), приготовленного на 5 %-ном растворе едкого натрия. После этого срезы переносят на 1 - 2 мин. в сосуд с насыщенным раствором метиленового голубого (15 г на 100 мл 80 %-ной уксусной кислоты). Затем срезы тщательно промывают в горячей воде (80 - 90 °С), вновь раскладывают на стекле компрессория и исследуют. Если срезы оказались густо окрашенными, их еще раз промывают горячей водой. Мышечные волокна окрашиваются в желтоватый цвет, капсулы трихинелл - в ярко-зеленый, а трихинеллы - в синий цвет. Иногда трихинеллы не окрашиваются, но хорошо выделяются на цветном фоне мышечной ткани. Трихинеллы имеют тонкую оболочку, нетрихинеллезные конкременты окружены толстой волокнистой оболочкой. При подготовке к микроскопии для улучшения видимости мышечных трихинелл можно применять и окрашивание срезов из консервированной свинины.
Личинки трихинелл необходимо дифференцировать от саркоспоридий (саркоцисты) и цистицерков (финн). Для обработки срезов применяют 3 - 5 %-ный раствор едкого калия при экспозиции 3 - 5 мин. Известь саркоспоридий растворяется, капсула трихинеллы не растворяется.
Дифференциация основана на изучении морфологии возбудителя и строения капсулы.
|
Возбудитель |
Строение капсулы |
Размеры |
|
Трихинелла |
Капсула лимоновидная, внутри - спирально свернутая личинка |
0,2 - 0,6 мм |
|
Саркоциста |
Циста цилиндрическая или неправильной формы (вытянутая, веретенообразная, серповидная, округлая), состоит из многочисленных камер (ячеек), внутри которых находятся мерозоиты. Соединительнотканная капсула отсутствует |
0,05 - 3,0 мм |
|
Цистицерк |
Капсула овальная, внутри находится головка с крючьями и прозрачная жидкость |
0,5 - 0,8 см |
Молодые цистицерки (финны) в отличие от личинок трихинелл располагаются не в мышечных волокнах, а между ними. Финны чаще обнаруживаются в мышце сердца, тогда как трихинеллы в нем не выявляются.
7.1.2. Методы переваривания мышечной ткани в искусственном желудочном соке
Метод переваривания позволяет брать более значительную массу мышц (20 - 30 г фарша и более), что повышает чувствительность индикации до 0,1 личинки на 1 г мышечной ткани. Метод предназначен для исследования таких мясопродуктов, как колбаса, солонина, копчености, мороженое мясо, мясные полуфабрикаты, например, пельмени и другие продукты.
7.1.2.1. Классический метод переваривания мясного фарша (Березанцев Ю.А.)
Искусственный желудочный сок готовят согласно прописи: кислоты соляной концентрированной - 7 мл, пепсина свиного - 15 г, воды дистиллированной - 1000 мл. Пепсин добавляют в последнюю очередь. Желудочный сок наливают в стеклянный сосуд (стакан, банка), помещают туда фарш в соотношении 1:20 - 1:25 (40 - 50 г) и тщательно размешивают. Затем сосуд помещают в термостат при температуре 39 °С на 16 - 18 часов. За это время содержимое сосуда несколько раз тщательно перемешивают стеклянной палочкой или с помощью магнитной мешалки. После окончания переваривания всю массу выливают в аппарат Бермана на сито из мельничного газа № 13 или центрифугируют в стаканах или пробирках. Через 15 - 20 минут все личинки оседают на дне сосуда. Надосадочную жидкость отсасывают пипеткой с резиновой грушей, а осадок микроскопируют в чашках Петри с использованием бинокуляпных стереоскопических микроскопов.
7.1.2.2. Ускоренный метод переваривания мясного фарша (Владимирова П.А.).
Мышечную ткань весом не менее 10 г тщательно измельчают. Для приготовления желудочного сока используют 3 % пепсин и 1 % соляную кислоту (на 1 л дистиллированной воды 10 мл соляной кислоты и 30 г пепсина). Фарш помещают в сосуд с искусственным желудочным соком в соотношении 1:25 и выдерживают смесь в термостате при температуре 42 - 47 °С в течение 3,5 - 4 часов при периодическом помешивании или использовании магнитной мешалки. Для осаждения личинок после переваривания мышц используют стаканы емкостью 50 - 100 мл. После отстаивания жидкости в стакане или пробирке в течение 15 - 20 мин. ее осторожно сливают. Осадок помещают на предметное стекло или чашку Петри и исследуют под малым увеличением стереоскопических микроскопов.
На мясоперерабатывающих предприятиях, а также при инспекторском ветеринарном контроле импортной свинины и осуществлении широкомасштабных исследований рекомендуется применять метод группового исследования свинины аппаратами по выделению личинок трихинелл (АВТ, ГАСТРОС), основанный на переваривании образцов мышечной ткани в искусственном желудочном соке. Каждый из этих аппаратов представляет собой термостатирующую камеру с вмонтированными в нее реакторами (от одного в ГАСТРОС до 2 - в АВТ), предназначенными для ферментного растворения мышечной ткани в переваривающей жидкости. Реактор аппарата имеет мешалку с индивидуальным приводом от электродвигателя, отстойник для сбора осадка и звуковой таймер.
7.2. Методы санитарно-паразитологического исследования мяса на наличие цистицерков (финн)
7.2.1. Метод визуального исследования мышц на стандартных разрезах
Исследование следует начинать с головы, жевательных мышц и сердца. Голову животных исследуют следующим образом: прощупывают губы и язык, жевательные мышцы с каждой стороны разрезают пластами на всю ширину параллельно их поверхности (наружные - двумя разрезами, а внутренние - одним) и просматривают. При исследовании сердца вскрывают околосердечную сумку, осматривают состояние миокарда, разрезают по большой кривизне правый и левый отделы сердца, осматривают состояние эндокарда, производят 1 - 2 продольных и один несквозной поперечный разрез мышцы сердца. При обнаружении финн на разрезах мышц головы и сердца производят дополнительно по два параллельных разреза шейных мышц в выйной области, лопаточно-локтевых, спинных, тазовой конечности и диафрагмы. Для оттягивания мышц во время разрезов пользуются крючком - вилкой.
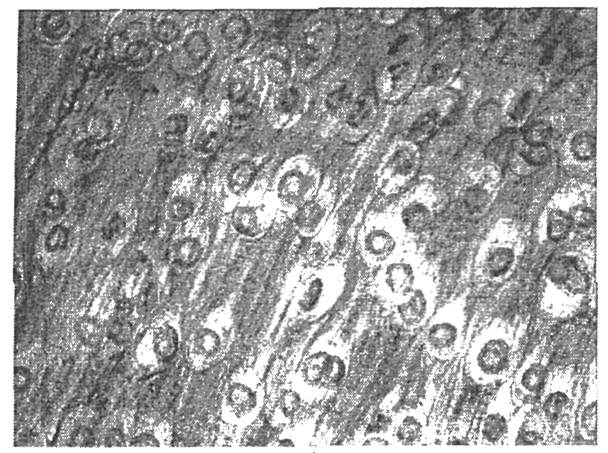
Рис. 1. Личинки Trichinella spiralis в мышечной ткани (Нагорный С.А., 2009 г.)
У северных оленей на наличие цистицерков осматривают головной мозг.
7.2.2. Метод микроскопического исследования мяса на наличие цистицерков (финн)
Полученный материал с пузырьками круглой или овальной формы серовато-белого цвета, содержащими прозрачную жидкость, следует тщательно осмотреть. При надавливании на пузырёк из него должна выворачиваться головка (сколекс). Далее проводят верификацию видовой принадлежности паразита, используя лупу или малое увеличение микроскопа (4×10; 10×10).
Сколекс цистицерка крупного рогатого скота (бовисного), являющегося причиной заражения людей тениаринхозом, имеет 4 сильноразвитые присоски, не вооруженные крючьями.
8. Учет результатов исследований
8.1. Учет результатов при исследовании мяса и мясопродуктов на наличие личинок трихинелл.
Инкапсулированные трихинеллы - это спиралеобразные свернутые паразиты, заключенные в полости, окруженные капсулой. Форма капсулы лимонообразная, бутылкообразная, овальная или круглая (рис. 1).
Полость заполнена прозрачной жидкостью, в ней помещается как правило, один паразит, реже два или три. Поперечный диаметр полости равен 0,2 мм, поэтому трихинеллы хорошо видны, если раздавленные мышцы рассматривать при малом увеличении.
Оценка. При обнаружении в 24 срезах компрессория или в осадке при переваривании проб мяса и мясопродуктов в искусственном желудочном соке хотя бы одной личинки трихинелл (капсульных и бескапсульных) независимо от ее жизнеспособности проба считается не соответствующей санитарно-гигиеническим нормативам. Мясо и мясопродукты при этом переводят в разряд "непригодной продукции"
Результаты санитарно-паразитологического исследования мяса и мясной продукции на наличие цистицерков и личинок трихинелл отражают в санитарно-эпидемиологическом заключении об исследовании образцов мяса, мясопродукции, составленном в соответствии с Приказом ФС Роспотребнадзора № 224 от 19.07.2007 г.
8.2. Учет результатов при исследовании мяса и мясопродукции на наличие цистицерков (финн) тениид.
Цистицерки бовисные (финны) представляют собой пузырьки круглой или овальной формы, серовато-белого цвета и величиной от булавочной головки до горошины (0,5 - 0,8 см), содержащие прозрачную жидкость (рис. 2.)
Рис. 2. Цистицерки в мышечной ткани (Антипин Д.Н., 1959)

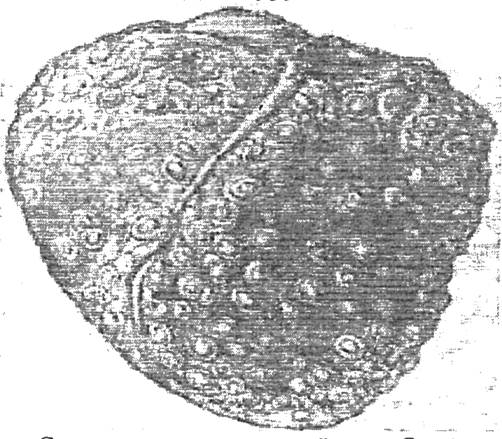
Рис. 3. Сердце свиньи, пораженное Cysticercus cellulosae (Антипин Д.Н, 1959)
Снаружи у них нежная соединительная капсула, сквозь которую просвечивает паразит. Головка и шейка его завернуты внутрь заполненного жидкостью овального пузырька. При надавливании на пузырек из него выворачивается головка (сколекс), при рассмотрении которой под лупой или малым увеличением микроскопа хорошо видны 4 сильноразвитых присосок, не вооруженные крючьями.
Цистицерк целлюлозный (свиной) - полупрозрачный пузырек шарообразной или овальной формы размером 0,5 - 0,8 см. (рис. 3). Внутрь пузырька вогнут сколекс, просвечивающийся в виде белой точки. Исследуя сколекс финны при малом увеличении микроскопа, обнаруживают ротовую щель (ботрикс), четыре присоски и хитиновые крючья (28 - 32), расположенные в два ряда.
При обнаружении финн (цистицерков) необходимо произвести подсчет их количества. При количественном содержании обнаруженных финн до трех хотя бы на одном из разрезов площадью 40 см2 мясо и мясопродукты переводят в разряд "условно годной" продукции. Обнаружение более трех финн хотя бы на одном из разрезов площадью 40 см2 - в разряд "непригодной".
Определение жизнеспособности выявленных цистицерков (при необходимости).
Цистицерки максимально очищают от мышечной ткани и помещают в разбавленную физиологическим раствором желчь крупного рогатого скота в соотношении 1:1. Выдерживают в термостате при температуре 37 - 38 °С на протяжении 30 - 90 минут. Жизнеспособные цистицерки выворачивают наружу сколекс и проявляют подвижность.
9. Санитарно-эпидемиологическая оценка безопасности исследованной продукции
Интерпретацию результатов и санитарно-эпидемиологическую экспертизу безопасности продукции проводят в соответствии с СанПиН 3.2.1333-03 "Профилактика паразитарных заболеваний на территории Российской Федерации", МУ 3.2.1756-03 "Эпидемиологический надзор за паразитарными болезнями".
10. Меры безопасности
Исследования при проведении работ по санитарно-паразитологической экспертизе мяса и мясопродуктов осуществляют строго в соответствии с действующими санитарными правилами (СП 1.3.2322-08 "Безопасность работы с микроорганизмами III - IV групп патогенности и возбудителями паразитарных болезней"), а также дополнениями и изменениями к ним.
11. Библиографические данные
1. Антонов Б.И. Лабораторные исследования в ветеринарии. - М., 1987. - 239 с.
2. Березанцев Ю.А. Простой способ исследования мышц на трихинеллез методом переваривания в искусственном желудочном соке//Лабораторное дело. - 1960. - № 6. - С. 7 - 8.
3. Бессонов А.С. Диагностика трихинеллеза. Часть вторая. - Вильнюс, Минтис, 1975. - 381 с.
4. Большой энциклопедический словарь "Ветеринария" - М., 1998. - 638 с.
5. Бритов В.А. Возбудители трихинеллеза. - М, Наука, 1982. - 271 с.
6. Владимирова П.А. Ускоренный метод диагностики трихинеллеза//Ветеринария. - 1965. - № 10. - С. 95 - 96.
7. Ветеринарное законодательство. - М., 1988. - Т. 1V. - 162 с.
8. Ветеринарное законодательство. - М, 2000. - Т. 1. - 384 с.
9. "Методические указания по лабораторной диагностике трихинеллеза животных" № 13-7-2/1428, утв. Департаментом ветеринарии Минсельхозпрода 28.10.1998.
10. Методические указания 3.2.1756-03 "Эпидемиологический надзор за паразитарными болезнями". - М., 2005. - 82 с.
11. СанПиН 3.2.1333-03 "Профилактика паразитарных болезней на территории Российской Федерации". - М., 2003. - 67 с.
12. Сергиев В.П., Лобзин Ю.В., Козлов С.С. Паразитарные болезни человека (протозоозы и гельминтозы). - Санкт-Петербург, 2008. - 586 с.