| Информационная система |  |
Федеральная
служба по надзору в сфере защиты прав потребителей
и благополучия человека
Метициллинрезистентные
Staphylococcus aureus – возбудители
внутрибольничных инфекций:
идентификация и генотипирование
Методические рекомендации
Москва 2006
Метициллинрезистентные Staphylococcus aureus - возбудители внутрибольничных инфекций: идентификация и генотипирование: Методические рекомендации - М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2006. - 43 с.
Разработаны: Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Г.Ф. Лазикова, А.А. Мельникова, Н.В. Фролова); Государственным учреждением «Научно-исследовательский институт микробиологии и эпидемиологии им. Н.Ф. Гамалеи РАМН» г. Москва (О.А. Дмитренко, В.Я. Прохоров, академик РАМН А.Л. Гинцбург).
СОДЕРЖАНИЕ
УТВЕРЖДАЮ
Заместитель
Руководителя Федеральной службы
по надзору в сфере защиты прав
потребителей и благополучия человека
Л.П. Гульченко
23 июля 2006 г.
Метициллинрезистентные Staphylococcus aureus
- возбудители внутрибольничных инфекций:
идентификация и генотипирование
Методические рекомендации
1. Область применения
1.1. В настоящих методических указаниях представлена информация о роли метициллинрезистентных штаммов золотистого стафилококка в возникновении внутрибольничных инфекций, их микробиологических и эпидемиологических особенностях, изложены традиционные и молекулярно-генетические методы идентификации и типирования.
1.2. Методические рекомендации разработаны в помощь специалистам органов и учреждений, осуществляющих государственный санитарно-эпидемиологический надзор, и лечебно-профилактических учреждений, осуществляющих организацию и проведение профилактических и противоэпидемических мероприятий по борьбе с внутрибольничными инфекциями.
2. Нормативные ссылки
2.1. Федеральный закон «О санитарно-эпидемиологическом благополучии населения» № 52-ФЗ от 30 марта 1999 г. (с изменениями от 30 декабря 2001 г., 10 января, 30 июня 2003 г., 22 августа 2004 г.)
2.2. Положение о государственной санитарно-эпидемиологической службе Российской Федерации, утвержденное постановлением Правительства Российской Федерации № 554 от 24 июля 2000 г.
2.3. Постановление № 3 от 05.10.2004 г. «О состоянии заболеваемости внутрибольничными инфекционными болезнями и мерах по их снижению».
2.4. Методические указания МУ 3.5.5.1034-01 «Обеззараживание исследуемого материала, инфицированного бактериями I-IV групп патогенности, при работе методом ПНР».
2.5. Методические указания МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам».
2.6. Методические указания по эпидемиологическому надзору за внутрибольничными инфекциями от 02.09.87. № 28-6/34.
3. Общие сведения
В последнее десятилетие проблема внутрибольничных инфекций (ВБИ) приобрела исключительно большое значение для всех стран мира. Это обусловлено, прежде всего, значительным ростом числа госпитальных штаммов микроорганизмов, обладающих устойчивостью к широкому кругу антимикробных препаратов. Несмотря на значительный недоучет, в Российской Федерации ежегодно регистрируется около 30 тыс. случаев внутрибольничных инфекций, при этом минимальный экономический ущерб составляет более 5 млрд. рублей ежегодно. Среди возбудителей ВБИ одно из первых мест, по-прежнему, принадлежит микроорганизмам рода Staphylococcus, наиболее патогенным представителем которого является S.aureus. Эпидемиологическая ситуация осложняется в связи с широким распространением в стационарах, а также появлением и во внебольничной среде, клинических изолятов S.aureus, устойчивых к оксациллину (ORSA или MRSA). MRSA способны вызывать разнообразные клинические формы внутрибольничных инфекций, включая наиболее тяжелые, такие как: бактериемия, пневмония, синдром септического шока, септический артрит, остеомиелит и другие, которые требуют длительного и дорогостоящего лечения. Появление осложнений, вызванных MRSA, приводит к увеличению сроков госпитализации, показателей летальности, значительным экономическим потерям. Показано, что рост частоты ВБИ, наблюдаемый в стационарах различных стран мира, обусловлен распространением эпидемических штаммов MRSA, многие из которых способны вырабатывать пирогенные токсины - суперантигены, подавляющие иммунный ответ на S.aureus.
С конца 90-х годов прошлого века в стационарах России отмечается рост частоты выделения MRSA, которая в ряде больниц достигла 30 - 70 %. Это делает неэффективным использование многих антимикробных препаратов и существенно ухудшает качество оказания медицинской помощи населению. В этих условиях совершенствование методов эпидемиологического и микробиологического мониторингов, направленных на выявление эпидемически значимых штаммов, приобретает все более актуальное значение.
4. Характеристика MRSA как возбудителей внутрибольничных инфекций
4.1. Таксономия и биологические особенности
В последние годы отчетливо прослеживается тенденция роста ВБИ, вызванных условно-патогенными грамположительными микроорганизмами и, в частности, представителями рода Staphylococcus. Согласно 9 изданию «Определителя бактерий Берджи» (1997) стафилококки отнесены к группе грамположительных факультативно анаэробных кокков вместе с родами Aerococcus, Enterococcus, Gemella, Lactococcus, Leuconostoc, Melissococcus, Pediococcus, Saccharococcus, Stomatococcus, Streptococcus, Trichococcus и Vagococcus. От других представителей этой группы стафилококков отличает совокупность свойств, включающая характерное, в виде виноградной грозди, взаиморасположение микробных клеток в культуре, способность к росту в температурном интервале от 6,5 до 45 °С, при рН среды в пределах 4,2 - 9,3, в присутствии повышенных концентраций NaCl (до 15 %) и 40 % желчи. Стафилококки обладают выраженной биохимической активностью. Они каталазоположительные, восстанавливают нитрат до нитрита или газообразного азота, гидролизуют белки, гиппурат, жиры, твины, расщепляют большое число углеводов в аэробных условиях с образованием уксусной кислоты и незначительных количеств СО2, однако эскулин и крахмал, как правило, не гидролизуют, индол не образуют. При культивировании в аэробных условиях они нуждаются в аминокислотах и витаминах, в анаэробных - требуют дополнительно урацил и ферментируемые источники углерода. Клеточная стенка содержит два главных компонента - пептидогликан и связанные с ним тейхоевые кислоты. В состав пептидогликана входят гликан, построенный из повторяющихся единиц: остатков N-ацетилглюкозамина и N-ацетилмурамовой кислоты, к последней в свою очередь присоединены пептидные субъединицы, состоящие из остатков Na (L-аланин-D-изоглутамил) -L-лизил-D-аланина. Пептидные субъединицы сшиты пентапептидными мостиками, состоящими исключительно или главным образом из глицина. В отличие от других грамположительных факультативно анаэробных кокков стафилококки чувствительны к действию лизостафина - эндопептидазы, гидролизующей глицил-глициновые связи в межпептидных мостиках пептидогликана, но устойчивы к действию лизоцима. Содержание гуанидина + цитозина в структуре ДНК Staphylococcus на уровне 30 - 39 % свидетельствует о филогенетической близости к родам Enterococcus, Bacillus, Listeria и Planococcus. Род Staphylococcus насчитывает 29 видов, наиболее патогенным среди них как для человека, так и для многих млекопитающих, является вид Staphylococcus aureus. Это объясняется способностью представителей данного вида продуцировать большое количество экстрацеллюлярных продуктов, к числу которых относятся многочисленные токсины и ферменты, участвующие в колонизации и развитии инфекционного процесса. Почти все штаммы секретируют группу экзопротеинов и цитотоксинов, которая включает 4 гемолизина (альфа, бета, гамма и дельта), нуклеазы, протеазы, липазы, гиалуронидазы и коллагеназы. Основная функция этих ферментов состоит в превращении тканей хозяина в питательный субстрат, необходимый для размножения микроба. Некоторые штаммы продуцируют один или несколько дополнительных экзопротеинов, к их числу относятся токсин синдрома токсического шока, стафилококковые энтеротоксины (А, В, Cn, D, E, G, Н, I) эксфолиативные токсины (ЕТА и ЕТВ), лейкоцидин. Наиболее известной таксономически значимой характеристикой S.aureus является способность коагулировать плазму крови, которая обусловлена продукцией внеклеточно секретируемого протеина с молекулярной массой около 44 kDa. Путем взаимодействия с протромбином плазмокоагулаза активирует процесс превращения фибриногена в фибрин. Образовавшийся сгусток защищает микробные клетки от действия бактерицидных факторов макроорганизма и обеспечивает благоприятную среду для их размножения. Впоследствии в результате растворения фибринового сгустка размножившиеся микроорганизмы поступают в кровяное русло, что может приводить к развитию генерализованных форм инфекции. В 8-ом издании «Руководства Берджи по определению бактерий» (1974) стафилококки характеризовались как микроорганизмы обычно чувствительные к антибиотикам, таким, как b-лактамовые, макролиды, тетрациклины, новобиоцин и хлорамфеникол, обладающие устойчивостью к полимиксину и полиенам. Это положение было опровергнуто широким распространением сначала пенициллинустойчивых, а впоследствии метициллинрезистентных штаммов. Устойчивый к действию стафилококковой b-лактамазы первый полусинтетический пенициллин - метициллин предназначался для лечения инфекций, вызванных пенициллинрезистентными штаммами. Однако менее чем через два года после его введения в лечебную практику в 1961 г. появились первые сообщения о выделении метициллинрезистетных штаммов золотистого стафилококка (MRSA). Они стали проблемой для специалистов только к середине 70-х - началу 80-х годов прошлого века, когда стало очевидным, что обладая всеми характерными морфологическими, культуральными, физиологическими и биохимическими свойствами, характерными для золотистого стафилококка, MRSA имеют свои биологические особенности. Во-первых, уникальный биохимический механизм резистентности к метициллину обеспечивает им устойчивость ко всем полусинтетическим пенициллинам и цефалоспоринам. Во-вторых, такие штаммы способны «аккумулировать» гены антибиотикорезистентности и поэтому не редко обладают устойчивостью к нескольким классам антимикробных препаратов одновременно, тем самым значительно затрудняя лечение пациентов. И, наконец, в третьих, такие штаммы способны к эпидемическому распространению, вызывают тяжелые формы внутрибольничных инфекций. Несмотря на то, что в последующие годы метициллин был заменен на оксациллин или диклоксациллин, термин MRSA прочно закрепился в научной литературе.
4.2. Клиническое значение
В настоящее время MRSA являются ведущими возбудителями внутрибольничных инфекций в стационарах многих странах мира. Частота их выделения в стационарах США, Японии, многих стран Западной Европы достигает 40 - 70 %. Исключение составляют, по-видимому, только ряд скандинавских стран, где исторически были приняты жесткие противоэпидемические меры по контролю за распространением таких штаммов. В стационарах Российской Федерации частота выделения MRSA колеблется от 0 до 89 %. Наибольшая частота выделения отмечается в реанимационных, ожоговых, травматологических и хирургических отделениях стационаров, расположенных в крупных городах. Одной из основных причин этой закономерности является концентрация в таких стационарах пациентов с нарушениями целостности кожных покровов и поврежденными иммунологическими барьерами. Наиболее частым местом локализации инфекции являются послеоперационные и ожоговые раны и дыхательные пути. Первичные и вторичные бактериемии наблюдаются примерно у 20 % инфицированных больных. В случае инфицирования ожоговых больных частота бактериемии нередко возрастает до 50 %. Факторами, способствующими развитию бактериемии, является присутствие центрального венозного катетера, анемия, гипотермия и назальное носительство. Развитие бактериемии значительно увеличивает вероятность летального исхода. Особенно высокая смертность, обусловленная бактериемией, наблюдается среди пациентов, находящихся в ожоговых и отделениях интенсивной терапии, где она может достигать 50 % по сравнению с 15 % в контрольной группе. Риск развития летального исхода возрастает почти в три раза среди пациентов, у которых бактериемия обусловлена MRSA по сравнению с пациентами, инфицированными метициллинчувствительными штаммами S.aureus. Развитие госпитальной бактериемии приводит к значительному увеличению стоимости госпитализации. В современных условиях лечение таких пациентов требует, как правило, внутривенного введения ванкомицина, тейкопланина или линезолида, однако клиническая эффективность этих препаратов нередко оказывается значительно ниже, чем у антибиотиков, используемых для лечения пациентов с осложнениями, вызванными метициллинчувствительными S.aureus. По данным Центра по контролю за заболеваниями (США) средняя продолжительность пребывания пациента в больнице в случае хирургического вмешательства составляет 6,1 дня, тогда как при возникновении осложнений, вызванных MRSA она увеличивается до 29,1 дней, при этом средние расходы возрастают с 29455$ до 92363$ в пересчете на каждый случай. Заболевания, вызванные MRSA, могут начинаться на фоне терапии антибиотиками, в том числе аминогликозидами и цефалоспоринами. В этой связи необходимо отметить, что неадекватное назначение антибиотиков в случае тяжелых ВБИ драматически ухудшает прогноз заболевания. Летальность при осложнениях, вызванных MRSA, значительно колеблется и зависит как от возраста пациента, сопутствующего заболевания (артериальная гипертензия, диабет и др.), так и от присоединения дополнительной микрофлоры. Наиболее распространенными вторичными проявлениями инфекции, обусловленной MRSA, являются эндокардиты, гематогенный остеомиелит, септический артрит. Одним из наиболее грозных осложнений, вызываемых MRSA, является синдром токсического шока (СТШ). Клинические проявления СТШ включают следующий симптомокомплекс: гипертермия, сыпь, рвота, диарея, гипотензия, генерализованный отек, острый респираторный дистресс синдром, полиорганная недостаточность, диссеминированная интраваскулярная коагуляция. СТШ может развиться как осложнение после родов, хирургических вмешательств, при суперинфицировании S.aureus трахеальных повреждений, вызванных вирусом гриппа. Недавно описанные стафилококковая скарлатина и синдром упорной десквамации эпителия рассматривают как варианты СТШ.
4.3. Факторы патогенности и вирулентность
Многие эпидемические штаммы MRSA продуцируют пирогенные токсины, обладающие суперантигенной активностью (PTSAgs), к числу которых принадлежат энтеротоксины А, В, С и токсин синдрома токсического шока (TSST-1). Взаимодействуя с вариабельной областью b-цепи рецепторов Т-клеток PTSAgs активируют значительную популяцию (10 - 50 %) Т-лимфоцитов, что приводит к выбросу большого количества цитокинов. Суперантигены способны разрушать эндотелиальные клетки и могут элиминировать нейтрофилы из очагов воспаления. Они являются причиной или осложняют патогенез острых и хронических заболеваний человека таких, как септический шок, сепсис, септические артриты, гломерулонефрит, и некоторых других. Неменструальный синдром токсического шока может быть ассоциирован не только со штаммами-продуцентами TSST-1, но и со штаммами, продуцирующими энтеротоксины А, В и С. Следует иметь ввиду, что распознавание постхирургического токсического шока нередко бывает затруднено вследствие отсутствия характерных для золотистого стафилококка признаков нагноения в области хирургической раны. Отмечена корреляция между сенсибилизацией стафилококковыми энтеротоксинами А и В и тяжестью течения таких заболеваний, как аллергический ринит, атопический дерматит, бронхиальная астма, реактивные артриты. Гены, детерминирующие синтез PTSAgs, могут находиться на мобильных генетических элементах (бактериофагах «островах патогенности») в составе хромосомы MRSA.
Вопрос о вирулентности MRSA остается дискутабельным. Они практически не вызывают заболевания у здоровых лиц из числа медицинского персонала. Вместе с тем, в многочисленных исследованиях показано, что прогноз при тяжелых формах внутрибольничных инфекций, таких как пневмония и бактериемия, значительно хуже среди пациентов, инфицированных MRSA, по сравнению с пациентами, инфицированными метициллинчувствительными S.aureus.
4.4. Генетический контроль устойчивости к метициллину и особенности фенотипической экспрессии
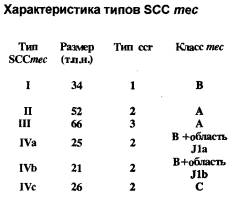
Мишенью действия b-лактамных антибиотиков (как пенициллинов, так и цефалоспоринов) являются транс- и карбоксипептидазы - ферменты, участвующие в биосинтезе основного компонента клеточной стенки микроорганизмов - пептидогликана. Благодаря своей способности связываться с пенициллином и другими b-лактамами данные ферменты получили название пенициллинсвязывающих белков (ПСБ). У Staphylococcus aureus имеются 4 ПСБ, отличающиеся как по молекулярной массе, так и по функциональной активности. Устойчивость метициллинрезистентных штаммов золотистого стафилококка (MRSA) к b-лактамным антибиотикам обусловлена продукцией дополнительного пенициллинсвязывающего протеина - ПСБ-2¢, отсутствующего у чувствительных микроорганизмов. При подавлении В -лактамным антибиотиком активности основных пенициллинсвязывающих белков ПСБ-2¢, в силу своего более низкого сродства к препаратам данной группы, продолжает функционировать и сохраняет микробной клетке жизнеспособность. Синтез ПСБ-2¢ кодируется геном mecA, расположенным на хромосоме S.aureus, в специфической области, обнаруживаемой только у метициллинрезистетных штаммов стафилококка - тес ДНК. Меc ДНК представляет новый класс мобильных генетических элементов, который получил название стафилококковая хромосомная кассета тес (Staphylococcal chromosomal cassette тес = SCCmec). Выявлено существование 4 типов SCCmec, различающихся как размерами (от 21 до 66 т.п.н.), так и набором генов, составляющих данные кассеты. Разделение на типы основано на различиях в генах, образующих собственно комлекс тес, и в наборе генов, кодирующих рекомбиназы ссrА и ссrВ, входящих в различных сочетаниях в стафилококковую хромосомную кассету (рис. 1). Комлекс тес может включать: тесА - структурный ген, детерминирующий синтез ПСБ-2¢; mecI - регуляторный ген, влияющий на транскрипцию тесА; mecR1 - ген, передающий внутрь клетки сигнал о наличии в среде b-лактамного антибиотика; а также инсерционные последовательности IS431 и IS1272. В настоящее время известны 4 варианта комплекса тес (рис. 2).
Кроме того, различия между типами кассет тес обусловлены присутствием ряда дополнительных генов, расположенных в генетических областях J1а, J1b.
Рис. 1. Типы SCCmec.
Генетическая структура комплексов тес различных классов
• Класс A, IS431 - mecA-mecR1-mec1
• Класс В, IS431 - mecA-DmecR1-IS1272
• Класс С, IS431 - mecA-DmecR1-IS431
• Класс D, IS431 - mecA-DmecR1
Рис. 2. тесА - структурный ген, детерминирующий синтез ПСБ-2¢;
mecI - регуляторный ген, влияющий на транскрипцию тесА;
mecR1 - ген, передающий внутрь клетки сигнал о наличии в среде b-лактамного антибиотика; IS431 и IS1272 - инсерционные последовательности
Уникальность метициллинрезистентности заключается также и в существовании феномена гетерорезистентности, суть которого состоит в том, что в условиях инкубации при 37 °С не все клетки популяции проявляют устойчивость к оксациллину. Генетический контроль феномена гетерорезистентности до настоящего времени полностью не выяснен. Известно только, что на экспрессию устойчивости могут влиять регуляторные гены b-лактамазы, а также ряд дополнительных генов, так называемые fem (factors essential for methicillin resistance) или aux, локализованные в различных частях хромосомы S.aureus, вне SCCmec. Сложность регуляции проявляется в фенотипических различиях. Выделяют 4 стабильных фенотипа (класса) резистентности. Первые три класса являются гетерогенными. Это означает, что в популяциях стафилококков, относящихся к этим классам, присутствуют субпопуляции микробных клеток с разным уровнем резистентности. При этом клоны стафилококков, получаемые из изолированных колоний (образовавшихся при рассеве первичной культуры) по популяционному составу полностью совпадают с исходной культурой.
Класс 1. Рост 99,99 % клеток подавляется оксациллином в концентрации 1,5 - 2 мкг/мл, рост 0,01 % микробов подавляется только при 25,0 мкг/мл.
Класс 2. Рост 99,9 % клеток подавляется при концентрации оксациллина 6,0 - 12,0 мкг/мл, тогда как рост 0,1 % микробов подавляется при концентрации > 25,0 мкг/мл.
Класс 3. Рост 99,0 - 99,9 % клеток подавляется при концентрации 50,0 - 200,0 мкг/мл и только рост 0,1 - 1 % микробной популяции подавляется при концентрации оксациллина 400,0 мкг/мл.
Класс 4. Представители этого класса характеризуются гомогенным уровнем устойчивости, который превышает 400,0 мкг/мл для всей популяции.
В связи с наличием гетерогенности по устойчивости к оксациллину могут возникать трудности при идентификации MRSA традиционными микробиологическими методами.
4.5. Особенности эпидемиологии MRSA
С помощью различных молекулярно-генетических методов типирования установлено, что глобальное распространение MRSA носит эпидемический характер. В отличие от метициллинчувствительных S.aureus, подавляющее большинство клинических изолятов MRSA принадлежат к ограниченному числу генетических линий или клонов. Выявленные в разных стационарах различными группами исследователей они первоначально получили и разные названия (табл. 1). Так, эпидемические штаммы EMRSA-1 - EMRSA-16 были впервые идентифицированы английскими исследователями, а эпидемические клоны: Иберийский, Бразильский, Японо-Американский, педиатрический - группой американских исследователей под руководством G. de Lencastre. Следует иметь в виду, что четкой градации между понятиями эпидемический штамм и эпидемический клон не существует. Согласно обычно используемой терминологии, эпидемическим считается штамм, вызвавший три и более случая заболеваний среди пациентов нескольких стационаров. Эпидемический клон - это эпидемический штамм, распространившийся в стационарах стран различных континентов. Вместе с тем, многие из первоначально идентифицированных в Великобритании эпидемических штаммов стали фактически эпидемическими клонами в силу своего широкого географического распространения. Использование для типирования метода секвенирования внутренних фрагментов 7 «housekeeping» генов, т.е. генов, ответственных за поддержание жизнедеятельности микробной клетки (метод мультилокусного секвенирования), позволило установить принадлежность этих многочисленных клонов всего лишь к 5 филогенетическим линиям или клональным комплексам: СС5, СС8, СС22, СС30, СС45. Внутри клональных комплексов возможно подразделение на группы или сиквенс-типы, которые различаются 1 - 3 мутациями или рекомбинациями в структуре секвенированных генов. Установлена довольно жесткая взаимосвязь между принадлежностью MRSA к определенному генетическому «бэкграунду» и содержанием определенного типа тес ДНК. Наиболее диверсифицированными и многочисленными являются клональные комлексы СС5 и СС8, которые содержат эпидемические клоны с различными типами SCCmec. В то же время SCCmec типа IV может присутствовать в различных «бэкграундах». Особенно многочисленной является группа St239, которая представляет отдельную ветвь внутри клонального комплекса СС8. Эта группа включает различные эпидемические штаммы и клоны: EMRSA-1, -4, -7, -9, -11, Бразильский, Португальский (табл. 1). В настоящее время в стационарах России выявлено эпидемическое распространение штаммов MRS А генетически родственных EMRSA-1 (Бразильскому клону) и Иберийскому клону.
Будучи однажды занесенными в стационар, MRSА могут выживать там в течение длительного времени. Это определяет стратегию противоэпидемических мероприятий: очень важно не допустить занос и распространение в стационаре эпидемических штаммов.
Следует отметить, что периодически происходит смена эпидемического штамма, доминирующего на отдельных территориях. Так, по данным стафилококковой референс-лаборатории в Colindale (London), в 1996 г. штаммы EMRSA-15 и EMRSA-16 были ответственны за более чем 1500 инцидентов, охвативших трех и более пациентов, в 309 больницах Англии, тогда как остальные эпидемические штаммы были ответственны только за 361 инцидент в 93 больницах. Распространение этих эпидемических штаммов привело к росту смертности от MRSA в 15, а частоты бактериемии в 24 раза за период с 1993 по 2002 г.г. согласно данным национального департамента статистики Великобритании.
Продолжает нарастать спектр антибиоткорезистентности эпидемических штаммов MRSA. Они гораздо быстрее, чем метициллинчувствительные, приобретают устойчивость к препаратам из группы фторхинолонов. Характерной чертой многих эпидемических штаммов MRSA является устойчивость практически ко всем известным классам антимикробных препаратов, за исключением гликопептидов и оксазолидинонов. В последние годы участились случаи выделения изолятов MRSA, обладающих умеренной чувствительностью к ванкомицину и даже ванкомицинрезистентных. Распространение таких штаммов в стационарах России может иметь драматические последствия.
С проблемой госпитальных штаммов MRSA тесно переплетается и проблема MRSA вне госпитального происхождения. Эти штаммы пока не обладают множественной резистентностью к антибиотикам, генетически отличаются от госпитальных штаммов, их происхождение остается неизвестным. Предполагается, что они сформировались из спорадических госпитальных штаммов. Внегоспитальные штаммы MRSA способны вызывать некротизирующую форму пневмонии, характеризующуюся крайне тяжелым течением и требующей госпитализации пациента, в связи с чем возникает угроза заноса и распространения таких штаммов в стационарах.
Основные эпидемические штаммы и клоны MRSA
|
Эпидемические штаммы, идентифицированные в CPHL* (г. Лондон) |
Молекулярно-генетические характеристики |
Международные клоны, идентифицированные в LMMRU** (г. Нью-Йорк) |
Страна распространения |
||
|
Клональный комплекс |
Сиквенс тип |
Тип SCCmec |
|||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
EMRSA-1, -4, -11 |
СС8 |
239 |
III |
Португальский, Бразильский |
Великобритания, США Финляндия, Германия, Польша, Швеция, Греция, Словения |
|
EMRSA-2, -6, -12, -13, -14 |
СС8 |
8 |
IV |
- |
Великобритания, США Германия, Франция, Нидерланды |
|
EMRSA-5, -17 |
СС8 |
247 |
I |
Иберийский |
Великобритания, США, Финляндия, Германия, Португалия, Швеция, Словения |
|
EMRSA-3 |
СС5 |
5 |
I |
- |
Великобритания, США |
|
|
СС5 |
5 |
II |
Японо-Американский |
Великобритания, США, Япония, Финляндия, Ирландия |
|
|
СС5 |
5 |
IV |
Педиатрический |
Великобритания, США, Португалия, Франция, Польша |
|
EMRSA-15 |
СС22 |
22 |
IV |
|
Великобритания, Германия, Швеция, Ирландия |
|
EMRSA-16 |
СС30 |
36 |
II |
- |
Великобритания, США, Финляндия |
|
|
СС45 |
45 |
IV |
- |
Германия, Финляндия, Швеция, Бельгия |
|
Примечание:* - Центральная лаборатория здравоохранения; ** - Лаборатория молекулярной микробиологии Рокфеллеровского университета. |
|||||
Резервуары и источники инфекции.
Основным резервуаром и источником инфекции в госпитальной среде являются как инфицированные, так и колонизованные пациенты. Факторами, способствующими инфицированию пациентов MRSA, являются: длительное пребывание в стационаре, неправильное назначение антибиотиков, прием более одного антибиотика, продолжительность антибиотикотерапии более 20 дней. При подозрении на развитие инфекции необходимо проведение микробиологического исследования отделяемого раны, кожных поражений, мест манипуляций, интравенозного катетера, трахеостомы и других видов стом, крови, мокроты, а также мочи у катетеризованных пациентов. В случае возникновения колитов или энтероколитов, ассоциированных с приемом антибиотиков, необходимо проводить исследование кала.
Колонизованными у пациента могут быть следующие эпитопы: передние отделы слизистой оболочки полости носа (наиболее часто колонизуемый эпитоп), слизистая оболочка глотки, область промежности, пупочное кольцо, влагалище, разнообразные кожные поражения. Колонизация пациента MRSA в 30 - 60 % случаев приводит к развитию инфекции. При соблюдении в надлежащем объеме профилактических санитарно-противоэпидемических мероприятий, наличие микроорганизмов в моче или кале менее значимо для распространения инфекции в окружающей среде лечебного учреждения.
Источниками MRSA в стационаре могут являться и медицинские работники, среди которых также наблюдается носительство на слизистой оболочке полости носа.
В целях профилактики случаев заноса рекомендуется проводить бактериологическое обследование на носительство MRSA при поступлении в стационар:
• пациентов, поступающих из других стационаров;
• пациентов, у которых в анамнезе была госпитализация в предыдущие 6 месяцев;
• пациентов из закрытых коллективов;
• пациентов с тяжелым течением пневмонии;
а также медицинских работников, поступающих на работу в отделения интенсивной терапии, хирургические, травматологические, ожоговые и родовспомогательные отделения.
Пациенты с подтвержденной инфекцией любой локализации, вызванной метициллин (оксациллин) - резистентным золотистым стафилококком, подлежат изоляции в отдельную палату. При входе в палату персонал надевает специально выделенный халат, маску, перчатки. После осмотра и проведения манипуляций такому пациенту персонал обрабатывает руки антисептиком. Перевязка пациента проводится в палате.
Механизм передачи инфекции.
В стационаре могут реализовываться несколько путей передачи инфекции:
• воздушно-капельный или воздушно-пылевой;
• контактно-бытовой (при непосредственном контакте с инфицированным или колонизованным пациентом, инфицированным бельем, медицинским инструментарием, аппаратурой, через предметы окружающей среды, и, главным образом, через руки медицинского персонала);
• артифициальный (при введении инфицированных лекарственных средств, использовании инфицированного шовного материала, введении протезов).
Основными факторами передачи MRSA служат воздух и руки медицинского персонала.
5. Лабораторные методы идентификации и типирования MRSA
Лабораторные методы можно подразделить на фено- и генотипические.
С помощью фенотипических методов изучаются характеристики экспрессируемые микроорганизмами. Среди фенотипических методов для исследования MRSA используют определение антибиотико- и фагочувствительности. Генотипические методы представляют методы исследования структуры ДНК.
Основанием для проведения исследований служат данные клинического мониторинга за ВБИ, эпидемиологического мониторинга за уровнем ВБИ, вызванных S.aureus, так и данные микробиологического мониторинга, отражающие антибиотикочувствительность клинических изолятов.
5.1. Фенотипические методы
Определение чувствительности к оксациллину
Согласно методическим указаниям 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам» идентификация MRSA проводится:
А) диско-диффузионным методом с использованием дисков, содержащих 1 мкг/мл оксациллина;
Б) с помощью скрининг-теста на агаре Мюллера-Хинтона, содержащего 4 % NaCl и 6,0 мкг/мл оксациллина.
Следует учитывать, что оба метода имеют свои недостатки. В первом случае к категории метициллинрезистентных штаммов могут быть ошибочно отнесены клинические изоляты с гиперпродукцией b-лактамазы, т.е. стафилококки с пограничным уровнем резистентности (borderline oxacillin- resistant S.aureus - BORSA, МПК оксациллина для которых колеблется в пределах 1,0 - 2,0 мкг/мл). Во втором - возникают трудности при идентификации MRSA, относящихся к первому классу по фенотипу гетерорезистентности. Ошибки при выявлении MRSA могут приводить как к неправильной тактике лечения пациентов, так и неверной оценке тяжести эпидемиологической ситуации.
Идентификация метициллинрезистентности возможна также путем определения продукции ПСБ-2¢ методом латекс-агглютинации с помощью готовых тест-систем, разрешенных к применению для этих целей в Российской Федерации в установленном порядке согласно инструкции производителя. В случае получения сомнительных результатов при использовании и этого метода необходимо прямое определение гена mecА, используя полимеразную цепную реакцию, являющуюся «золотым стандартом» для идентификации MRSA.
Идентифицированные как MRSA клинические изоляты в дальнейшем подлежат типированию с целью выявления источника (ов) инфекции в стационаре.
Фаготипирование.
Более 40 лет фаготипирование было основным методом внутривидовой дифференциации S.aureus. Однако низкая чувствительность штаммов MRSA к бактериофагам Международного набора послужила толчком к бурному развитию молекулярно-генетических методов их типирования. В настоящее время фаготипирование следует рассматривать как вспомогательный метод, а результаты, полученные с его помощью, оценивать как предварительные, позволяющие выявить фенотипическое разнообразие исследуемых клинических изолятов MRSA.
Фаготипирование проводят с использованием Международного набора бактериофагов, выпускаемых ГУ НИИЭМ им. Н.Ф. Гамалеи РАМН, согласно прилагаемой стандартной методике. Для типирования необходимо использовать разведение фагов в концентрации 100 РТД, поскольку до 90 % клинических изолятов MRSA нечувствительны к бактериофагам в концентрации 1ТР.
При оценке результатов фагочувствительности следует иметь в виду, что клинические изоляты, чувствительные только к одному бактериофагу, принадлежат и к одному генотипическому варианту. Изоляты, чувствительные к нескольким одинаковым бактериофагам, могут принадлежать к различным генотипическим вариантам.
Согласно международным критериям при использовании типирующих бактериофагов в концентрации 1ТР изоляты, отличающиеся по чувствительности к бактериофагам на две сильные реакции, считаются различными. Однако при использовании бактериофагов в концентрации 100ТР такие изоляты, в ряде случаев, могут принадлежать к одному генотипическому варианту. В этой связи результаты фаготипирования следует рассматривать как ориентировочные, подлежащие дальнейшему подтверждению с помощью молекулярно-генетических методов типирования.
5.2. Молекулярно-генетический анализ генома MRSA с использованием полимеразной цепной реакции
5.2.1. Обоснование
В настоящее время методы молекулярной биологии, основанные на применении полимеразной цепной реакции (ПЦР), находят все более широкое применение в целях диагностики и экспресс-анализа разнообразного биологического материала. Интенсивное развитие подобных методик обусловлено очень высокой чувствительностью ПЦР, возможностью быстрого получения результатов, низкой стоимостью получаемых результатов (по сравнению с другими методиками) и технологичностью. Другие молекулярно-биологические методы не только требуют для своей реализации сложного дорогостоящего оборудования, специально подготовленного персонала, но и специального программного обеспечения для обработки полученных результатов.
Проведенными в последние годы исследованиями установлено, что хромосома S.aureus составлена из двух категорий ДНК: хромосомного «ядра», полученного от бактерии-предшественницы, тесно связанной с представителями рода Bacillus, и «геномных островов», полученных от других бактерий в результате горизонтального переноса (33, 43).
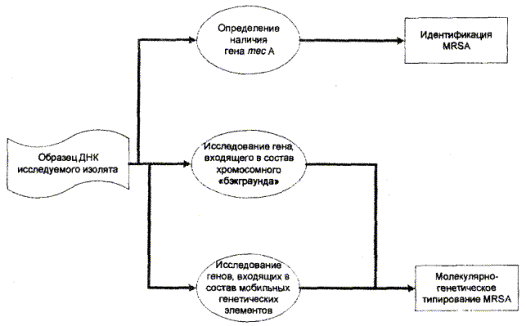
В связи с этим схема типирования MRSA, основанная на использовании метода ПЦР, включает исследование:
• структурного полиморфизма гена, входящего в состав хромосомного «ядра»;
• генов и генных комлексов, находящихся на мобильных генетических элементах в составе хромосомы S.aureus.
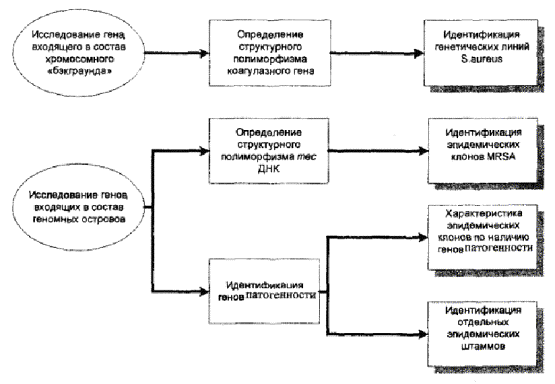
Среди генов хромосомного «ядра», обладающих выраженным структурным полиморфизмом, в методику анализа включен ген, детерминирующий синтез коагулазы. На основании размеров образовавшихся ампликонов, а также размеров и числа рестрикционных фрагментов, полученных в результате обработки эндонуклеазой Cfo1, исследуется фрагмент гена, расположенный между 1513 и 2188 нуклеотидами. Проведенный таким образом анализ позволяет выявить различные генотипические варианты S.aureus.
Среди генов, расположенных на мобильных генетических элементах, принципиально важным для дифференциации штаммов MRSA является исследование генных комплексов, входящих в состав стафилококковых хромосомных кассет тес, а также определение генов, детерминирующих синтез энтеротоксинов А, В, С и токсина синдрома токсического шока. Исследование структурного полиморфизма тес ДНК позволяет выявить клоны MRSA, отличающиеся содержанием разных типов SCCmec. Определение наличия генов PTSAgs позволяет выявить патогенный потенциал и охарактеризовать отдельные штаммы MRSA.
Схема анализа генома MRSA представлена на рис. 3.
Рис. 3. Анализ генома MRSA (схема).
Принцип метода. В основе метода ПЦР лежит многократное копирование (амплификация) специфического фрагмента ДНК-мишени. Такое копирование осуществляется ферментом термостабильной ДНК-полимеразой в присутствии дезоксирибонуклеотид-трифосфатов (дНТФ) и синтетических олигонуклеотидных затравок синтеза ДНК, называемых праймерами. Праймеры комплиментарны концевым последовательностям ДНК специфического фрагмента и ориентированы таким образом, что синтез ДНК протекает только между ними. В результате происходит экспоненциальное увеличение числа копий специфического фрагмента по формуле 2n, где n - число циклов амплификации. Каждый цикл состоит из трех этапов, каждому из которых соответствует определенный температурный режим.
1). Расплетение двойной спирали ДНК (денатуризация ДНК) происходит при 93 - 95 °С.
2). Присоединение (отжиг) праймеров происходит комплиментарно при температуре, специфичной для данной пары праймеров.
3). Синтез новых цепей ДНК протекает при 72 °С путем удлинения, начиная с праймера, в направлении 5¢ - 3¢. В результате 30 - 35 циклов амплификации синтезируется необходимое число копий фрагмента, которое делает возможным визуальный учет результатов после электорофореза в агарозном геле.
5.2.2. Оборудование и реактивы
Для идентификации и типирования MRSA используется стандартное оборудование ПЦР-лаборатории.
Оборудование и принадлежности.
Настольная центрифуга типа Eppendorf для микропробирок объемом 1,5 и 0,5 мл.
Ультратермостат для микропробирок
Встряхиватель для микропробирок типа Vortex
СВЧ-печь
Программируемый термостат (ДНК-амплификатор).
Электрофоретическое оборудование для разделения фрагментов ДНК в агарозном геле: источник напряжения для электрофореза и прибор для горизонтального миниэлектрофореза (миникамера).
УФ осветитель для визуализации результатов электрофореза (трансиллюминатор)
Гель - документирующая видео-система
Термостат
Холодильник
РН-метр
Весы до 0,5 кг
Автоматические микропипетки переменного объема (0,5 - 10 мкл, 5 - 40 мкл, 200 - 1000 мкл)
Наконечники для микропипеток
Микроцентрифужные пробирки типа Eppendorf на 1,5 и 0,5 мл (свободные от ДНК-аз и РНК-аз)
Реактивы и растворы.
Реактивы.
Трис (hydroxymethyl) aminometane
НСl конц.
Ледяная уксусная кислота
ЭДТА
NaCl
Гуанидин тиоцианат
Этиловый спирт 95 %
Агароза для электрофореза
Бромистый этидий
Бромфеноловый синий
Глицерин
Маркер молекулярной массы ДНК
Рестриктаза Cfo1
Приготовление основных растворов.
1 М Трис рН-8,0. Растворить 12,1 г Трис в 80,0 мл горячей дистиллированной воды. Для ускорения растворения мешать на магнитной мешалке с подогревом. Раствор довести до необходимого значения рН добавлением концентрированной НСl. Перед окончательным доведением рН дать раствору остыть до комнатной температуры и довести объем до 100 мл.
0,5 М ЭДТА рН-8,0. Добавить 18,6 г двузамещенной соли ЭДТА-2 Н2O к 80,0 мл воды. Интенсивно размешать на магнитной мешалке. Довести рН до 8,0 с помощью NaOH (около 2,0 г NaOH).
70 %-ный этанол. Для приготовления 100 мл раствора требуется 74 мл 95 % этанола и 26 мл воды.
Взвесь SiO2. K 10 мл дистиллированной воды добавить 0,1 мл 1 М НСl и 2 г SiO2.
6М раствор гуанидина тиоцианата. К 21,3 г гуанидина тиоцианата добавить небольшое количество дистиллированной воды (5 - 7 мл), подогреть на водяной бане до почти полного растворения гуанидина и довести объем до 30 мл.
Трис-ацетатный (ТАЕ) буфер для электрофореза (0,04М Трисацетат, 0,002М ЭДТА). Для приготовления 0,5 л концентрированного (50´) буфера 121 г Трис растворить в 300 мл горячей воды (Трис растворяется медленно, в течение приблизительно 20 мин, лучше перемешивать на магнитной мешалке с подогревом), добавить 50 мл 0,5 М раствора ЭДТА, и около 25 мл ледяной уксусной кислоты, перемешать на магнитной мешалке, довести рН до 8.
ТЕ буфер. К 1 мл 1М Трис-HCl рН-8,0 добавить 1 мл 0,5 М раствора ЭДТА рН 8,0 и 98 мл дистиллированной Н2О.
Буфер для нанесения образца - 6х (0,25 %-ный бромфеноловый синий, 30 %-ный глицерин, 10 мМ Трис-HCl, 1 мМ ЭДТА). Для приготовления 10 мл буфера для нанесения требуется: к 9,9 мл 30 % водного раствора глицерина добавить 2,5 мг бромфенолового синего, 0,1 мл Трис, 0,02 мл 0,5М ЭДТА рН-8,0.
Раствор этидия бромида (10 мг/мл). Растворить 0,1 г этидия бромида в 10,0 мл воды. Для визуализации ДНК в агарозном геле используется раствор в концентрации 5 мкг/мл. Внимание! Все манипуляции с бромидом этидия и его растворами проводить в перчатках.
Все приготовленные растворы можно хранить при 4 - 12 °С в течение 2-х лет.
5.2.3. Вспомогательные методики
Выделение ДНК.
• 1,5 мл 18-час. культуры S.aureus, выращенной в жидкой питательной среде brain-heart -infusion или L-бульоне, осадить центрифугированием при 14000 об./мин. в течение 20 мин;
• ресуспендировать в 500 мкл ТЕ буфера (рН8);
• встряхнуть на Vortex;
• осадить центрифугированием при 14000 об/мин в течение 5 мин;
• буфер слить, оставив около 50 мкл и снова встряхнуть на Vortex;
• добавить 100 мкл 6М раствора гуанидина тиоцианата, встряхнуть на Vortex и инкубировать в ультратермостате при 65 °С в течение 20 мин, периодически встряхивая;
• осадить на Vortex в течение 30 сек;
• добавить 20 мкл взвеси Si2O;
• встряхнуть на Vortex и снова инкубировать в ультратермостате при 65 °С 10 мин, продолжая периодически встряхивать на Vortex;
• осадить на Vortex 30 сек;
• добавить 300 мкл 70 % этанола;
• встряхнуть на Vortex;
• осадить на центрифуге Eppendorf при 5000 об./мин в течение 1 мин, надосадочную жидкость отсосать пипеткой, меняя наконечники для каждой из проб;
• добавить 500 мкл этанола и встряхнуть на Vortex;
• центрифугировать при 5000 об./мин в течение 1 мин;
• этанол отсосать пипеткой и снова осадить при 5000 об./мин, остатки этанола снова отсосать, пробы не сушить;
• к осадку добавить 100 мкл ТЕ буфера, встряхнуть на Vortex, инкубировать в ультратермостате 5 мин при 65 °С;
• осадок удалить центрифугированием при 12000 об./мин. в течение 2 мин;
• раствор ДНК сохранять при -20 °С (может храниться в течение нескольких лет).
Амплификация геномной ДНК.
Амплификацию геномной ДНК проводят в 25 мкл реакционной смеси. В состав стандартной реакционной смеси входят: амплификационный буфер 2,5 мкл (10´) рН 8, 6, 2,5 мМ каждого трифосфата, 2,5 мМ MgCl2, 0,4 мкл Tag-полимеразы (5 ед./мкл), по 1 мкл каждого праймера, 1 мкл ДНК- матрицы, деионизированную воду добавляют до конечного объема 25 мкл. Концентрация праймеров и количество MgCl2 может меняться в зависимости от свойств праймеров. В ряде случаев концентрацию ДНК- матрицы следует уменьшить путем разведения в 10 - 100 раз, используя деионизированную воду.
Состав стандартной реакционной смеси, рассчитанный на различный объем проводимых исследований, представлен в таблице (приложение, табл. 2).
Техника постановки эксперимента:
• стерильные пробирки типа Eppendorf на 0,5 мл поместить в штатив и подписать;
• в одной из пробирок сформировать реакционную смесь, последовательно добавляя компоненты;
• разнести реакционную смесь по соответствующим пробиркам;
• внести в пробирки геномную ДНК и тщательно пипетировать перемешивая пробы;
• поверх реакционной смеси наслоить несколько капель минерального масла (около 17 мкл);
• для удаления пузырьков воздуха пробирки центрифугировать в течение нескольких секунд в настольной центрифуге и перенести пробы в штатив амплификатора ДНК;
• установить и запустить необходимую программу амплификации ДНК.
Электрофорез в агарозном геле и визуализация продуктов амплификации.
Для приготовления 2,5 %-ной агарозы необходимо к 1,25 г агарозы добавить Трис-ацетатный буфер до 50 мл и тщательно перемешать.
Колбу с агарозой поместить в микроволновую печь и растопить агарозу, доводя несколько раз до непродолжительного кипения и перемешивая в промежутках между нагреванием.
Расплавленную агарозу охладить до 50 °С, добавить 5 мкл раствора бромида этидия и залить в подготовленную форму для геля, избегая образования пузырьков в геле; толщина геля должна быть 0,5 - 0,7 см.
Через 20 - 30 мин, когда гель сформируется, удалить гребенку и перенести его в камеру для электрофореза. В камеру залить Трис-ацетатный буфер так, чтобы он покрывал гель на 1 - 2 мм.
Реакционную смесь, содержащую продукты амплификации ДНК, тщательно перемешать пипетированием и нанести в лунки агарозного геля. В крайнюю лунку нанести маркер молекулярной массы ДНК.
Электрофорез проводят при 80 В (8,0 В/см), пока маркер не пройдет 4 - 4,5 см. Обычно электрофорез длится около 1,5 часов.
Гель поместить на фильтр трансиллюминатора и просмотреть в проходящем ультрафиолете через защитный экран и специальные защитные очки. Фрагменты амплифицированной ДНК будут флюоресцировать под УФ оранжевым светом.
Рестрикционный анализ ДНК ПЦР-амплифицированного коагулазного гена.
Постановка рестрикции.
Рестрикцию проводить в объеме 15 мкл.
• 2 - 5 мкл ПЦР-продукта, содержащего около 500 ng ДНК, обработать 2 единицами рестриктазы Cfo1 согласно прилагаемой инструкции;
• реакционную смесь инкубировать в течение 2 час. при 37 °С в ультратермостате;
• 15 мкл полученного продукта анализировать путем электрофореза.
5.2.4. Идентификация гена тес А
Показаниями для проведения молекулярно-генетической индикации MRSA служат:
• сомнительные результаты при определении чувствительности к оксациллину с помощью фенотипических методов;
• тяжелые случаи ВБИ (бактериемия, сепсис и т.д.), а также случаи низкой клинической эффективности при использовании оксациллина или антибиотиков цефалоспоринового ряда при лечении осложнений, вызванных S.aureus;
• выделение клинических изолятов S.aureus, устойчивых к 2 - 3 антибиотикам, помимо b-лактамов, но чувствительных к оксациллину при определении диско-диффузионным методом;
• увеличение частоты ВБИ, вызванных S.aureus.
Используются следующие праймеры:
прямой праймер: MecA-F 5¢ -ACT GCT АТС САС ССТ САА АС-3¢;
обратный праймер МесА-R 5¢ -CTG GTG AAG TTG ТАА ТСТ GG-3¢.
Размер генного продукта 163 н.п. Состав реакционной смеси стандартный. Концентрация праймеров - 12 - 15 пкм/мл.
Режим амплификации № 1:
94 °С - 2 мин, 35 циклов амплификации (94 °С - 30 сек, 57 °С - 30 сек, 72 °С - 20 сек), заключительная элонгация при 72 °С в течение 5 мин. Ориентировочное время амплификации 1 час 15 мин.
5.2.5. Генотипирование
Показания для проведения генотипирования MRSA.
1. В стационарах, где MRSA выделены впервые.
Подлежат типированию все выделенные клинические изоляты с целью выявления источника эпидемического штамма и предотвращению его дальнейшего распространения.
2. В стационарах, где MRSA являются эндемичными.
A) В отделениях с высоким риском передачи инфекции: отделениях интенсивной терапии, хирургических, травматологических и ожоговых подлежат типированию все клинические изоляты.
При возкиковении вспышки внутрибольничной инфекции типированию подлежат изоляты, выделенные и от колонизованных больных.
Б) Подлежат типированию все клинические изоляты, выделенные от пациентов при бактериемии, пневмонии, септическом шоке, а также от носителей среди лиц из числа медицинского персонала и из окружающей среды.
B) В родовспомогательных учреждениях подлежат типированию все изоляты.
Схема генотипирования представлена на рисунке 4.
Рис. 4. Генотипирование MRSA.
5.2.5.1. Исследование полиморфизма структуры коагулазного (соа) гена
Исследование полиморфизма структуры коагулазного гена включает два этапа.
1) Определение величины размеров ампликонов, полученных при амплификации фрагмента коагулазного гена, расположенного в 3¢-конце гена между 1513 и 2188 нуклеотидами.
Используются следующие праймеры:
прямой праймер Coa1 - 5¢ ATA GAG ATG CTG GTA CAG G 3¢;
обратный праймер Соа2 - 5¢ GCT TCC GAT TGT TCG ATG С 3¢.
Рабочая концентрация праймеров составляет 12 - 15 пкм/мкл.
Режим амплификации № 1
Размер ПЦР-продукта коагулазного гена может варьировать от 400 до 800 н.п. Вариабельность размеров ампликонов указывает на существование структурных различий коагулазного гена у исследуемых изолятов.
2) Рестрикционный анализ продукта амплификации с использованием рестриктазы Cfo1.
На рис. 5 представлена схема образцов рестрикции стандартных международных штаммов как метициллинчувствительных (группа PS штаммов - штаммы, предназначенные для размножения бактериофагов из коллекции Международного набора), так и эпидемических штаммов EMRSA.
Рис. 5. Схема образцов рестрикции штаммов при использовании рестриктазы Cfo1
Примечание:
1 EMRSA-3
2 EMRSA-15*
3 PS 29, EMRSA-16*
4 PS 52, EMRSA-1, EMRSA-4, 7, 9, 11*
5 PS 6, PS 53, EMRSA-12, EMRSA-2, 5, 6, 8, 13, 14*
6 PS 95, Airdale-16 вариант EMRSA 16*
7 PS 94, PS 96
8 EMRSA-2
9 PS 42E
10 PS 71
Результаты рестрикции представлены в работе (34).
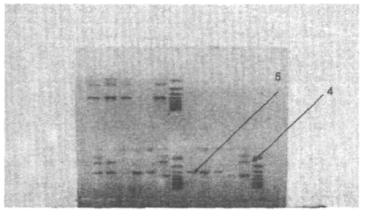
Рис. 6. Электрофореграмма рестрикции эндонуклеазой Cfo1 коагулазного гена клинических изолятов MRSA, выделенных в стационарах России
Анализ результатов рестрикции позволяет сравнивать исследуемые изоляты между собой, сделать ориентировочное заключение о генетической гетерогенности исследуемой популяции клинических изолятов, сопоставить их с данными рестрикции коагулазного гена международных штаммов.
5.2.5.2. Идентификация типов SCCmec.
Определение типа SCCmec осуществляют на основании результатов амплификации с использованием 7 разных пар праймеров, выявляющих структурные элементы кассет различных типов.
Стратегия идентификации типов SCCmec.
На первом этапе определяют специфичность набора генов, кодирующих синтез рекомбиназ (тип ccr 1, 2, 3) с использованием 3-х пар праймеров: bс и a1, bс и a2, bс и a3, соответственно. Праймер bc является общим для определения генов ccrB1, ccrB2 и ccrВ3.
Этот этап типирования позволяет сделать предварительное заключение о возможном присутствии в исследуемом изоляте SCCmec того или иного типа. Следующим этапом является определение набора генов, входящих в состав комплекса тес (класс А или класс В) с использованием праймеров mI3 и mI4, а также IS5 и mА6. Результаты амплификации, полученные с использованием 5 пар праймеров, позволяют идентифицировать присутствие SCCmec I, II и III типов.
Для определения возможного присутствия SCCmec типа IV, в случае идентификации набора тес класса В и набора ccr типа 2, дополнительно проводят амплификацию с праймерами, выявляющими области J1a или J1b.
Следует иметь в виду, что в ряде изолятов могут присутствовать «неправильные» кассеты SCCmec, а также дополнительные кассеты.
Состав реакционной смеси стандартный.
Праймеры a1, a2, a3, bс mI4, mI3, IS5, mA6 используются в концентрации 15 пкм/мкл. Праймеры 4a1, 4a2, 4b1, 4b2 используются в концентрации 15 - 20 пкм/мкл.
Режим амплификации № 2: предварительная денатурация при 94 °С - 2 мин, 30 циклов амплификации (94 °С - 30 сек, 50 °С - 1 мин, 72 °С - 2 мин).
Ориентировочное время амплификации - около 2,5 часов.
Используемые праймеры представлены в таблице 2.
Наборы праймеров для идентификации типов SCCmec
|
Тип идентифицируемого элемента |
Название праймера |
Нуклеотидная последовательность |
Размер ампликонов н.п. |
|
|
1 |
Ссr тип I |
bc |
5¢-ATT GCC TTG ATA ATA GCC I TCT-3¢ |
700 |
|
|
|
a1 |
5¢-AAC СТА TAT CAT CAA TCA GTA CGT-3¢ |
|
|
2 |
Ссr тип II |
bc |
|
1000 |
|
|
|
a2 |
5¢-TAA AGG CAT CAATGC АСА AAC ACT-3 |
|
|
3 |
Ссr тип III |
bc |
|
1600 |
|
|
|
a3 |
5¢-AGC TCA AAA GCA AGC AAT AGA AT-3¢ |
|
|
4 |
Класс А тес Генный комплекс тесI |
mI4 |
5¢-CAA GTG AAT TGA AAC CGC CT-3¢ |
180 |
|
|
|
mI3 |
5¢-CAA AAG GAC TGG ACT GGA GTC CAAA-3¢ |
|
|
5 |
Класс В тес (IS272 - mecA) |
IS5 |
5¢-AAC GCC ACT CAT AAC ATA AGG AA-3¢ |
2000 |
|
|
|
mA6 |
5¢-TAT ACC AA CCC GAC AAC-3¢ |
|
|
6 |
Подтип IVa |
4a1 |
5¢-TTT GAA TGC CCT CCA TGA ATA AAA T-3¢ |
450 |
|
|
|
4a2 |
5¢-AGA AAA GAT AGA AGT TCG AAA GA-3¢ |
|
|
7 |
Подтип IVb |
4b1 |
5¢-AGT АСА TTT TAT CTT TGC GTA-3¢ |
1000 |
|
|
|
4b2 |
5¢-AGT CAC TTC AAT ACG AGA AAG TA-3¢ |
|
5.2.5.3. Идентификация генов, детерминирующих синтез энтеротоксинов A(sea), В(seb), С(sec) и токсина синдрома токсического шока(tst-Н)
Для определения генов sea, seb, sec используется мультиплексная ПЦР.
Состав реакционной смеси стандартный. Концентрация праймеров для определения генов sea - 15 пкм/мкл, seb, sec - 30 пкм/мкл.
Для определения гена tst-H концентрация MgCl2 в реакционной смеси - 2,0 мМ, концентрация праймеров - 12 пкм/мкл.
Режим амплификации № 1
Наборы праймеров для идентификации генов sea, seb, sec
|
Праймер |
Олигонуклеотидная последовательность (5¢ - 3¢) |
Локализация внутри гена |
Размер амплифицированного продукта |
|
|
sea |
GSEAR-1 |
GGTTATCAATGTTGCGGGTGG |
349 - 368 |
102 |
|
|
GSEAR-2 |
CGGCACTTTTTTCTCTTCGG |
431 - 450 |
|
|
seb |
GSEBR-1 |
GTATGGTGGTGTAACTGAGC |
666 - 685 |
164 |
|
|
GSEBR-2 |
CCAAATAGTGACGAGTTAGG |
810 - 829 |
|
|
sec |
GSECR-1 |
AGATGAAGTAGTTGATGTGTAT |
432 - 455 |
451 |
|
|
GSECR-2 |
CACACTTTTAGAATCAACCG |
863 - 882 |
|
|
tst-H |
GTSSTR-1 |
ACCCCTGTTCCCTTATCAATC |
88 - 107 |
326 |
|
|
GTSSTR-2 |
TTTTCAGTATTTGTAACGCC |
394 - 413 |
|
6. Организация эпидемиологического надзора за внутрибольничными инфекциями, вызванными MRSA
Эпидемиологический надзор за MRSA является составной частью эпидемиологического надзора за ВБИ и включает следующие составные элементы:
• выявление, учет и регистрацию всех случаев ВБИ, вызванных MRSA и подтвержденных результатами микробиологических исследований;
• выявление пациентов, колонизованных MRSA (по эпидемическим показаниям);
• определение спектра устойчивости изолятов MRSA к антибиотикам, антисептикам, дезинфектантам и чувствительности к бактериофагам;
• контроль за состоянием здоровья медицинского персонала (носительством эпидемически значимых штаммов, заболеваемостью);
• санитарно-бактериологические исследования объектов окружающей среды на наличие MRSA;
• проведение молекулярно-генетического мониторинга, целью которого является получение данных о структуре госпитальных изолятов, выявлении среди них эпидемически значимых, а также расшифровка механизмов их циркуляции и распространения в стационаре;
• слежение за соблюдением санитарно-гигиенического и противоэпидемического режима;
• эпидемиологический анализ заболеваемости и смертности от ВБИ, позволяющий сделать заключение об источниках, путях и факторах передачи, а также условиях, способствующих инфицированию.
Центральным звеном эпидемиологического анализа должен являться молекулярно-генетический мониторинг. Основанный на его данных эпидемиологический анализ не только позволит правильно оценивать, но и прогнозировать эпидемические ситуации, посредством заблаговременных противоэпидемических мероприятий предотвращать вспышки ВБИ, вызванные MRSA.
Организационно-методическое руководство работой по профилактике и борьбе с ВБИ, вызванными MRSA, осуществляют структурные подразделения органов и учреждений, осуществляющих государственный санитарно-эпидемиологический надзор в республиках, краях, областях, округах и г.г. Москве и Санкт-Петербурге.
Федеральные органы исполнительной власти, включая органы управления здравоохранением, участвуют в осуществлении комплекса мероприятий по профилактике ВБИ, в т.ч. обусловленных MRSA.
Библиографические данные
1. Концепция профилактики внутрибольничных инфекций. Утверждена первым заместителем министра здравоохранения Российской Федерации Г.Г. Онищенко 6.12.1999 г. Авторы: Покровский В.И., Монисов А.А., Шандала М.Г., Семина Н.А., Ковалева Е.П., Пантелеева Л.Г., Акимкин В.Г., Савицкая К.К., Абрамова И.М., Шаханина И.Л., Трофимова О.Д., Перепанова Т.С., Лазикова Г.Ф., Фролочкина Т.И., Соколова Н.Ф., Федорова Л.С. Эпидемиология и инфекционные болезни, 2000, № 5, 4 - 14.
2. Бут О.М., Шеремет О.В., Ясенкова О.Е. и др. Микробный пейзаж отделяемого ран в стационарах хирургического профиля. В сб. «Роль клинической микробиологии в профилактике внутрибольничных инфекций. Тезисы докладов Российской научно-практической конференции с международным участием». Москва, 2004 г.: 22.
3. Гаян Л.В. Распространенность полирезистентных штаммов микроорганизмов в городском стационаре ургентного профиля. В сб. «Роль клинической микробиологии в профилактике внутрибольничных инфекций. Тезисы докладов Российской научно-практической конференции с международным участием». Москва, 2004 г.: 31 - 32.
4. Герамсичик Л.Ф., Кузнецова А.Ю., Середа Т.А. Микробный пейзаж и формирование антибиотикорезистентности возбудителей ГСИ в ожоговом отделении МУЗМСЧ «Северсталь». В сб. «Роль клинической микробиологии в профилактике внутрибольничных инфекций. Тезисы докладов Российской научно-практической конференции с международным участием». Москва, 2004 г.: 32 - 33.
5. Дмитренко О.А., Прохоров В.Я., Суворова Т.И., Волков И.И., Шагинян И.А., Гинцбург А.Л. Метициллинрезистентные Staphylococcus aureus - возбудители внутрибольничных инфекций в стационарах России. Роль факторов патогенности. В сб. Узловые вопросы борьбы с инфекцией. Материалы конференции. СПб ВМедА. - 2004: 76 - 77.
6. Дмитренко О.А., Шагинян И.А., Прохоров В.Я. и др. Молекулярно-генетическое типирование метициллинрезистентных штаммов Staphylococcus aureus, выделенных в разных регионах Российской Федерации на основании изучения размеров продукта амплификации и последующего рестрикционного анализа коагулазного гена. ЖМЭИ, 2005, 4, 46 - 52.
7. Евстропов А.Д., Ильина В.Н., Шмырин А.А. и др. Этиология бактериемии у обожженных. Материалы VIII съезда Всероссийского общества эпидемиологов, микробиологов и паразитологов. Москва, РОСИНЭКС, 2002 г., т. 4: 147 - 148.
8. Зуева В.С., Дмитренко О.А., Акатов А.К. и др. Метициллинрезистентные стафилококки. ЖМЭИ, 1988, 4, 100 - 108.
9. Никитенко Т.А., Кондратенко Н.Н. Ведущие микроорганизмы - возбудители внутрибольничных инфекций в стационарах различного профиля в современных условиях. В сб. «Роль клинической микробиологии в профилактике внутрибольничных инфекций. Тезисы докладов Российской научно-практической конференции с международным участием». Москва, 2004 г.: 68 - 69.
10. Определитель бактерий Берджи. Т. 2. Пер. с англ. / Под ред. Дж. Хоума, Н. Крига, П. Снита и др. М.: Мир, 1997.
11. Пылаева С.И., Гординская Н.А., Кувакина Н.А. и др. Эпидемиологическая ситуация в травматологической клинике, связанная с циркуляцией метициллинрезистентных стафилококков. Материалы VIII съезда Всероссийского общества эпидемиологов, микробиологов и паразитологов. Москва, РОСИНЭКС, 2002 г., т. 4: 163 - 164.
12. Черепанова Т.А., Шаликова Г.Г. Чувствительность к антибиотикам S.aureus. Материалы VIII съезда Всероссийского общества эпидемиологов, микробиологов и паразитологов. Москва, РОСИНЭКС, 2002 г., т. 4: 128.
13. Страчунский Л.С., Дехнич А.В., Белькова Ю.А. Сравнительная активность антибактериальных препаратов, входящих в лекарственные формы для местного применения, в отношении Staphylococus aureus: результаты российского мультицентрового исследования. Клиническая микробиология и антимикробная химиотерапия 2002, т. 4: 157 - 162.
14. Шагинян И.А., Дмитренко О.А. Молекулярная эпидемиология инфекций, вызываемых метициллинустойчивыми стафилококками. ЖМЕИ. 2003, 3, 99 - 109.
15. Ayliffe, G.A. The progressive intercontinental spread of methicillin-resistant Staphylococcus aureus. // Clin. Infect. Dis. - 1997, 25: 574 - 579.
16. Baird-Parker A.C. 1974. Genus Staphylococcus. In Buchanan and Gibbons(ed.), Bergeys manual of determinative bacteriology, 8th ed., The Williams and Wilkins Co., Baltimore, pp. 483 - 489.
17. Beck W.D., Berger-Bachi В. and Kayser F.H. Additional DNA in methicillin-resistant Staphylococcus aureus and molecular cloning of mec -specific DNA. // J. Bacteriol. 1986, 165: 373 - 378.
18. Berger-Bachi В., Strassle A., Gustsfson J.E. and Kayser F.H. Mapping and characterization of multiple chromosomal factors involved in methicillin resistance in Staphylococcus aureus. // Antimicrob. Agents Chemother. 1992, 36: 1367 - 1373.
19. Boyce J.M. Epidemiology and prevention of nosocomial infection, p. 309 - 329. In K.B. Crossley and G.L.Archer (ed.) The staphylococci in human disease. Churchill Livingstone, New York, N.Y. 1997.
20. Centers for disease control and prevention NNIS system. 2001. National Nosocomial Infections Surveillance (NNIS) System report, data summary from January 1992 - June 2001. // Am. J. Infect. Control- 2001, issued August, 2: 404 - 421.
21. Combined Working party of the British Society of Antimicrobial Chemotherapy, the Hospital Infection Society and the Infection Control Nurses Association. Revised guidelines for the control of methicillin-resistant Staphylococcus aureus infections in hospitals. // J. Hosp. Infect. - 1998, 39: 253 - 290
22. Copsgrove S.E., Sakoulas G., Perecevich E.N. et al. Comparison of mortality associated with methicillin-resistant and methicillin susceptible Staphylococcus aureus bacteremia; a meta-analysis. // Clin.Infect.Dis. - 2003, 36: 53 - 59.
23. Corne Ph., Marchandin H., Jonquet O. et al. Molecular evidence that nasal carriage of Staphylococcus aureus plays a role in respiratory tract infections of critically ill patients // J. Clinical Microbiol. - 2005, 43, 7: 3491 - 3493.
24. Dinges M.M., Orwin P.M. and Schlievert P.M. Exotoxins of Staphylococcus aureus. // Clin. Microbiol. Rev. - 2000, 13, 1: 16 - 34.
25. Czachor J.S., Herchline Т.Е. Bacterimic nonmenstraal staphylococcal toxic shock syndrome associated with enterotoxins A and C. // Clin. Infect. Dis. - 2001, 32: e 53 - 56.
26. Edmond M.B., Wallace S.E., Modish D.K., et al. Nosocomial bloodstream infections in United States hospitals: A three-year analysis. // Clin. Infect Dis. - 1999, 29: 239 - 244
27. Engelmann J.J., Carmeli Ye., Cosgrove S.E., Fowler V. G., Bron-stein M.Z., Trivette Sh. L., Brigs J.P., Sexton D.J., Kaye K.S. Adverse clinical and economic outcomes attributable to methicillin resistance among patients with staphylococcus aureus surgical site infection. // Clin.Infect.Dis. 2003, 36: 592 - 597.
28. Enright M. C, Robinson D.A., Randle G. et al. The evolutionary history of methicillin-resistant Staphylococcus aureus (MRSA). // PNAS - 2002, 99, 11: 7687 - 7692.
29. Fridkin S.K., Hageman J., Mcdougal L.K. et al. Epidemiological and microbiological characterization of infections caused by Staphylococcus aureus with reduced susceptibility to vancomycin, United States, 1997 - 2001. Clin. Infect. Dis. 2003, 36: 429 - 439.
30. Giacometti A., Cirioni O., Schimizzi A.M. et al. Epidemiology and microbiology of surgical wound infections. // J.Clin. Microbiol. - 2000, 38, 2: 918 - 922.
31. Griffiths C, Lamagni T.L., Crowcroft N.S, Duckworth G. et al. Trends in MRSA in England and Wales: analysis of morbidity and mortality data for 1993 - 2002. // Health Stat Q. - 2004, Spring, (21): 15 - 22.
32. Hartman B.I., Tomasz A. // Low-affinity penicillin-binding protein associated with P-lactam resistance in Staphylococcus aureus. // J. Bacterid. - 1984, 158: 513 - 516.
33. Hiramatsu K. Molecular evolution of MRSA. // Microbiol. Immunol. - 1995, 39, 8: 531 - 543.
34. Holden M.T.G., Feil E.J., Lindsay J.A. et al. Complete genomes of two clinical Staphylococcus aureus strains: Evidence for the rapid evolution of virulence and drug resistance. // PNAS 2004, 1001, 26: 9786 - 9791.
35. Hookey J.V., Richardson J.F. and Cookson B.D. Molecular typing of Staphylococcus aureus on PCR restriction fragment length polimorphism and DNA sequence analysis of the coagulase gene. // J. Clin. Microbiol. - 1998, 36, 4: 1083 - 1089.
36. Huang S.S. and Piatt R. Risk of methicillin-resistant Staphylococus aureus infection after previous infection or colonization. // Clin. Infect. Dis. 2003: 36, 281 - 285.
37. Jevons M.P. «Celbenin» - resistant staphylococci. Br. Med. J. 1961, 1: 124 - 125.
38. Ito Т., Katayama Y., Asada K. et al. Structural comparison of three types of staphylococcal cassette chromosome mec integrated in the chromosome in methicillin-resistant Staphylococcus aureus. // Antimicrob. Agents Chemother. - 2001, 45, 5: 1323 - 1336.
39. Katayama Y., Ito Т., and Hiramatsu K. A new class of genetic element, staphylococcus cassette chromosome mec, encodes methicillin resistance in Staphylococcus aureus. // Antimicrob. Agents Chemother. -2000, 44: 1549 - 1555.
40. Kaye K.S., Engelmann J.J., Mozaffari E., and Carmeli Ye. Reference group choice and antibiotic resistance outcomes. // Emerg. Infect. Dis. -2004, 10, 6: 1125 - 1128.
41. Keiko, O., Iwakawa K., Turnidge J.D. et. al. Dissemination of new methicillin-resistant Staphylococcus aureus clones in the community. // J. Clin. Microbiol. - 2002, 40, 11: 4289 - 4294.
42. Kerr S., Kerr G.E., Makintosh C.A, and Marples R.R.. A survey of methicillin-resistant Staphylococcus aureus affecting patients in England and Wales. // J. Hosp. Infect. -1990, 16: 35 – 4.
43. Kluytmans J.,van Belcum A., Verbruch H. Nasal carriage of Staphylococcus aureus: epidemiology, underlying mechanism and associated risks. // Clin. Micro Rev. 1997, 10, 3: 505 - 520.
44. Kuroda M., Ohta Т., Uchiama I. et al. Whole genome sequencing of methicillin-resistant Staphylococcus aureus. // The Lancet-2001, 357, 21: 1225 - 1240.
45. Lechmann H.S., Heaton Т., Mallon D., Holt P.G. Staphylococcal enterotoxin-B-mediated stimulation of interleukin-13 production as a potential aetiologic factor in eczema in infants. // Int. Arch. Allery Immunol. -2004, 135, 4: 306 - 312.
46. Liassine N., Auckenthaler R., Descombes M.-C. et al. Community-acquired methicillin-resistant Staphylococcus aureus islated in Swizerland contains the Panton-Valentine leukocidin or exfoliative toxin genes. // J. Clin. Microb. 2004, 42, 825 - 828.
47. Lowy F.D. Antimicrobial resistance: the example of Staphylococcus aureus. J. Clin. Invest. 2003, 111, 9, 1265 - 1273.
48. Marples R.R., and E.M. Cooke. Workshop on methicillin-resistant Staphylococcus aureus. // J. Hospital. Infect - 1985, 6: 342 - 348.
49. Mehrotra M., Wang G., and Johnson W.M. Multiplex PCR for detection of genes for Staphylococcus aureus enterotoxins, exfoliative toxins, toxic shock syndrome toxin 1, and methicillin resistance. // J. Clin. Microbiol - 2000, 38, 3: 1032 - 1035.
50. Mongkolrasttanothai K, Boyle S. Kahana M.D. and Daum R.S. Severe Staphylococcus aureus infections caused by clonally related community-acquired methicillin-susceptible and methicillin-resistant isolates. // Clin. Infect. Dis. - 2003, 37: 1050 - 1058.
51. Novick R.P. Mobile genetic elements and bacterial toxinoses: the superantigen-encoding pathogenicity islands of Staphylococcus aureus. // Plasmid-2003, 49, 2: 93 - 105.
52. Oliveira D., Santos- Sanches I., Mato S. et. al. Virtually all methicillin-resistant Staphylococcus aureus (MRSA) infections on the Cargest Portuguese teaching hospital are caused two internationally spread multiresistant strains: the «Iberian» and the Brazilian clones of MRSA. // Clin. Microbiol. Infect. - 1998, 4: 373 - 384.
53. Oliveira D.C., Tomasz A, and de Lencastre H. Secrets of success of human pathogen: molecular evolution of pandemic clones of methicillin-resistant Staphylococcus aureus. // The Lancet Infect. Dis. - 2002, 2: 180 - 189.
54. Romero-Vivas J., Rubio M., Fernandez C, Picazo J.J. Mortality associated with nosocomial bacteraemia due to methicillin-resistant Staphylococcus aureus. // Clin. Infect. Dis. 1995, 21: 1417 - 1423.
55. Ross F.J., Studevant D.E., Mackie St.M. et al. Evolutionary genomics of Staphylococcus aureus: Insights into the origin of methicillin-resistant strains and toxic shock syndrome epidemic. // PNAS-2001, 9815: 8821 - 8826.
56. Rubin R.J., Harrington C.A., Poon A. et al. The economic impact of Staphylococcus aureus infections in New York City hospitals. // Emerg. Infect. Dis. - 1999, 5: 9 - 17.
57. Rybak m.J., Pharm D. K.L. Community-associated methicillin-resistant Staphylococcus aureus: a review. // Pharmacotherrapy - 2005, 25, 1: 74 - 85.
58. Schlivert P.M. Staphylococcal enterotoxin В and toxic-shock syndrome toxin-1 are significantly associated with non-menstrual TSS. // Lancet - 1986, 1: 1149 - 1150.
59. Smith T.L., Pearson M.L., Wilcox K.R. et al. Emergence of vancomycin resistance in Staphylococcus aureus. Glycopeptide - intermediate Staphylococcus aureus working group. N. England J. Med. 1999, 18, 340, 7: 493 - 501.
60. de Sousa M.A., de Lancastre H. Evolution of sporadic isolates of methicillin-resistant Staphylococcus aureus (MRSA) in hospitals and their similarities to isolates of community-acquired MRSA. // J. Clin. Microbiol. 2003, 41, 8: 3806 - 3815.
61. Tomasz A., Nachman S. and Leaf H.. Stable classes of phenotypic expression in methicillin-resistant clinical isolates of staphylococci. // Antim-icrob. Agents Chemother. 1991, 35: 124 - 129.
62. Voss A., Milatovich D., Wallrauch-Schwarz C. et al. Methicillin-resistant Staphylococcus aureus in Europe. // Eur. J. Clin. Microbiol. Infect. Dis. - 1994, 13, 1: 50 - 55.
63. Wagner P.L. and Waldor M.K. Bacteriophage control of bacterial virulence. // Infect. Immun. - 2002, 70, 8: 3985 - 3993.
64. Wilcox M.H., Walker C, Winstanley N.G., Limb D.I. True identity of control Staphylococcus aureus strains and their performance in the tube coagulase test. // J.Med. Microbiol. - 1996, 44, 6: 496 - 499.
Приложение
Список контрольных штаммов для амплификации
|
Ген coa |
Тип CCR |
Класс тес |
Тип SCCmec |
Гены PTSAgs |
|
|
S.aureus Е84/5528/1 |
+ |
3 |
A |
III |
sea |
|
S.aureus Е03/М307 |
+ |
1 |
A |
I |
- |
|
S.aureus Е12/М258 |
+ |
2 |
В |
IV |
- |
|
S.aureus NCTC 8507 |
+ |
- |
- |
- |
sea, seb |
|
S.aureus NCTC 10972 |
+ |
- |
- |
- |
seb |
|
S.aureus NCTC 8331 |
+ |
- |
- |
- |
sec |
|
S.aureus NCTC 9315 |
+ |
- |
- |
- |
tst-H |
|
S.epidermidis 14990 |
+ |
- |
- |
- |
- |
Расчет реакционной смеси для ПЦР-амплификации в объеме 25 мкл
|
Н2O (мкл) |
Б´10 (мкл) |
MgCl2 (25 mM) (мкл) |
dNTP (мкл) |
Праймеры |
Фермент (мкл) |
ДНК (мкл) |
||
|
R (мкл) |
F (мкл) |
|||||||
|
1 |
14,5 |
2,5 |
2,5 |
2,5 |
1 |
1 |
0,4 |
1 |
|
5 |
72,5 |
12,5 |
12,5 |
12,5 |
5 |
5 |
2 |
|
|
10 |
145 |
25 |
25 |
25 |
10 |
10 |
4 |
|
|
15 |
217,5 |
37,5 |
37,5 |
37,5 |
15 |
15 |
6 |
|
|
20 |
290 |
50 |
50 |
50 |
20 |
20 |
8 |
|
Приготовленная смесь разливается по пробиркам по 24 мкл. Затем в каждую вносится тестируемая ДНК в количестве 1 мкл.