| Информационная система |  |
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА СССР
ГЛАВСЕЛЬСТРОЙПРОЕКТ
ГИПРОНИСЕЛЬХОЗ
ИНСТРУКЦИЯ
ПО ЛАБОРАТОРНОМУ КОНТРОЛЮ
ОЧИСТНЫХ СООРУЖЕНИЙ
НА ЖИВОТНОВОДЧЕСКИХ КОМПЛЕКСАХ
ЧАСТЬ II
МЕТОДЫ ХИМИЧЕСКОГО АНАЛИЗА СТОЧНЫХ ВОД
ЖИВОТНОВОДЧЕСКИХ КОМПЛЕКСОВ
МОСКВА «КОЛОС» 1983
В разработке инструкции приняли участие научно-исследовательские институты и организации: Гипронисельхоз (Н.Г. Ковалев, М.М. Еселевич, Н.С. Максимовский, И.К. Глазков, С.Д. Дурдыбаев, С.А. Кабанкова); Свинопром РСФСР, (Ю.М. Ревякин), совхоз «50 лет СССР» Калининской обл. (П.П. Смирнов); Укрниигипросельхоз (О.П. Смирнов), НИИТИМЭСХ Нечерноземной зоны РСФСР (В.Н. Афанасьев), ЛИСИ (Б.Г. Мишуков), ВНИИМЖ (Ю.Е. Шуть, В.И. Нетеча), ВНИИВС (И.Д. Гришаев), Росгипрониисельстрой (И.П. Можайцев), ВИГИС (А.А. Черепанов).
Инструкция включает правила организации лабораторий по контролю за работой очистных сооружений, методики отбора и хранения проб жидкого навоза и продуктов его переработки, проведение химических, санитарно-бактериологических и гельминтологических анализов, методы оценки результатов контрольных измерений, правила техники безопасности при работе в лаборатории и предназначена для использования в лабораториях действующих и строящихся комплексов по производству животноводческой продукции.
Инструкция согласована с Главным управлением ветеринарии Министерства сельского хозяйства СССР, Главживпромом СССР, Главсельстройпроектом, Минздравом СССР, Минводхозом СССР. Утверждена Министерством сельского хозяйства СССР 17 ноября 1980 г.
СОДЕРЖАНИЕ
|
1. Физико-химические показатели сточных вод. 1 2. Общее содержание примесей. 2 |
1. ФИЗИКО-ХИМИЧЕСКИЕ ПОКАЗАТЕЛИ СТОЧНЫХ ВОД
Температура. В стоках ее измеряют одновременно с отбором пробы ртутным термометром. При измерении температуры сточной воды определяют и температуру воздуха (± 0,5 °С).
В сосуд наливают не менее 1 л стоков и погружают нижнюю часть термометра. Показания термометра определяют через 5 мин. Сосуд в период определения температуры должен быть защищен от воздействий тепла и солнечного света [4, 5, 6].*
* Список литературы, см. III часть данной инструкции.
Окраска. Цвет воды определяют визуально - светло-желтый, бурый, серый и т.д. [4, 5, 6].
Цветность. При содержании большого количества взвешенных веществ цветность стоков определяют после отстаивания или фильтрации.
Пробу наливают в цилиндр с плоским дном. Высота столбика воды должна быть 10 см. Пробу в цилиндре рассматривают сверху на белом фоне при рассеянном дневном освещении, для контроля ставят такой же цилиндр с дистиллированной водой. Результат определения записывают, указывая оттенки и интенсивность окрашивания (бесцветная, зеленоватая, слабо-желтая, бурая и т.д.).
Прозрачность. Ее определяют, применяя цилиндры Снеллена. При отсутствии их используют широкий цилиндр (диаметр 5 - 7 см) и плоским дном, со шкалой на 30 - 50 см, разделенной на линейные миллиметры.
Пробу наливают в цилиндр, под который на расстоянии 2 см от дна цилиндра положен текст, напечатанный шрифтом Снеллена (высота букв 3,5 мм). Избыток воды спускают сифоном до тех пор, пока можно будет прочесть текст. Высоту столба жидкости отсчитывают по шкале или измеряют линейкой с миллиметровой шкалой. Результат выражают в сантиметрах, как среднее арифметическое двух определений [5, 6].
Мутность. Она обусловлена присутствием в пробе нерастворенных и коллоидных веществ неорганического и органического происхождения. Мутность воды характеризуют как прозрачная, опалесцентная, слабая муть, мутная и т.д. [7].
Запах. Определяют запах пробы в открытом сосуде. Если запах не ясен, то отливают небольшое количество стоков в колбу, накрывают ее часовым стеклом и подогревают до 50 - 65 °С, после чего запах определяют как гнилостный, фекальный, сероводородный, навозный и т.д. [4, 5, 7].
Концентрация ионов водорода (pH). Под активной реакцией (pH) подразумевают кислотные и щелочные свойства сточной воды, обусловленные концентрацией в воде ионов водорода (H+) и гидроксида (OH-). Условная величина pH равна отрицательному десятичному логарифму концентрации ионов водорода. Величину pH определяют колориметрическим или электрометрическим методом.
Ориентировочное определение pH проводят с помощью индикаторных бумажек. Для этого конец полоски универсальной индикаторной бумажки опускают в исследуемый раствор или каплю этого раствора наносят на полоску индикаторной бумаги с помощью стеклянной палочки. Появившуюся окраску сравнивают со стандартной шкалой с точностью ± 0,5 ед. pH.
Электрометрический метод определения pH со стеклянным электродом является наиболее точным методом, не зависящим от присутствия в пробе окислителей или восстановителей, наличия цветности и мутности, взвеси, свободного хлора, повышенного содержания солей в пробе. Метод основан на том, что изменение pH на единицу вызывает изменение потенциала электрода на 5,81 мВ при 20 °С. Результат определения зависит от температуры стоков. Температуру регулируют специальным устройством, вмонтированным в лабораторный pH-метр. Если такое устройство отсутствует, пробу следует нагреть или охладить до требуемой температуры.
Определение pH проводят на лабораторном pH-метре (потенциометре) со стеклянным электродом измерения и каломельным электродом. Методика определения дана в описании к прибору [5].
2. ОБЩЕЕ СОДЕРЖАНИЕ ПРИМЕСЕЙ.
2.1. Определение сухого остатка.
Сухой остаток - это масса всех растворенных и взвешенных веществ, которую определяют при выпаривании определенного объема взболтанной пробы на водяной бане, высушивании остатка пробы при 105 °С до постоянной массы и взвешивании [7].
Аппаратура. Фарфоровые чашки, водяная баня, сушильный шкаф (105 °С), электрическая муфельная печь (600 °С), эксикатор.
Ход определения. В предварительно взвешенную фарфоровую чашку переносят 100 - 200 мл тщательно перемешанной сточной жидкости и выпаривают на водяной бане до сухого остатка. Дно чашки с наружной стороны обтирают фильтровальной бумагой, смоченной разбавленной соляной кислотой, а потом дистиллированной водой. После выпаривания сухой остаток сушат в сушильном шкафу при 105 °С до постоянной массы. Охлажденную в эксикаторе чашку с высушенным остатком взвешивают.
Расчет. Общее содержание примесей (X, мг/л - сухой остаток) вычисляют по формуле:
![]()
где m2 - масса чашки с высушенным остатком, мг;
m1 - масса пустой чашки, мг;
V - объем пробы, взятой для определения, мл;
1000 - единица перевода мл в л.
2.2. Определение сухого остатка пробы после прокаливания (золы).
Чашку с высушенным остатком пробы помещают в муфельную печь и прокаливают при 600 °C до постоянной массы, затем помещают в эксикатор, охлаждают и взвешивают.
Расчет. Массу золы (Y, мг/л) вычисляют по формуле
![]()
где m3 - масса чашки с остатком после прокаливания, мг;
m1 - масса пустой чашки, мг;
V - объем пробы, взятой для определения, мл;
1000 - единица перевода мл в л.
Если проба содержит большое количество органических веществ, остаток после прокаливания иногда бывает темного цвета. В этом случае после охлаждения чашку с остатком увлажняют дистиллированной водой, высушивают и снова прокаливают. Органические вещества пробы сильно загрязненных сточных вод удаляют при прокаливании с большим трудом, тогда остаток увлажняют 10 %-ным раствором нитрата аммония. Увлажнение и прокаливание, если необходимо, повторяют несколько раз.
2.3. Определение органического вещества пробы.
Содержание органического вещества сухого остатка (Z, мг/л) определяются по формуле
![]()
где m2 - масса чашки с высушенным остатком, мг;
m3 - масса чашки с остатком после прокаливания, мг;
V - объем пробы, взятой для определения, мл;
1000 - единица перевода мл в л.
3. РАСТВОРЕННЫЕ ВЕЩЕСТВА
3.1. Определение плотного остатка.
Плотный остаток определяют выпариванием определенного объема пробы, профильтрованной через бумажный фильтр, высушивают при 105 °С до постоянной массы и взвешивают.
Аппаратура та же, что и при определении общего содержания примесей.
Ход определения. В прокаленную и взвешенную фарфоровую чашку помещают 10 - 100 мл профильтрованной (фильтр с белой лентой) сточной воды и выпаривают на водяной бане. При выпаривании чашку наполняют не более чем на 3/4 ее объема. После выпаривания пробы чашку переносят в сушильный шкаф и сушат при 105 °С до постоянной массы, охлаждают в эксикаторе и взвешивают.
Расчет. Содержание плотного остатка (Х1, мг/л) вычисляют по формуле
![]()
где m2 - масса чашки с высушенным остатком, мг;
m1 - масса пустой чашки, мг;
V - объем пробы, взятой для определения, мл;
1000 - единица перевода мл в л.
3.2. Определение остатка после прокаливания (зола).
Для определения растворенных веществ фарфоровую чашку с высушенным остатком пробы помешают в муфельную печь и прокаливают при 600 °C до постоянной массы. Прокаливание ведут осторожно (чтобы избежать потери неорганических веществ) до тех пор, пока остаток в чашке не станет белого или буроватого цвета (при значительном содержании железа). Прокаленную чашку (с золой) помещают в эксикатор, охлаждают и взвешивают.
Расчет. Остаток пробы после прокаливания (Y1, мг/л - масса золы) рассчитывают по формуле
![]()
где m3 - масса чашки с остатком после прокаливания, мг;
m1 - масса пустой чашки, мг;
V - объем пробы, взятой для определения, мл;
1000 - единица перевода мл в л.
По разности между массой растворенных веществ и массой золы определяют приближенное содержание органических веществ или потерю их при прокаливании.
Примечание. При прокаливании сухого остатка улетучиваются, кроме органических веществ, частично и неорганические компоненты: кристаллизационная и гигроскопическая вода, углекислый газ из карбонатов кальция и магния, соляная кислота, окислы азота, образующиеся при восстановлении нитратов. Многие органические вещества испаряются при выпаривании. Натриевые соли органических кислот превращаются в углекислый натрий. Ошибка при расчетах будет тем больше, чем меньше органических загрязнений [8].
4. ВЗВЕШЕННЫЕ ВЕЩЕСТВА
4.1. Определение взвешенных веществ фильтрованием через бумажный фильтр.
Сущность метода - задерживать на фильтре все взвешенные вещества, содержащиеся в отмеренном объеме тщательно перемешанной пробы, и определять их массу после высушивания в сушильном шкафу при 105 °С.
Метод применяют при содержании в пробе взвешенных веществ не менее 100 мг/л. Пробы для определения взвешенных веществ не консервируют [6].
Ход определения. Беззольные фильтры средней плотности (белая лента) помещают предварительно в бюксы и высушивают с открытыми крышками при 105 °С до постоянной массы. После сушки бюксы с фильтром закрывают крышками, помещают в эксикатор, охлаждают и взвешивают. Через фильтр, подготовленный таким образом, пропускают 10 - 1000 мл (в зависимости от содержания взвешенных веществ) тщательно перемешанной сточной жидкости. Для ускоренного фильтрования используют воронку Бюхнера и водоструйный насос. Пробу сточной воды отбирают мерным цилиндром. Оставшийся на стенках цилиндра осадок смывают небольшой порцией фильтрата. Фильтр помещают в тот же бюкс, в котором его взвешивали до фильтрования, высушивают в сушильном шкафу при 105 °C до постоянной массы, охлаждают в эксикаторе и снова взвешивают.
Расчет. Содержание взвешенных веществ (X2, мг/л) вычисляют по формуле
![]()
где m1 - масса бюкса с фильтром, мг;
m3 - масса бюкса с фильтром и высушенными взвешенными веществами, мг;
V - объем пробы, взятой для определения, мл;
1000 - единица перевода мл в л.
Количеств взвешенных веществ можно определить и другим способом: из показателя общего содержания примесей вычитают количество растворенных веществ.
4.2. Определение взвешенных веществ фильтрованием через мембранный фильтр.
Метод применяют при содержании в пробе взвешенных веществ меньше 100 мг/л. Используют пробы очищенных отстойников из контактного резервуара или биопрудов [9].
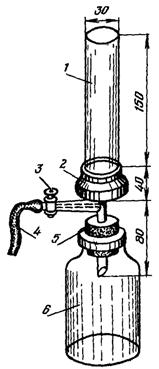
Аппаратура. Фильтровальный аппарат Олихова (рис. 1). Можно использовать и прибор Зейтца с металлической трубкой.
Мембранные фильтры (предварительные или № 4). Для удаления имеющегося в их порах воздуха, а также остатков растворителей фильтры кипятят в дистиллированной воде 5 - 10 мин, два - три раза, заменяя после каждого кипячения воду. Просушивают фильтры в сушильном шкафу при 105 °C до постоянной массы два - три часа.
Ход определения. Подготовленный мембранный фильтр, помеченный карандашом и взвешенный на аналитических весах, помещают в прибор для фильтрования. Через фильтр пропускают определенный объем сточной жидкости (объем зависит от количества взвешенных веществ). Если фильтрат недостаточно прозрачный, то его вторично пропускают через тот же фильтр. Для создания вакуума в приборе используют водоструйный или масляный насос. Осевший на стенках прибора осадок смывают фильтратом на мембранный фильтр. По окончании фильтрования фильтр с осадком подсушивают на воздухе, а затем в сушильном шкафу при 105 °C до постоянной массы и взвешивают.
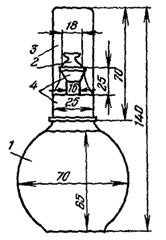
Рис. 1. Прибор Олихова для фильтрования через мембранные фильтры:
1 - стеклянная трубка; 2 - гайка с резьбой; 3 - кран; 4 - вакуумный шланг; 5 - резиновая пробка.
Расчет. Содержание взвешенных веществ (Х, мг/л) вычисляют по формуле
![]()
где a - масса мембранного фильтра с осадком, мг;
b - масса мембранного фильтра без осадка, мг;
V - объем профильтрованной анализируемой сточной воды, мл;
1000 - единица перевода мл в л.
5. ОСЕДАЮЩИЕ И ВСПЛЫВАЮЩИЕ ВЕЩЕСТВА
Взвешенные вещества определяют измерением объема осадка, выпавшего или всплывшего в течение определенного времени в пробе. Количество оседающих или всплывающих веществ можно определить до и после отстаивания пробы.
Аппаратура. Цилиндры Лисенко (емкостью один литр) для определения небольшого количества оседающих веществ и мерные цилиндры емкостью один литр для определения большого количества оседающих и всплывающих веществ.
Ход определения. В цилиндр Лисенко или мерный цилиндр наливают тщательно перемешанную пробу. Объем оседающих или всплывающих частиц измеряют через 5, 10, 15, 30, 45, 60 и 120 мин. За пять минут до начала отсчета цилиндр несколько раз вращают вокруг вертикальной оси, чтобы отделить частицы, прилипшие к стенкам. Результаты опыта используют при построении графика, отмечая на оси ординат количество всплывающих или оседающих веществ, а на оси абсцисс - время всплывания или оседания частиц.
Если через два часа сточная вода полностью не отстоялась, продолжают наблюдения (в течение 3 - 12 ч). В сточных водах оседающие вещества составляют около 65 - 70 % взвешенных веществ по массе [4].
6. ОКИСЛЯЕМОСТЬ
Количество кислорода, эквивалентное количеству расходуемого окислителя, называется окисляемостью.
В зависимости от применяемого окислителя различают окисляемость перманганатную, бихроматную и т.д. Все методы определения окисляемости условны. Результаты, полученные разными методами, могут быть различными для одной и той же пробы вследствие неодинаковой степени окисления, которая зависит от свойств окислителя, его концентрации, температуры, pH и др. Наиболее полное окисление пробы получают при обработке бихроматом калия в присутствии серной кислоты.
«Общая окисляемость» - это кислородный эквивалент всех окисляющихся органических и неорганических (за исключением хлорид-ионов) веществ.
«Окисляемость с поправкой» - это кислородный эквивалент только органических веществ. Его находят путем вычитания из результата общей окисляемости величин кислородных эквивалентов, присутствующих в пробе нитритов, сульфатов, сульфидов, железа и т.д. [4, 7]. Для сточных вод животноводческих комплексов, содержащих большое количество органических и трудноокисляемых веществ, рекомендуется бихроматный метод определения окисляемости, который в этом случае называют химическим потреблением кислорода (ХПК).
Для получения более точных результатов необходимо определять ХПК исходных навозных стоков во взболтанной пробе.
6.1. Бихроматная окисляемость (химическое потребление кислорода - ХПК).
Сущность метода. В 18 н. растворе серной кислоты (1:1) бихромат калия действует как сильный окислитель, который окисляет при кипячении большинство органических и некоторые минеральные вещества. Окисление органических веществ осуществляется до образования двуокиси углерода и воды, азот выделяется в виде газа. Метод основан на учете бихромата калия, расходуемого на окисление.
3C + 2K2Cr2O7 + 8H2SO4 = 2Cr2(SO4)3 + 2K2SO4 + 8H2O + 3Cl2.
Окисление происходит в сильнокислой среде и сопровождается восстановлением шестивалентного хрома в трехвалентный. Избыток бихромата калия, оставшийся в растворе после окисления, учитывают при титровании солью Мора.
K2Cr2O7 + 7H2SO4 + 6FeSO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O.
Для лучшего окисления органических веществ в пробе добавляют в качестве катализатора сульфат серебра. Сточные воды от свинооткормочных комплексов, поступающие на очистные сооружения, окисляются без катализатора в среднем на 56 % [10]. Поэтому добавление сернокислого серебра при определении ХПК сточных вод является обязательным.
Подготовка пробы для анализа. Определению качества сточной жидкости мешают хлориды, сульфиды, нитриты, двухвалентное железо. При содержании хлоридов более 200 мг/л результаты ХПК получаются завышенными из-за окисления их бихроматом калия до свободного хлора.
K2Cr2O7 + 7H2SO4 + 6NaCl = Cr2(SO4)3 + K2SO4 + 3Na2SO4 + 7H2O + 3Cl2.
Влияние хлоридов устраняют добавлением соли сернокислой ртути. Если концентрация хлорид-ионов превышает 1 г/л, то следует добавить в пробу на каждый миллиграмм хлорид-иона 15 мг ртути (22,5 мг сернокислой ртути) и 5 мл концентрированной серной кислоты для лучшего растворения сульфата ртути.
Влияние сульфидов можно устранить, добавив бихромат калия и небольшое количество серной кислоты к пробе перед определением, и затем смесь на несколько минут помещают в холодное место.
K2Cr2O7 + 3H2S + 4H2SO4 = Cr2(SO4)3 + 3S + K2SO4 + 4H2O.
При необходимости сероводород, нитриты, двухвалентное железо следует определять отдельно по общепринятым методикам и результат, пересчитанный в мг/г кислорода, вычитают из найденной величины окисляемости [11] .
1 мг H2S соответствует 0,47 мг кислорода
1 мг NO2 « 0,35 мг «
1 мг Fe+2 « 0,14 мг «
Реактивы. 1. Бихромат калия 0,25 н. Берут 12,259 г бихромата калия, предварительно высушенного в течение двух часов при 105 °С, растворяют в дистиллированной воде (в небольшом количестве) и доводят объем до 1 л.
2. Серная кислота, концентрированная ч.д.а. (плотность - 1,84).
3. Сернокислое серебро кристаллическое (ч.д.а.)
Его готовят следующим образом: растворяют 100 г азотнокислого серебра в 75 мл дистиллированной воды и 50 г сернокислого аммония в таком же объеме воды. Вливают горячий раствор сульфата аммония в горячий раствор азотнокислого серебра при энергичном помешивании стеклянной палочкой. Выделившийся при охлаждении кристаллический осадок серебра отфильтровывают через бумажный фильтр на воронке Бюхнера, и промывают холодной дистиллированной водой до удаления нитрат-ионов. Проводят контроль промывки: в пробирку отбирают немного фильтрата, добавляют такой же объем концентрированной серной кислоты, а затем по стенке пробирки осторожно приливают насыщенный раствор сернокислого железа. Если в фильтрате присутствует нитрат-ион, то в пробирке образуется бурое кольцо. Полученный осадок сернокислого серебра (80 г) сначала сушат между листами фильтровальной бумаги, а потом в сушильном шкафу при 50 °C также между листами фильтровальной бумаги. Хранят осадок в склянке из темного стекла. Все операции проводят быстро, так как сернокислое серебро на воздухе темнеет.
4. Сульфат ртути (ч.д.а.).
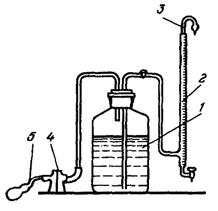
5. Соль Мора 0,25 н. Растворяют 98 г железоаммониевых квасцов (ч.д.а.) в дистиллированной воде, приливают 20 мл концентрированной серной кислоты (для предотвращения образования солей железа) и после охлаждения доводят до объема 1 л дистиллированной водой. При необходимости полученный раствор фильтруют. Хранят раствор в изолированном от воздуха сосуде (рис. 2).
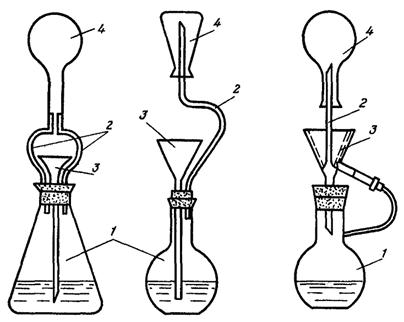
Рис. 2. Прибор для хранения титрованного раствора соли Мора:
1 - раствор соли Мора; 2 - бюретка; 3 - трубка с FeSO4; 4 - склянка Тищенко со щелочным раствором пирогаллона; 5 - резиновая груша.
Титр раствора соли Мора устанавливают для каждой серии проводимых определений: отбирают 25 мл 0,25 н. хромовокислого калия, разбавляют дистиллированной водой приблизительно до 250 мл, приливают 20 мл концентрированной серной кислоты, перемешивают и после охлаждения титруют раствором соли Мора в присутствии индикатора-N-фенилантраниловой кислоты. Титр раствора соли Мора (K, мл) определяют по формуле
![]()
где A - объем раствора соли Мора, израсходованного на титрование, 25 мл; 0,25 н. хромовокислый калий, мл; 0,25 - концентрация хромовокислого калия.
6. Индикаторы: а) фенилантраниловая кислота (порошок) - растворяют 0,2 г индикатора в 100 мл. 0,2 %-ного раствора соды. Для лучшего смачивания порошка индикатора рекомендуется взятую навеску предварительно перемешать в фарфоровой чашечке стеклянной палочкой с 2 - 5 мл 0,2 %-ного раствора углекислого натрия до пастообразного состояния, а затем довести содой до объема 100 мл при тщательном перемешивании или 0,25 г фенилантраниловой кислоты растворить в 12 мл 0,1 н раствора едкого натра и разбавить дистиллированной водой до объема 250 мл. Раствор фенилантраниловой кислоты может сохраняться до использования. Прозрачный раствор постепенно темнеет, но не портится;
б) ферроин (порошок) - 1,5 г 1,10 - фенантролина и 0,7 г сернокислого железа растворяют в 100 мл дистиллированной воды. Индикатор сохраняется больше года;
в) дефиниламин (порошок) - 0,5 г растворяют в 100 мл концентрированной серной кислоты и приливают полученный раствор к 20 мл дистиллированной воды. Этот индикатор нужно применять в присутствии фосфорной кислоты (2 мл), устраняющей окислительное действие трехвалентного железа на дифениламин. Индикатор сохраняется больше года.
Аппаратура. Колбы емкостью 250 - 300 мл для кипячения и плоскодонные колбы со шлифом, снабженные пробками с обратным холодильником.
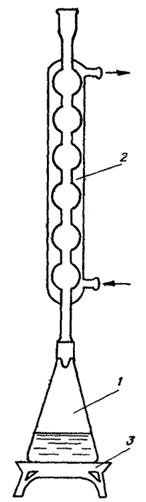
Ход определения. Загрязненные сточные воды перед определением разбавляют так, чтобы расход бихромата калия составлял не более 50 %. 20 мл пробы или меньший ее объем, доведенный до объема 20 мл дистиллированной водой, помещают в колбу со шлифом. Добавляют 10 мл 0,25 н. раствора бихромата калия, 0,4 г сульфата ртути, 0,4 г сульфата серебра. Раствор перемешивают и осторожно приливают к нему 30 мл концентрированной серной кислоты, после чего вставляют в колбу пришлифованный обратный холодильник и кипятят два часа. Прибор для определения ХПК представлен на рис. 3.
В процессе кипячения окраска раствора должна меняться от оранжевой до буровато-коричневой. Если она становится зеленой, опыт нужно повторить (недостаток окислителя). После окончания кипячения и остывания раствора отсоединяют холодильник, смывают остатки смеси из холодильника в колбу, промывают 100 мл дистиллированной водой и весь раствор снова охлаждают. Прибавляют 5 - 10 капель фенилантраниловой кислоты или 3 - 4 капли раствора ферроина или дифениламина (в присутствии фосфорной кислоты). Избыток бихромата калия титруют раствором соли Мора до изменения окраски индикатора (финилантраниловой кислоты: от вишнево-фиолетовой до буровато-зеленой; ферроина - от голубовато-зеленой до красновато-голубой; дифениламина - от оранжево-бурой до зеленой).
Параллельно проводят холостое определение с 20 мл дистиллированной воды.
Расчет. Бихроматную окисляемость (X, мг/л) кислорода вычисляют по формуле
![]()
где a - объем раствора соли Мора, израсходованной в холостом опыте, мг;
b - объем раствора соли Мора, израсходованной на титрование пробы, мл;
N - нормальность соли Мора;
K - поправочный коэффициент раствора соли Мора (0,25 н.);
V - объем пробы взятой для анализа, мл;
8 - эквивалент кислорода;
1000 - единица перевода мл в л.
Бихроматным методом можно определять окисляемость кислорода 20 - 100 мг/л. Окисление проводят 0,05 н. или 0,025 н. раствором бихромата калия, а последующее титрование 0,05 н. или 0,025 н. раствором соли Мора.
При определении бихроматной окисляемости с использованием 0,025 н. бихромата калия используют исключительно чистую посуду, так как даже незначительное загрязнение раствора следами органических веществ может повлиять на результат определения. Необходимо делать пропарку колб и холодильников. Отклонение от получаемых результатов должно составлять 10 %.
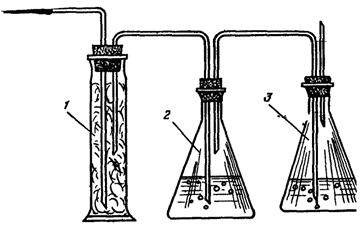
Рис. 3. Установка для определения ХПК:
1 - колба со шлифом; 2 - обратный холодильник; 3 - плитка.
6.2. Регенерация солей серебра.
Отработанные растворы, содержащие соли, ионы серебра, собирают в бутыль. Когда остаток (растворов) будет примерно 1/2 или 3/4 объема бутылки, к раствору приливают при помешивании (5 % от общего количества жидкости) техническую соляную кислоту (плотность 1,19), чтобы полностью выделить из раствора ионы серебра. Проверяют полноту осаждения хлорида серебра (проба на Cl-), после чего раствор отстаивают не менее 12 ч. Осветленный раствор (над осадком) сливают сифоном и промывают осадок водой до удаления хлора и трехвалентного железа. К промытому осадку приливают разведенную (1:4) серную кислоту (техническую) и вносят металлический цинк для восстановления серебра, примерно 235 г цинка на 1 кг хлористого серебра.
Если осадок хлористого серебра восстановился не полностью, а выделение водорода прекратилось, то сливают отработанную кислоту и наливают разбавленную серную кислоту. При необходимости добавляют немного металлического цинка. Восстановление серебра следует проводить в вытяжном шкафу.
Выделившийся темно-серый осадок металлического серебра промывают водой до удаления свободной серной кислоты и ионов цинка, после чего серебро отфильтровывают на воронке Бюхнера и высушивают. Высушенное серебро растворяют в азотной кислоте. Растворение проводят в вытяжном шкафу небольшими порциями (по 50 г) с разбавленной (1:1) азотной кислотой.
Раствор азотнокислого серебра выпаривают на электроплитке до появления пленки, после чего его оставляют кристаллизоваться, а затем выделившийся осадок фильтруют с помощью воронки Бюхнера.
Соль высушивают при 50 - 60 °C в сушильном шкафу, а фильтрат снова выпаривают. Если азотнокислое серебро имеет нейтральную реакцию среды, то его можно использовать в качестве реактива, если кислую - соль перекристаллизовывают.
6.3. Ускоренный метод определения ХПК.
Вышеописанный метод определения бихроматной окисляемости (ХПК) занимает продолжительное время. Поэтому в отдельных случаях можно применять ускоренный метод (менее точный). Рекомендуется периодически проводить определение обоими методами для нахождения ориентировочного коэффициента пересчета [9].
Ход определения. Объем пробы для анализа зависит от степени загрязненности сточной воды. Если окисляемость анализируемой пробы 50 - 500 мг/л, то для анализа берут 5 мл пробы, если окисляемость 500 - 4000 мг/л берут 1 мл, если больше (4000 мг/л), то пробы разбавляют. При окисляемости ниже 50 мг/л метод применять нельзя.
Пробу помещают в термостойкую колбу емкостью 250 мл, добавляют 2,5 мл 0,25 н. раствора бихромата калия, 0,2 г сульфата ртути (двухвалентной) и при перемешивании концентрированную серную кислоту (7,5 мл на 1 мл пробы и 15 мл кислоты на 5 мл пробы). При этом температура раствора поднимается свыше 100 °C. Через 2 мин охлаждают раствор до комнатной температуры, приливают 100 мл дистиллированной воды и титруют избыток бихромата калия раствором соли Мора, как в арбитражном методе.
Расчет проводят, как описано выше, при определении ХПК арбитражным методом.
7. РАСТВОРЕННЫЙ КИСЛОРОД
Содержание растворенного кислорода определяют при оценке качества сточной воды в открытых водоемах и контроле работы установок и сооружений для биологической очистки сточных вод. Минимальное содержание кислорода в воде для нормальной жизнедеятельности микроорганизмов в аэротенках составляет 2 мг/л. Определение растворенного кислорода является частью анализа при определении биохимического потребления кислорода (БПК). Пробы, предназначенные для определения кислорода, не консервируют.
7.1. Метод Винклера.
Сущность метода. В анализируемую пробу сразу после отбора добавляют соль двухвалентного марганца и щелочь. Образуется осадок гидроокиси марганца, который, окисляясь, превращается в марганцоватистую кислоту, нерастворимую в воде.
Mn(OH)2 + O2 = H2MnO4.
При избытке серной кислоты и иодита калия осадок растворяется.
H2MnO3 + 4H+ + 2J- = Mn+2 + J2 + 3H2O.
Выделившийся йод титруют раствором тиосульфата натрия.
J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ.
Количество выделившегося йода эквивалентно количеству кислорода, содержащегося во взятой пробе.
Этот метод используют при содержании в сточной воде не больше 0,1 мг/л азота нитритов и не более 10 мг/л окисного железа. Другие окислители или восстановители должны отсутствовать [7, 10].
Подготовка пробы к анализу. При определении растворенного кислорода необходимо учитывать присутствие в жидкости нитритов, солей железа, взвешенных веществ, сульфитов, свободного хлора. Устраняют их влияние, применяя одну из модификаций метода Винклера.
В биологически очищенных водах чаще всего определению мешают нитриты, которые в кислой среде, действуя как катализатор, способствуют окислению йодидов до йода кислородом воздуха, что приводит к повышенному расходу тиосульфата натрия и мешает окончанию титрования, так как окраска индикатора крахмала через некоторое время восстанавливается.
2KJ + 2KNO2 + 4HCl = 2NO + 4KCl + 2H2O + J2.
Влияние нитритов устраняют добавлением азида натрия, сульфаминовой кислоты или мочевины, с которыми азотистая кислота реагирует с выделением азота.
Определению мешает и большое количество взвешенных веществ, поэтому перед опытом пробу осветляют гидроокисью алюминия. Фильтрование не производят.
Выделение йода происходит при содержании в растворе свободного хлора, хлорамина, трехвалентного железа. Восстановление йода йодид вызывают сульфиты и сульфиды. Для их окисления применяют гипохлорид натрия. Влияние активного хлора устраняют добавлением роданида калия, а железа - фосфорной кислоты.
Аппаратура. Для определения растворенного кислорода применяют калиброванные склянки (от 150 до 250 мл) с пришлифованными пробками.
Калибрование склянок проводят следующим образом: на технических весах взвешивают пустую сухую склянку с пробкой с точностью до 0,01 г, заполняют ее доверху дистиллированной водой, закрывают пробкой (пузырьки воздуха не должны оставаться), воду с горлышка склянки убирают фильтровальной бумагой и снова взвешивают. По результатам двух взвешиваний определяют объем склянки [24].
Реактивы. 1. 0,5 %. раствор крахмала (5 г на 1 л). Растирают крахмал в ступке с небольшим количеством холодной дистиллированной воды и вливают при постоянном помешивании в кипящую дистиллированную воду, кипятят 5 - 10 мин и отстаивают 10 - 12 ч. После этого сливают прозрачный раствор. Для консервирования раствора добавляют салициловую кислоту (1,25 г на 1 л).
2. Сульфат марганца. В дистиллированной воде растворяют 480 г сульфита марганца (400 г сульфата марганца) или 425 г хлорида марганца. Фильтруют и доводят объем до 1 л дистиллированной водой.
Если неизвестно количество кристаллизационной воды в препарате, то плотность раствора сернокислого марганца доводят водой до 1,27 г/см3 при температуре 20 °С. В случае применения хлорида марганца для растворения осадка гидроокиси марганца применяют соляную кислоту (1:1).
3. Щелочной раствор йодида калия. В дистиллированной воде растворяют 700 г едкого кали или 500 г едкого натра, 150 г йодистого калия (ч.д.а.) и доводят объем до 1 л. В растворе должны отсутствовать карбонаты. При подкислении и разбавлении раствор не должен давать с крахмалом синего окрашивания (отсутствие нитритов йодидов, солей окиси железа), но должен синеть от добавления одной капли 0,1 н. раствора йода. Если в щелочном растворе есть вещества, выделяющие йод при подкислении, раствор обрабатывают сплавом Деварда. Для этого к раствору добавляют 1 г сплава Деварда, оставляют на 10 - 12 ч, затем нагревают до кипения (контрольная реакция на отсутствие нитритов с реактивом Грисса после нейтрализации), отстаивают и сливают прозрачный раствор. В случае поглощения щелочью йода (загрязнение сульфитами), обрабатывают щелочь раствором йода. Готовят несколько миллилитров щелочного йодида и проводят с ним, а также с проверенным щелочным йодидом несколько параллельных определений растворенного кислорода в пробе одной и той же воды. По изменению объема гипосульфита, пошедшего на титрование, и выделившегося йода в равных объемах воды, вычисляют количество йода, поглощенного испытуемым раствором йодида. Добавляют расчетное количество титрованного раствора йода в раствор щелочи и затем йодид.
Йодистый калий необходимо бережно хранить. Если он загрязнен, то приобретает слабо-желтоватый цвет, тогда его сушат при 110 °C, чтобы удалить йод (реактив становится белым).
4. Серная кислота (2:3). Разбавленный раствор серной кислоты не должен синеть в присутствии крахмала при добавлении к нему раствора йодистого калия, свободного от йодатов.
5. Серная кислота (1:4).
6. Тиосульфат натрия 0,01 н. раствор. В свежепрокипяченной дистиллированной воде растворяют 2,5 г серноватистокислого натрия (ч.д.а.) и доводят объем до 1 л. Добавляют 4 мл 1 н. едкого натра и 5 мл хлороформа. Раствор хранят в темной склянке без доступа углекислого газа.
Титр устанавливают по бихромату калия и периодически проверяют.
Установка титра по бихромату калия (K2Cr2O7).
В коническую колбу с притертой пробкой приливают 100 мл дистиллированной воды и добавляют 1,8 г йодистого калия, 15 мл 2 н. соляной кислоты и 20 мл 0,01 н. двухромовокислого калия.
После перемешивания раствор оставляют стоять в темном месте 15 мин и затем титруют 0,01 н. раствором тиосульфата натрия, предварительно добавив 1 - 2 мл крахмала (в качестве индикатора). Титр (K) тиосульфата натрия проверяют не реже одного раза в неделю.
![]()
где a - количество 0,01 н. раствора тиосульфата натрия, пошедшего на титрование, мл;
20 - количество титруемого 0,01 н. раствора двухромовокислого калия, мл.
7. Едкое кали с азидом. Растворяют 700 г едкого кали в 700 мл дистиллированной воды, 10 г азида натрия растворяют в 40 мл дистиллированной воды. Оба раствора смешивают и доводят объем до 1 л. Если раствор не прозрачен, то его отстаивают и сифонируют.
8. Едкое кали с йодидом и азидом натрия. В 700 мл дистиллированной воды растворяют 700 г едкого кали и 150 г йодида калия. Отдельно растворяют 40 г азида натрия в 40 мл дистиллированной воды. Оба раствора смешивают и объем доводят до 1 л. Если раствор не прозрачен, его отстаивают, а затем сифонируют.
9. Сульфаминовая кислота или мочевина, 40 %-ные водные растворы.
10. Едкое кали, 70 %-ный раствор.
11. Йодид калия, раствор 15 %-ной концентрации. Растворяют 15 г йодида калия (ч.д.а.) в дистиллированной воде, прибавляют 1 мл 1 н. раствора едкого натра и доводят до объема 100 мл. Для проверки раствора 2 мл его помещают в колбу со 100 мл дистиллированной воды и 5 мл серной кислоты (1:4). После добавления 5 мл раствора крахмала окраска не должна появляться.
12. Двухромовокислый калий 0,01 н. раствор. Растворяют 0,4904 г бихромата калия (ч.д.а.), высушенного при 105 °C, в дистиллированной воде и доводят объем до 1 л. 0,01 н. Раствор биохромата калия можно приготовить из 0,01 н. фиксанала, разбавляя его в 10 раз.
13. Соляная кислота 2 н. Берут 41,75 мл соляной кислоты (плотность 1,19) и доводят до объема 250 мл дистиллированной водой.
Ход определения. В склянки объемом 300 - 380 мл наливают по 2 мл реактивов, а в склянки на 150 - 250 мл и 125 мл и меньше - соответственно по 1 и 0,5 мл реактивов.
7.2. Определение кислорода при отсутствии нитритов.
В калиброванную кислородную склянку, заполненную доверху испытуемой водой, вводят пипеткой 1 мл раствора сульфата марганца, погружая ее до дна склянки. Другой пипеткой приливают 1 мл щелочного раствора йодида калия. В этом случае пипетку вводят в горлышко кислородной склянки. При этом выливается 2 мл анализируемой воды (сколько налили реактивов). При расчетах вносят соответствующую поправку.
При добавлении в склянки ёмкостью 250 мл 1 мл раствора сульфата марганца кислород полностью поглощается через 40 - 50 сек после тщательного перемешивания, при добавлении 2 мл раствора - через 25 - 30 сек. Перемешивают содержимое склянки и к осевшему осадку добавляют 3 мл серной кислоты (2:3) так, чтобы не взмутить осадок. После этого закрывают склянку пробкой и тщательно перемешивают содержимое. Если при приливании кислоты осевший осадок начинает всплывать (за счет выделяющегося углекислого газа), то это объясняется обилием карбонатов в щелочном растворе йодида и карбонатной жесткостью испытуемой воды. Чтобы избежать ошибки, в анализе перед подкислением из склянки отбирают 3 мл жидкости в колбу для титрования, в которой содержится немного серной кислоты. Вставляя пробку, собирают вытекшую воду в ту же колбу для титрования. После растворения осадка содержимое склянки переносят в колбу для титрования. Титруют 0,01 н. раствором тиосульфата натрия до бледно-соломенного цвета. Затем в колбу добавляют 1 мл раствора крахмала и быстро титруют до исчезновения синей окраски. Кислородную склянку ополаскивают титрованным раствором. При посинении раствора его дотитровывают тиосульфатом натрия.
Расчет. Содержание растворенного кислорода (X, мг/л) вычисляют по формуле
![]()
где a - количество 0,01 н. раствора тиосульфата натрия, пошедшего на титрование пробы, мг;
K - поправочный коэффициент раствора тиосульфата натрия;
0,08 - количество кислорода, которому соответствует 1 мл 0,01 н. раствора тиосульфата натрия;
V1 - объем склянки, в котором фиксировался кислород, мл;
V2 - объем реактивов, взятых для фиксации кислорода, мл;
1000 - единица перевода мл в л.
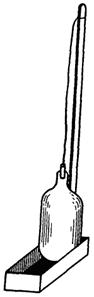
Растворенный кислород в присутствии активного ила. При отборе проб из аэротенков на определение растворенного кислорода необходимо приостановить потребление кислорода активным илом. В качестве консервирующего вещества применяют 10 %-ный раствор сернокислой меди. Пробу иловой смеси отбирают при помощи специального устройства (рис. 4).
Для отбора проб используют склянки емкостью 400 - 500 мл с хорошо притертыми пробками. В склянку перед отбором пробы наливают сернокислую медь 2,5 мл на 1 г сухого ила.
Заполняют ее жидкостью так, чтобы не оставалось пузырьков воздуха. Замеряют температуру жидкости, закрывают склянку пробкой. После оседания ила сливают жидкость сифоном в калиброванную склянку с притертой пробкой.
7.3. Определение растворенного кислорода по Ридель-Стюарту (в присутствии нитритов).
Сущность метода. Метод основан на реакции окисления нитритов и нестойких органических веществ перманганатом калия в кислой среде и последующим определением растворенного кислорода йодометрическим способом (метод Винклера).
Рис.4. Прибор для взятия проб на растворённый кислород.
Подготовка пробы для анализа. Определению мешают активный ил, органические вещества, железо. Активный ил перед определением осаждают раствором сернокислой меди. Нитриты, нестойкие органические вещества окисляют перманганатом калия в кислой среде. Железо связывают фтористым калием. Метод не применяют при наличии закисных солей железа и нитритов больше 0,1 мг/л.
Реактивы. 1. Раствор перманганата калия 0,2 н. Берут 6,32 г перманганата калия, растворяют в 1 л дистиллированной воды.
2. Раствор щавелевой кислоты. 1,4 г щавелевой кислоты растворяют в 100 мл дистиллированной воды (раствор быстро портится). 1 мл раствора восстанавливает около 1,1 мл раствора перманганата калия.
3. Раствор фтористого калия. В дистиллированной воде растворяют 40 г фторида калия и объем доводят до 100 мл.
4. Фосфорная кислота, 85 %-ный раствор.
5. Серная кислота разведенная (2:3).
6. Реактивы для йодометрического определения растворенного кислорода (см. реактивы - Растворенный кислород).
Ход определения. В калиброванную склянку, заполненную испытуемой жидкостью, наливают 0,5 мл серной кислоты (2:3) и добавляют раствор перманганата калия. Если окраска при встряхивании исчезает, то добавляют еще раствор перманганата калия (по 0,5 или 1 мл) до появления фиолетовой окраски, не считаясь с коричневым окрашиванием. Если количество перманганата калия превысит 5 мл, то пользуются более концентрированным раствором (1 - 5 %-ным, в зависимости от содержания нитритов).
Пробе (фиолетовый цвет) дают постоять 15 мин. Затем приливают 0,5 мл раствора щавелевой кислоты для разрушения избытка перманганата калия. Если через 5 мин окраска сохраняется, снова добавляют 0,5 мл раствора и ждут полного обесцвечивания, так как даже следы коричневатой окраски дадут выделение йода из йодидов (получают не точный результат).
В присутствии солей железа обесцвечивание протекает иногда медленно (24 ч и более), тогда добавляют 2 мл фтористого калия. Влияние железа можно устранить, если при растворении осадка добавить 4 мл 85 %-ной фосфорной кислоты.
Если железа в пробе больше 1 мг/л, то обесцвечивание необходимо проводить в темноте, так как на свету щавелевая кислота восстанавливает соли железа из окисных в закисные. К обесцвеченному раствору прибавляют 1 мл сернокислого марганца и 3 мл щелочного раствора йодистого калия. Закрывают склянку пробкой и перемешивают. Когда выпадает осадок, открывают склянку и добавляют 3 мл серной кислоты (2:3). Закрывают склянку пробкой и перемешивают. Выливают содержимое склянки в колбу для титрования. Титруют 0,01 н. раствором тиосульфата натрия до бледно-соломенного цвета, приливают 1 мл крахмала и снова титруют до исчезновения синей окраски раствора. Последующее появление синей окраски не учитывают.
При большом содержании нитритов после растворения осадка в кислоте, содержимое кислородной склянки переливают в колбу для титрования, в которую предварительно наливают насыщенный раствор уксуснокислого натрия. Объем его зависит от объема склянки, реактивов, поэтому устанавливают один раз для данных условий опыта. Количество необходимого уксуснокислого натрия (46,25 г на 100 л воды) определяют в холостом опыте с дистиллированной водой, в которую вносят те же объемы реактивов, что и при определении растворенного кислорода в пробе. После титрования йода в колбу добавляют несколько капель индикатора (бром-фенолового синего, 2 %-ный спиртовой раствор) и при помешивании раствор уксуснокислого натрия до перехода окраски из желтой в сине-голубую, что соответствует pH 4 [13].
Если трудно установить границу изменения окраски, то в кислородную склянку с дистиллированной водой не наливают раствор сернокислого марганца. После добавления в пробу насыщенного раствора уксуснокислого натрия выделившийся йод титруют тиосульфатом натрия.
Расчет. Содержание растворенного кислорода (X, мг/л) вычисляют по формуле
![]()
где a - количество 0,01 н. раствора тиосульфата натрия, пошедшего на титрование пробы, в мл;
K - поправочный коэффициент раствора тиосульфата натрия;
0,08 - количество кислорода, которому соответствует 1 мл 0,01 н. раствора тиосульфата натрия;
V1 - объем склянки, в котором фиксировался кислород, мл;
V2 - объем реактивов, взятых для окисления и осаждения, в мл;
1000 - единица перевода мл в л.
8. БИОХИМИЧЕСКОЕ ПОТРЕБЛЕНИЕ КИСЛОРОДА (БПК)
8.1. Метод разбавления (для неочищенных сточных вод).
Определение БПК основано на способности микроорганизмов минерализовать органические вещества. Биохимическое потребление кислорода не включает расхода кислорода на нитрификацию. Метод позволяет учитывать потребление кислорода в первую очередь относительно нестойких, легко окисляемых органических веществ.
Определяют пятисуточное потребление кислорода (БПК5) или полное биохимическое потребление кислорода (БПКполн.).
Сущность метода. Исследуемую сточную воду после двухчасового отстаивания разбавляют специально подготовленной дистиллированной водой, взятой в таком объеме, чтобы содержащегося в ней кислорода было достаточно для полного окисления органических веществ, находящихся в сточной жидкости (стоки вторичных отстойников не отстаивают). Определив содержание растворенного кислорода в полученной смеси, ее оставляют в закрытой склянке. Повторное определение проводят через 5, 10, 15, 20, 25, 30 суток.
Содержащийся кислород в первоначально разбавленной пробе будет обеспечивать нормальные условия протекания аэробных биохимических процессов, если анализируемая смесь пробы с разбавляющей водой будет насыщена кислородом перед началом определения опыта (приблизительно до 8,8 мг/л при 20 °С). Во время инкубационного периода потребление кислорода должно быть не менее 3 - 4 мг/л, а концентрация кислорода после инкубационного периода - не меньше 3 - 4 мг/л. Наиболее правильным считается результат анализа БПК, когда израсходовано приблизительно 50 % первоначально присутствовавшего кислорода.
Лабораториям всех ведомств рекомендуется для исходных и прошедших обработку сточных вод комплексов определять БПК полное [3, 14].
Подготовка пробы для анализа. Величина БПК зависит от процессов, которые протекают в пробе в период между отбором пробы и ее обработкой. Взятую пробу необходимо сразу обработать. Если невозможно выполнить анализ в день отбора пробы, то пробу хранят при низкой температуре в холодильнике. Определяют БПК во взболтанных, отстоянных или фильтрованных пробах. Предварительная обработка пробы зависит от характера исследуемого объекта или указаний контролирующего органа. Способ предварительной обработки пробы всегда приводится с результатами анализа.
Определению БПК мешают токсичные вещества (медь, свинец и другие тяжелые металлы, активный хлор и т.д.). Их действие проявляется и после разбавления пробы. В таких случаях правильную величину БПК можно определить после удаления из воды токсичных веществ или соответствующим разбавлением пробы при котором устраняется действие биоцидов [15].
При определении БПК сточных вод, обработанных хлором или хлорной известью, следует предварительно удалить избыток активного хлора. При малом его содержании (0,5 мг/л) вода должна отстояться один-два часа. При более высоком содержании активный хлор следует удалять сульфитом натрия [15]. Для определения требуемого количества сульфита натрия отбирают порцию сточной воды, подкисляют 0,02 н. соляной кислотой, приливают 10 мл 10 %-ного йодистого калия, крахмал и титруют 0,025 н. раствором сульфита натрия до исчезновения синего окрашивания раствора.
Можно также обрабатывать пробы тиосульфатом натрия. Необходимое его количество для восстановления свободного хлора определяют титрованием. К 100 мл пробы приливают 10 мл серной кислоты (1:50), 10 мл 10 %-ного раствора йодистого калия, титруют раствором тиосульфата натрия в присутствии индикатора-крахмала.
Раствор сульфита натрия - 3,5 г кристаллического сернистокислого натрия растворяют в 1 л воды, добавляют серную кислоту и устанавливают pH 4 - 5. Титр раствора устанавливают по йоду. Раствор тиосульфата натрия - 0,16 г растворяют в 100 мл дистиллированной воды непосредственно перед употреблением (раствор плохо сохраняется). К 100 мл испытуемой воды наливают эквивалентное количество раствора сульфита натрия, рассчитанное по результатам титрования. Качественными реакциями определяют присутствие свободного хлора и сернистокислого натрия (тиосульфата натрия). С этой целью к 10 мл пробы прибавляют раствор крахмала и одну каплю 0,01 н. раствора йода. Если нет избытка сернистокислого натрия, получают синее окрашивание. Пробу для определения БПК берут до хлорирования, так как усложненная методика определения БПК в присутствии активного хлора часто дает большие неточности в анализе [6].
Приготовление дистиллированной разбавляющей воды. Дистиллированная вода не должна содержать веществ, которые оказывают влияние при определении БПК - меди больше 0,01 мг/л, цинка - больше 1 мг/л, а также хлора, хлорамина и других бактерицидных веществ. Дистиллированную воду выдерживают в бутылях, закрытых ватным тампоном, в течение нескольких дней при комнатной температуре.
Свежеприготовленная дистиллированная вода аэрируется продолжительное время. Насыщенную кислородом дистиллированную воду тщательно предохраняют от загрязнений. Сосуды, предназначенные для хранения такой воды, нельзя использовать для других целей.
Перед применением в дистиллированную воду (1 л) прибавляют по 1 мл следующих растворов:
1) раствор сульфата магния - 22,5 г MgSO4 × 7H2O (ч.д.а.) растворяют в дистиллированной воде и доводят до объема 1 л;
2) раствор хлористого кальция - 27,5 г CaCl2 безводного (ч.д.а.) растворяют в дистиллированной воде и доводят до объема 1 л;
3) раствор хлористого железа - 0,25 г FeCl3 × 6H2O (ч.д.а.) растворяют в дистиллированной воде и доводят до объема 1 л:
4) фосфатный буферный раствор pH 7,2 - 8,5 г KH2PO4, 21,75 г K2HPO4, 33,4 г Na2HNO4 × 7H2O и 1,7 г NH4Cl растворяют в дистиллированной воде и доводят до объема 1 л. После прибавления солей воду хорошо перемешивают, но не аэрируют. Разбавляющая вода при 20 °C должна содержать приблизительно 8,8 мг/л растворенного кислорода.
Сточные воды свиноводческих комплексов содержат большое количество микроорганизмов, способных развиваться за счет загрязнения стока, поэтому искусственного заражения разбавляющей воды бактериальной затравкой не делают.
Разбавление сточной воды. Ориентировочно разбавление сточной водой рассчитывают по результату определения ХПК бихроматным методом.
Условно принимают, что БПК5 составляет 40 - 60 % от ХПК, вычисленное значение БПК5, выраженное в мг/л, делят на 4 или 5. Полученный результат показывает, во сколько раз надо разбавить анализируемую пробу.
Пример расчета. ХПК пробы равно 5000 мг/л. Принимаем БПК5 равным 42 % от ХПК, что составляет 2100 мг/л. Делим эту величину на 4 и получаем результат - сточную воду надо разбавить в 520 раз.
Правильность разбавления сточной воды проверяют следующим образом: после всего периода инкубации величина концентрации кислорода в жидкости и потребления кислорода должна быть не менее 3 - 4 мг/л.
Результаты анализа проб с разным разбавлением необязательно должны иметь одинаковые значения. Необходимо следить за тем, чтобы разбавленная смесь имела температуру 20 °C, а pH смеси 7 - 8,3.
Мерные колбы для разбавления и склянки для инкубации следует обезжиривать хромовой смесью, тщательно промывать и пропаривать, так как незначительное загрязнение при больших разбавлениях вызывает резкое увеличение БПК (рис. 5, 6).
Реактивы. (см. - растворенный кислород)
Аппаратура. 1. Кислородные склянки (см. растворенный кислород). Для устранения потерь кислорода или его добавочного поглощения во время инкубации необходимо применять водяные затворы.
Рис. 5. Склянка для инкубации при определении БПК:
1 - склянка; 2 - притертая пробка; 3 - колпачок; 4 - шлиф.
Рис. 6. Приборы для обработки посуды паром:
1 - колба с водой; 2 - трубка для пара; 3 - воронка для стока конденсированной воды; 4 - очищаемый сосуд.
Специальные склянки для определения БПК имеют колпачки, которые и выполняют роль водяных затворов (рис. 5). Если в лаборатории нет таких склянок, то можно использовать бутыли с притертыми пробками. В качестве водяного затвора могут быть использованы фотографические кюветы, заполненные дистиллированной водой и помещенные в термостат. В кювете ставят склянки пробкой вниз. Используют и резиновые соски. Соску заполняют водой, склянку переворачивают вверх дном и на ее горлышко натягивают соску с водой.
2. Термостат на 20 °С регулируется автоматически. Отклонение от нормы составляет ± 1 °С.
Xод определения. В мерную колбу емкостью 1 л наливают с помощью сифона (не должны попадать пузырьки воздуха) разбавляющую воду до половины колбы, приливают рассчитанный по ХПК точно отмеренный объем исследуемой сточной воды, предварительно взболтанной или отстоянной в течение двух часов, и доливают до метки разбавляющей водой. Колбу закрывают пробкой и содержимое тщательно перемешивают. Если требуется большее разбавление, то из полученного объема жидкости опять отбирают отмеренный объем жидкости и доводят объем до 1 л в другой колбе.
Разбавленную сточную воду разливают с помощью сифона в 7 калиброванных склянок для последующей инкубации на 5, 10, 15, 20, 25, 30 суток. При наличии достаточного количества склянок целесообразно проводить параллельные опыты, для чего разбавленную сточную воду разливают в 14 калиброванных склянок, наполняют их доверху и закрывают кососрезанными притертыми пробками так, чтобы не оставалось пузырьков воздуха. Затем эту воду наливают в колпачки от склянок и, перевернув склянки вверх дном, вставляют их в колпачки, вытесняя из последних воду так, чтобы пузырьки воздуха не попали в колпачки. Склянки ставят в нормальное положение и помещают в термостат при 20 °С. Таким же образом наполняют семь других калиброванных склянок только разбавляющей водой (контрольный опыт) и помещают их в термостат. После заполнения сосудов испытываемыми жидкостями сразу определяют растворенный кислород (см. растворенный кислород) в склянке с испытываемой водой и в склянке с разбавляющей водой. Остальные склянки инкубируют в термостате. Через 5, 10, 15, 20, 25, 30 суток от начала инкубации вынимают по одной склянке с испытуемой водой и по одной склянке с разбавляющей водой и определяют в них содержание растворенного кислорода по Винклеру и нитритов по Гриссу. Если в пробе начался процесс нитрификации (концентрация нитритов 0,1 мг/л), то дальнейшее определение БПК не проводят. Нитриты определяют в воде, налитой в колпачок.
При появлении следов нитритов следующее определение проводят чаще, через 2 - 3 дня.
Наиболее точные результаты при определении (БПК) получают в пробах, где нитрификация только началась.
Расчет. БПК (мг/л) рассчитывают по формуле
![]()
где A1 - концентрация растворенного кислорода в пробе, в начале инкубации, мг/л;
A2 - концентрация растворенного кислорода в пробе после инкубации, мг/л;
B1 - концентрация растворенного кислорода в разбавляющей воде в начале инкубации, мг/л;
B2 - концентрация растворенного кислорода в разбавляющей воде после инкубации, мг/л;
V - объем сточной воды в 1 л пробы после всех разведений, мл;
1000 - единица перевода мл в л.
Определить истинное значение полной биохимической потребности в кислороде сложно, так как в пробе остается незначительное количество органических веществ, окисление которых проходит одновременно с процессом нитрификации.
Данный метод определения БПК имеет ряд недостатков: длительные сроки инкубации, предварительное разбавление сточной жидкости, неточность получаемых результатов (погрешность 10 - 20 %), объем окисленного вещества учитывают лишь до начала нитрификации.
Наряду с БПК используют показатель ХПК. Показатель ХПК можно определить за 2,5 - 3 ч с точностью ± 10 %. При автоматическом измерении ХПК титрометрами и специальными приборами продолжительность измерения сокращается, а точность определения составляет 0,5 - 1 % [5];
Для экскрементов свиней соотношение величины ХПК к БПКполн. и БПК5 составляет 1:0,84:0,42 (ОНТП 17-81). Для сточных вод эти соотношения определяют экспериментально для каждого конкретного случая.
8.2. Определение БПКполн. через ХПК. Методы определения с применением ингибиторов нитрификации (для неочищенных сточных вод).
Сущность
метода. Разрушение органических веществ при биохимическом окислении
происходит по схеме: органическое вещество + микроорганизмы ![]() CO2
+ H2O + прирост
биомассы + органическое вещество (оставшееся).
CO2
+ H2O + прирост
биомассы + органическое вещество (оставшееся).
Если определить ХПК, то расход кислорода на окисление органических веществ до CO2 и H2O и на превращение их в биомассу есть величина БПК за время инкубации.
БПКполн. = (ХПКожидкости + ХПКобиомассы) - (ХПКпжидкости + ХПКпбиомассы)
или
БПКполн = (ХПКн.ж. + ХПКн.т.) - (ХПКк.ж. + ХПКк.т.),
где ХПКн.ж. + ХПКн.т. - значения ХПК жидкой и твердой (введенной затравки) фаз в начале инкубации;
ХПКк.ж. + ХПКк.т. - значения ХПК жидкой и твердой фаз в конце инкубации (вещества неокислившиеся и превратившиеся в биомассу).
Для определения БПК проводят определения ХПК до и после инкубации. При первом определении ХПК следует учитывать введенную затравку, а при втором - образовавшуюся биомассу, не отделяя ее фильтрованием.
Для доведения процесса биохимического окисления до конца, а не только до появления следов (0,1 мг/л) нитрит-ионов (как это делали при определении БПК методом разбавления, условно принимаемого за БПК полное), в раствор вводят ингибитор - этилентиомочевину, который подавляет жизнедеятельность нитрифицирующих бактерий, но не влияет на бактерии, осуществляющие основной процесс биохимического окисления [18].
Определение конечного ХПК (ХПКк.ж. + ХПКк.т.) проводят через 3, 5, 7 и т.д. суток до получения постоянной величины, которую и используют в приведенной выше формуле расчета.
Если в конце определения провести фильтрование аликвотной части пробы и определить ХПК фильтрата = ХПКк.ж., то можно рассчитать показатели, характеризующие способность сточной воды очищаться в биохимических сооружениях [19].
Величина А показывает, какая часть присутствующих в пробе органических веществ не подвергается биохимическому окислению.
![]()
Величина Б характеризует количество биомассы, которое образуется в процессе анализа биохимического потребления кислорода.
![]()
Показатель В - отношение величины БПК за определенное время суток к начальному ХПК, то есть к общему содержанию органических веществ. Он характеризует относительное количество «биохимически мягких» веществ.
![]()
Показатель Г характеризует относительное количество «биохимически жестких» органических веществ.
![]()
8.3. Определение БПКполн. с «продуванием воздуха» и применение ингибиторов нитрификации.
Метод апробирован в производственных условиях на свиноводческих неочищенных стоках, применение ограничено из-за этилентиомочевины.
Реактивы. Реактив А - 28,25 г фосфат калия однозамещенного и 149,25 г фосфат натрия растворяют в дистиллированной воде и объем доводят до 1 л. Реактив Б - 3,66 г хлорид кальция и 28,64 г хлорид аммония растворяют в дистиллированной воде и объем доводят до 1 л. Реактив В - 3,06 г сульфат магния, 0,7 г сульфат железа и 0,4 г сульфат цинка растворяют в дистиллированной воде и доводят той же водой до объема 1 л. Раствор этилентиомочевины 500 мг/л.
Ход определения. Если концентрация органических веществ в пробе превышает (в пересчете на ХПК) 3000 мг/л, то пробу предварительно разбавляют. В мерную колбу емкостью 250 мл наливают 150 мл пробы (неразбавленной или разбавленной, как указано выше), приливают 10 мл реактива А, 5 мл реактива В, 5 мл реактива С, 5 мл заражающей микроорганизмами воды (фильтрат очищенной воды из аэротенка или другая подобная жидкость, БПК ее не больше 5 - 8 мг/л), 0,25 мл 0,05 %-ного раствора этилентиомочевины, разбавляют анализируемой пробой до метки и хорошо перемешивают, pH полученного раствора должен быть 6,5 - 7,5. Отбирают 25 мл раствора и определяют начальное ХПК. Остальную жидкость переливают в коническую колбу емкостью 500 мл и туда подают воздух (250 мл/мин). Воздух должен быть очищенным и увлажненным. Для этого перед колбой с исследуемой жидкостью помещают сосуд и колбу с дистиллированной водой. Схема установки на рис. 7. Процесс инкубации проводят при 20 °C.
Через 3, 5, 7, 10 суток отбирают из колбы порции смеси (предварительно хорошо перемешивают раствор) и определяют в них величину ХПК. Фильтровать смесь не следует. Определяют сумму ХПКк.ж. + ХПКк.т.. Когда эта величина практически перестанет изменяться, процесс биохимического окисления считают законченным.
Расчет. Значение БПКполн. находят путем вычитания из результата начального ХПК значения конечного ХПК обеих фаз (жидкой и твердой). Эту величину разности умножают на 1,11 (коэффициент, отражающий разбавление пробы при добавлении реактивов) и на коэффициент, выражающий первоначальное разбавление пробы, если такое разбавление было сделано.
Рис. 7. Установка для определении БПК:
1 - цилиндр с ватой; 2 - колба с дистиллированной водой; 3 - колба со сточной жидкостью.
Вышеизложенный метод определения БПКполн. по сравнению с методом разбавления имеет преимущества: окисление органических веществ происходит не до начала нитрификации, а до конца благодаря применению ингибитора нитрификации - этилентиомочевины: сокращаются сроки инкубации до 5 - 10 суток; определяют БПКполн. сточных вод с содержанием органических веществ по ХПК до 3000 мг/л без разбавления.
Синтез этилентиомочевины. В двухлитровую круглодонную колбу помещают 120 г (1,83 моля) 92 %-ного этилендиамина, 300 мл 95 %-ного этилового спирта и 300 мл воды. Присоединяют к колбе обратный холодильник. В делительную воронку, соединенную при помощи пробки с вырезом с верхней частью холодильника, наливают 121 мл сероуглерода и по каплям добавляют его в круглодонную колбу. Когда начнется бурная реакция подставляют под колбу водяную баню, нагретую до 60 °C. Остаток сероуглерода добавляют так, чтобы пары его поднимались на 1/3 высоты обратного холодильника. На добавление сероуглерода требуется около двух часов. К концу этого времени температуру бани повышают до 100 °C и смесь кипятят еще в течение одного часа. Затем к содержимому колбы добавляют 15 мл концентрированной соляной кислоты и кипятят в вытяжном шкафу (температура бани 100 °C) 9 - 10 ч. После этого смесь охлаждают в бане со льдом. Препарат отфильтровывают (под вакуумом) на воронке Бюхнера и промывают холодным ацетоном (200 - 300 мл). Получают 155 - 167 г бесцветных кристаллов.