 | Информационная система |  |
3.5.2. ДЕЗИНСЕКЦИЯ
Методы
определения
эффективности инсектицидов, акарицидов,
регуляторов развития и репеллентов,
используемых в медицинской дезинсекции
Методические указания
МУ 3.5.2.1759-03
1. Разработаны: Институтом медицинской паразитологии и тропической медицины им. Е. И. Марциновского, кафедрой паразитологии, паразитарных и тропических болезней ММА им. И. М. Сеченова (В. П. Сергиев, Л. А. Ганушкина, В. П. Дремова, Р. Л. Наумов, М. М. Артемьев, И. С. Васильева, В. П. Гутова, А. С. Ершова, Е. А. Черникова); Научно-исследовательским институтом дезинфектологии Минздрава России, кафедрой дезинфектологии ММА им. И. М. Сеченова (М. Г. Шандала, Е. И. Баканова, О. М. Германт, О. Ю. Еремина, М. Н. Костина, Ю. В. Лопатина, В. В. Олифер, Т. А. Перегуда, С. А. Рославцева, А. И. Фролова, Н. А. Хрусталева, Н. И. Шашина); Министерством здравоохранения Российской Федерации (Н. В. Шестопалов, Л. С. Бойко); Федеральным центром государственного санитарно-эпидемиологического надзора (Т. Н. Сыскова, Т. Н. Цыбина); Центром государственного санитарно-эпидемиологического надзора в г. Москве (Т. Н. Иванова, В. Ф. Негрий); Центром государственного санитарно-эпидемиологического надзора в г. Нижневартовске (Т. М. Гузеева); Центром государственного санитарно-эпидемиологического надзора в г. Нижнем Новгороде (Т. Д. Душина).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Министерстве здравоохранения Российской Федерации (протокол № 19 от 19 сентября 2003 г.).
3. Утверждены и введены в действие Главным государственным санитарным врачом Российской Федерации, Первым заместителем Министра здравоохранения Российской Федерации Г. Г. Онищенко 28 сентября 2003 г.
4. Введены впервые.
СОДЕРЖАНИЕ
|
|
|
УТВЕРЖДАЮ |
|
|
|
Главный государственный санитарный |
|
|
|
Г. Г. Онищенко |
|
|
|
28 сентября 2003 г. |
|
|
|
Дата введения: с момента утверждения |
3.5.2. ДЕЗИНСЕКЦИЯ
Методы определения
эффективности инсектицидов, акарицидов,
регуляторов развития и репеллентов,
используемых в медицинской дезинсекции
Методические указания
МУ 3.5.2.1759-03
1. Область применения
Методические указания предназначены для специалистов организаций, занимающихся тестированием и исследованием инсектоакарицидной, рострегулирующей, репеллентной и аттрактивной активности различных веществ и эффективности препаративных форм на их основе, рекомендуемых для целей медицинской дезинсекции.
2. Общие положения
Вновь синтезированные вещества проходят скрининг (отбор). Вещества, поступающие на скрининг, должны быть снабжены паспортом, в котором указаны химическая формула, молекулярная масса, степень чистоты соединения, основные физико-химические параметры, организация, в которой синтезировано соединение.
При изучении препаративных форм дезинсекционных средств должна быть представлена рецептура, в которой указаны все компоненты и их процентное содержание.
2.1. Расчет дозировок и оценка токсичности препаратов
Если инсектоакарицидность веществ для членистоногих неизвестна, исследования проводят в два этапа, если же имеются ориентировочные сведения об уровне инсектоакарицидности, исследования начинают сразу со второго этапа.
На первом этапе для испытания готовят серию из 4 - 5 последовательных 10-кратных разведений испытуемого вещества. Вначале готовят исходный раствор (Сисх) с концентрацией вещества, необходимой для получения исследуемых концентраций ДВ.
Расчет концентрации исходного раствора (эмульсии, суспензии) проводят по формуле:
![]() (1)
(1)
где
А - необходимая концентрация ДВ;
В - необходимое количество раствора;
С - концентрация ДВ в веществе.
Пример 1. Из вещества, содержащего 90 % ДВ, необходимо приготовить 100 мл раствора с концентрацией ДВ 0,3 %.
Сисх. = 0,3 ´ 100 : 90 = 0,33 мл (мг), т. е. к 99,67 мл растворителя необходимо добавить 0,33 мл испытуемого вещества.
Пример 2. Из 50 % концентрата эмульсии необходимо приготовить 0,7 %-ную водную эмульсию.
Сисх. = 0,7 ´ 100 : 50 = 1,4 мл.
В том случае, если необходимо приготовить раствор заданной концентрации для обработки определенной площади так, чтобы получить заданную дозировку, производят расчет по формуле 2:
![]() , (2)
, (2)
где
Спреп. - концентрация ДВ в препарате;
Сисх. - концентрация ДВ в исходном растворе;
D - заданная дозировка;
S - площадь обрабатываемой поверхности;
V - объем препарата для обработки этой поверхности.
Пример. Нужно получить дозировку (D) величиной 0,1 г/м при обработке диска из фильтровальной бумаги площадью (S) 78 см2 (0,0078 м2) раствором в объеме (V) 1 мл. Концентрация ДВ в препарате (Спреп.) - 5 % (0,05). Все показатели используют в одной размерности - граммы и квадратные метры или килограммы и гектары. Проценты обозначают десятичной дробью (5 % = 0,05).
Расчет: Сисх. = (0,1 ´ 0,0078) : (0,05 ´ 1) ´ 100 % = 1,56 %.
То есть, для получения исходного (рабочего) раствора нужно приготовить 1 мл 1,56 %-ного раствора препарата (развести в соотношении 1 : 63).
Из исходного раствора готовят серию 10-кратных разведений. Для этого к 1 мл исходного раствора добавляют 9 мл растворителя и в результате получают второе разведение; к 1 мл второго разведения добавляют 9 мл растворителя и получают третье разведение и т. д. В нашем примере получаем серию растворов, 1 мл которых на фильтрах стандартного размера обеспечивает дозировки 0,1, 0,01, 0,001 г/м2 и т. д.
На втором этапе для исследования препаратов за исходный берут раствор с максимальным разведением, вызвавшим 100 %-ную гибель особей в опытах первого этапа и исследуют серию растворов с нисходящими 2-кратными разведениями.
Для определения СД50 (95,99), СК50 (95,99) используют графический способ вычисления этих показателей на пробит-логарифмической бумаге. На оси абсцисс откладывают дозы ДВ (г/м2, мкг/г массы насекомого, мг/особь) или концентрации (%) в последовательных разведениях. На оси ординат - %% гибели насекомых при этих дозах (концентрациях). Между полученными точками проводят линию регрессии. Для определения СД50 (СК50) проводят горизонтальную линию на уровне 50 % до пересечения с линией графика. Опущенный из точки пересечения перпендикуляр на ось абсцисс покажет по шкале на этой оси искомое значение. Проводя горизонтальную прямую на других уровнях и опуская перпендикуляр, можно определить соответствующие другие значения СД (СК), например, для определения СД99 горизонтальную прямую до пересечения с линией графика проводят на уровне 99 % и т. д.
Для определения массы 1 членистоногого до опыта взвешивают не менее 10 анестезированных особей (обычно от 10 до 100 особей).
Пересчет концентрации (%) в дозу (мкг/г массы членистоногого) при использовании топикального метода нанесения проводят по формуле:
![]() , (3)
, (3)
где
А - концентрация СК50, %;
Y - нанесенный объем, мкл;
В - масса членистоногого, мг.
Пересчет величин СД50 (95, 99) (ЛД50 (95,99)) мкг на 1 мг массы проводят по формуле:
![]() , (4)
, (4)
где
x - ЛД50 (95,99) на 1 насекомое в мкг;
у - средняя масса 1 насекомого в мг.
Среднюю величину гибели насекомых вычисляют по формуле:
![]() ,
,
где
V - % гибели в каждом опыте;
n - число повторностей;
S- знак суммы.
Для оценки степени достоверности средней величины при данном числе наблюдений используют формулу для подсчета ошибки средней:
 ,
,
где
V - каждое измерение;
М - среднее из всех измерений;
n - число измерений;
S - знак суммы.
2.2.
Расчет инсектицидной активности веществ
и препаративных форм
Инсектицидную активность оценивают по гибели членистоногих в опытах по сравнению с контролем. В зависимости от организации эксперимента возможны 3 варианта оценки инсектицидной активности (формулы 5, 7, 8).
Опыт, при котором членистоногое контактирует с испытуемым веществом, нанесенным на поверхность (или при топикальном нанесении вещества на тело), и в контроле - с растворителем или необработанной поверхностью. В этом случае инсектицидную активность вещества (Y) в каждой повторности оценивают по формуле:
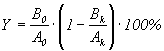 , (5)
, (5)
где
A0 и Ak - исходное число особей в опыте и в контроле;
B0 и Bk - число погибших в опыте и в контроле.
Заключительная оценка представляет среднюю величину из всех повторностей опыта.
В случае гибели в контроле 5 - 20 % особей к данным опытов вводят поправку по формуле Аббота:
![]() , (6)
, (6)
где
А - гибель насекомых в опыте (%);
В - гибель насекомых в контроле (%).
Если гибель особей в контроле превышает 20 %, то опыт бракуют. Для получения более надежных оценок препарата исследование следует повторить с более жизнеспособной культурой членистоногих или изменить условия опыта в сторону большей их комфортности для объекта как в контроле, так и в опыте.
Если по каким-то причинам постановка контроля невозможна и об инсектицидной активности приходится судить только по числу (численности) особей до и после применения вещества, формулу 5 упрощают (обозначения те же, что и в формуле 5):
![]() , (7)
, (7)
При испытании веществ в природе, когда об их эффективности судят по уменьшению численности объекта на опытном и контрольном участках, расчет проводят по формуле:
![]() , (8)
, (8)
где
А0 - численность объекта в опыте до обработки;
В0 - численность объекта в контроле до обработки;
At - численность объекта через t суток (ч) после обработки в опыте;
Bt - численность объекта через t суток (ч) после обработки в контроле.
Коэффициент отпугивающего действия для насекомых рассчитывают по формуле:
![]() , (9)
, (9)
где
А - количество насекомых на необработанной поверхности за определенный промежуток времени;
В - количество насекомых на обработанной репеллентом поверхности за такой же промежуток времени.
Коэффициент отпугивающего действия для клещей рассчитывают по той же формуле (9), где А - количество клещей, взятых в опыт; В -количество клещей, прошедших обработанную репеллентом зону.
Ошибку среднего значения инсектицидной активности препарата (и других средних величин) рассчитывают по известной формуле ошибки средней (см. выше). Из-за малого числа повторностей ошибка средней в энтомотоксикологических исследованиях может быть очень велика, особенно в диапазоне около 50 %, но при приближении средней эффективности к 100 % она снижается. Так, при эффективности препарата в трех повторностях 70, 80 и 90 % ошибка составит 7,1 %, а при значениях эффективности 85, 90 и 95 % - 3,5 %.
2.3. Организация экспериментов
На первом этапе на ограниченном количестве видов насекомых устанавливают наличие (или отсутствие) у испытуемых веществ инсектоакарицидных, репеллентных или других свойств. Вещества, у которых такие свойства обнаружены, исследуют по полной схеме второго этапа, которая включает дополнительные методы и расширенный перечень видов членистоногих в зависимости от поставленных задач исследований. На втором этапе проводят более точное определение инсектоакарицидной (или другой) активности веществ. В обоих случаях используют одни и те же методы, описание которых приведено в соответствующих разделах.
Методы определения активности и эффективности дезинсекционных средств при проведении исследований действующих веществ этих средств и препаративных форм при их разработке, изучении и регистрации включает в себя:
• определение специфической инсектоакарицидной, рострегулирующей, аттрактантной, репеллентной и прочих видов активности;
• оценку эффективности дезинсекционных средств в различных препаративных формах, включая аэрозольные и пиротехнические; акарицидных средств для обработки помещений и одежды человека; репеллентных средств для нанесения на кожу и обработки одежды; педикулицидных средств для борьбы с головным, лобковым и платяным педикулезом; акарицидных и инсектицидных средств для применения в природных стациях; регуляторов развития членистоногих; аттрактантов и феромонов при различных режимах применения.
2.4. Характеристика
тест-членистоногих,
используемых в опытах
В целях получения сравнимых данных при проведении экспериментов используют стандартные, чувствительные к инсектоакарицидам культуры членистоногих, выращенные в инсектарии. Для опытов отбирают однородные партии членистоногих определенного возраста, пола, питавшихся стандартным кормом. В зависимости от целей экспериментов можно использовать природные популяции членистоногих.
При изучении биологической активности используют, как правило, следующих членистоногих.
Комнатные мухи Musca domestica L.
Имаго самки и самцы 3 - 5-дневного возраста, питавшиеся молоком и сахарным сиропом; личинки - 1 дня III возраста или другие возраста в зависимости от целей экспериментов, развивающиеся во влажных отрубях; яйца, свежеотложенные.
Постельные клопы Cimex lectularius L.
Имаго - самки, самцы 5-дневного возраста, накормленные за 3 ч до опыта на морской свинке, кролике или мыши; яйца - 3 - 5-дневные.
Рыжие тараканы Blattella germanica L.
Имаго - сытые самки до выдвижения оотеки, самцы - 3 - 21-дневного возраста; личинки разных возрастов.
Крысиные блохи Xenopsylla cheopis Roth.
Имаго - самки, самцы 5-дневного возраста, накормленные на белых мышах за 3 ч до опыта; личинки II и последнего возрастов.
Платяные вши Pediculus humanus corporis De Geer.
Имаго - самки, самцы 15-дневного возраста, накормленные не ранее чем за 1 ч до опыта; личинки III возраста; яйца - любых возрастов в зависимости от целей эксперимента.
Комары - pp. Anopheles, Aedes, Culex.
Личинки II, III или начала IV возраста, развивающиеся в водопроводной дехлорированной воде, отстоянной в течение 24 ч; имаго - самки 5-дневного возраста, накормленные сахарной водой за 3 ч до опыта.
Платяная моль Tineola bisselliella Humm.
Бабочки и гусеницы 28 - 30-дневного возраста.
Кожеед Attagenus smirnovi.
Имаго и личинки 11 - 12-дневного возраста.
Клещи
Иксодовые - таежный Ixodes persulcatus P. Sch. и лесной I. ricinus L. - активные голодные имаго и нимфы.
Аргасовые - Ornithodoros papillipes (Bir.) - нимфы III и IV возрастов, голодавшие не более 5 -7 месяцев при комнатной температуре и влажности воздуха 90 - 100 %; самки, самцы, голодавшие не более 1 года в тех же условиях (наиболее подходящими в качестве тест-объектов являются нимфы IV возраста).
Гамазовые - крысиный клещ, имаго Ornythonissus bacoti (Hirst).
Чесоточные - самки ушного кроличьего клеща Psoroptes cuniculi (Hering).
Клещи домашней пыли - Dermatophagoides pteronyssinus (Trouessart) и D. farinae (Huges).
При изучении кишечного действия инсектицидов в опытах используют голодных мух, тараканов, которым за 12 ч до опыта дают только воду, но не дают пищи. При изучении репеллентной активности веществ используют голодных имаго блох 2 - 3-недельного возраста и голодных имаго комаров 8 - 10-дневного возраста. При проведении всех экспериментов ставят контрольный вариант (необработанные членистоногие) для оценки состояния биоматериала.
3. Методы оценки инсектицидной
и рострегулирующей активности веществ
3.1.
Методы определения инсектицидных свойств
действующих веществ (субстанций)
3.1.1. Метод топикального нанесения инсектицидов
Растворы инсектицидов (спиртовые или ацетоновые) определенного объема с помощью микродозатора наносят на среднеспинку мух, среднегрудь клопов и тараканов. В качестве микродозатора можно использовать микрошприцы, специальные аппликаторы или петли из некорродирующей проволоки. Размер капли должен быть сопоставим с размером членистоногого, но не должен его превышать. Для мух, тараканов и клопов рекомендуется размер капель около 1 мкл.
Петлю можно изготовить самостоятельно из некорродирующего материала (платина, держатель спирали в электролампе) путем наматывания на иглу одного завитка. Форма петли должна быть круглой. Затем в месте соединения петли и стержня делают изгиб под прямым углом и стержень петли прикрепляют к держателю (микробиологический держатель, цанговый карандаш и др.). Петлю калибруют путем перенесения 0,5 мл спирта из маленького стаканчика объемом 1 мл на фильтровальную бумагу с подсчетом количества перенесенных капель. Опыт повторяют не менее 3 раз. Оптимальным является объем петли 1 мкл (0,5 мл = 500 капель).
В опыте используют не менее 5 - 7 концентраций инсектицидов. Параллельно ставят 2 контрольных варианта: в первом на членистоногих наносят растворитель без инсектоакарицида, во втором — насекомых оставляют без обработки (биоконтроль). Все опыты ставят в 3 повторностях, в каждой по 20 особей. В период проведения опытов температура воздуха в помещении должна составлять 21 - 23 °С, относительная влажность - 55 - 60 %.
Насекомых после нанесения инсектицида (растворителя) и его высыхания помещают в чистые сосуды: клопов - в пробирки с фильтровальной бумагой, сложенной «гармошкой»; мух и тараканов - в стаканы. Тараканам дают пищу. Сосуды с насекомыми размещают в условиях постоянной температуры (21 - 23 °С) и освещенности или при комнатной температуре и естественной освещенности. Учет результатов опытов для насекомых проводят через 1 сутки. К живым относят особей, способных к направленному передвижению, а особей, неподвижных или с резкими нарушениями координации, - к мертвым. Если смертность насекомых в контроле составляет более 5 %, то в расчеты гибели необходимо вводить поправку по формуле Аббота (6), если смертность выше, то опыт бракуют и повторяют снова, пытаясь выяснить причины неудачи в первом случае.
При проведении экспериментов используют не менее 5 концентраций, которые должны вызывать гибель в интервале 0,1 - 99,9 %. Полученные результаты обрабатывают с помощью пробит-анализа, строя кривую регрессии «концентрация - гибель» или «доза - гибель». По кривой регрессии рассчитывают показатели СК50 (ЛД50), СК95 (ЛД95), СК99 (ЛД99) (формулы 3, 4).
При указании данных по летальным концентрациям или дозам необходимо указывать вид насекомого (при возможности пол), стадию развития, происхождение расы или популяции, температуру при проведении экспериментов. Наличие таких сведений позволяет сравнивать данные разных экспериментаторов.
Если перед началом исследований неизвестен диапазон концентраций, вызывающих 100 %-ную гибель объекта, то целесообразно поставить ориентировочный опыт с 10-кратным интервалом разведений.
3.1.2. Метод опрыскивания с
помощью опрыскивателя
с вращающимся столиком (опрыскиватель Поттера)
Применение метода опрыскивания в аппарате типа «Поттера» дает возможность одновременно и равномерно обработать большое количество членистоногих или поверхности водными растворами и эмульсиям.
Опрыскиватель состоит из следующих основных частей: распылитель жидкости, вращающийся столик для размещения биологических объектов, колпак, воздуходувка с мотором для подачи сжатого воздуха. Собственно распылитель изготавливают из латуни, нержавеющей стали или бронзы. Распылитель вставляют в отверстие колпака, воздушный шланг, идущий от воздуходувки, соединяют с распылителем. Колпак обычно делают из стекла или нержавеющей стали с окошком для наблюдения за ходом опрыскивания, высота его 40 - 45 см. Столик опрыскивателя делают вращающимся со скоростью 30 - 40 об./мин для обеспечения равномерного покрытия поверхности каплями инсектицида. Столик снабжают тарелкой с отверстием посередине и бортиками.
На столик опрыскивателя помещают тест-поверхности или обездвиженных диэтиловым эфиром членистоногих, ставят колпак. Устанавливают на колпак распылитель, в патрубок распылителя заливают отмеренное количество рабочего раствора определенной концентрации инсектицида (например 2,5 мл), включают мотор столика и воздуходувку. Жидкость вытекает через центральную трубку и разбивается конической струей воздуха, проходящей через щели между центральной трубкой и наконечником. Мелкие капли оседают на столик, стенки колпака и опрыскиваемые предметы. Растворы могут быть водными, спиртово-водными или приготовленными на 60 %-ном ацетоне, поскольку растворы на чистом спирте или ацетоне слишком сильно испаряются. Количество жидкости, заливаемой в опрыскиватель, подбирается экспериментально, путем сравнения результатов, полученных методом опрыскивания, с результатами, полученными методом топикального нанесения инсектицида откалиброванной петлей или микрошприцем (микродозатором). Обработанных членистоногих после подсыхания на них капель жидкости переносят в сухие чистые стаканы и оставляют для наблюдения и учетов гибели.
3.1.3. Методы принудительного
контакта насекомых
с обработанными поверхностями
Поверхности разных типов - пластины размером 10´20 см из стекла, фанеры, неокрашенной или окрашенной масляной краской, линолеума и других материалов - обрабатывают раствором вещества или рабочими жидкостями, изготовленными из препаративных форм (концентраты эмульсий, суспензий, смачивающиеся порошки, флоу, гели и др.). При этом используют градиент концентраций. Одновременно одной концентрацией вещества обрабатывают не менее 3 пластин.
Для обработки поверхностей пластин, не впитывающих жидкость (стекло), используют 50 мл/м2 рабочей жидкости, для обработки поверхностей, впитывающих жидкость (фанера) - 100 мл/м2. Растворы наносят на поверхность путем распыления из распылителя. Контакт насекомых с обработанными пластинами проводят только после полного испарения растворителя с пластин - не ранее чем через 3 ч. При обработке порошками их равномерно распределяют по поверхности кисточкой при норме расхода 3 - 10 г/м2. При испытании инсектицидных карандашей (брусков и т. п.) ими обрабатывают стеклянные и фанерные пластинки. Количество ДВ, находящееся на пластинке, вычисляют путем взвешивания пластинки до обработки и после нее. Расчет ДВ проводят на 1 м2.
Для контакта насекомых с обработанными пластинами используют два типа экспозиметров:
• Набокова, представляющие собой стеклянный цилиндр высотой 13 - 15 см, диаметром 3,5 - 4,0 см;
• (стеклянные) высотой 8 - 10 см, диаметром 8 - 9 см, применяемые в международной практике для тестирования инсектицидных средств по методу CSMA (Chemical Specialities Manufacturers Association).
На одну обработанную пластину помещают 1 - 2 экспозиметра с насекомыми. Время контакта в экспозиметрах Набокова - 5 - 15 мин (тараканов и постельных клопов - 15 мин, крысиных блох, комнатных мух и комаров - 5 мин), в больших экспозиметрах CSMA - 1 ч и более.
Экспозиметры приспосабливают для работы с разными насекомыми. Так, для мух и комаров используют специальный стеклянный поршень, прижимающий насекомых к поверхности, для блох - экспозиметр накрывают влажной многослойной марлевой салфеткой, для экспериментов с тараканами верхний край экспозиметров смазывают вазелином.
Контактирование имаго комаров можно проводить также в пластмассовых экспозиметрах - конусах, рекомендованных ВОЗ для биотестов с обработанными инсектицидами поверхностями. Внутренний диаметр конуса - 85 мм у основания, высота - 55 мм. Конусы сделаны из прозрачного гладкого пластика. В отверстие на вершине конуса запускают самок комаров с помощью стандартного аспиратора с загнутым концом (диаметром 10 мм). Комары остаются в экспозиметре в течение 30 мин. Опыты ставят в 3 повторностях, в каждой используют по 10 насекомых. Опыты сопровождают контролем, в котором насекомые контактируют с поверхностями, обработанными растворителем. Одновременно ставят контроль к биоматериалу.
По результатам опытов высчитывают показатели СК50 (СД50), СК95 (СД95), СК99 (СД99).
Насекомых после контакта с обработанными пластинами переносят в чистые пластиковые стаканы (комаров - в садки) и регистрируют состояние (без внешних признаков паралича, парализованные, мертвые) блох, мух, клопов, комаров в течение 24 - 48 ч, тараканов - 72 - 96 ч. В стакан с тараканами кладут влажный тампон и пищу.
С целью изучения остаточного действия веществ (препаратов) пластины обрабатывают в дозировках (минимальных), которые в предыдущих опытах обеспечивали гибель 99 - 100 % насекомых. Обработанные пластинки хранят в горизонтальном положении при комнатной температуре и рассеянном освещении.
Контакт насекомых с обработанной поверхностью проводят раз в 5 - 10 суток до тех пор, пока гибель насекомых составит менее 70 %. Тогда поверхность считают утратившей инсектицидные свойства. Длительность остаточного действия выражают в сутках от даты обработки тест-поверхности.
3.1.4. Метод свободного контакта насекомых
Этот метод позволяет более полно оценить инсектицидный препарат с учетом степени его репеллентности. Опыты с тараканами проводят в специальных полигонах площадью не менее 0,2 м2 (40´50 см) и высотой бортов 12 - 20 см, края которых смазаны вазелином. В центре полигона помещают пластинку (стекло, фанера) размером 10´10 см, верхняя сторона которой обработана инсектицидом в определенной выбранной дозе, обеспечивающей 50, 95 или 99 % гибели тараканов в опыте с принудительным контактом. По углам этой пластинки располагают прокладки высотой 15 мм и сверху накрывают чистыми фанерными пластинками того же размера. Таким образом получается укрытие для тараканов.
В каждый полигон помещают 120 тараканов при соотношении самок, самцов и личинок II - IV возраста 1 : 1 : 4. В полигоне расставляют сосуды с водой и кормом (белый хлеб). Опыты ставят не менее чем в 3 повторностях. Учет погибших насекомых проводят каждые 24 ч в течение 3 - 5 суток или более в зависимости от целей эксперимента и изучаемого средства.
Опыты на мухах проводят в стеклянных камерах объемом 1 м, имеющих затянутые марлей «окна» для проветривания. В каждую камеру помещают по 300 особей мух обоего пола в соотношении 1:1 и сосуд с 10 %-ным сахарным сиропом. Камеру снаружи освещают электролампой (60 Вт). В верхней части камеры подвешивают ленты или пластинки, обработанные инсектицидом в дозах, обеспечивающих 50, 95 и 99 % гибели мух в опытах с принудительным контактированием. Жидкие препараты в чашке Петри помещают на дно камеры.
Каждый вариант опыта и контроль ставят не менее чем в 3 повторностях. Учет погибших насекомых проводят через 24 ч. Эффективность препарата в каждом варианте опыта оценивают по формуле (5).
3.1.5. Изучение овицидного действия инсектицидов
3.1.5.1. Изучение овицидного действия
инсектицидов
по отношению к мухам
При определении овицидности препаратов для яиц мух можно использовать два метода. При первом методе 20 мг яиц комнатных мух помещают на влажные отруби в 0,5-литровые сосуды. Для приготовления влажных отрубей берут на 100 г прокаленных 200 г воды и тщательно перемешивают. В каждый сосуд помещают 200 г влажных отрубей, поверхность субстрата с яйцекладками равномерно орошают 10 мл раствора (эмульсии, суспензии) инсектицида, что соответствует норме расхода рабочей жидкости 1 л/м2. Дозу препарата рассчитывают по ДВ на 1 кг субстрата. Опыты ставят одновременно не менее чем в 5 дозах, каждая в 3 повторностях. В контрольном варианте яйцекладки орошают водой или растворителем. После орошения яйцекладки засыпают тонким слоем (1,0 - 1,5 см) влажных отрубей, чтобы предотвратить их высыхание. Сосуды завязывают салфетками из бязи.
При втором методе на пластинки черной бумаги (1´1 см), слегка смоченные молоком или белком куриных яиц, кисточкой или препаровальной иглой наносят по 20 жизнеспособных яиц. Пластинки с яйцами погружают на 3 с в спиртовые или водные рабочие растворы препаратов или действующих веществ; контрольные - в чистый спирт или воду, подсушивают на фильтровальной бумаге и переносят в чашки Конвея, в которых круговые емкости заполнены водой для поддержания 100 %-ной влажности. Для нахождения величин СК50 и СК95 используют не менее 5 - 6 концентраций в 5 - 7-кратной повторности.
Учет результатов проводят через 48 ч, подсчитывая число личинок, выплодившихся из контрольных и обработанных яйцекладок. Эффективность препарата устанавливают по соотношению числа личинок в обработанном и контрольном субстрате. Определяют дозу (концентрацию), обеспечивающую 50 и 99 % гибели яиц.
3.1.5.2. Изучение овицидного
действия инсектицидов
по отношению к клопам
Яйцекладки 3 - 5-дневного возраста, помещенные на листы фильтровальной бумаги размером 30 см2, орошают 0,3 мл раствора (эмульсии, суспензии) инсектицида. Каждый инсектицид испытывают не менее чем в 5 концентрациях, в 3 повторностях каждая. Дозу инсектицида по ДВ рассчитывают в граммах на 1 м2 обработанной поверхности. В контроле яйцекладки обрабатывают водой или растворителем. После обработки яйцекладки переносят в стеклянные стаканы и сверху покрывают нарезанной фильтровальной бумагой.
Учет результатов проводят через 5 - 7 суток. Эффективность препарата определяют по соотношению числа личинок, вылупившихся из обработанных и контрольных яйцекладок. Определяют дозу (концентрацию), обеспечивающую 50, 95 и 99 % гибели яиц.
3.1.5.3. Изучение овицидного
действия инсектицидов
по отношению к блохам
На дно трехлитрового сосуда кладут листы черной бумаги так, чтобы она полностью покрывала дно сосуда, и помещают туда белую мышь в сетчатой клетке. На зверька выпускают 100 самок и 25 самцов блох. Листы бумаги меняют ежедневно и подсчитывают количество отложенных на них яиц. Из листа, на котором отложены яйца блох, вырезают листки размером 4´5 см и обрабатывают каждый 0,2 мл раствора (эмульсии) инсектицида. Опыты ставят в 5 концентрациях, в 3 повторностях каждая. В контрольном варианте лист бумаги обрабатывают растворителем.
Опыты с яйцекладками насекомых проводят при температуре воздуха в помещении 23 - 27 °С. Учет результатов проводят через 4 - 6 суток. Эффективность обработки определяют по соотношению числа личинок, выплодившихся на обработанном и контрольном листах. Определяют дозу (концентрацию), обеспечивающую 50, 95 и 99 % гибели яиц.
3.1.6. Методы изучения инсектицидной
активности веществ
на преимагинальных стадиях мух
3.1.6.1. Обработка субстрата, в котором находятся личинки
В сосуды объемом 0,5 л с 200 г влажных отрубей помещают на поверхность субстрата 30 личинок III возраста. Когда все личинки проникнут в субстрат (через 10 - 15 мин), из распылителя равномерно орошают поверхность 10 мл раствора (эмульсии, суспензии) инсектицида, что соответствует 2 л/м2 рабочей жидкости. Сосуды закрывают бязевыми салфетками, которые закрепляют резинками. В каждом опыте используют 5 концентраций инсектицида в 3 повторностях. В контроле субстрат с личинками орошают растворителем.
Учет результатов проводят через 48 ч, подсчитывая число личинок, погибших в 3 сосудах, живых личинок оставляют в субстрате до окончания метаморфоза. Эффективность препарата определяют по процентному соотношению числа погибших личинок и выплодившихся имаго в контроле и опыте. Определяют концентрацию, обеспечивающую 50, 95 и 99 % гибели личинок (формула 5).
3.1.6.2. Обработка субстрата до подсадки личинок
Влажные отруби обрабатывают раствором (эмульсией, суспензией) инсектицида из расчета 50 мл на 1 кг субстрата и тщательно перемешивают. В каждые 200 г обработанного субстрата подсаживают 30 личинок III возраста. В каждом опыте используют 4 концентрации инсектицида в 3 повторностях. В контроле субстрат обрабатывают растворителем. Учет результатов проводят через 24 и 48 ч после постановки опыта. Оставшихся в живых личинок пересаживают через двое суток в необработанные отруби и наблюдают за циклом метаморфоза - подсчитывают число куколок и выплодившихся имаго.
Эффективность препарата определяют по соотношению числа личинок и выплодившихся имаго в контроле и опыте (формула 5). При подсчете результатов опытов рассчитывают дозировку по ДВ на 1 кг субстрата и определяют концентрацию, обеспечивающую 90, 95 и 99 % гибели личинок.
3.1.7. Изучение действия инсектицидов на куколок мух
По 10 - 20 куколок комнатных мух помещают на дно стеклянных сосудов и засыпают слоем песка высотой 6 - 7 см, затем с помощью распылителя обрабатывают песок водными эмульсиями (растворами, суспензиями) препарата из расчета 1 л раствора на 1 м2. Обработку проводят 5 - 7 концентрациями препарата, каждый опыт ставят в 3 повторностях. Сосуды с куколками обвязывают марлевыми салфетками либо ставят открытыми в марлевый (сетчатый) садок. Подсчет выплодившихся мух проводят через 2 - 3 - 5 суток после обработки. Одновременно ставят контроль - сосуды с куколками, обработанными растворителем (водой). Эффективность препарата определяют по процентному соотношению числа мух, выплодившихся в контроле и опыте (формула 5). Определяют концентрации, обеспечивающие 50, 95 или 99 % гибели мух.
3.1.8. Изучение фумигационного действия инсектицидов
Опыты проводят в сосудах емкостью 1 л. На стенках внутри сосуда помещают фильтровальную бумагу (10´20 см), предварительно пропитанную 2 мл ацетонового (спиртового) раствора препарата и просушенную при комнатной температуре не менее 20 мин. При использовании сосудов большего объема размер бумаги соответственно увеличивают. Расчет препарата проводят в г/м3 по ДВ. К крышке сосудов подвешивают садок из металлической сетки на расстоянии 10 см от дна. В садок помещают комнатных мух, тараканов или постельных клопов (не менее 10 насекомых). В опытах используют серии концентраций в 3 повторностях.
Подсчет погибших насекомых осуществляют через 3 - 6 - 24 ч. Расчет эффективности проводят по формуле (5). Определяют концентрации, которые обеспечивает 50, 95 и 99 % гибели насекомых.
3.1.9. Изучение кишечного действия инсектицидов
3.1.9.1. Метод группового кормления мух
Раствором инсектицида в 10 %-ном сахарном сиропе (50 мл) пропитывают кусочки ваты массой 1 г, которые размещают тонким слоем на дне чашек Петри. При изучении веществ, нерастворимых в воде, готовят 10 %-ный спиртовой раствор, а затем разбавляют его сахарным сиропом до нужной концентрации. Испытания инсектицидов проводят в концентрациях 0,001; 0,01; 0,1; 1,0 %, в каждой не менее 3 повторностей. В марлевый садок размером 20´20´20 см помещают чашку Петри с испытуемым веществом (отравленной приманкой), в качестве альтернативной пищи ставят сосуд с молоком. При изучении эффективности сухой сахарной приманки (40 - 60 % сахара) ее наносят на пластинки из стекла или фанеры, которые помещают в садок. В опытах используют 30 мух обоего пола 3 - 5-дневного возраста. За 12 ч до опыта в садках, в которых выращивают мух, оставляют только воду. Контролем служат мухи, питавшиеся молоком. Подсчет погибших мух проводят через 3, 24 и 48 ч. Эффективность инсектицида определяют по числу мух, погибших в опытных и контрольных садках (формула 5). Определяют концентрации, которые обеспечивают 50, 95 или 99 % гибели мух.
3.1.9.2. Метод группового кормления тараканов
Приготавливают растворы (эмульсии, суспензии) инсектицида в подсолнечном масле или воде (в 4 - 5 концентрациях) и наносят по 1,5 мл на кусочки пшеничного хлеба размером 2´1´1 см. Опыты ставят одновременно со всеми концентрациями, в 3 повторностях каждая. Хлеб, смоченный инсектицидом, помещают на подложке из полиэтилена (целлофана) в сосуд диаметром около 30 см и высотой в около 10 см. Края сосуда смазывают изнутри вазелином, чтобы предотвратить выползание тараканов. В сосуд помещают по 30 насекомых (самки, самцы, личинки II - IV возрастов) в соотношении 1 : 1 : 4. В качестве альтернативной пищи кладут необработанный инсектицидом кусочек пшеничного хлеба и тампон, смоченный водой. В контроле используют хлеб, смоченный растворителем (масло, вода). Одновременно ставят контроль к биоматериалу.
Учет гибели тараканов проводят ежедневно в течение 5 суток. Критерием оценки кишечного действия инсектицида является число выживших насекомых через 5 суток от начала опыта в сравнении с контролем (формула 5). Рассчитывают концентрации, вызывающие 50, 95 или 99 % гибели насекомых.
3.1.9.3. Метод дозированного кормления насекомых
Метод предусматривает кормление насекомых из микропипетки с оттянутым концом водными растворами (эмульсиями), приготовленными на 10 %-ном сахарном сиропе. Метод позволяет точно регулировать количество раствора, выпиваемого насекомыми, путем прерывания кормления в нужный момент.
При постоянном объеме раствора (для комнатных мух - 0,01 мл, рыжих тараканов - 0,05 мл) дозу инсектицида варьируют путем изменения концентрации ДВ. Перед кормлением мух выдерживают без питания 12 ч, тараканов - двое суток. В контрольных опытах насекомых кормят сахарным сиропом или растворителем. Опыты ставят в 3 повторностях для каждой концентрации, в каждой повторности используют не менее 10 насекомых.
За процессом отмирания комнатных мух наблюдают в течение суток, тараканов - в течение 3 - 5 суток. Критерием оценки эффективности инсектицида служит величина ЛД50(99), выраженная в мкг на одно насекомое или в мкг на 1 г массы насекомого (формулы 3, 4).
3.1.9.4. Изучение
ларвицидного действия инсектицидов
по отношению к личинкам комаров
В сосуды объемом 0,5 л (стеклянные сосуды, полистироловые или парафинированные стаканы и т. п.) наливают по 249 мл водопроводной воды, отстоянной в течение 24 ч. В каждый сосуд (за 2 ч до опыта) помещают по 25 личинок III или начала IV возраста. Через 2 ч погибших или ослабленных личинок удаляют и заменяют на жизнеспособных. В сосуды добавляют 1 мл раствора (эмульсии, суспензии) инсектицида определенной концентрации. Одновременно испытывают 4 - 5 концентраций, каждая в 3 повторностях. Контролем служат личинки, находившиеся в воде без добавления инсектицида. Параллельно ставят контроль с эталонным препаратом. В период эксперимента температура воды должна находиться в пределах 21 - 23 °С.
Подсчет погибших личинок проводят через 24 ч. Если более 10 % личинок в контроле окуклилось, опыт не учитывают и повторяют.
Испытания бактериальных препаратов проводят следующим образом: 50 мг препарата (порошок) помещают в 20 мл флакон, добавляют 10 мл дистиллированной воды и 15 стеклянных шариков диаметром 6 мм. Содержимое гомогенизируют 10 мин в шейкере при скорости 700 ударов в мин. Затем 0,1 мл гомогената смешивают с 9,9 мл дистиллированной воды. Из этой суспензии делают последующие разведения. Для этого в сосуды, содержащие 150 мл дистилированной воды, добавляют 120, 90, 60, 30 и 15 мкл исходной суспензии, получая концентрации 0,04, 0,03, 0,02, 0,01 и 0,005 мг/л соответственно. В каждый сосуд подсаживают по 25 личинок комаров начала IV возраста. Опыты проводят в 3 повторностях. В контроле личинок помещают в дистиллированную воду. Опыты проводят при температуре 23 - 27 °С. Гибель личинок определяют через 24 и 48 ч.
По другой методике опыты проводят в чашках Петри с диаметром 80 - 100 мм, объем суспензии препарата - 50 мл. При разведении препарата соседние концентрации отличаются в 4 раза (шкала с шагом 4). В каждый сосуд помещают 20 личинок комаров II возраста и выдерживают при 27 °С в течение 23 ч. Высчитывают эффективные концентрации, обеспечивающие гибель 99 - 100 % личинок.
3.1.10. Изучение раздражимости комаров
Раздражимость комаров может быть вызвана не только самим инсектицидом, но и другими компонентами, входящими в состав испытываемой формы. Раздражимость крайне важна при работе с эпидемиологически опасными малярийными комарами, поскольку способствует перелету комаров из обработанных помещений (хлева, надворные постройки) в необработанные (жилые помещения). Риск заражения малярией при этом многократно увеличивается.
Для определения раздражимости рекомендуется предложенный ВОЗ метод с усовершенствованиями, внесенными ИМПиТМ. Фильтровальную бумагу обрабатывают из пульверизатора рабочим раствором инсектицида в концентрации, отобранной в первичном опыте. Исследования проводят через 1 - 2 суток после обработки.
Аппарат для определения раздражимости представляет собой светонепроницаемую камеру из легкого дерева размером 135´135´90 мм. Свет проникает в нее сквозь круглое отверстие в задней стенке диметром 90 мм, по бокам которого имеются пазы для матового стекла с нанесенным на него инсектицидом (или контрольного) и конического экспозиметра (те же конусы, что и для определения продолжительности действия инсектицида). Опыты проводят в темной комнате с единственной электрической лампочкой, помещаемой перед задней стенкой прибора на расстоянии, зависящем от мощности лампы: 40 Вт - 41 см, 60 Вт - 55 см, 100 Вт - 92 см. Комаров в садке перед опытом содержат в той же комнате при том же освещении (т. е. расстояние от лампы) в течение 0,5 - 1 ч. Каждого комара (сытых самок) сначала сажают в контрольный экспозиметр (та же бумага, но без инсектицида), где выдерживают 3 мин, а затем в течение 10 мин подсчитывают число взлетов. Комары, взлетевшие в контроле 2 и более раз, выбраковываются как спонтанно раздражимые. Причиной спонтанной раздражимости могут быть травмы комаров при пересадке или неблагоприятные условия (при массовой раздражимости). Спокойных комаров (не было взлетов или 1 случайный взлет без ползания по бумаге) по одному пересаживают в опытный экспозиметр с бумагой, обработанной инсектицидом, и после 3 мин начинают подсчет взлетов, продолжающийся 10 мин. Отмечают «хождение» комара по бумаге, что также говорит о раздражимости.
В опыте должно быть использовано не менее 50 особей. По окончании опыта подсчитывают распределение особей по степени раздражимости.
Для подвальных комаров С. pipiens опыты по раздражимости также важны, поскольку при некачественной обработке (с огрехами) комары, обладающие раздражимостью, выбирают для посадок необработанные инсектицидом места.
3.2.
Методы изучения активности веществ по отношению
к иксодовым и аргасовым клещам
Оценку акарицидной активности проводят на активных нетравмированных самках видов клещей, являющихся основными переносчиками возбудителей эпидемически значимых инфекций.
Испытания на иксодовых клещах предпочтительно проводить в весенне-летний период и использовать самок природной популяции, собранных с растительности не более чем за сутки до проведения опытов и хранившихся в пробирках дифференцированной влажности или во влажных бинтах при температуре (12 ± 2) °С. Возможно использование самок лабораторного разведения после проверки их двигательной активности и агрессивности. Самки таежного клеща при температуре (22 ± 2) °С должны за 2 мин проходить на контрольном тесте (ленте) путь 25 - 30 см, следуя за пальцем экспериментатора.
3.2.1. Методы топикального нанесения
акарицидов на клещей
С помощью микродозатора наносят 0,3 мкл раствора исследуемого вещества на спинную поверхность клеща. Используют не менее 4 концентраций, в каждом варианте по 20 клещей. В контроле на клещей наносят растворитель в том же объеме.
Если токсичность препарата для клещей не известна хотя бы приблизительно, ставят ориентировочный опыт. Готовят четыре-пять 10-кратных разведений препарата и на каждое разведение используют по 10 клещей. Для более точного определения акарицидной активности берут то максимальное разведение (минимальную концентрацию), которое вызвало 100 %-ную гибель клещей в ориентировочном опыте, и из него готовят пять 2-кратных разведений. Каждое из 2-кратных разведений испытывают не менее, чем на 20 клещах. В опыте используют клещей одного пола, желательно - самок. Если использованы клещи обоих полов, то оценку токсичности проводят для самцов и самок отдельно. После высыхания раствора иксодовых клещей помещают в пробирки дифференцированной влажности и содержат при комнатной температуре и естественном освещении, аргасовых клещей - в пробирки с полоской фильтровальной бумаги, сложенной гармошкой, и содержат в специальных шкафах, в которых для поддержания высокой влажности (около 90 %) стоят стаканы с водой, или в коробках, прикрытых влажным полотенцем.
Учет результатов проводят на пятые сутки для иксодовых клещей и через 5 - 15 суток - для аргасовых. При анализе результатов опытов методом пробит-анализа вычисляют показатели СД50 и СД99 в мкг на одну особь.
3.2.2. Методы принудительного
контакта клещей
с обработанной поверхностью
Контактирование иксодовых клещей с обработанными поверхностями проводят, используя фильтровальную бумагу. Бумагу в виде круга диаметром 10 см (на 1 см больше диаметра стандартной чашки Петри), площадью - 78 см2 размещают горизонтально на невпитывающей поверхности (стекло, керамическая плитка и т. д.) и с помощью пипетки равномерно наносят на нее раствор изучаемого вещества в ацетоне (серия концентраций - не менее 5) из расчета 1 мл раствора на 100 см2 или 0,78 мл на круг. В контрольном варианте на круги такой же бумаги наносят тем же способом растворитель. После испарения растворителя фильтры помещают на дно чашек Петри так, чтобы края слегка загибались на стенки чашки. Продолжительность контакта клещей с бумагой 10 мин. Клещей, выползающих за пределы круга, кисточкой возвращают на бумагу. Поскольку клещи достаточно подвижны, одновременно в чашку Петри целесообразно помещать не более 2 - 3 особей. Контакт с каждой концентрацией проводят в 3 повторностях по 10 клещей в каждой при комнатной температуре. В контроле, едином на весь опыт, также 3 повторности по 10 клещей. Все работы с контрольными клещами должны быть проведены на отдельном столе с использованием незагрязненных инструментов (ножниц, кисточек и т. д.). Работы с разными концентрациями необходимо начинать с меньших. Сразу после контакта клещей кисточкой переносят в пробирки дифференцированной влажности (по 10 особей в пробирку), которые размещают горизонтально в условиях комнатной температуры и естественной освещенности. Учет результатов опыта проводят ежедневно в течение 5 суток. К живым относят особей, способных к передвижению, к категории «мертвые» - неподвижных клещей, не реагирующих на тепло руки и дыхание (обычно у мертвых клещей раздвинуты пальпы), а также слабоподвижных клещей с резкими нарушениями координации. Если смертность клещей в контроле составляет более 5 %, то в дальнейшие расчеты необходимо вводить поправку по формуле Аббота. Полученные данные обрабатывают с помощью метода пробит-анализа.
Контактирование аргасовых клещей проводят по той же методике. Эти клещи плохо передвигаются по стеклянной вертикальной поверхности и крайне редко заползают на стенки, поэтому всех особей одной повторности запускают в чашку одновременно. Продолжительность контакта 30 - 60 мин. Для препаратов с низкой акарицидной активностью экспозицию увеличивают до 2 - 4 ч. Гибель клещей отмечают на пятый и пятнадцатый дни после контакта. Учет гибели, как у иксодовых клещей.
На основании результатов проверок высчитывают СК50 и СК99. Акарицидную активность препарата в каждом разведении определяют по формуле (5).
Для установления длительности остаточного действия препаратов используют фильтр, импрегнированный в минимальной дозировке, вызвавшей 100 %-ную гибель клещей в предыдущем опыте. Обработанные единовременно фильтры хранят при комнатной температуре так, чтобы они не соприкасались. Контакт клещей проводят впервые через неделю после импрегнирования бумаги и далее еженедельно в течение месяца, а затем с месячными интервалами до тех пор, пока доля погибших клещей не достигнет 70 % или менее. Для каждого контакта используют новый фильтр. Учет результатов проводят, как в основном опыте. Продолжительность остаточного действия препарата выражают в сутках со дня обработки бумаги до времени регистрации 70 %-ной смертности.
3.2.3. Определение скорости
наступления состояния нокдауна
и высоты подъема клещей по обработанной ткани
Тест для опытов готовят следующим образом. На ленте из хлопчатобумажной бязи размером 10´70 см карандашом наносят отметки длины от 0 до 60 см, причем первая (нулевая) отметка делается на расстоянии 10 см от края. На участок ленты, размещенной горизонтально на невпитывающей поверхности (стекло, керамическая плитка и т. д.), начиная от отметки 0 до 10 (площадь обрабатываемого участка 100 см2) из пипетки равномерно наносят 1 мл 1 %-ного ацетонового раствора изучаемого вещества. Контрольный тест обрабатывают аналогично, используя ацетон. После испарения растворителя тесты развешивают в лаборатории в одинаковых контролируемых условиях температуры, влажности и освещенности. Опыты проводят в день обработки. Тесты закрепляют под углом 70°. Клещей по одному помещают на 5 см ниже нулевой отметки и наблюдают за их передвижением вверх по ткани, дополнительно стимулируя их пальцем наблюдателя, который держат на расстоянии 0,5 см от гипостома клеща. С помощью секундомера регистрируют время от момента пересечения клещем нижней черты обработанного участка до отпадения клеща с теста, что соответствует времени наступления состояния нокдауна (ТН, мин или КТ, мин). Отпавших клещей фиксируют в 70 %-ном растворе этилового спирта или продолжают дальнейшее наблюдение за ними. Опыт проводят не менее чем с 30 самками. Рассчитывают среднее значение времени наступления состояния нокдауна ТНср. в минутах и статистическую ошибку.
Одновременно с определением ТНср. регистрируют максимальную высоту подъема клеща по тесту (MB, см). Рассчитывают среднее значение показателя МВср. в сантиметрах и статистическую ошибку.
3.2.4. Определение скорости
присасывания клещей, контактировавших
с исследуемыми веществами
На тщательно выстриженную спину лабораторного кролика коллодием или другим не токсичным для кожи клеем приклеивают 4 стеклянных цилиндра (диаметр 3 см, высота 4 см) с отогнутыми краями. Один из них является контрольным, а три - опытными. Сначала в контрольный цилиндр запускают 5 самок, ползавших до этого в течение 2 мин на необработанном (контрольном) тесте. Верхнее отверстие цилиндра затягивают мелкосетчатым материалом, закрепляя его резиновым кольцом. В каждый из опытных цилиндров запускают по 5 самок сразу после их контакта с обработанной поверхностью. Продолжительность контакта должна составлять половину ТНср.. Время от запуска до присасывания каждой самки к кролику регистрируют с помощью секундомера. Контроль и опыт повторяют трижды. Рассчитывают среднее значение времени присасывания самок в контроле, опыте и отношение этих показателей, которое называется индексом скорости присасывания (ИСП).
![]() ,
,
где
Vk - средняя скорость присасывания клещей в контроле, мин;
V0 - средняя скорость присасывания клещей в опыте, мин.
Методы изучения акарицидной активности веществ по отношению к другим группам клещей - гамазовым, чесоточным, клещам домашней пыли - представлены в главе 5.
3.3. Методы изучения регуляторов развития насекомых
3.3.1. Общие сведения
Группа регуляторов развития насекомых (РРН) объединяет соединения, являющиеся по механизму действия аналогами природных гормонов насекомых: ювенильного (АЮГ или ювеноиды), личиночного (ЛГ или экдизоиды), нейрогормонов и ряда других. В эту группу входят также химические соединения, не являющиеся по структуре аналогами природных гормонов, но вызывающие у насекомых гормоноподобные эффекты. К ним относятся ингибиторы синтеза хитина (ИСХ): хлор- и фторпроизводные мочевины (дифлубензурон, тримфлумурон, гексафлумурон и др.). Из группы аналогов ювенильного гормона в нашей стране наиболее известны метопрен, гидропрен и пирипроксифен, из группы ИСХ - димилин.
Для характеристики активности АЮГ и ИСХ используют величины эффективных концентраций и доз, вызывающие морфогенетические или прочие изменения у 50, 95 или 99 % членистоногих.
3.3.2. Тип действия
Механизм действия АЮГ заключается в том, что введение экзогенного аналога в тот период, когда титр истинного гормона в организме насекомого минимален («критический период»), вызывает эффекты, отсутствующие при нормальном прохождении метаморфоза. Поскольку эти соединения являются аналогами природных гормонов, организм реагирует на их появление (присутствие) образованием промежуточных особей, гигантских, сильно меланизированных личинок, недоразвитых куколок с развитой головой имаго и т. п.
Ингибиторы синтеза хитина - это соединения, которые ингибируют процесс образования глюкозы, необходимой для синтеза хитина. Из-за ее отсутствия ослабляется связь между эндо- и экзокутикулой, и насекомое не может завершить процесс окукливания.
3.3.3. Проявление гормоноподобного действия
Проявлением гормоноподобного действия ИСХ является отсутствие куколок и различные нарушения линьки на протяжении всего цикла развития от яйца до начала окукливания. Появление куколок свидетельствует об окончании срока действия ИСХ.
При воздействии АЮГ отмечаются нарушения морфогенеза на протяжении всего цикла развития, отсутствие вылета (выплода) имаго, появление неполноценных имаго или особей с признаками предшествующей фазы развития - «адультоидов».
Фаза яйца. Воздействие АЮГ на процессы эмбриогенеза заключается в ингибировании дифференциации клеток и тканей и может проявляться в гибели эмбрионов на разных стадиях развития внутри яйца или в отрождении уродливых нежизнеспособных личинок. Видимые нарушения эмбриогенеза могут быть вызваны как путем нанесения АЮГ непосредственно на яйцо, так и путем обработки самок в период, предшествующий яйцекладке. Воздействие препаратов на свежеотложенное яйцо (20 - 30 ч после откладки) препятствует нормальному развитию эмбриона, приводя его к гибели. В более поздние сроки после откладки, когда процесс эмбриогенеза уже завершен, и в яйце происходят процессы личиночной дифференциации, обработка уже не препятствует отрождению личинок. Однако личинки могут иметь нарушения линьки, образовывать промежуточные формы и погибать при линьке на имаго.
ИСХ в отличие от АЮГ не блокируют эмбриогенез: из яйца развивается личинка, которая погибает на стадии очередной линьки или при формировании куколки.
Фаза имаго. АЮГ не рекомендуется для использования в отношении имаго мух: вместо ожидаемого эффекта подавления численности они повышают яйцепродуктивность самок в 1,5 - 2 раза в сравнении с контролем. У имаго тараканов они вызывают эффект стерилизации и резко выраженные морфогенетические эффекты: деформированные или укороченные крылья, смазанный рисунок жилкования, промежуточные формы сильно меланизированные, редукция члеников конечностей, недоразвитые оотеки. У блох наблюдается эффект стерилизации у самок при воздействии ИСХ и нарушения при формировании кокона при воздействии АЮГ.
ИСХ обладают стерилизующим действием на имаго мух при скармливании им приманок. Эффект выражается в частичной или полной нежизнеспособности отложенных яиц или в полном отсутствии кладок.
Фаза личинки. В процессе онтогенеза насекомых периоды очень высокой чувствительности к АЮГ чередуются с периодами полной нечувствительности к его действию. Поэтому получить видимые эффекты от применения АЮГ возможно лишь в отдельные моменты развития, когда титр природного гормона в гемолимфе снижается до критического уровня или гормон отсутствует вообще. В это время организм наиболее чувствителен к АЮГ - это и есть «критический период», во время которого и следует проводить испытания АЮГ. Учитывая, что «критический период» у АЮГ - это личинка последнего возраста, для получения достоверных результатов необходим строго выровненный биологический материал, отличающийся по возрасту в пределах от нескольких часов до суток.
Фаза куколки. ИСХ и АЮГ слабо проникают через пупарий, поэтому этот метод испытания не рекомендуется, поскольку для получения очень слабого эффекта концентрации приходится увеличивать в 3 - 5 раз по сравнению с теми, которые использовали для обработки личинок.
В целом отличие испытаний РРН от инсектицидов касается работы с личинками мух и комаров (блох - в меньшей степени), где необходимо учитывать «критический период», т. к. воздействие вещества можно просто «не поймать». При работе с тараканами и в меньшей степени с блохами, имеющими сухопутную (воздушную) среду для развития и имаго, и личинок, методы испытаний почти не отличаются по сути; различны лишь методы оценки эффективности и сами получаемые эффекты.
3.3.4. Тест-объекты и постановка экспериментов
Комары. При испытании АЮГ в отношении личинок комаров их следует вносить в сосуды с водой, где содержатся личинки комаров IV возраста. Наблюдения за развитием личинок проводят ежедневно, регистрируя особи с признаками начала окукливания, затем - формирующие куколку. Показателями эффективности являются: 1) отсутствие нормально сформированной куколки; 2) особи, которые не смогли освободиться от экзувия; 3) особи, которые не смогли подняться с поверхности воды.
ИСХ вносят в воду с личинками комаров I - II возраста и ежедневно наблюдают за процессом линьки, отмечая ее нарушения. Появление куколок свидетельствует о прекращении действия препарата.
Мухи. АЮГ вносят в субстрат, где происходит развитие преимагинальных стадий, в период, когда преобладают личинки III возраста. Показатель эффективности - отсутствие вылета нормально сформированных имаго.
ИСХ вносят в субстрат для развития преимагинальных стадий при наличии любых личиночных возрастов. Показатель эффективности - отсутствие нормально сформированной куколки.
Блохи. Испытания проводят методом обработки субстрата (песок + альбумин), где развиваются личинки блох. Соединения можно вносить в виде растворов в ацетоне, который быстро испаряется, а вещество остается в субстрате. Показатели эффективности: 1) нарушения в развитии личинок; 2) отсутствие нормально сформированного кокона; 3) отсутствие выплода жизнеспособных имаго.
Тараканы. Испытания АЮГ и ИСХ проводят на имаго и личинках методом скармливания отравленных пищевых приманок в течение 1 - 3 суток, особи с явными нарушениями в развитии появляются не ранее чем через 5 - 7 дней. Учет эффективности АЮГ и ИСХ аналогичен: 1) количество особей с нарушениями; 2) отсутствие жизнеспособных оотек; 3) выплод нормального поколения.
3.4.
Методы изучения репеллентной
активности веществ
Отбор веществ, обладающих репеллентной активностью, проводят в два этапа: на первом этапе определяют уровень репеллентной активности в сравнении с эталоном, которым является диэтилтолуамид (ДЭТА) в аналогичных концентрациях, на втором этапе изучают спектр репеллентного действия веществ в разных концентрациях по отношению к различным видам насекомых.
3.4.1. Определение
репеллентной активности веществ
по отношению к лабораторной культуре комаров
методом ольфактометрии
На полоски фильтровальной бумаги или ткани (бязь) размером 2´6 см наносят 0,12 мл 5 - 20 %-ных растворов испытуемых соединений, 0,5 %-ных растворов синтетических и натуральных душистых веществ. Тесты помещают в ольфактометр после полного высыхания тестов.
Для опытов используют ольфактометр, основная часть которого состоит из цилиндрической камеры высотой 12 см и диаметром 30 см. Камера имеет по окружности 24 отверстия, в которые впаяны трубки диаметром 2,5 см, длиной 6 - 8 см. Трубки имеют боковые отводки, а на конце Т-образные приемники, в которые через трубки вылетают насекомые. Один конец приемников закрывают мельничным газом, другой - пробкой. Внутрь боковых отводов трубок вкладывают полоски тестов, пропитанные раствором изучаемого вещества. Внутри камеры имеется подвижная цилиндрическая шторка высотой 6 см, плотно прилегающая к стенкам ольфактометра. При движении шторки вверх-вниз одновременно закрываются или открываются боковые отверстия приемников с изучаемыми веществами, позволяя или препятствуя комарам, находящимся в камере, залететь в трубки и реагировать на пары репеллентов. В приборе использована реакция бегства насекомых при возбуждении и стремление их лететь к свету через трубки.
Ольфактометр помещают в специально оборудованный бокс, где поддерживают оптимальные для насекомых условия: температуру воздуха (26 ± 1) °С, относительную влажность 60 - 70 % и имеется постоянный источник света (лампа 150 Вт). В камеру ольфактометра помещают 500 голодных комаров, открывают, опуская шторку, боковые отверстия, включают электромотор и лампу, расположенную над камерой. Камера медленно вращается вокруг оси для выравнивания освещения. Экспозиция 15 мин. За это время основная часть насекомых покидает камеру и распределяется по трубкам. Для подсчета насекомых, находящихся в трубках, шторку закрывают, а насекомых усыпляют эфиром. Степень отпугивающего действия вещества определяют по числу комаров, залетевших в трубки с обработанными и контрольными полосками, и вычисляют КОД (формула 9).
При определении длительности отпугивающего действия обработанные полоски испытывают каждые 3 - 5 суток вплоть до утраты ими репеллентных свойств, когда КОД становится ниже 70 %. При изучении быстро испаряющихся веществ (натуральные душистые вещества и др.) опыты следует проводить чаще (в отдельных случаях - ежедневно).
3.4.2. Определение
репеллентной активности веществ
по отношению к лабораторной культуре блох
методом ольфактометрии
Метод основан на способности голодных блох вспрыгивать и оставаться длительное время на колеблющихся полосках бумаги или ткани.
Полоски бумаги или ткани размером 1,5´14,5 см пропитывают 0,2 мл раствора испытуемого вещества (препарата) в 3 повторностях. Соединения изучают в 2 - 5 - 10 - 20 %-ной концентрации, синтетические и натуральные душистые вещества - в 1 %-ной. Контрольные полоски пропитывают 0,2 мл растворителя.
Опыты проводят в ольфактометре, который представляет собой цилиндрическую камеру с внутренним цилиндром. На оси под верхней крышкой расположен вращающийся диск. На диске по окружности имеются 24 отверстия, куда вставляют стеклянные трубки с развернутым верхним краем и внутренним диаметром не менее 15 мм. Высота внешнего цилиндра - 15 см, диаметр - 25 см, внутреннего - 15 и 17 см соответственно. Трубки висят между стенками наружного и внутреннего цилиндров.
При проведении опыта обработанные и контрольные полоски помещают в трубки ольфактометра, чередуя 1 контрольный с 4 - 5 обработанными, и закрывают сверху пробками. На дно камеры между внешним и внутренним цилиндрами помещают 500 голодных блох. Экспозиция - 20 мин. Для равномерного распределения насекомых диск с трубками вращают с помощью мотора со скоростью 10 оборотов в минуту. Насекомые покидают камеру прибора и распределяются по полоскам в трубках. По окончании экспозиции мотор выключают, трубки быстро извлекают из прибора, помещают в пробирки, расположенные в штативе, блох усыпляют и подсчитывают.
Степень отпугивающего действия веществ определяют по соотношению числа блох, оставшихся на обработанных и контрольных полосках. Коэффициент отпугивающего действия (КОД) вычисляют по формуле (9).
Длительность репеллентного действия устанавливают на полосках, которые повторно проверяют один раз в 2 - 3 суток, а в промежутках между опытами хранят подвешенными при комнатной температуре.
3.4.3. Определение
репеллентной активности веществ
по отношению к иксодовым клещам
3.4.3.1. Метод отсекающей концентрации
Для иксодовых клещей, обладающих свойством отрицательного геотаксиса, возможны два варианта опытов: по отсекающей концентрации и по градиенту концентраций. В первом, более простом варианте, используют тест из полоски хлопчатобумажной бязи размером 10´70 см. На нее карандашом наносят отметки длины от 0 до 60 см, причем первая (нулевая) отметка делается на расстоянии 10 см от края. На участок ленты, размещенной горизонтально на невпитывающей поверхности (стекло, керамическая плитка и т. д.), начиная от отметки 0 до 10 (площадь обрабатываемого участка 100 см2), из пипетки равномерно наносят 1 мл 20 %-ного раствора изучаемого вещества в этиловом спирте. Эталонный тест обрабатывают аналогично опытному, используя раствор ДЭТА. Контрольный тест обрабатывают, используя только растворитель. После испарения растворителя все тесты развешивают в лаборатории в одинаковых контролируемых условиях температуры, влажности, освещенности. Опыты проводят в день обработки. Тесты закрепляют под углом 70°. Клещей по одному помещают на 5 см ниже нулевой отметки и наблюдают за их передвижением вверх по ткани, дополнительно стимулируя их пальцем наблюдателя, который держат на расстоянии 0,5 см от гипостома клеща. На контрольном тесте, как правило, все клещи проползают отмеченную зону. При испытаниях опытного и эталонного тестов регистрируют число клещей, проползших обработанную зону. После испытаний клещей фиксируют в 70 %-ном растворе этилового спирта или продолжают дальнейшее наблюдение за ними. Опыт проводят не менее чем с 30 самками. Рассчитывают КОД, который в данном случае равен доле (в процентах) клещей, не проползших обработанную зону от числа клещей в опытном варианте. Результаты опытов сопоставляют с результатами испытаний эталонного теста, который, как правило, обеспечивает для таежных клещей КОД 95 - 100 %. Для определения длительности репеллентного действия (ДРД) испытания повторяют ежедневно до тех пор, пока КОД сохраняется равным или выше 90 %.
3.4.3.2. Метод градиента концентраций
На ленте бязи (10´70 см) обрабатывают зоны по 5 см (площадь 50 см2) одним миллилитром 5 - 10 - 20 - 40 %-ных растворов репеллента в этиловом спирте. Обработанные зоны чередуют с контрольными (необработанными) полосами по 10 см. Нижний край ленты на 10 см оставляют необработанным. Подготовленную к испытанию ленту просушивают в горизонтальном положении и закрепляют под углом 70°.
Клещей по одному подсаживают на 5 см ниже первой обработанной полосы и наблюдают за его передвижением вверх. Стремление ползти вверх усиливают пальцем экспериментатора, перемещаемым на расстоянии 0,5 см от гипостома движущегося клеща. Отмечают поведение клещей при пересечении каждой из обработанных полос. Малоактивных клещей, не достигших нижней обработанной полосы, в опыте не учитывают. Определяют наименьшую концентрацию, отпугивающую клещей. Удовлетворительными репеллентными свойствами обладает та концентрация, при которой обработанное пространство пересекают не более 10 % клещей, от числа взятых в опыт.
3.4.4. Определение
репеллентной активности веществ
по отношению к природным популяциям кровососущих двукрылых
методом ольфактометрии
В опытах используют природные популяции кровососущих двукрылых, доминирующих в данной климатической зоне. Конструкция ольфактометра аналогична описанной выше, но его размер и число трубок зависят от того, сколько веществ одновременно исследуется и по отношению к каким видам насекомым. При проведении опытов на комарах и слепнях используют ольфактометр, состоящий из 12-канальной камеры емкостью 1 л и Т-образных трубок диаметром 2,5 - 3,0 см, длиной 8 - 10 см. При проведении опытов на мошках и мокрецах используют ольфактометр с камерой объемом 0,5 л и трубками диаметром 1,5 и длиной 8 см.
Принцип работы ольфактометра такой же, как и в лабораторных опытах. Полоски фильтровальной бумаги или бязи пропитывают изучаемым препаратом или раствором вещества. Поскольку отпугивающие свойства веществ и реакция на них насекомых изменяются под влиянием различных факторов, в каждый опыт обязательно включают эталон (ДЭТА) и контроль. Каждое вещество изучают в 3-х повторностях. Контрольными служат полоски фильтровальной бумаги или бязи, пропитанные растворителем.
Насекомых для опытов собирают в ловушки или сачками. Чтобы насекомых меньше травмировать при сборах, сачки снабжают приемником - трубкой, вставленной в узкий конец сачка. В ольфактометр помещают 500 мошек или мокрецов, 100 комаров или 50 - 100 слепней. В период постановки опытов регистрируют температуру, влажность воздуха, освещенность.
Коэффициент отпугивающего действия (КОД) определяют по соотношению числа насекомых, залетевших в контрольные трубки и трубки с обработанными тестами (формула 9). Соединения и препараты, у которых установлен широкий спектр отпугивающего действия при КОД не менее 90 %, отбирают для проведения испытаний на обработанной ткани.
3.4.5. Определение
репеллентной активности веществ по отношению
к природным популяциям кровососущих двукрылых при обработке ткани
Полоски марли размером 20´50 см площадью 1000 см2 пропитывают 10 - 20 %-ными спиртовыми растворами репеллентов из расчета 20 г на 1 м2 ткани. При испытании концентратов эмульсий репеллентов марлю обрабатывают 10 - 20 %-ными эмульсиями, приготовленными из концентратов. При изучении эмульсий и лосьонов на полоску марли наносят 10 мл препарата. При изучении эффективности наполнителей аэрозольных баллонов марлю обрабатывают струей из баллона с расстояния 15 - 20 см, из расчета 15 - 20 г смеси на 1 м2 ткани. Расход смеси определяют взвешиванием баллона до и после обработки. Обработанные полоски марли развешивают и подсушивают в течение суток.
Первое определение отпугивающего действия тестов проводят через сутки после обработки, последующие - один раз в 3 - 5 - 7 дней. В промежутках между опытами тесты хранят в вертикальном положении на открытом воздухе под навесом в условиях, обеспечивающих свободное испарение вещества.
Испытания проводят в местах массового нападения кровососущих насекомых. До начала исследований и в период проведения опытов проводят учеты численности насекомых и их сбор (сачком или эксгаустером) для определения доминирующих видов, регистрируют метеорологические факторы (температура и влажность воздуха, сила ветра, освещенность, давление). Интенсивность нападения кровососов на человека определяют путем подсчета числа насекомых, севших на обнаженное предплечье (голень) испытателя в течение 20 мин (4 раза по 5 мин) через каждый час в период суточной активности кровососущих насекомых.
Эффективность репеллента определяют в часы максимальной активности доминирующих видов при интенсивности их нападения на обнаженное предплечье (голень) испытателя не менее 25 - 30 особей за 5 мин. Испытания проводят не менее 3 человек (один испытывает опытный образец, второй - эталон, третий - контроль). Испытатели с опытной и эталонной полосками ткани располагаются с подветренной стороны от контрольного на расстоянии не менее 5 м от него и друг от друга в условиях равномерного освещения. Полоски ткани размещают на обнаженном предплечье (голени) и подсчитывают число кровососов, садящихся на них в течение 15 мин (три раза по 5 мин).
Величину репеллентного действия препарата определяют по показателю КОД. Острое репеллентное действие характеризует КОД, установленный в первые сутки после обработки тестов. В качестве эталона используют ДЭТА в аналогичной концентрации.
Определение длительности репеллентного действия обработанной ткани проводят периодически в течение сезона. Препарат считают неэффективным, когда его КОД опускается ниже 70 %. Длительность репеллентного действия выражают в сутках.
4. Методы оценки эффективности инсектоакарицидов, регуляторов развития, репеллентов в различных препаративных формах
4.1. Метод оценки эффективности липкой ловушки без инсектицидов в виде домиков для борьбы с тараканами
Оценку эффективности липких ловушек проводят на рыжих тараканах инсектарной культуры. Для этого используется бокс из оргстекла (20´20´30 см) или жестяные полигоны (60´40´15 см), на верхнюю часть внутренней поверхности которых нанесена полоска вазелина шириною 2 см, препятствующая выползанию насекомых. В бокс (полигон) помещают по 20 самок, 20 самцов и 80 личинок II - IV возрастов. Снимают бумагу и освобождают липкую поверхность ловушки. Вскрывают пакетик с пищевой приманкой и помещают ее в центре ловушки (если приманка не находится в ловушке под защитной бумагой).
Ловушку помещают в центре бокса (полигона), там же располагают поилку с водой и альтернативное укрытие. Учеты эффективности проводят через 1 - 5 ч через 1, 2, 7 и 14 дней и далее при необходимости. Повторность опыта трехкратная.
Параллельно ставят контрольный вариант: в бокс (полигон) помещают альтернативный корм на подложке (кусочек белого хлеба с подсолнечным маслом), поилку с водой и альтернативное укрытие.
4.2.
Метод оценки эффективности клейких (липких)
ловушек для борьбы с летающими насекомыми
(мухи, моль)
Оценку эффективности липких листов, лент и палочек проводят на комнатных мухах инсектарной культуры. Для этого используют большие садки (50´50´50 см), представляющие собой каркасы с натянутыми на них садками из марли или мельничного газа, или камеры объемом 1 м3.
Липкие листы, предварительно разъединив или сняв с них защитный бумажный слой, помещают по одному в садок или камеру. Липкие палочки или липкие ленты освобождают от защитного слоя бумаги или гильзы и также подвешивают в садке или камере. В садок выпускают 100 комнатных мух (50 самок и 50 самцов), в камеру - 300 насекомых (150 самок и 150 самцов). Повторность опыта трехкратная. Количество прилипших мух подсчитывают в динамике: через 3 - 5 ч, 1 и 2 суток и далее в зависимости от необходимости.
4.3.
Метод оценки эффективности инсектицидных пищевых
приманок в борьбе с тараканами и муравьями
Оценку эффективности пищевых приманок (в виде контейнеров - приманочных станций, таблеток, шариков, брикетов, гранул, порошка, пасты, гелей и т. д.) проводят на рыжих тараканах и домовых рыжих муравьях инсектарной культуры или домовых рыжих муравьях, черных садовых муравьях природных популяций.
Для этого используют боксы из оргстекла (20´20´30 см), стеклянные кристаллизаторы (диаметр 30 см) или жестяные полигоны (60´40´15 см), на внутреннюю поверхность которых сверху нанесена полоска вазелина шириною 2 см, препятствующая выползанию насекомых. Жестяные полигоны изнутри оклеивают бумагой. В бокс (кристаллизатор или полигон) помещают по 20 самок, 20 самцов и 80 личинок II - IV возрастов тараканов или 100 особей муравьев; после этого там же располагают контейнер или на подложке инсектицидную пищевую приманку массой 0,5 - 3,0 г, поилку с водой и альтернативное убежище.
Параллельно ставят контрольный вариант: в бокс (контейнер, полигон) помещают альтернативную приманку (кусочек белого хлеба с подсолнечным маслом), поилку и альтернативное убежище.
Учет гибели насекомых ведут ежедневно. Для изучения остаточного действия проводят подсадку новой экспериментальной группы насекомых через 7, 14, 21, 28 и более суток.
При испытании гелей опыты могут быть заложены в двух модификациях: а) нанесение геля в виде пунктирной линии по периметру сосуда (1,5 см геля с интервалом в 4 см), б) помещение геля массой 0,5 - 1,5 г на подложку.
Учет поедаемости геля (приманки) ведут путем ежедневного взвешивания подложки с гелем (приманки в контейнере) с точностью до 0,001 г. Поскольку гель в первые несколько суток теряет влагу, входящую в рецептуру, учитывают потерю массы средства в сравнении с массой контрольного варианта (гель в отсутствие тараканов) путем ежедневного взвешивания подложки с полоской геля.
Повторность опытов трехкратная при температуре 20 - 22 °С и относительной влажности воздуха 50 - 70 %.
4.4.
Метод оценки эффективности пищевых инсектицидных
приманок для борьбы с мухами
Оценку эффективности пищевых приманок (жидких, сухих сахарных, гранулированных) проводят на комнатных мухах инсектарной культуры.
Для этого используют большие садки (50´50´50 см), представляющие собой каркасы с натянутыми на них садками из марли или мельничного газа или специальные боксы объемом 1,0 м3. В центре бокса размещают емкость с жидкой приманкой или на подложку помещают 2 - 3 г сухой формы приманок (порошок, пена, паста, гранулы). Сахарную приманку наносят на стеклянную, фанерную или другие типы поверхностей и дают им подсохнуть, затем помещают в бокс или садок.
Параллельно ставят контрольный вариант: в садки (боксы) помещают сосуд с 5 %-ным сахарным сиропом и выпускают 100 мух.
Учитывают гибель мух через 1, 2, 4, 24 ч, а далее в зависимости от цели эксперимента.
4.5.
Методы оценки инсектицидной активности средств
в аэрозольных или беспропеллентных упаковках
4.5.1. Оценка инсектицидной
активности средств
в аэрозольной упаковке по отношению к летающим насекомым
Оценку эффективности средств в аэрозольной упаковке проводят на комнатных мухах или комарах p. Anopheles, Ae. aegypti или С. pipiens инсектарной культуры.
В камеру объемом 2 м3 выпускают 300 насекомых. Во время испытаний температуру поддерживают в режиме (22 ± 2) °С, чтобы избежать излишне возбуждающего или угнетающего влияния температуры, относительную влажность - в пределах 50 - 70 %. При изучении каждой рецептуры ставят не менее 5 опытов. Струю аэрозоля из баллона направляют в камеру, расход смеси не должен превышать 1 г/м3. При помощи секундомера определяют время (Т) поражения 99 % насекомых. Определяют концентрацию (С) инсектицида в воздухе по формуле:
![]() ,
,
где
Q - количество смеси, выпущенной из аэрозольного баллона в камеру, определяемое по разности веса упаковки до и после опыта;
Z - доля инсектицида в смеси (% действующего вещества, пересчитанного в мг/г), определяемая составом наполнителя;
V - объем камеры.
Эффект определяют по импульсу концентрации (С ´ Т), где Т - время поражения 99 % насекомых, для которого устанавливают среднюю величину и доверительный интервал при Р = 0,05.
Критерием оценки эффективности аэрозолей служит условно принятая величина концентрации инсектицида в воздухе - С15, мг/м3, которая вызывает поражение 99 % мух или комаров в течение условно принятого времени - 15 мин и Q15, мг/м3 - количество смеси, выпущенное из баллона, вызывающее поражение 99 % насекомых за 15 мин, а также величина КТ50 - время поражения 50 % особей.
![]() ;
; ![]()
Величину КТ50 вычисляют графически.
4.5.2. Оценка эффективности
средств в аэрозольных
или беспропеллентных упаковках по отношению к
нелетающим членистоногим
Эксперименты проводят в камерах объемом 1 м3, снабженных вентиляционной системой. Дно камеры выстилают фильтровальной бумагой. Температура в камере при проведении экспериментов составляет 22 - 25 °С, относительная влажность - 50 - 70 %. Для характеристики эффективности средств в аэрозольных и беспропеллентных аэрозольных упаковках с механическим распылителем определяют острое действие и период остаточного действия.
Определение острого действия. Для определения острого действия используют имаго рыжих, черных и американских тараканов, которых помещают в 0,5-литровые емкости по 10 экземпляров (5 самок и 5 самцов); постельных клопов и их яйца 1 - 4-дневного эмбрионального развития помещают в стеклянные экспозиметры (высота 5 см, диаметр 4,5 см), которые располагают на стеклах (10´10 см), покрытых фильтровальной бумагой.
Определение остаточного действия. Для определения остаточного действия отложений аэрозоля в пяти точках дна камеры располагают тест-поверхности (стеклянные, из фанеры или из других типов материалов) размером (10´20 см). Эти обработанные поверхности после обработки и подсушки хранят в вертикальном положении при комнатной температуре и периодически на них проводят подсадку имаго рыжих тараканов, постельных клопов и других для выявления длительности инсектицидного действия. Насекомых и поверхности орошают препаратом из баллона с высоты 20 см, направляя струю аэрозоля под углом 45°. Насекомых и тесты удаляют из камеры через 10 мин после орошения. Насекомых переносят в чистую посуду. За их состоянием наблюдают, отмечая через 5, 10, 30 мин, 1, 2, 4 ч и далее ежедневно в течение 2 - 5 суток число насекомых без внешних признаков паралича, парализованных и погибших. Энтомологическую оценку каждой рецептуры наполнителя аэрозольных баллонов или беспропеллентных упаковок проводят в 3 повторностях. Норма расхода препарата составляет 10 - 20 г на 1 м2 обрабатываемой поверхности в зависимости от состава рецептуры средства. Отклонение от средней величины расхода препарата не должно превышать 5 %. Расход препарата определяют путем взвешивания баллона (упаковки) до и после опыта.
Остаточное действие отложений аэрозолей определяют через 1, 2, 3 суток и далее при наличии длительного остаточного действия через каждые 7 дней в течение 28 суток и более после контакта тараканов с обработанными поверхностями в течение 15 мин с помощью экспозиметров Набокова или в течение 1 ч и более в экспозиметрах диаметром 8 - 9 см.
Насекомых после контакта с обработанными пластинками переносят в чистые сосуды и регистрируют их состояние в течение 24, 48 и 72 ч в зависимости от химической структуры действующих веществ. Действие инсектицида считают законченным, когда смертность насекомых составляет менее 50 %.
4.6. Методы оценки эффективности пиротехнических средств
4.6.1. Метод оценки пиротехнических
средств для борьбы
с летающими насекомыми
Оценку эффективности пиротехнических средств (таблетки, шашки, шнуры и др.) проводят на комнатных мухах или комарах инсектарной культуры.
На дно камеры объемом 2 м3 раскладывают по 5 тест-поверхностей из стекла и фанеры или других типов поверхностей в зависимости от задач экспериментов и выпускают 300 насекомых. Во время испытаний температуру поддерживают в режиме (22 ± 2) °С, чтобы избежать излишне возбуждающего или угнетающего влияния температуры, относительную влажность - в пределах 50 - 70 %. На подложку из негорючих материалов помещают в камеру пиротехническое средство. Требуемое количество пиротехнического средства для опыта рассчитывают на камеру объемом 2 м3. Средство поджигают, камеру закрывают, выдерживают в течение 2 ч, подсчет погибших насекомых проводят через 2 ч.
Остаточное действие определяют путем подсадки имаго комнатных мух или комаров на 5 мин в экспозиметрах на тест-поверхности через 2 ч после их обработки и далее через 1 и более суток. Учет гибели ведут через 24 ч.
4.6.2. Метод оценки пиротехнических
средств для борьбы
с нелетающими насекомыми
Оценку эффективности пиротехнических средств проводят на рыжих тараканах, крысиных блохах и постельных клопах инсектарной культуры.
На дно камеры объемом 2 м раскладывают по 5 тест-поверхностей из стекла и фанеры или других материалов в зависимости от цели эксперимента; в 5 точках поверхности дна камеры расставляют емкости на 0,5 л, в которых помещено по 10 имаго тараканов (5 самок и 5 самцов), клопы в стеклянных экспозиметрах (высота 5 см, диаметр 4,5 см). Во время испытаний температуру поддерживают в режиме (22 ± 2) °С, чтобы избежать излишне возбуждающего или угнетающего влияния температуры, относительную влажность - в пределах 50 - 70 %. На подложку из негорючих материалов помещают в камеру пиротехническое средство. Требуемое количество пиротехнического средства для опыта рассчитывают на камеру объемом 2 м3. Средство поджигают, камеру закрывают, выдерживают в течение 2 ч, подсчет погибших насекомых проводят через 2 ч.
Остаточное действие определяют путем подсадки рыжих тараканов, постельных клопов и крысиных блох в экспозиметрах на тест-поверхности через 2 и 24 ч после их обработки на 15 мин. В дальнейшем подсадки ведут через 3, 5, 7 суток и более в зависимости от длительности защитного действия средства. Учет гибели ведут через 24 ч.
В том случае, если пиротехническое средство рассчитано на помещения больших объемов, испытания следует проводить не в камере, а в модельных помещениях, поскольку нельзя нарушать строение средства. При нарушении меняется термодинамика и получаются искаженные результаты.
4.7. Методы оценки эффективности инсектицидных порошков
Оценку эффективности инсектицидных порошков проводят на рыжих тараканах и других нелетающих насекомых и комнатных мухах инсектарной культуры.
Навески порошка для выбора нормы расхода данного средства из расчета на площадь тест-поверхности наносят на пластинки из фанеры размером 10´20 см (площадь 200 см2). Навеску равномерно распределяют по пластинке. Насекомых подсаживают в экспозиметрах на обработанную поверхность на 30 с, затем их переносят в чистые стаканы. Кратковременность выбранного контакта связана с тем, что порошок быстро налипает на насекомых и продолжает действовать после пересадки их в чистый стакан.
При
определении острого действия подсадку насекомых проводят сразу после нанесения
порошка. Учет гибели проводят через 24 - 48 ч.
При определении остаточного действия насекомых подсаживают через 1, 3 и более суток после обработки поверхности вплоть до окончания инсектицидного действия. Учет гибели насекомых проводят через 24 - 48 ч после контакта.
4.8.
Методы оценки эффективности инсектицидных карандашей,
мелков, брусков для борьбы с нелетающими членистоногими
Оценку эффективности инсектицидных карандашей, мелков, брусков проводят на рыжих тараканах инсектарной культуры двумя методами.
При первом в качестве тест-поверхности используют пластинку из фанеры размером 10´20 см (площадь 200 см2), которую закрашивают инсектицидным карандашом или бруском. Норму расхода для тестируемого средства рассчитывают на площадь тест-поверхности, как указано выше. Для контроля нормы расхода пластинку взвешивают до и после обработки. При необходимости средство удаляют или же добавляют.
При определении острого действия подсадку насекомых в экспозиметрах на пластинку на 30 с проводят сразу после нанесения средства, затем их переносят в чистые стаканы. Учет гибели проводят через 24 ч. При определении остаточного действия насекомых подсаживают на 30 с через 1, 3 и более суток после обработки тест-поверхности вплоть до окончания инсектицидного действия. Учет гибели насекомых также проводят через 24 - 48 ч.
При использовании экспресс-метода берут емкость (таз или кристаллизатор) диаметром не менее 30 см. Из оберточной бумаги вырезают круги, диаметр которых соответствует диаметру таза. На кругах карандашом наносят 6 окружностей. Диаметр первой составляет 4 см, диаметр каждой последующей увеличивается на 2 см. Предварительно рассчитывают площадь 3 концентрических полос на каждом круге по формуле:
![]() (см2)
(см2)
Для нашего примера упрощенный расчет выглядит так:
![]() 169,56 см2
169,56 см2
В соответствии с рекомендуемыми нормами расхода инсектицидного средства на 1 м2 обрабатываемой поверхности рассчитывают количество средства, наносимого на концентрические полосы. Так, при норме расхода 5 г/м2 в рассматриваемом случае должно быть нанесено 85 мг средства. Далее инсектицидным карандашом или мелком закрашивают 3 концентрических полосы. Количество нанесенного средства определяют путем взвешивания бумажных кругов до и после обработки, при необходимости средство удаляют или добавляют.
При определении острого действия в центр бумажного круга, помещенного в емкость, края которой смазаны вазелином, из пробирки выпускают 10 имаго рыжих тараканов (5 самцов и 5 самок). Тараканы разбегаются и прячутся под бумажный круг. При этом время контакта насекомых с обработанной поверхностью составляет 3 - 5 с.
Затем круг аккуратно вынимают и собирают тараканов в чистые стаканы. Учет гибели проводят через 24 ч. Опыты ставят в 3 - 5-кратной повторности.
При определении остаточного действия бумажные круги с нанесенным средством хранят 3 и более суток в горизонтальном положении вдали от солнечных лучей. Для определения продолжительности остаточного действия описанный выше процесс повторяют через 3 и более суток в зависимости от продолжительности остаточного действия или выбранных экспериментатором экспозиций.
4.9.
Метод оценки эффективности микрокапсулированных инсектицидных
средств для борьбы с нелетающими насекомыми
Оценку эффективности микрокапсулированных инсектицидных средств проводят на разных видах насекомых инсектарных культур.
Образец средства, интенсивно взбалтывают и берут навеску. Необходимые концентрации готовят, используя стандартные методики.
Опыты проводят на рыжих тараканах в камере объемом 1 м3, снабженной вентиляционной системой. На дне камеры на площади 0,5 м по постоянной схеме равномерно размещают в 5 точках по 10 экземпляров рыжих тараканов (соотношение самок и самцов 1:1), помещенных в сосуды объемом 0,5 л. Одновременно в камеру помещают тест-поверхности (не менее чем по 10 пластинок стекла и фанеры размером 10´20 см), которые в дальнейшем используют для установления остаточного действия тестируемого средства. Насекомых и тест-поверхности орошают препаратом из пульверизатора или опрыскивателя типа «Росинка» или «Квазар» с высоты 20 см, направляя струю под углом 45°. Норма расхода рабочей жидкости 50 мл/м2. Расход препарата определяют или предварительно забирая 50 мл рабочей жидкости, или путем взвешивания опрыскивателя до и после проведения обработки. Температура в камере во время опытов должна быть постоянной - (22 ± 2) °С, относительная влажность - более 50 %. Насекомых и тест-поверхности удаляют из камеры через 10 мин после орошения. Насекомых переносят в чистую посуду. Число особей без внешних признаков паралича, парализованных и погибших отмечают через 10, 30 мин, затем каждый час в течение 5 ч и далее ежедневно в течение 5 суток.
Остаточное действие отложений средства определяют методом контакта тараканов в экспозиметрах в течение 15 мин с обработанными поверхностями на первые, седьмые сутки после обработки и далее с интервалом в 1 - 2 недели вплоть до окончания инсектицидного действия. Насекомых после контакта с обработанными пластинками переносят в чистые сосуды и регистрируют их состояние через 24 - 48 ч.
4.10.
Метод оценки эффективности
средств, применяемых путем опрыскивания
Оценку эффективности концентратов эмульсий, микро- и макроэмульсий, суспоэмульсий, смачивающихся и растворимых порошков, гелей, из которых готовят рабочие жидкости, флоу, водных растворов средств, предназначенных для борьбы с насекомыми путем опрыскивания проводят на тараканах и других насекомых инсектарных культур. В том случае, если средство предназначено для уничтожения определенного вида членистоногого, испытания проводят именно на этом объекте.
Образец средства, представленный для определения его активности, интенсивно взбалтывают и берут навеску для приготовления серии концентраций. Путем разбавления водой готовят необходимые концентрации.
Опыты проводят на насекомых в камере объемом 1 м3, снабженной вентиляционной системой. На дне камеры на площади 0,5 м2 по постоянной схеме равномерно размещают в 5 точках по 10 экземпляров тараканов (соотношение самок и самцов 1:1) в сосудах объемом 0,5 л, постельных клопов и их яйца в экспозиметрах, описанных выше. Одновременно в камеру помещают тест-поверхности (не менее чем по 5 пластинок стекла и фанеры размером 10´20 см), которые в дальнейшем используют для установления остаточного действия тестируемого средства. Насекомых и тест-поверхности орошают препаратом из пульверизатора или опрыскивателя типа «Росинка» или «Квазар» с высоты 20 см, направляя струю под углом 45°. Норма расхода рабочей жидкости 50 мл/м2. Расход препарата определяют или предварительно беря 50 мл рабочей жидкости при обработке стекла и 100 мл при обработке фанеры, или путем взвешивания опрыскивателя до и после проведения обработки. Температура в камере во время опытов должна быть постоянной - (22 ± 2) °С, относительная влажность - более 50 %. Насекомых и тест-поверхности удаляют из камеры через 10 мин после орошения. Насекомых переносят в чистую посуду. Число особей без внешних признаков паралича, парализованных и погибших отмечают через 10, 30 мин, затем каждый час в течение 5 ч и далее ежедневно в течение 3 суток.
Остаточное действие отложений средства определяют методом контакта тараканов в экспозиметрах в течение 15 мин (мух, блох - в течение 5 мин) с обработанными поверхностями на первые, седьмые сутки после обработки и далее с интервалом в 1 - 2 недели вплоть до окончания инсектицидного действия. Насекомых после контакта с обработанными пластинками переносят в чистые сосуды и регистрируют их состояние через 24 - 48 ч.
4.11.
Метод оценки эффективности
средств, предназначенных для борьбы
с личинками комаров
Оценку активности инсектицидов для личинок комаров проводят на личинках II - IV возраста p. Anopheles, Ae. aegypti, С. pipiens инсектарных культур.
Образец средства, представленный для определения его активности, если он представляет собой жидкую форму, интенсивно взбалтывают и берут навеску для приготовления серий концентраций. Путем разбавления водой готовят необходимые концентрации.
В сосуды объемом 0,5 л (стеклянные сосуды, химические или парафинированные стаканы и т. п.) наливают по 249 мл водопроводной воды, отстоянной в течение 24 ч. В каждый сосуд помещают по 25 личинок II - IV возрастов и через 2 ч добавляют 1 мл рабочего раствора (эмульсии, суспензии) инсектицида определенной концентрации. Контролем являются личинки, находившиеся в воде без добавления инсектицида.
Каждый опыт повторяют не менее трех раз. В период эксперимента температура воды должна находиться в пределах (22 ± 1) °С. Подсчет погибших личинок проводят через 24 ч. Если более 10 % личинок в контроле окуклилось, опыт не учитывают и повторяют.
4.12. Определение эффективности
электрофумигаторов, предназначенных для борьбы
с летающими насекомыми
Оценку активности инсектицидов для комаров проводят на имаго p. Anopheles, Ае. aegypti, С. pipiens инсектарных культур в возрасте 14 - 20 дней, получавших углеводное питание.
4.12.1. Электрофумигаторы с матами (пластинами)
4.12.1.1. Метод оценки КТ50
В чистую камеру объемом 1 м3 запускают (100 ± 5) самок комаров. Температуру в помещении поддерживают в пределах (25 ± 2) °С. Электрофумигатор (нагревательное устройство) включают в электрическую сеть согласно инструкции за 15 мин до начала опыта. Инсектицидный мат (пластину) помещают на нагревательную поверхность и сразу размещают электрофумигатор с пластиной в камере с комарами. С помощью секундомера регистрируют время начала нокдауна у первого комара в камере и время нокдауна у 99 % комаров. По этим показателям графическим методом определяют время наступления нокдауна у 50 % особей (КТ50, мин). Опыт повторяют три раза. Рассчитывают среднее значение KT50 и статистическую ошибку.
4.12.1.2. Метод оценки резерва мата
Для определения резерва мата (максимального времени использования мата) определяют KT50 для комаров (по приведенному выше методу), используя маты, которые уже нагревались до опыта 1 - 5 и более часов. Опыт повторяют три раза. Рассчитывают среднее значение KT50 и статистическую ошибку. За резерв мата принимается максимальное время нагрева мата в часах, при котором KT50 остается не более 3 мин.
4.12.2. Жидкостные электрофумигаторы
4.12.2.1. Метод оценки KT50
Электрофумигатор включают в электрическую сеть согласно инструкции и через 60 мин помещают его в камеру с комарами так же, как описано выше для электрофумигаторов с матами. С помощью секундомера регистрируют время начала нокдауна у первого комара в камере и время нокдауна у 99 % комаров. По этим показателям графическим методом определяют время наступления нокдауна у 50 % особей (KT50, мин). Опыт повторяют три раза. Рассчитывают среднее значение KT50 и статистическую ошибку.
4.12.2.2. Метод оценки резерва жидкости во флаконе
Для определения резерва жидкости во флаконе (максимального времени использования жидкости во флаконе) определяют количество испарившейся жидкости после непрерывной работы электрофумигатора в течение не менее 8 ч. Этот процесс должен быть повторен не менее 3 - 5 раз. Каждый раз флакон взвешивают до и после эксплуатации, фиксируя время работы. По разнице в массе флакона рассчитывают количество вышедшего в воздух содержимого флакона (мг/ч) и далее резерв флакона в часах путем деления массы нетто флакона в мг на количество вышедшего в воздух в мг/ч.
4.13. Методы-оценки эффективности
педикулицидных средств
Оценку эффективности педикулицидных свойств средств проводят на платяных вшах P. humanis corporis (имаго, личинки, яйца) лабораторной культуры.
В опытах используют сытых вшей. Подопытных вшей содержат в термостате при температуре (28 ± 2) °С и относительной влажности 70 - 76 %. При изучении эффективности инсектицидов используют методы погружения насекомых и яиц и контактирования их с обработанными поверхностями. Контролем являются насекомые и яйца, подвергающиеся воздействию растворителя, а также насекомые и яйца, не подвергающиеся воздействию средства и растворителя (биоконтроль).
4.13.1. Метод погружения
Приготавливают рабочие жидкости (эмульсии, суспензии и др.) или используют готовые к применению растворы (лосьоны) и порошки педикулицидов.
Насекомых (личинок III возраста, как наиболее устойчивых к инсектицидам, имаго) и яйца по 30 штук помещают в марлевые салфетки (5´5 см) и погружают в рабочие жидкости или в порошок на сроки от 30 с до 60 мин в зависимости от рекомендованной экспозиции в трех повторностях. Опыты сопровождаются контролем. По окончании экспозиции насекомых промывают теплой водой, просушивают на фильтровальной бумаге, переносят в чашки Петри на чистые кусочки бязи (10´10 см) и помещают в термостат при температуре (28 ± 2) °С.
4.13.2. Метод контактирования насекомых с обработанными поверхностями
При оценке средств, предназначенных для борьбы с платяным педикулезом, кусочки бязи размером 10´10 см обрабатывают тестируемым средством (эмульсией, раствором, суспензией, порошком). Жидкие формы используют из расчета 100 мл/м2, порошок равномерно распределяют по поверхности в рекомендуемой в инструктивных материалах норме расхода, чаще всего это 10 г/м2. Бязь, обработанную жидким средством, после высыхания помещают в чашки Петри и на нее подсаживают не менее 20 вшей (10 имаго и 10 личинок III возраста). Срок контакта насекомых со средством составляет от 5 до 60 мин, в зависимости от назначения эксперимента.
При оценке средств, предназначенных для борьбы с головным педикулезом, пряди волос (или полиамидные волокна) обрабатывают средством из расчета 1 мл/10 см2 волос или волокон. Насекомых подсаживают на обработанные волосы на срок от 1 до 60 мин. После контактирования волосы с насекомыми промывают теплой водой с мылом или шампунем и переносят на фильтровальную бумагу для подсушивания. После этого насекомых переносят в чашки Петри на чистые полоски бязи (10´10 см), которые помещают в термостат при температуре (28 ± 2) °С.
При установлении эффективности педикулицидных мазей или гелей, их с помощью кисточки наносят на насекомых и их яйца из расчета 1 г / 10 см2 на период от 1 до 60 мин. После этого насекомых и яйца промывают теплой водой с добавлением мыльного крема для бритья или шампуня для мытья волос, переносят на чистые кусочки бязи (10´10 см) в чашки Петри, которые помещают в термостат для дальнейших наблюдений при температуре (28 ± 2) °С. Опыты ставят в трех повторностях и сопровождают контролем.
4.13.3. Метод оценки педикулицидных
средств в виде
аэрозольных или беспропеллентных упаковок
Оценку эффективности педикулицидных средств в виде аэрозольных или беспропеллентных упаковок проводят в камере объемом 0,75 м3. Кусочки ткани с подсаженными на них насекомыми (имаго и личинками III возраста), а также яйцекладками, орошают струей аэрозоля, направляя ее с высоты 50 см под углом 45°. Норма расхода составляет 10 или 20 г/м2. Количество нанесенного средства определяют по разнице веса баллона до и после выпуска смеси и далее рассчитывают расход действующего вещества, исходя из состава содержимого упаковки. Через 10 мин после орошения подопытных насекомых пересаживают в чашки Петри на чистые кусочки бязи размером 10´10 см и помещают в термостат для наблюдения. Опыты проводят в 3 повторностях и сопровождают контролем. Учеты гибели насекомых проводят через 5, 10, 15, 30 мин и 1 - 5 ч, учеты гибели яиц - в течение двух недель.
4.14.
Методы оценки эффективности
регуляторов развития
При оценке активности регуляторов развития (РРН) основным условием является использование в экспериментах строго выровненного по возрасту (не менее 5 - 6 ч со времени последней линьки) биологического материала: при оценке аналогов ювенильного гормона (АЮГ) используют личинок последнего возраста; при оценке активности ингибиторов синтеза хитина (ИСХ) - личинок II возраста для всех биологических объектов.
Берут навеску вещества или средства, представленного для определения его активности, и готовят серии концентраций.
В том случае если средство представляет собой жидкую форму, его интенсивно взбалтывают и берут навеску; если это гранулы или порошкообразные формы, то навеску берут без предварительных манипуляций.
4.14.1. Оценка эффективности
аналогов
ювенильного гормона
Оценку активности АЮГ для личинок комаров проводят на личинках IV возраста комаров p. Anopheles, Ae. aegypti; личинках крысиных блох X. cheopis, комнатных мух М. domestica, рыжих тараканов В. germanica последних возрастов инсектарных культур.
4.14.1.1. Оценка эффективности АЮГ по отношению к комарам
При испытании АЮГ вносят в сосуды с водой, где содержатся личинки комаров IV возраста. Наблюдения за их развитием проводят ежедневно, регистрируя особей с признаками начала окукливания, затем - формирующих куколку. Показателями эффективности являются: 1) отсутствие нормально сформированной куколки; 2) особи, которые не смогли освободиться от экзувия; 3) особи, которые не смогли подняться с поверхности воды.
При оценке эффективности АЮГ в форме брикетов (гранул) исходят из нормы расхода 1 брикет массой до 10 г на 10 м2 водной поверхности. Строго выдерживают температуру (27 ± 2) °С, поскольку в зависимости от температуры меняются сроки развития личинок. Учет эффективности проводят ежедневно, регистрируя количество личинок с морфогенетическими нарушениями.
Из-за медленной диффузии ДВ в воду из брикетов в отличие от жидких и порошкообразных форм, при использовании которых ДВ сразу попадает в воду, эффект проявляется медленнее.
4.14.1.2. Оценка
эффективности АЮГ
по отношению к комнатным мухам
Препаративные формы на основе АЮГ вносят в субстрат, где происходит развитие преимагинальных стадий в период, когда преобладают личинки последнего возраста. Показатель эффективности - отсутствие вылета нормально сформированного имаго.
При оценке эффективности АЮГ в форме гранул их вносят, исходя из рекомендованной нормы расхода, в субстрат для развития личинок, в который помещают личинок последнего возраста. Строго выдерживают температуру (20 ± 2) °С, поскольку в зависимости от температуры меняются сроки развития личинок: при 20 °С - 4 дня, при 16 °С - 6 - 8 дней. Учет результатов проводят ежедневно.
4.14.1.3. Оценка
эффективности АЮГ
по отношению к крысиным блохам
В субстрат для развития личинок (тонкий слой песка, предварительно, во избежание заплесневения, прокаленный в течение 2 ч и смешанный с сухим стандартным альбумином и пивными дрожжами: 3 г альбумина на 10 г песка) вносят раствор АЮГ в ацетоне. После испарения растворителя по 30 личинок блох последнего возраста помещают в субстрат. Эффективность оценивают, подсчитывая ежедневно личинок с нарушением метаморфоза. Показатели эффективности: 1) нарушения в развитии личинок; 2) отсутствие нормально сформированного кокона; 3) отсутствие выплода жизнеспособных имаго.
4.14.1.4. Оценка эффективности АЮГ по отношению к тараканам
Испытания АЮГ проводят на имаго и личинках методом скармливания отравленных пищевых приманок в течение 1 - 3 суток. Особи с явными нарушениями в развитии появляются не ранее, чем через 5 - 7 дней. Учет эффективности АЮГ аналогичен: 1) количество особей с нарушениями; 2) отсутствие жизнеспособных оотек; 3) выплод нормального поколения.
4.14.2. Оценка эффективности
ингибиторов
синтеза хитина (ИСХ)
Оценку активности ИСХ проводят на личинках II возраста комаров p. Anopheles, Ае. aegypti, крысиных блох X. cheopis, комнатных мух М. domestica, рыжих тараканов В. germanica инсектарных культур.
4.14.2.1. Оценка эффективности ИСХ по отношению к комарам
ИСХ вносят в воду с личинками комаров, находящимися на I - II стадиях развития и наблюдают за процессом линьки, отмечая ежедневно ее нарушения. Появление куколок свидетельствует о прекращении действия средства.
При оценке эффективности ИСХ в форме брикетов (гранул) исходят из нормы расхода 1 брикет массой до 10 г на 10 м2 водной поверхности. Строго выдерживают температуру (27 ± 2) °С, поскольку в зависимости от температуры меняются сроки развития личинок. Учет эффективности проводят ежедневно, регистрируя количество деформированных личинок. Из-за медленной диффузии ДВ в воду из этой формы в отличие от жидких и порошкообразных форм, при использовании которых ДВ сразу попадает в воду, эффект проявляется медленнее.
4.14.2.2. Оценка
эффективности ИСХ по отношению
к комнатным мухам
При оценке эффективности ИСХ в любой препаративной форме вносят, исходя из нормы расхода, в субстрат для развития личинок, в который помещают личинок II возраста. Строго выдерживают температуру (20 ± 2) °С, поскольку в зависимости от температуры меняются сроки развития личинок: при 20 °С - 4 дня, при 16 °С - 6 - 8 дней. Учет результатов проводят ежедневно, подсчитывая количество деформированных личинок. Показатель эффективности - отсутствие нормально сформированной куколки.
4.14.2.3. Оценка
эффективности ИСХ по отношению
к крысиным блохам
В субстрат для развития личинок (тонкий слой песка, предварительно, во избежание заплесневения, прокаленный в течение 2 ч и смешанный с сухим стандартным альбумином и пивными дрожжами: 3 г альбумина на 10 г песка) вносят раствор ИСХ в ацетоне. После испарения растворителя по 30 личинок блох II возраста помещают в субстрат. Эффективность оценивают, подсчитывая ежедневно личинок с нарушением метаморфоза.
4.14.3. Оценка эффективности
пищевых приманок
на основе АЮГ и ИСХ
4.14.3.1. Эффективность
пищевых приманок на основе
АЮГ и ИСХ для мух
Пищевую приманку с регулятором развития насекомых ставят в садок размером 30´30´30 см, в который запускают 50 - 100 имаго 3 - 4-дневных комнатных мух. В этот же садок ставят субстрат для откладки яиц (смесь отрубей с водой и молоком) и поилки с водой. Наблюдения ведут ежедневно в течение 5 суток до получения яйцекладок.
4.14.3.2. Оценка
эффективности пищевых приманок на основе
АЮГ и ИСХ для тараканов
Пищевую приманку с РРН ставят в пластиковые боксы размером 20´20´30 см, в которые вносят имаго и личинок тараканов (самцы, самки, личинки в соотношении 1:1:4). Туда же ставят поилки с водой. Наблюдения проводят ежедневно в течение 7 суток, подсчитывая количество личинок с морфологическими изменениями. Особи с явными нарушениями в развитии появляются не ранее чем через 5 - 7 дней. Учет эффективности АЮГ и ИСХ аналогичен: 1) количество особей с нарушениями; 2) отсутствие жизнеспособных оотек; 3) выплод нормального поколения.
4.15.
Методы оценки
эффективности репеллентных средств
Оценку инсекторепеллентной активности средств в лабораторных условиях проводят на имаго (только самки) комаров p. Anopheles, Ae. aegypti инсектарной культуры в возрасте 8 -10 дней, получавших углеводное питание, и на имаго (самки и самцы) крысиных блох X. cheopis 1 - 3-недельного возраста, не питавшихся кровью.
Оценку акарорепеллентных средств проводят на активных нетравмированных самках видов клещей, являющихся основными переносчиками возбудителей эпидемиологически значимых инфекций. Например, если средство предназначено для защиты людей от переносчиков возбудителей клещевого энцефалита и Лайм-боррелиоза, то испытания должны быть проведены на таежных клещах I. persulcatus и I. ricinus, если средство предназначено для защиты людей от переносчиков возбудителя крымской геморрагической лихорадки, то испытания должны быть проведены на клещах Hyalomma marginatum marginatum. Желательны, но не обязательны, дополнительные испытания в отношении второстепенных переносчиков.
Тест-объекты для проведения исследований подбирают так же, как при испытаниях акарицидов (см. раздел 4.2).
4.15.1. Метод оценки эффективности
репеллентных средств,
предназначенных для нанесения на кожу
К испытаниям допускаются только средства (кремы, лосьоны, эмульсии, салфетки, карандаши, аэрозоли), имеющие подтверждение безопасности их применения на кожу людей. В опытах используют голодных самок p. Anopheles и Ае. aegypti инсектарной культуры в возрасте 8 - 12 дней, получавших углеводное питание. В марлевый садок размером 30´30´30 см выпускают (50 ± 5) самок. В опытах можно использовать садок большего размера, в этом случае количество находящихся в нем комаров соответственно увеличивают. Испытания репеллентных средств начинают через 30 мин после запуска комаров. В период проведения опыта температура в помещении должна составлять 23 - 25 °С относительная влажность 60 - 70 %. Опыты проводят при рассеянном освещении, избегая прямого солнечного света.
Чтобы подтвердить активность комаров, в садок помещают оголенное предплечье испытателя, защитив кисть руки резиновой перчаткой. Проводят учет посадок и укусов комаров в течение 30 с. Активность комаров признается удовлетворительной, если за этот период зарегистрировано не менее 10 посадок и 3 укусов. После этого изучаемое средство наносят на обнаженное предплечье испытателя в норме расхода 0,1 мл (г) на 100 см2 поверхности кожи. Обработанную руку помещают в садок с комарами на 3 мин и регистрируют число посадок и укусов комаров. Как правило, сразу после нанесения репеллентные средства обеспечивают отпугивание всех насекомых, т. е. КОД равен 100 %. С целью определения длительности репеллентного действия (ДРД) опыт повторяют через каждые 30 мин до тех пор, пока не будет зарегистрировано 3 или более укусов за 3 мин испытания. В каждом садке повторное испытание можно проводить не ранее чем через час после предыдущего. Испытания должны быть проведены с 9 до 14 ч. Каждое средство испытывают не менее чем три испытателя в трех повторностях (всего 9 повторностей). Рассчитывают среднее значение ДРД и статистическую ошибку.
4.15.2. Метод оценки эффективности репеллентных
средств в виде аэрозолей, предназначенных для нанесения на одежду
Возможно применение 2 методов: метод ольфактометрии (см. раздел 3.4.1) и метод обработанных рукавов. Рукава подготавливают из хлопчатобумажной бязи (ткань рукава должна плотно прилегать к предплечью испытателя) и обрабатывают аэрозолем из расчета 20 г/м2. Испытание репеллентной эффективности проводят первый раз после полного высыхания ткани (примерно через 1 ч) и затем через 1 - 2 - 3 - 5 суток и далее суток. В промежутках между испытаниями рукава развешивают в помещении. При испытаниях обработанный рукав надевают на предплечье испытателя (кисть руки в резиновой перчатке) и руку помещают в садок с комарами аналогично методике, описанной выше.
4.15.3. Метод оценки эффективности
репеллентных средств
в виде аэрозолей, предназначенных для защиты от иксодовых
клещей при нанесении на одежду
Тест-объекты для проведения исследований подбирают так же, как при испытаниях акарицидов (см. раздел 4.2). Используют тест из хлопчатобумажной бязи - ленту (10´70 см), которую, прикрыв полиэтиленом нижние 10 см, закрепляют на впитывающей поверхности (ткань, фильтровальная бумага и т. п.) размером 0,5 м2. Затем эту поверхность с тестом закрепляют вертикально и обрабатывают аэрозолем в соответствии с рекомендуемой нормой расхода, обычно 12 с на 0,5 м2 ткани. После обработки тесты открепляют, просушивают и развешивают в лаборатории в одинаковых контролируемых условиях температуры, влажности, освещенности. Опыты проводят в день обработки. Тесты закрепляют под углом 70°. Клещей по одному помещают на 5 см ниже нулевой отметки (границы обработанного участка теста) и наблюдают за их передвижением вверх по обработанной репеллентным средством ткани, дополнительно стимулируя их пальцем наблюдателя, который держат на расстоянии 0,5 см от гипостома клеща. Регистрируют число клещей, проползших отрезок длиной 50 см. На контрольном тесте, как правило, все клещи проползают отмеченную зону. После испытаний клещей фиксируют в 70 %-ном растворе этилового спирта или продолжают дальнейшее наблюдение за ними. Опыт проводят не менее чем с 30 самками. Рассчитывают КОД по формуле (9) для клещей. Результаты опытов сравнивают с результатами испытаний эталонного теста. Для определения длительности репеллентного действия испытания повторяют ежедневно до тех пор, пока КОД сохраняется равным или выше 90 %.
4.16.
Методы оценки эффективности
акарицидных средств, предназначенных для нанесения
на одежду и другие изделия
4.16.1. Метод оценки эффективности
инсектоакарицидных
средств в виде аэрозоля, предназначенных для защиты людей
от нападения иксодовых клещей
Тест-объекты для проведения исследований подбирают так же, как при испытаниях инсектоакарицидов (см. раздел 4.2).
4.16.1.1. Определение
скорости
наступления состояния нокдауна и высоты подъема по ткани
Подготовка тестов и постановка экспериментов как в разделе 4.15.3. С помощью секундомера регистрируют время от момента пересечения клещом нижней границы обработанного участка до отпадения клеща с теста, что соответствует наступлению состояния нокдауна. Опыт проводят не менее чем с 30 самками. Рассчитывают среднее значение времени наступления состояния нокдауна в минутах ТНср. и статистическую ошибку. Одновременно с определением ТНср. регистрируют максимальную высоту подъема клеща по тесту. Рассчитывают среднее значение этого показателя в сантиметрах - МВср..
4.16.1.2. Определение скорости присасывания
Определение ИСП проводят по методике, описанной в разделе 4.2.4. Контроль и опыт повторяют трижды. Рассчитывают среднее значение времени присасывания самок в контроле, опыте и отношение этих показателей (ИСП).
4.16.2. Метод оценки эффективности
инсектоакарицидных средств в виде бруска, предназначенных
для защиты людей от нападения иксодовых клещей
4.16.2.1. Определение скорости
наступления состояния нокдауна и высоты подъема по ткани
Используемый тест готовят следующим образом: на ленту (10´70 см) из хлопчатобумажной бязи, закрепленную на горизонтальной поверхности, на расстоянии 10 см от края бруском наносят полосы в соответствии с рекомендуемым способом применения. Опыты проводят в день обработки. Тесты закрепляют под углом 70°. Клещей по одному помещают на 5 см ниже нулевой отметки и наблюдают за их передвижением вверх по ткани, дополнительно стимулируя их пальцем наблюдателя, который держат на расстоянии 0,5 см от гипостома клеща. С помощью секундомера регистрируют время от момента пересечения клещом нижней черты полосы от бруска до отпадения клеща с теста, что соответствует наступлению состояния нокдауна. Отпавших клещей фиксируют в 70 %-ном растворе этилового спирта или продолжают дальнейшее наблюдение за ними. Опыт проводят не менее чем с 30 самками. Рассчитывают среднее значение времени наступления состояния нокдауна в минутах ТНср., и статистическую ошибку. Одновременно с определением ТНср. регистрируют максимальную высоту подъема клеща по тесту. Рассчитывают среднее значение этого показателя в сантиметрах - МВср..
4.16.2.2. Определение скорости присасывания
См. раздел 4.16.1.2.
4.17.
Метод оценки эффективности инсектициднорепеллентных
средств в виде аэрозолей, предназначенных для защиты людей
от нападения иксодовых клещей
Оценку инсектициднорепеллентных средств проводят по двум направлениям: как акарицидного средства и как репеллентного. Подготовка тестов и постановка экспериментов, как в разделе 4.15.3. Изучение эффективности проводят, как это описано в разделе 4.15.3 и 4.16.1. Определяют показатели ТНср., МВср., ИСП, КОД и ДРД.
4.18.
Методы оценки эффективности средств (скабицидов)
для уничтожения чесоточных клещей
Оценку эффективности средств, предназначенных для обработки поверхностей в помещениях, одежды, белья и других предметов с целью уничтожения чесоточных клещей, проводят in vitro на ушном кроличьем клеще P. cuniculi инсектарной культуры.
В зависимости от препаративной формы средства оценку скабицидной активности проводят различными методами. Концентрированное средство интенсивно взбалтывают и берут навеску для приготовления серии рабочих концентраций. Готовые препаративные формы испытывают без разведения.
4.18.1. Метод погружения для
исследования жидких
препаративных форм
По 10 самок клещей помещают на кружок фильтровальной бумаги, свернутой углом в виде «фунтика», и погружают в исследуемую рабочую жидкость (эмульсия, суспензия, раствор и т. п.) на 1 мин.
Затем клещей переносят в чистую пробирку с вложенной в нее фильтровальной бумагой. Через 24 ч определяют количество пораженных клещей и подсчитывают процент поражения. Опыты ставят при комнатной температуре в трех повторностях. В качестве контрольного варианта используют необработанных клещей.
4.18.2. Метод орошения
По 10 самок клещей подсаживают в чашки Петри на впитывающую (фильтровальная бумага, бязь) поверхность, после чего чашки Петри с клещами размещают случайным образом в камере (раздел 4.1) в пяти точках и обрабатывают средствами в аэрозольной или беспропеллентной упаковке или водными рабочими растворами различных препаративных форм при помощи аппаратуры типа «Квазар» или «Росинка» с высоты 20 см, направляя струю средства под углом 45°. Температура в камере во время опытов должна быть постоянной - (22 + 2) °С, относительная влажность - 50 - 70 %. На края чашек необходимо нанести полоску вазелина для предотвращения расползания клещей.
Через 10 мин чашки Петри вынимают из камеры, клещей пересаживают в чистые пробирки и проводят учет гибели через 24 ч, подсчитывая процент пораженных особей. Опыты проводят при комнатной температуре в трех повторностях. В качестве контроля используют необработанных клещей.
4.18.3. Метод подсадки клещей на обработанную поверхность
Самок клещей (по 10 особей) в экспозиметрах подсаживают на обработанную тестируемым средством невпитывающую (стекло, 10´20 см) и впитывающую (фильтровальная бумага, бязь, 10´20 см) поверхность на 15 мин. Опыты проводят при комнатной температуре в трех повторностях. В качестве контроля используют необработанных клещей.
После экспозиции клещей пересаживают в чистые пробирки и проводят учет гибели через 24 ч, подсчитывая процент пораженных особей. Определяют эффективные концентрации и норму расхода средства, обеспечивающие достаточное качество (равномерность) нанесения на разные типы поверхностей с обеспечением скабицидной эффективности.
Остаточное действие средства определяют методом контакта клещей с обработанными поверхностями в течение 15 мин в экспозиметрах на 1, 3, 5, 7 сутки после обработки и более. После контакта с обработанными тестами клещей переносят в чистые пробирки и регистрируют их состояние через 24 ч.
4.19.
Методы оценки эффективности средств (акарицидов и акарорепеллентов)
по отношению к кровососущим гамазовым клещам
Как модельный объект используют гамазового крысиного клеща О. bacoti. Подопытные и контрольные клещи должны быть одного возраста. Клещей содержат при стабильных оптимальных для их развития условиях в термостатах при температуре воздуха 25 - 26 °С и относительной влажности воздуха 80 %. Каждый опыт сопровождают контролем.
4.19.1. Методы оценки акарицидных средств
Оценку эффективности средств, предназначенных для обработки поверхностей в помещениях с целью уничтожения кровососущих гамазовых клещей, проводят в зависимости от формы средства.
4.19.1.1. Метод подсадки на обработанную тест-поверхность
Акарицидное действие средства оценивают в лабораторных условиях на поверхностях двух типов - впитывающей влагу поверхности (фанера) и невпитывающей (стекло). Для предотвращения расползания клещей в эксперименте края стеклянных пластин и кусков фанеры стандартного размера (20´10 см) обрабатывают репеллентами, эффективными в отношении О. bacoti (20 %-ными растворами диметилфталата или акрепа), или в течение времени контактирования клещей не дают им покидать тест-поверхности и возвращают назад при помощи тонкой кисточки.
Острое акарицидное действие определяют методом контактирования клещей со свежеобработанной поверхностью (после высыхания тест-поверхностей). Время контакта клещей с обработанной поверхностью составляет 5 мин. После этого клещей переносят в чистую посуду и помещают в термостат. Учет пораженных клещей проводят через 24, 48, 72 ч.
Остаточное акарицидное действие средства определяют аналогичным методом, подсаживая клещей на 5 мин на обработанные тест-поверхности на 3, 7, 14 сутки и более вплоть до окончания акарицидного действия. Тест-поверхности после их обработки хранят в вертикальном положении при комнатной температуре. После экспозиции клещей переносят в чистые емкости и помещают в термостат. Учет погибших клещей проводят через 24, 48, 72 ч после контактирования с обработанной поверхностью.
4.19.1.2. Метод оценки эффективности
средств в аэрозольных
и беспропеллентных упаковках
Оценку эффективности средств в аэрозольных и беспропеллентных упаковках в отношении крысиных клещей проводят по стандартной методике (5.10). Клещей помещают в чашки Петри (не менее 30 особей в каждой), края которых смазывают вазелином или 20 %-ным раствором репеллента (диметилфталата, акрепа), чтобы избежать расползания клещей. Чашки Петри размещают в 5 точках в камере и затем обрабатывают средствами в аэрозольной или беспропеллентной упаковке. Норму расхода средства - 10 или 20 г/м2 - определяют рекомендованным режимом его применения.
Через 10 мин после нанесения препарата чашки Петри вынимают из камеры и пересаживают крысиных клещей в чистые влажные пробирки (камеры Нельзиной), которые помещают на 24 ч в термостат. Учет смертности клещей проводят через 24 ч.
4.19.2. Метод оценки эффективности акарорепеллентных средств
Оценку эффективности репеллентых средств в отношении О. bacoti проводят при помощи методики, разработанной для иксодовых клещей, при этом оценивается отрицательная локомоторная реакция клеща на границе химического барьера, представляющего собой репеллент, нанесенный на субстрат на пути следования клещей. В опыте используют голодных самок О. bacoti. Путь следования определяется их отрицательным геотропизмом, подкрепленным привлекающим фактором добычи (рука экспериментатора). Отпугивающее действие исследуют на 1, 3 и 5 сутки после обработки. Опыт с каждым исследуемым средством проводят в 3 повторностях, используя не менее 30 клещей в каждой.
Для оценки репеллентной активности веществ вычисляют коэффициент отпугивающего действия (КОД) по формуле (9) для клещей. Длительность репеллентного действия (ДРД) оценивают как время (в сутках), в течение которого КОД сохраняется не менее 70 %.
4.20.
Методы оценки эффективности средств (акарицидов)
по отношению к клещам домашней пыли
В качестве биологического материала используют клещей домашней пыли D. pteronyssinus и (или) D. farinae из сем. Pyroglyphidae. Подопытные и контрольные клещи должны быть одного вида, возраста. Клещей содержат при стабильных, оптимальных для их развития условиях: в стеклянных плотно закрытых эксикаторах в термостатах при температуре воздуха 25 - 26 °С и относительной влажности воздуха 70 %, поддерживаемой за счет насыщенного раствора поваренной соли в эксикаторе. Пищевой рацион клещей должен содержать все необходимые компоненты для их нормальной жизнедеятельности.
4.20.1. Методы оценки эффективности акарицидных средств
В лабораторных условиях оценку акарицидной активности средств по отношению к клещам домашней пыли проводят на впитывающей тканевой поверхности (бязь). Размеры и форма кусочков бязи, используемых в качестве тест-поверхности, соответствует форме и размеру дна сосуда (бюксы, небольшие стеклянные стаканчики и т. п.), в которых содержат клещей во время экспериментов. Края каждого сосуда с клещами домашней пыли предварительно обклеивают липкой лентой во избежание расползания клещей («ловчий пояс»). Каждый опыт включает не менее 3 повторностей, в каждой из которых используют не менее 20 клещей, и сопровождается контролем.
Метод, используемый для оценки эффективности средств, предназначенных для уничтожения клещей домашней пыли, выбирают в зависимости от препаративной формы средства.
4.20.1.1. Метод оценки эффективности
средств в аэрозольных
и беспропеллентных упаковках
Для оценки эффективности средств в аэрозольных и беспропеллентных упаковках используют метод опрыскивания членистоногих в герметичной камере объемом 1 м3, в пяти точках которой размещают чашки Петри с клещами, помещенными непосредственно на бязь. Одновременно для изучения длительности остаточного действия в камеру в пяти различных точках помещают тест-поверхности (кусочки бязи). Клещей и бязь орошают тестируемым средством с расстояния 20 - 30 см под углом 45°. Через 10 мин после орошения клещей переносят в чистую посуду и помещают в эксикаторы. Гибель клещей учитывают через 10 мин, 24 ч после обработки. К мертвым относят и необратимо парализованных клещей.
Тест-поверхности (бязь) удаляют из камеры через 24 ч после их обработки и хранят в подвешенном положении при комнатной температуре. На 1 и 3 сутки после обработки для определения длительности остаточного действия отложений аэрозоля на них подсаживают клещей с добавлением кормового субстрата и оставляют для дальнейшего наблюдения. Учеты гибели клещей проводят ежедневно в течение 5 суток.
4.20.1.2. Метод подсадки на
обработанную
тест-поверхность
Острое акарицидное действие жидких препаративных форм определяют методом свободного контактирования клещей со свежеобработанной впитывающей влагу поверхностью (бязь), помещенной в стеклянный небольшой сосуд для содержания клещей. После высыхания тест-поверхности клещей помещают на обработанную бязь и добавляют пищевой субстрат. Учет пораженных клещей проводят через 24, 48, 72 ч. Оценка остаточного действия средств и показатели их эффективности - как в разделе 4.19.1.1.
4.21.
Методы оценки эффективности средств борьбы
с молью и кожеедами
Оценку эффективности проводят на имаго и гусеницах платяной моли Т. bisselliella 28 - 30-ти дневного возраста; имаго и личинках кожееда A. smirnovi 11 - 12-дневного возраста инсектарной культуры.
4.21.1. Методы оценки эффективности
средств
контактного действия
Острое действие определяют при непосредственном орошении гусениц и личинок на пищевом субстрате - сукне Артикул 3907, а также методом свободного контактирования насекомых с поверхностью кусочков ткани размером 4´4 см, обработанных средством в 5 концентрациях. Средства в аэрозольной упаковке изучают, используя норму расхода 10 или 20 г/м2. Обработанные кусочки ткани высушивают в течение 24 ч при комнатной температуре. Затем на них помещают по 10 гусениц моли или личинок кожееда и вместе с насекомыми переносят в стеклянные стаканчики диаметром 3,5 см и высотою 6 см, которые сверху закрывают бязью. Учет гибели ведут через 72 ч. Повторность опыта трехкратная.
4.21.2. Методы оценки эффективности средств
фумигационного действия
Оценку острой активности проводят в экспериментальных емкостях - коробах объемом 0,5 м3. Емкости заполняют шерстяной одеждой, средство размещают желаемым образом. Эксперименты ведут при (22 ± 2) °С. В емкость вносят по 20 бабочек моли и имаго кожеедов, последние помещены в чашки Петри. Учет гибели ведут через 24 или 48 ч в зависимости от примененного средства. При применении высоко летучих ДВ, таких как вапортрин, - через 24 ч, иных - через 48 ч.
4.21.3. Методы оценки эффективности
средств
репеллентного действия
Для оценки репеллентного действия используют ольфактометр, в который запускают 1 - 2-дневных имаго моли и определяют коэффициент отпугивающего действия (КОД) через 24 ч.
4.22.
Методы оценки
эффективности аттрактантов (феромонов)
Оценку эффективности аттрактантов и феромонов проводят на имаго комнатных мух М. domestica и рыжих тараканов В. germanica.
4.22.1. Оценка эффективности
аттрактантов (феромонов)
по отношению к комнатным мухам
В садок размером 30´30´30 см помещают лист бумаги с нанесенным на него энтомологическим клеем, тестируемое средство и выпускают 50 имаго мух. В контрольном варианте в садок помещают лист бумаги с нанесенным клеем. Наблюдения ведут в течение 3 мин, подсчитывают количество прилипших мух в опытном и контрольном вариантах.
Далее рассчитывают коэффициент аттрактивного действия по формуле:
![]() ,
,
где
О - количество прилипших мух в опыте, %;
К - количество прилипших мух в контрольном варианте, %.
4.22.2. Метод оценки эффективности аттрактантов
(феромонов) для рыжих тараканов
Оценку эффективности аттрактантов (феромонов) проводят на рыжих тараканах инсектарной культуры. Для этого используют бокс из оргстекла (20´20´30 см), на верхнюю часть внутренней поверхности которого нанесена полоска вазелина шириною 2 см, препятствующая выползанию насекомых. В бокс помещают по 20 самок, 20 самцов и 80 личинок II - IV возрастов, в центре располагают аттрактант (феромон) и клейкую поверхность (4.22.1). В контрольном варианте в бокс вместо аттрактанта помещают 0,5-литровую стеклянную банку с приманкой (кусочком белого хлеба с подсолнечным маслом). Край банки также смазывают вазелином. Учеты эффективности проводят через 17 - 24 ч. Повторность опыта трехкратная.
5. Оценка дезинсекционных и
репеллентных средств
в практических условиях
5.1.
Общие требования к проведению испытаний
в практических условиях
На основании изучения в лабораторных условиях инсектицидной, акарицидной, рострегулирующей, репеллентной активности веществ и их препаративных форм определяют эффективные концентрации и нормы расхода по отношению к разным видам членистоногих, имеющим эпидемиологическое и санитарно-гигиеническое значение (спектр действия) и ориентировочную кратность обработок.
Испытания препаратов в практических условиях включают два этапа. Первый этап - ограниченные практические испытания (натурные эксперименты), второй - широкие практические испытания.
На первом этапе определяют оптимальные режимы обработок в зависимости от типа объектов и используемой аппаратуры, возможные побочные явления, которые могут возникнуть у людей, контактировавших с препаратом (проводящих обработку, находящихся в обработанных помещениях, или использующих репеллентные средства). Эти испытания проводят на ограниченном количестве объектов.
На проведение второго этапа испытаний в практических условиях в настоящее время получают разрешение Департамента государственного санитарно-эпидемиологического надзора Минздрава Российской Федерации.
Широкие практические испытания (второй этап) проводят силами практических организаций в разных регионах, отличающихся климатическими и географическими условиями, видовым составом и сезонной динамикой численности членистоногих и др. При проведении этих испытаний определяют эффективность средства по отношению к доминирующим видам членистоногих в зависимости от климатических условий региона и уровня чувствительности природных популяций членистоногих к инсектицидам, определяют длительность остаточного действия средства при использовании его в разных климатических зонах, пригодность для обработки серийной стандартной аппаратурой, возможность рекомендовать его для использования населением.
Испытания на втором этапе проводят в соответствии с утвержденными Департаментом Госсанэпиднадзора Минздрава России программой проведения практических испытаний и инструкцией по их проведению, разработанными для каждого испытуемого средства специалистами (энтомологами, биологами, паразитологами, врачами, гигиенистами). В инструкцию должны быть включены общие сведения о средстве (состав полностью, класс опасности, для каких целей предназначено); методика обработки; рабочие концентрации и нормы расхода препарата по отношению к каждой группе членистоногих, для которых средство предназначено; методика учета эффективности обработок; меры предосторожности при работе со средством и меры первой помощи при случайном отравлении.
К инструкции прилагают формы необходимой документации (акты, анкеты, опросные листы и др.), которые заполняют специалисты практических организаций, непосредственно руководившие испытаниями препарата. В анкетах, кроме эффективности средства, отмечают наличие или отсутствие побочных явлений у людей, проводивших обработки, пользовавшихся средством или находившихся в обработанных объектах.
Обобщение и анализ материалов практических испытаний проводит организация, ответственная за подготовку и проведение таких испытаний.
Подготовленные отчеты по результатам практических испытаний с приложением подлинников актов организаций, проводивших испытания представляют в Центр нормирования и сертификации Департамента ГСЭН Минздрава России. При получении разрешения на применение средства разрабатывают инструкцию по использованию его в медицинской дезинсекции и этикетку, если средство разрешено применять в быту и продавать населению. Эти документы утверждает Департамент ГСЭН Минздрава России.
5.2. Изучение эффективности
инсектицидных
средств по отношению к имаго комаров pp. Anopheles и Culex
В населенном пункте выбирают помещения, в которых концентрируются малярийные комары p. Anopheles (хлевы, сараи, жилые комнаты и др.). До обработки проводят учет численности комаров.
Участки помещения, являющиеся дневками комаров, обрабатывают рабочими растворами средства в норме расхода 100 мл на 1 м2. В одном населенном пункте каждым препаратом обрабатывают не менее 3 помещений в концентрациях, отобранных при лабораторных испытаниях.
Эффективность инсектицида определяют либо визуально, подсчитывая на следующий день после обработки и затем каждые 3 - 5 дней количество погибших комаров в помещениях, либо с помощью прозрачных пластмассовых конусов, прикрепленных к обработанным поверхностям липкими лентами. В каждый конус с помощью эксгаустера помещают 10 - 20 комаров на 30 мин. После этого комаров из конусов переносят в чистый садок и оставляют на сутки. В садки помещают вату, смоченную водой. Такие испытания проводят первый раз через сутки после обработки и затем раз в 7 - 10 суток вплоть до того, как гибель комаров снизится до 70 %.
Контрольными являются помещения, не обработанные инсектицидом. В этих помещениях также ставят конусы, потому что необходимо учитывать травмы комаров при посадке их в конусы и пересадке в садки эксгаустером (сравнение гибели в опыте и контроле).
Эффективными считают инсектициды (их концентрации), обеспечивающие гибель 100 % комаров в течение первых 3 - 4 недель после обработки и не менее 95 % в течение последующих 4 - 8 недель.
Для обработки отдельных очагов (по показаниям) могут быть использованы инсектициды, не имеющие длительного остаточного действия, обеспечивающие 100 %-ную гибель комаров в течение 5 - 7 суток после обработки.
При изучении степени раздражимости комаров к изучаемому инсектициду в обработанное помещение выпускают 100 - 200 комаров и в течение часа наблюдают за их поведением. Если комары садятся на обработанные поверхности и гибнут, не обнаруживая признаков возбуждения, то раздражимости нет, и инсектицид может быть рекомендован для применения. Если комары беспокойны и пытаются вылететь из обработанного помещения, то раздражимость имеется, и изучаемый инсектицид в практику противомалярийных обработок можно рекомендовать только после повторного испытания и подтверждения отсутствия раздражимости комаров.
При изучении эффективности инсектицидов по отношению к имаго комаров p. Culex обрабатывают 2 - 3 подвала с высокой численностью комаров (более 100 экз./м2) концентрациями, отобранными при лабораторных испытаниях и норме расхода 100 мл/м2. Через сутки проводят учет численности комаров, а также определяют действие инсектицида на стенах подвала с помощью конусов по описанной выше методике. Комаров из конусов помещают в садки, учет их гибели проводят через 24 ч. Следующие учеты численности комаров и опыты с конусами проводят раз в 7 - 10 суток вплоть до того, когда препарат будет обеспечивать гибель менее 70 % комаров. Эффективными считают инсектициды, обеспечивающие 100 %-ную гибель комаров в течение первых двух недель после обработки и не менее 90 %-ной гибели в последующий месяц. В отдельных объектах (по показаниям) могут быть использованы инсектициды с коротким остаточным действием на обработанных поверхностях (5 - 7 суток).
5.3. Изучение эффективности
инсектицидов и регуляторов развития
по отношению к личинкам комаров
5.3.1. Изучение эффективности инсектицидов
Вещества испытывают не менее чем в трех концентрациях на водоемах площадью не менее 1 - 5 м2. Для определения эффективности одной концентрации подбирают не менее трех водоемов одного типа. Рабочими растворами или порошками из опрыскивающей или распыливающей аппаратуры обрабатывают поверхность водоема из расчета 100 мл (г) на 1 м2. Гранулы равномерно разбрасывают вручную из расчета 20 - 30 г на 1 м2. Нормы расхода инсектицида рассчитывают в граммах ДВ на 1 м2, если глубина водоема не превышает 20 см; если же глубина водоема больше, то расчет проводят на объем воды в граммах ДВ на 1 м3.
Эффективность обработки оценивают путем сравнения численности личинок комаров до и после обработки через 1, 2, 5, 7 и 14 суток в обработанном и контрольном водоемах. Оценку полученных результатов проводят по формуле 5.
Учет численности личинок разных возрастов проводят стандартным сачком (диаметр - 20 см, глубина - 25 см) или кюветой с пересчетом числа личинок каждого возраста на 1 м2. Пробы берут не менее чем в 10 местах равномерно по всей площади водоема. В период испытаний в водоемах регистрируют температуру, рН воды, степень зарастания водоема растительностью, степень проточности, загрязненность воды органическими веществами.
Остаточное действие инсектицидов определяют на личинках комаров инсектарной культуры. Для этого из обработанного водоема набирают в 0,5-литровые емкости по 250 мл воды, в которую помещают по 25 личинок II - III возраста. Учет погибших личинок проводят через 1 и 2 суток. Каждые 5 - 7 суток опыт повторяют вплоть до того, как число личинок, погибших в воде, взятой из обработанного водоема, будет ниже 70 %. Одновременно ставят контроль.
Инсектицид считают эффективным, если в течение 1 - 2 суток он обеспечивает 100 %-ную гибель личинок в водоеме.
5.3.2. Изучение эффективности регуляторов развития насекомых
Вещества испытывают не менее чем в трех концентрациях на водоемах площадью водной поверхности от 1 до 5 м2. Для определения эффективности одной концентрации подбирают не менее трех водоемов одного типа. Рабочими растворами или порошками из опрыскивающей или распыливающей аппаратуры обрабатывают поверхность водоема из расчета 100 мл (г) на 1 м2. Гранулы равномерно разбрасывают вручную из расчета 20 - 30 г на 1 м2. Нормы расхода РРН рассчитывают в граммах ДВ на 1 м2, если глубина водоема не превышает 20 см; если же глубина водоема больше, то расчет проводят на объем воды в граммах ДВ на 1 м3.
Эффективность обработки оценивают ежедневно путем сравнения численности и внешнего вида личинок комаров до и после обработки до получения явных эффектов нарушения линьки в обработанных водоемах.
Учет численности личинок разных возрастов проводят стандартным сачком (диаметр - 20 см, глубина - 25 см) или кюветой с пересчетом числа личинок каждого возраста на 1 м2. Пробы берут не менее чем в 10 местах равномерно по всей площади водоема. В период испытаний в водоемах регистрируют температуру, рН воды, степень зарастания водоема растительностью, степень проточности, загрязненность воды органическими веществами.
Остаточное действие РРН определяют на личинках комаров инсектарной культуры. Для этого из обработанного водоема набирают в 0,5-литровые емкости по 250 мл воды, в которую помещают по 25 личинок II возраста в случае с ИСХ и IV возраста при испытании АЮГ. Учет погибших личинок проводят ежедневно. Каждые 5 - 7 суток опыт повторяют вплоть до того, как число личинок, погибших в воде, взятой из обработанного водоема, будет ниже 70 %. Одновременно ставят контроль.
Регуляторы развития насекомых считают эффективными, если в течение 25 - 30 суток они обеспечивают нарушения линьки или гибель куколок при окрылении в воде, взятой из обработанного водоема.
5.4. Изучение эффективности инсектоакарицидных
средств
для обработки природных биотопов с целью уничтожения иксодовых клещей
5.4.1. Изучение эффективности
концентратов эмульсий
и смачивающихся порошков
Изучение акарицидной активности средств проводят на территории, где отмечена высокая численность клещей (не менее 20 экз. на 1 км маршрута при стандартном учете численности клещей флагом), в период подъема численности или в период пика (середина апреля - первая половина июня). В период падения численности клещей (вторая половина июня - июль) испытания акарицидов не проводят.
Для испытания препаратов на выбранной территории размечают квадратные делянки размером 50´50 м, площадью 0,25 га. В случае испытания нескольких инсектицидов или концентраций делянки следует располагать вплотную одна к другой. Контрольную делянку располагают так, чтобы исключить попадание на нее инсектицидов (занос ветром во время обработок, стоком воды при дождях).
Обработку делянок проводят испытуемым инсектицидом в концентрациях, рекомендованных в инструкции. Для обработки используют любые опрыскиватели, обеспечивающие мелкокапельное распыление. Обработку проводят так, чтобы обеспечить равномерное покрытие испытуемым препаратом всей площади делянки.
Учеты клещей проводят одновременно на делянках и в контроле перед обработкой и затем еженедельно в течение месяца после обработки в утренние часы после схода росы. В жаркие полуденные часы учеты не проводят. Если погода пасмурная, без заметного повышения полуденных температур, учеты можно проводить и днем. Для учета на опытных делянках и в контроле используют разные флаги, которые должны быть соответственно маркированы.
На каждой делянке учет проводят челночным ходом так, чтобы суммарная длина маршрута составляла не менее 0,5 км, желательно - 1 км (10 - 20 параллельных ходов на площадке со стороной 50 м). Оценку полученных результатов проводят по формуле (5). При этих расчетах принимают во внимание численность клещей на опытной делянке до обработки и после нее и численность в контроле в те же сроки.
5.4.2. Изучение эффективности
аттрактивно-акарицидных гранул
Аттрактивно-акарицидные гранулы содержат нейтральный наполнитель, аттрактант - вещество, привлекающее клещей к грануле, и акарицид - убивающий клещей после контакта их с гранулой.
Проверку акарицидной активности гранул проводят на площадках размером 2 га и более на участках с высокой численностью клещей. Разметку площадок желательно закончить до начала активации клещей или в начале периода активности. В последнем случае в процессе разметки площадки следует постоянно осматриваться, снимать и выбрасывать в месте поимки напавших на работника клещей.
Разметка и обработка площадки. Перед началом работы проводят учет численности клещей на территории, намеченной под обработку и в контроле. Если выбранный для обработки участок не имеет естественных границ (тропы, дороги, просеки, опушка леса), то перед обработкой необходимо обозначить его границы заметными метками (матерчатые ленточки, бумажные флажки, несмываемая краска и др.).
Обработку проводит бригада дезинфекторов (желательно 5 человек) и инструктор. Инструктор выстраивает дезинфекторов в шеренгу с промежутками между людьми в 4 м. По команде инструктора шеренга начинает движение с остановками через каждые 2 м. Крайний дезинфектор движется по границе площадки, остальные - параллельными ходами, стараясь сохранять расстояние между собой в 4 м. Инструктор, замыкающий шеренгу, отмечает границу обработанной полосы метками, меряет шагами расстояние и каждые 2 м дает команду дезинфекторам бросить 2 гранулы, одну сразу позади себя, а другую - на 2 м в сторону соседнего дезинфектора под прямым углом к направлению движения шеренги.
Дойдя до третьей границы обрабатываемого участка, шеренга смещается по этой границе вглубь площадки так, что первый дезинфектор (шедший по границе участка) становится на трассу, пройденную и размеченную дезинструктором, а остальные -дальше от него с интервалами в 4 м. Замыкает шеренгу дезинструктор. Операция повторяется, но уже в обратном направлении. Так, челночными ходами обрабатывается вся площадка. Производительность труда пяти дезинфекторов в зависимости от их опыта и расторопности 1,5 - 2,0 га/ч. Если препарат использован не весь, то оставшееся количество уничтожают, т. к. за год препарат существенно снижает аттрактивность и, следовательно, эффективность.
Действие препарата основано на привлечении клещей к грануле, содержащей акарицид. Эффект, приближающийся к 100 %, достигается к концу второй недели после обработки, если послезимовочная активация клещей закончилась. Если обработка проведена в начале активации, то появление все новых, активирующихся клещей будет отсрочивать достижение 100 %-ного эффекта. Оптимальное время для обработки - первая половина мая.
Через неделю после размещения на площадке гранул проводят учет численности клещей на флаг. Учетчик, двигаясь параллельно визирам челночным ходом, проходит по площадке не менее 1,5 - 2,0 км, подсчитывая прикрепившихся к флагу и одежде клещей и выпуская их, по возможности, в месте поимки. Одновременно проводится учет флагом на контрольной территории на маршруте протяженностью также не менее 1,5 - 20 км (если на контрольном маршруте собрано менее 50 клещей, его длину следует увеличить). Последующие учеты на площадке проводятся также с недельными интервалами в течение периода высокой численности клещей. Если два последних учета дали нулевые результаты, учеты прекращают. Если нулевые результаты не получены, учеты продолжают до конца сезона активности клещей, но с интервалами до 2 недель.
Расчет эффективности действия инсектицида проводят по формулам 5 - 7 для каждого срока контрольного обследования. Изменение показателей эффективности по сезону служит критерием длительности эффекта обработок.
Если есть возможность, то для разметки площадок желательно применять простейшую геодезическую аппаратуру, отмечая на местности параллельные трассы на расстоянии 4 м друг от друга. Это поможет избежать огрехов при размещении гранул и снизит ошибки при оценке их эффективности.
5.5. Изучение эффективности
инсектицидных средств
по отношению к тараканам, постельным клопам и блохам
При обследовании объекта на наличие постельных клопов и тараканов используют визуальный контроль, отмечая места нахождения насекомых и их количество. Степень заселенности насекомыми помещения оценивают следующими показателями (см. таблицу). Визуальную оценку количества тараканов в объекте целесообразно проводить в часы их активности - вечером. Учет количества тараканов можно проводить, расставляя ловушки разных типов: картонные укрытия с липкой массой, а также ловушки, содержащие в качестве приманки аттрактанты или феромоны тараканов в сочетании с клеем. В качестве ловушек могут быть использованы стеклянные банки емкостью 200 - 250 мл, в которые в качестве приманки помещают куски хлеба, смоченные пивом, пивные дрожжи, кусочки яблока. Ловушки расставляют из расчета 1 шт. на 10 м2 пола и не менее 2 шт. в помещениях до 20 м2.
|
Насекомые |
Степень заселенности помещения, 20 м2 |
||
|
малая |
средняя |
высокая |
|
|
Постельные клопы |
единичные |
до 10 мест скопления насекомых |
свыше 10 мест скопления насекомых |
|
Синантропные тараканы |
единичные |
3 - 5 экземпляров |
свыше 5 экземпляров |
Инсектициды контактного действия наносят на поверхности стен и предметов обстановки в местах обитания насекомых. Расход жидкости составляет 50 - 100 мл на 1 м2, дуста - 2 - 5 г на 1 м2 в зависимости от типа обрабатываемой поверхности и действующего вещества в дусте.
Учет эффективности обработок проводят первый раз через 24 ч после обработки, затем каждые 5 - 7 дней в течение месяца.
При обследовании объекта после обработки подсчитывают количество погибших насекомых (по полу и возрасту). При учете эффективности обработки необходимо использовать средства, активизирующие выход клопов и тараканов из укрытий (средства в аэрозольных упаковках). Если в течение 2 недель не обнаружены живые насекомые, последующие обследования проводят раз в 2 недели в течение 2 месяцев.
При оценке эффективности обработок по отношению к блохам используют липкие листы (2´30 см), которые раскладывают на полу под предметами обстановки из расчета 2 листа на 10 м2 площади. Если на 1 лист в течение первых суток попало в среднем не более 2 блох, считают, что в помещении «блохи единичные», от 3 до 10 - «блох много», более 10 - «блох очень много».
Эффективными считают препараты, которые обеспечивают 100 %-ную гибель насекомых в объектах в течение 1 - 2 суток и обладают остаточным инсектицидным действием не менее 3 недель. Для одномоментного уничтожения насекомых могут быть отобраны препараты острого действия, у которых остаточная инсектицидная активность не превышает 3 суток.
5.6. Изучение эффективности
инсектицидных средств
по отношению к мухам
При изучении ларвицидной активности препаратов органические отходы в сборниках разного типа, в которых происходит развитие преимагинальных фаз мух, обрабатывают водными растворами (эмульсиями, суспензиями) и дустами инсектицидов. Норма расхода рабочих растворов (эмульсий, суспензий) составляет 0,5 - 5 л на 1 м2 для твердых отходов при толщине слоя до 30 - 50 см, при толщине слоя субстрата свыше 50 см - 2 - 12 л на 1 м2. Норма расхода дуста (порошка) - 150 - 300 г на 1 м2. Одновременно обрабатывают не менее 3 объектов одного типа.
Перед началом обработки проводят учет численности преимагинальных фаз развития мух в каждом отдельном биотопе. При учете численности личинок и куколок мух в скоплениях твердых отходов в мусоросборниках, штабелях мусора, компостах не менее чем в 5 - 6 точках отбрасывают верхний слой мусора или навоза на площадках размером примерно 20´25 см и отмечают наличие личинок по шкале; личинок нет (0), личинки единичные - до 5 на площадке (+), личинки встречаются десятками (++), личинки встречаются сотнями (+++). В скоплениях жидких отходов наличие личинок отмечают по той же шкале при осмотре поверхности субстрата.
Проверку эффективности инсектицидов проводят раз в 3 дня в течение 2 недель после обработки. При учетах отмечают наличие погибших личинок в обработанном субстрате, а также появление новых кладок и развитие личинок в обработанном и новом субстрате. Эффективным считают препарат, который обеспечивает гибель 100 % личинок в течение 5 суток.
При изучении эффективности регуляторов развития через 24 ч после обработки субстрата отбирают не менее 3 проб, содержащих куколок, каждую с участка размером 20´40 см. Пробы переносят в лабораторию и содержат при температуре 23 - 25 °С в течение 10 суток, подсчитывая количество вылетевших мух. Контролем служат пробы, взятые из необработанного субстрата. Препарат считают эффективным, если он обеспечивает гибель 98 % куколок.
Контактную активность инсектицидов для окрыленных мух определяют при обработке нежилых помещений различного типа, куда происходит постоянный залет мух: мусорокамер, подсобных комнат пищевых объектов, помещений туалетов и т. п. В помещениях выборочно орошают поверхности суспензиями (эмульсиями, растворами) препаратов в концентрациях, отобранных при лабораторных экспериментах и обеспечивающих полную гибель мух. В одном населенном пункте обрабатывают не менее трех объектов.
Обработку поверхностей проводят из распыливающей аппаратуры, орошая места концентрации мух (стены около оконных рам, дверей, оконные стекла, плафоны и др.), но не более 10 % поверхностей стен помещения. Норма расхода жидкости для не впитывающих жидкость поверхностей составляет 50 мл на 1 м2, для впитывающих - 100 мл на 1 м2. Расчет проводят по количеству ДВ на 1 м2.
За сутки до обработки в помещениях проводят учет численности мух с помощью листов (лент) липкой бумаги или сахарных приманок с сильно действующим кишечным инсектицидом. Непосредственно перед обработкой проводят визуально учет численности мух, подсчитывая среднее (из трех подсчетов) число насекомых на 1 м2 поверхности стены. Липкие листы размером 25 ´ 30 см раскладывают из расчета 1 лист на 10 м2 пола.
Результаты обработки учитывают по числу погибших и живых мух в помещениях в утренние часы 2 раза в неделю в течение 3 - 4 недель. После каждого учета погибших мух удаляют из помещения.
Эффективным считают инсектицид, который обеспечивает гибель более 95 % мух в течение 3 ч и сохраняет остаточное инсектицидное действие на обработанных поверхностях в течение 10 дней.
С целью установления кишечной активности инсектициды изучают в виде жидких и сухих приманок. Для приготовления жидких приманок используют 10 %-ный сахарный сироп, в котором растворяют необходимое количество инсектицидного препарата. Емкости, содержащие по 50 - 100 мл приманки (которой пропитывают вату, фильтровальную бумагу), расставляют на подоконниках, в закрытых витринах магазинов и т. п. из расчета 1 емкость на 10 м2 площади пола. По мере высыхания в них добавляют воду до ранее отмеченного уровня, чтобы сохранить необходимую концентрацию инсектицида.
Для приготовления сухих приманок используют 40 - 60 %-ные растворы сахара и необходимое количество инсектицида. Раствор наносят кистью полосами шириной 3 - 4 см по границе оконного стекла и на другие невпитывающие поверхности из расчета 100 мл раствора на помещение площадью 50 м2. Гранулированные формы пищевых приманок раскладывают на подложки, которые расставляют в местах наибольшего скопления мух согласно инструкции по практическим испытаниям средства.
Учет эффективности приманок проводят через сутки и далее 1 раз в 5 - 7 суток в течение месяца. Если приманки сохраняют эффективность и далее, учеты проводят 1 раз в 2 недели в течение 3 месяцев. При учете подсчитывают число погибших мух в сосуде с приманкой и в радиусе 50 см от него и отмечают наличие летающих мух в помещении в утренние часы до начала залета новых насекомых. Дополнительно 1 раз в 5 дней проводят учет эффективности приманочного метода с помощью лент (листов) липкой бумаги, размещаемых из расчета 1 лента (лист) на помещение площадью 20 м2.
Эффективными считают жидкие приманки, которые обеспечивают гибель 95 % мух в помещениях в течение 3 недель, сухие - гибель 95 % мух в помещениях в течение 2 месяцев. Эффективность рассчитывают по формулам 7, 8.
5.7. Изучения эффективности составов
в аэрозольных баллонах
Изучение инсектицидной активности составов в аэрозольных баллонах по отношению к комнатным мухам и комарам проводят в квартирах, а также в объектах общественного назначения, не менее чем в 10 помещениях.
За сутки до проведения обработки в помещениях учитывают численность мух с помощью листов (лент) липкой бумаги или сахарных приманок. Визуальный учет численности мух и комаров проводят непосредственно перед обработкой.
Препарат из баллона распыляют в воздух при закрытых дверях и окнах. Обработку помещения начинают с противоположного от входа конца, постепенно отступая к входной двери. Сняв с баллона колпачок и нажимая на распылительную головку, направляют струю аэрозоля в воздух и места скопления насекомых, передвигая баллон вдоль обрабатываемого участка на расстоянии 50 см от поверхности. Время распыления препарата из баллона зависит от содержания пропеллента, типа распылительной головки и указано в инструкции по испытанию баллона. Через 15 мин после обработки помещение проветривают сквозным потоком воздуха. В зависимости от состава средства, время обработки помещения может меняться.
Контроль эффективности действия препарата проводят визуально через 15 мин после применения препарата, затем через 6 и 24 ч. При проверке отмечают острое действие препарата и возможное остаточное действие - время, в течение которого происходит гибель мух и комаров, залетающих в обработанное помещение. Контроль проводят путем осмотра помещения, отмечая погибших и парализованных насекомых, а также путем опроса населения. Препарат считают эффективным, если в течение 15 мин зарегистрирована полная гибель насекомых в обработанном помещении.
Изучение инсектицидной активности составов в аэрозольных баллонах для нелетающих насекомых проводят в квартирах и в объектах общественного назначения, не менее чем в 10 помещениях для каждого вида насекомых. За сутки до проведения опытных работ объект обследуют с целью установления степени его заселенности насекомыми, используя методы и средства, изложенные выше.
Препарат распыляют при открытых окнах и форточках. Сняв с баллончика колпачок, слегка нажимают на распылительную головку и наносят препарат на места, где обнаружены скопления насекомых или места их возможного обитания. При этом баллон держат на расстоянии 20 см, продвигая его вдоль обрабатываемых участков. Норма расхода инсектицида составляет 10 - 20 г/м2 обрабатываемой поверхности.
При обработке против постельных клопов орошают места обнаружения клопов в кроватях, диванах, плинтусы, места отхождения обоев, щели в стенах, тыльные стороны картин, ковров. Не допускают попадания инсектицида на полированные поверхности. После окончания обработки помещение проветривают сквозным потоком воздуха в течение не менее 30 мин.
Контроль эффективности препарата проводят сразу после обработки объекта, далее через сутки, одну или две недели, а при необходимости и в более поздние сроки после дезинсекции. При этом устанавливают заселенность объекта насекомыми, используя те же градации, что и при предварительном учете заселенности, реакцию насекомых на препарат (быстро ли активизируют аэрозоли выход насекомых из укрытий), сроки наступления паралича и гибели насекомых. Инсектицид считают эффективным, если в течение 1 недели после обработки активные насекомые в помещении не обнаружены.
5.8. Изучение защитного действия репеллентных средств
5.8.1. Изучение защитного действия
репеллентных средств,
предназначенных для нанесения на кожу
Репеллентные средства (кремы, лосьоны, эмульсии, салфетки, карандаши, аэрозоли) наносят на открытые участки кожи специалистов-испытателей в соответствии с рекомендуемым режимом, как правило, тонким слоем, не втирая. Опыт показывает, что на обнаженное предплечье расходуется 0,4 г крема, 0,5 г лосьона или эмульсии, 0,2 г пены. Учет эффективности защиты от летающих кровососущих насекомых проводят в природных биотопах с разнообразным видовым составом нападающих на человека кровососов. Регистрируют КОД через 15 мин после нанесения средства. Критерием окончания защитного действия служит регистрация 3 укусов насекомых в предплечье одного испытателя за 10 мин. Контрольный испытатель во время испытаний учитывает и отлавливает кровососущих насекомых, производит все записи, измеряет температуру и влажность воздуха, направление и силу ветра, отмечает состояние погоды и пр.
Испытание каждого средства проводят не менее 10 раз при различных условиях (разные биотопы, погодные условия, время суток). На основании полученных данных высчитывают КОД и показатель ДРД по отношению к различным группам кровососущих насекомых (комары, мошки, мокрецы, слепни), который выражают в часах. В качестве эталона используют ДЭТА в аналогичных концентрациях. В качестве дополнительных возможно проведение испытаний защитных свойств репеллентных средств при разной физической нагрузке испытателей.
5.8.2. Изучение защитного действия
репеллентных средств,
предназначенных для нанесения на одежду
Обработку одежды (костюмы, наголовные сетки и т. д.) проводят в соответствии с рекомендованным способом применения (замачивание в эмульсии, распыление эмульсии, распыление из аэрозольной упаковки). Испытания проводят специалисты, одетые в обработанную одежду, в местах с высокой численностью гнуса и клещей. Необработанная одежда не должна защищать от укусов насекомых. Эффективность защитного действия пропитанной репеллентами одежды определяют по соотношению числа кровососов, нападающих за единицу учетного времени (20 мин) на испытателя в обработанной и контрольной (необработанной) одежде. Острое отпугивающее действие определяют через сутки после обработки. В дальнейшем испытания проводят один раз в 3 - 5 дней вплоть до утраты одеждой защитных свойств. Длительностью защитного действия репеллентного средства является период в сутках, в который защитные свойства сохраняются не менее чем на 90 % обработанной поверхности, т. е. пока число укусов через обработанную одежду и число клещей, находящихся на обработанной одежде более 10 мин, составляет менее 10 % от контроля.
5.8.3. Изучение защитного действия
инсектоакарицидных средств в виде брусков, концентратов
эмульсий и аэрозольных упаковок
Испытуемым средством обрабатывают хлопчатобумажные костюмы в соответствии с рекомендуемым способом применения. Испытания костюмов проводят в природных биотопах, где численность иксодовых клещей составляет не менее 20 экз. на 1 км маршрута при стандартном методе учета. Биотопы и время испытаний определяют специалисты-энтомологи. Две пары испытателей идут по лесу параллельными курсами в 5 - 10 м друг от друга. Испытатели в одежде, обработанной инсектоакарицидным средством, регистрируют число клещей, прицепившихся к одежде и двигающихся по ней более 5 мин. Если клещ находится на одежде более 10 мин, но при этом не двигается, то его не учитывают. Пара контрольных испытателей учитывает и собирает всех клещей, прицепившихся к необработанной одежде. Оценку защитного действия проводят по соотношению количества клещей, собранных за 2 ч с необработанной одежды и с обработанной. Защитное действие оценивают в процентах клещей, снятых с обработанной одежды, от числа клещей, снятых с необработанной одежды. Костюмы, обеспечивавшие защиту от клещей в первые сутки после обработки более чем на 95 %, оставляют для определения длительности защитного действия. Обработанные костюмы в промежутках между испытаниями хранят в полиэтиленовых (клеенчатых) пакетах или развешивают под навесом в тени. Защитные свойства обработанных костюмов проверяют через день. Утратившими защитные свойства признают костюмы, на которых собирают более 5 % клещей от числа собранных на контрольных костюмах.
Приложение 1
Термины и символы
Адультоид - имагинально-личиночная форма, образующаяся под воздействием регуляторов развития насекомых.
Акарицид - вещество или препаративная форма, предназначенная для уничтожения клещей.
АЮГ- аналог ювенильного гормона.
ДВ - действующее вещество - активный ингредиент, обладающий инсектицидной, акарицидной и другими типами активности.
Доза - количество ДВ, нанесенное на членистоногое или введенное в его организм; выражают в мг (мкг) на особь или единицу массы (мкг/г).
ДРД - длительность репеллентного действия.
ИК50 (95) - концентрация, ингибирующая вылет (выплод) имаго для аналогов ювенильного гормона и развитие личинок (личинки не могут окукливаться) для ингибиторов синтеза хитина.
Инсектицид - вещество или препаративная форма, предназначенная для уничтожения насекомых.
Инсектоакарицидная активность - способность вещества обеспечить гибель членистоногого в результате попадания на его тело, в дыхательную систему или в пищеварительный тракт.
ИСП - индекс скорости присасывания клещей.
ИСХ - ингибитор синтеза хитина.
КОД - коэффициент отпугивающего действия.
Концентрация - величина, характеризующая содержание вещества в препаративной форме, рабочих растворах, смесях, различных средах (жидкость, воздух и др.); выражают в %, весовых или объемных единицах (г/м3, мг/л), 1 часть инсектицида на 1 миллион (ppm), на 1 миллиард (ppb).
КТ50(99) (ТН) - время наступления нокдауна у 50 (99) % членистоногих после воздействия инсектоакарицида.
МВср - среднее значение максимальной высоты подъема клещей по обработанной ткани (см).
Норма расхода - масса или объем испытуемого рабочего раствора (эмульсии, суспензии, дуста или др.), наносимого на единицу поверхности или объема или на объект (например, на костюм при его пропитке репеллентом, педикулицидом).
Педикулицид - вещество или препаративная форма, предназначенная для уничтожения вшей (головных, платяных, лобковых).
Препарат, средство, препаративная форма - поступающий в продажу инсектоакарицид, репеллент, регулятор развития, содержащий ДВ и функциональные составляющие.
Репеллент (инсекторепеллент, акарорепеллент) - вещество или средство, предназначенное для отпугивания насекомых (клещей).
РРН - регулятор развития насекомых.
СД50 (95,99) (ЛД50 (95,99)) - доза инсектицида, вызывающая гибель 50 (95, 99)% членистоногих в эксперименте.
СК50 (95,99) (ЛК50 (95,99)) - концентрация инсектицида, вызывающая гибель 50 (95, 99) % членистоногих в эксперименте.
Скабицид - вещество или препаративная форма, предназначенная для уничтожения чесоточных клещей.
Тест-членистоногое (биообъект) - вид насекомого (клеща), используемый в эксперименте.
Тест-поверхность - поверхность, обрабатываемая инсектоакарицидом (репеллентом, регулятором развития насекомых), используемая в эксперименте.
ТНср. - среднее время наступления состояния нокдауна у членистоногих (мин).