Информационная система |
| Карта сайта |
Скачать МУ 1.2.2635-10 Медико-биологическая оценка безопасности наноматериалов
Дата актуализации: 10.08.2017

 МУ 1.2.2635-10
МУ 1.2.2635-10
Медико-биологическая оценка безопасности наноматериалов
| Обозначение: |  МУ 1.2.2635-10 МУ 1.2.2635-10 |
| Обозначение англ: |  MU 1.2.2635-10 MU 1.2.2635-10 |
| Статус: | введен впервые |
| Название рус.: | Медико-биологическая оценка безопасности наноматериалов |
| Дата добавления в базу: | 01.02.2017 |
| Дата актуализации: | 05.05.2017 |
| Дата введения: | 24.05.2010 |
| Область применения: | Методические указания устанавливают требования к медико-биологической оценке безопасности наночастиц и наноматериалов искусственного происхождения на основе тестов на культурах клеток, семенах высших растений и лабораторных животных. Требования, изложенные в настоящих методических указаниях, применяются в ходе установления безопасности наноматериалов на стадиях их производства, оборота, использования и утилизации в Российской Федерации в целях принятия решений по оценке рисков, связанных с данными процессами. Методические указания разработаны с целью обеспечения единства измерений и адаптации имеющихся методов и средств измерений в ходе оценки безопасности наноматериалов искусственного происхождения. Методические указания предназначены для специалистов органов Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, а также могут быть использованы научно-исследовательскими организациями гигиенического профиля, медицинскими учебными заведениями и иными организациями и учреждениями, проводящими исследования по оценке безопасности наноматериалов. |
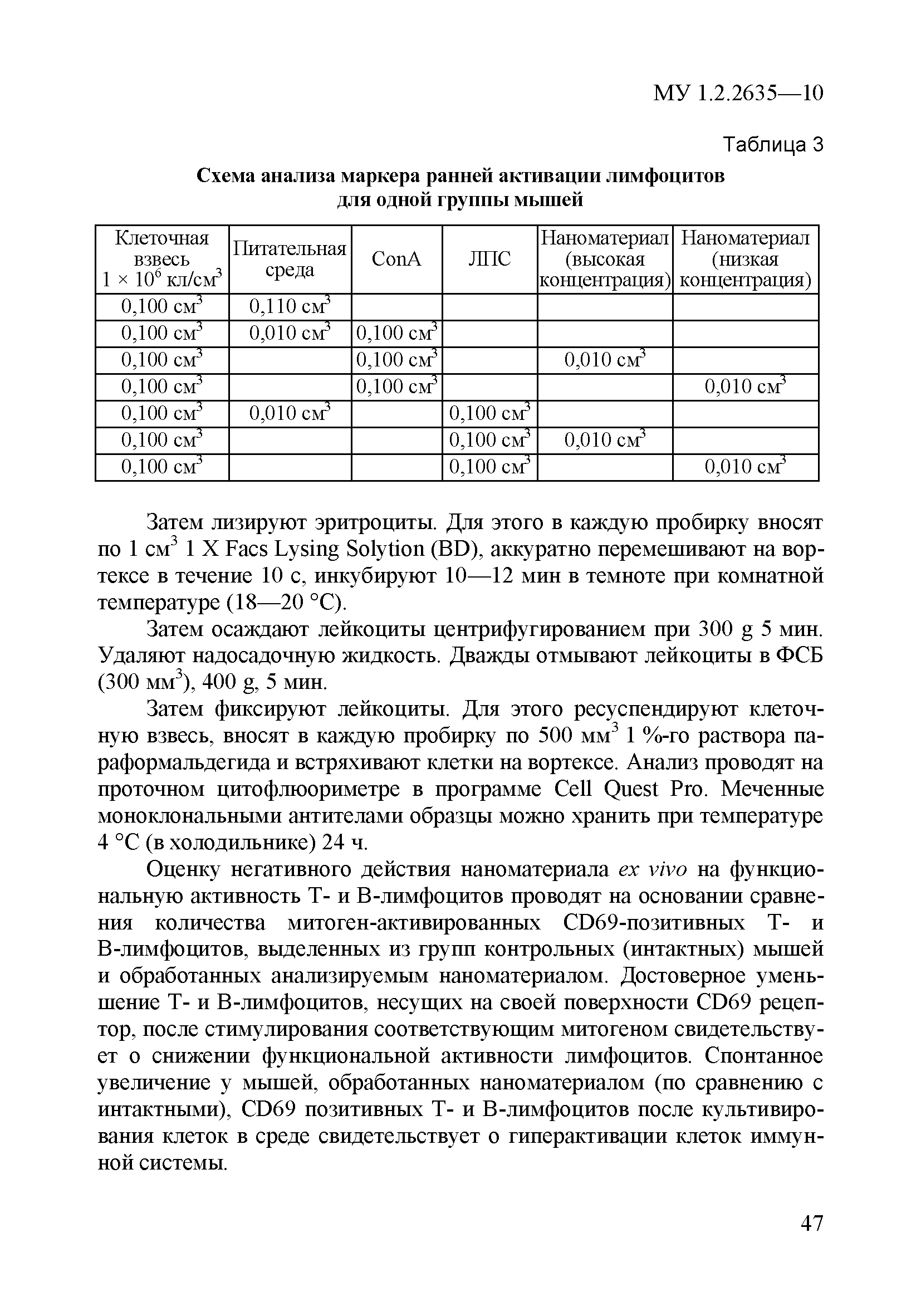
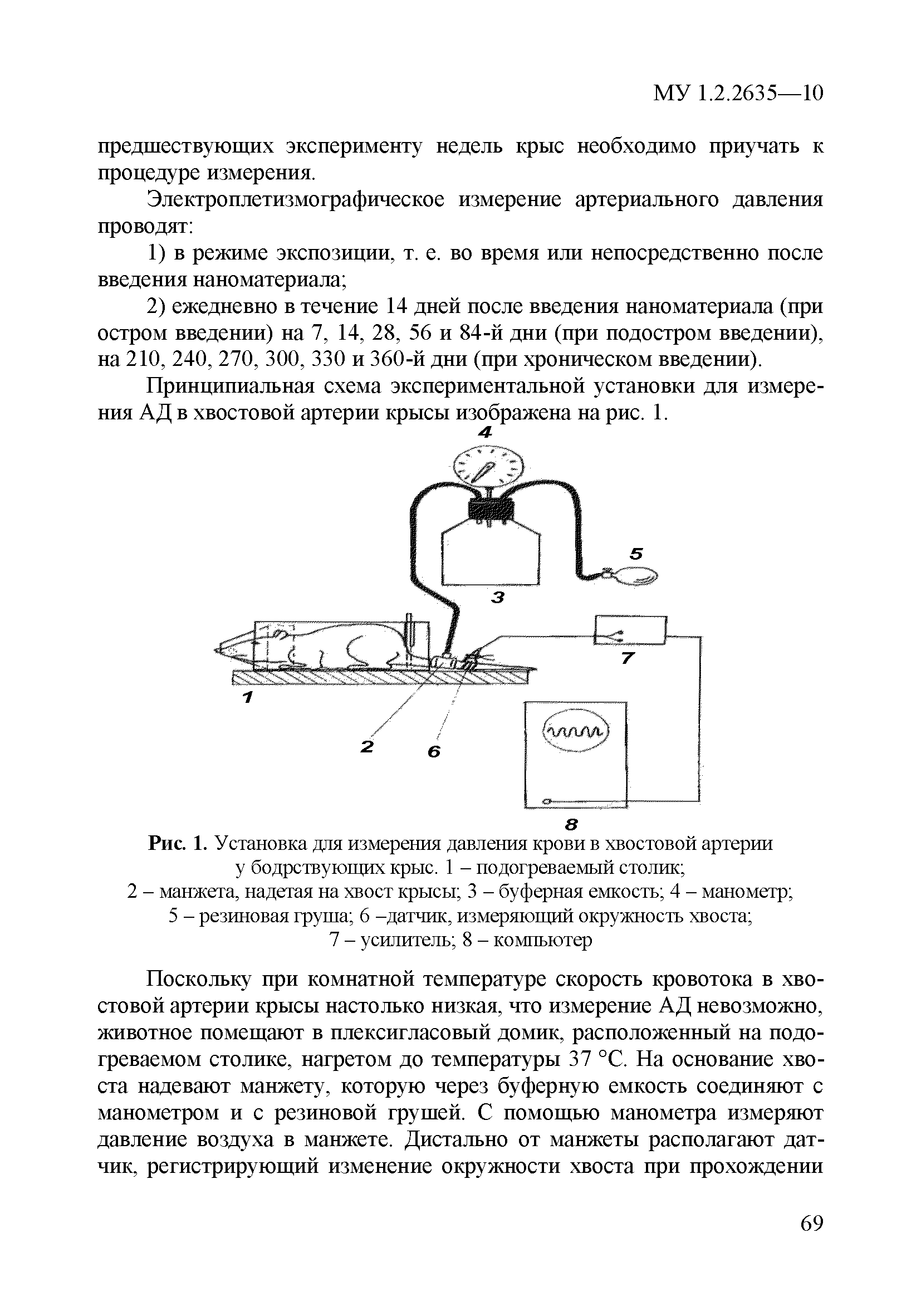
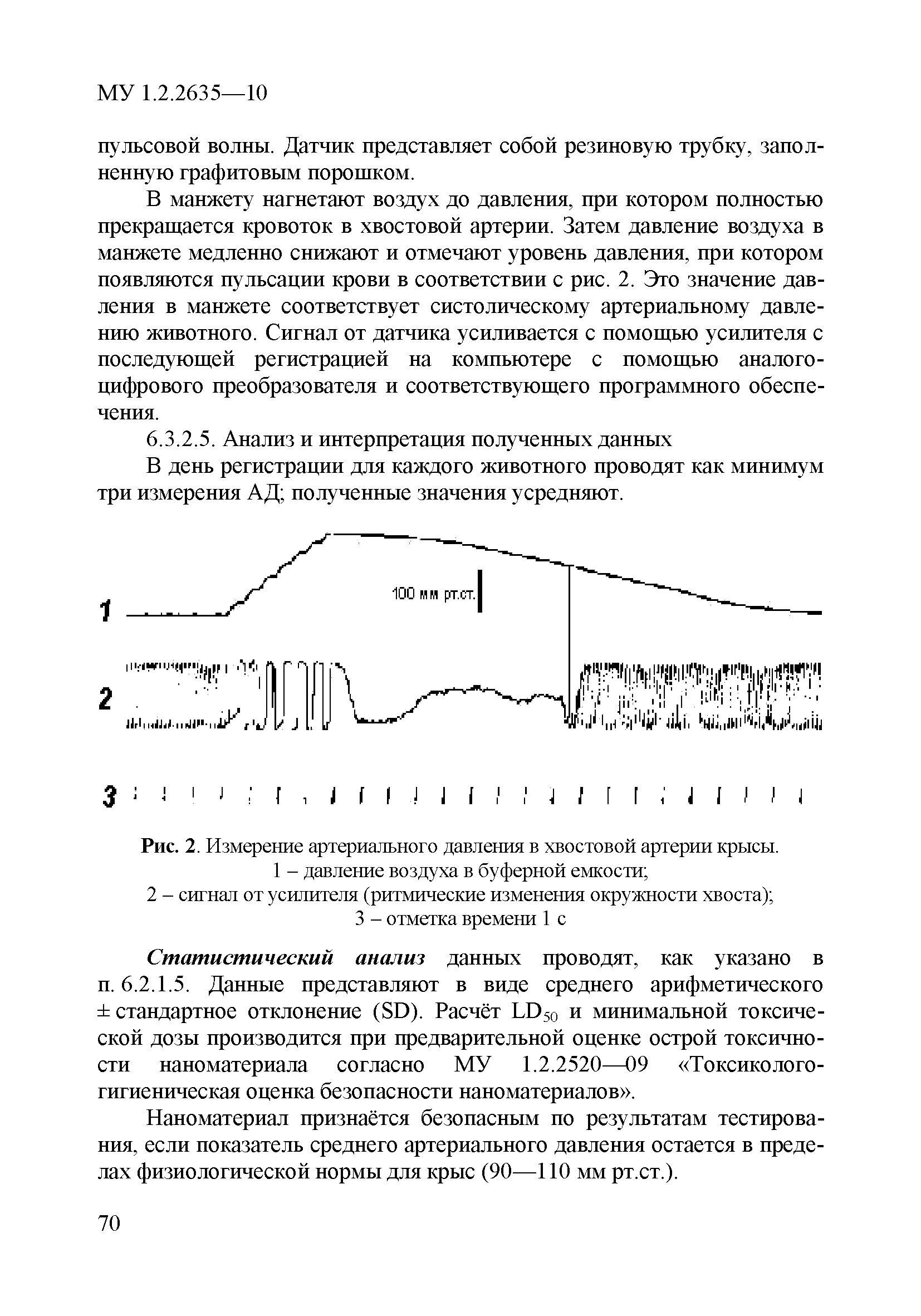
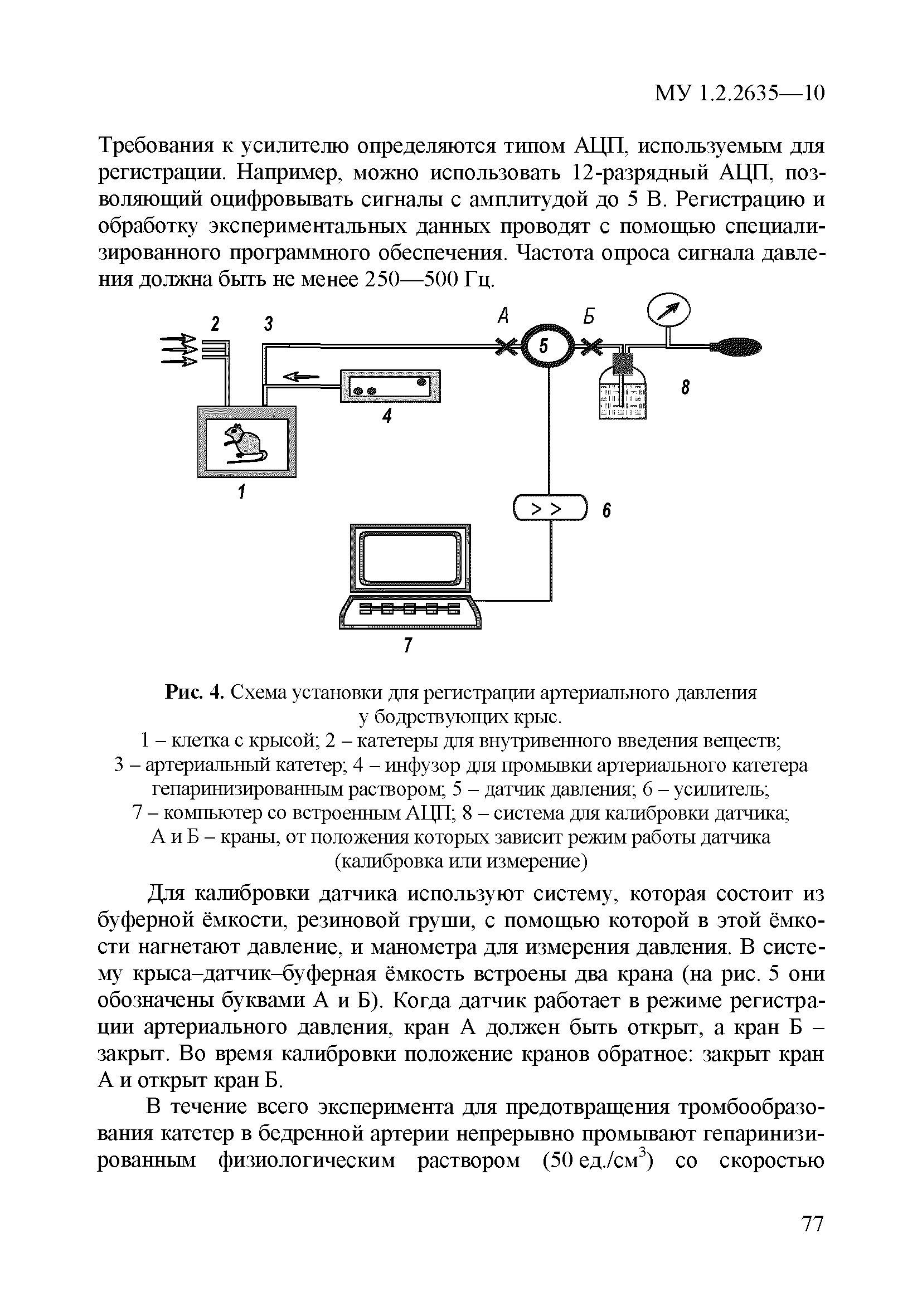
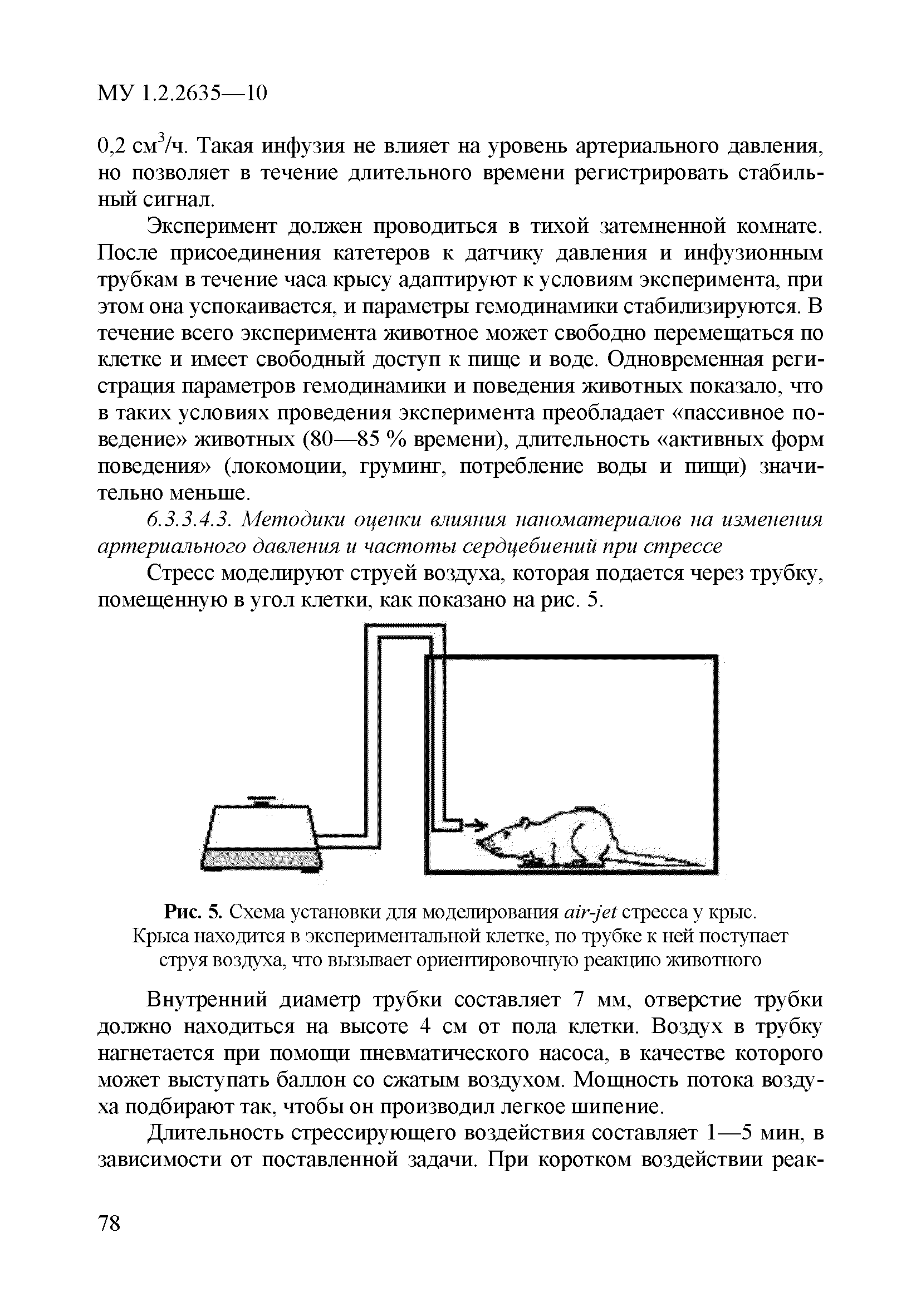
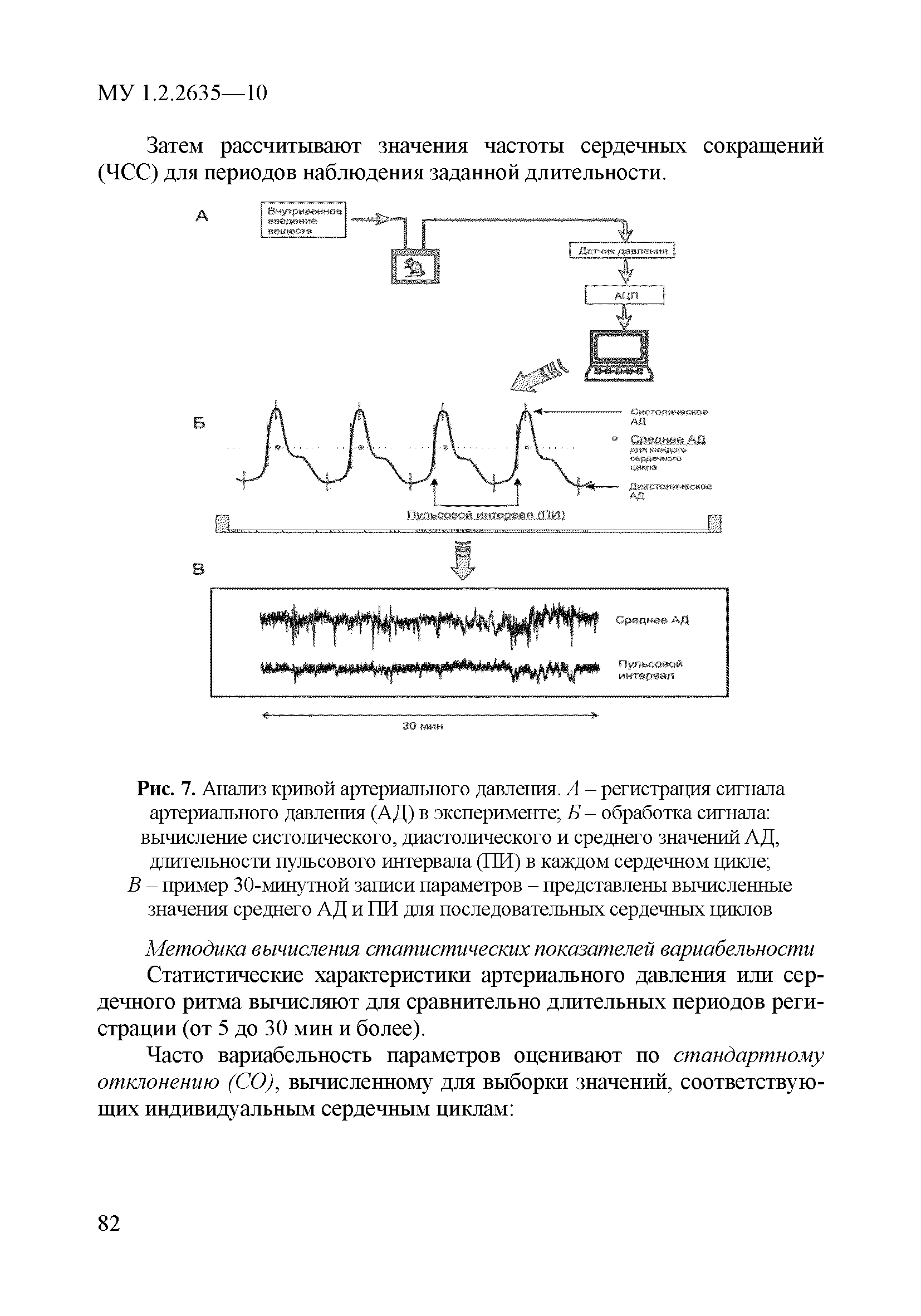
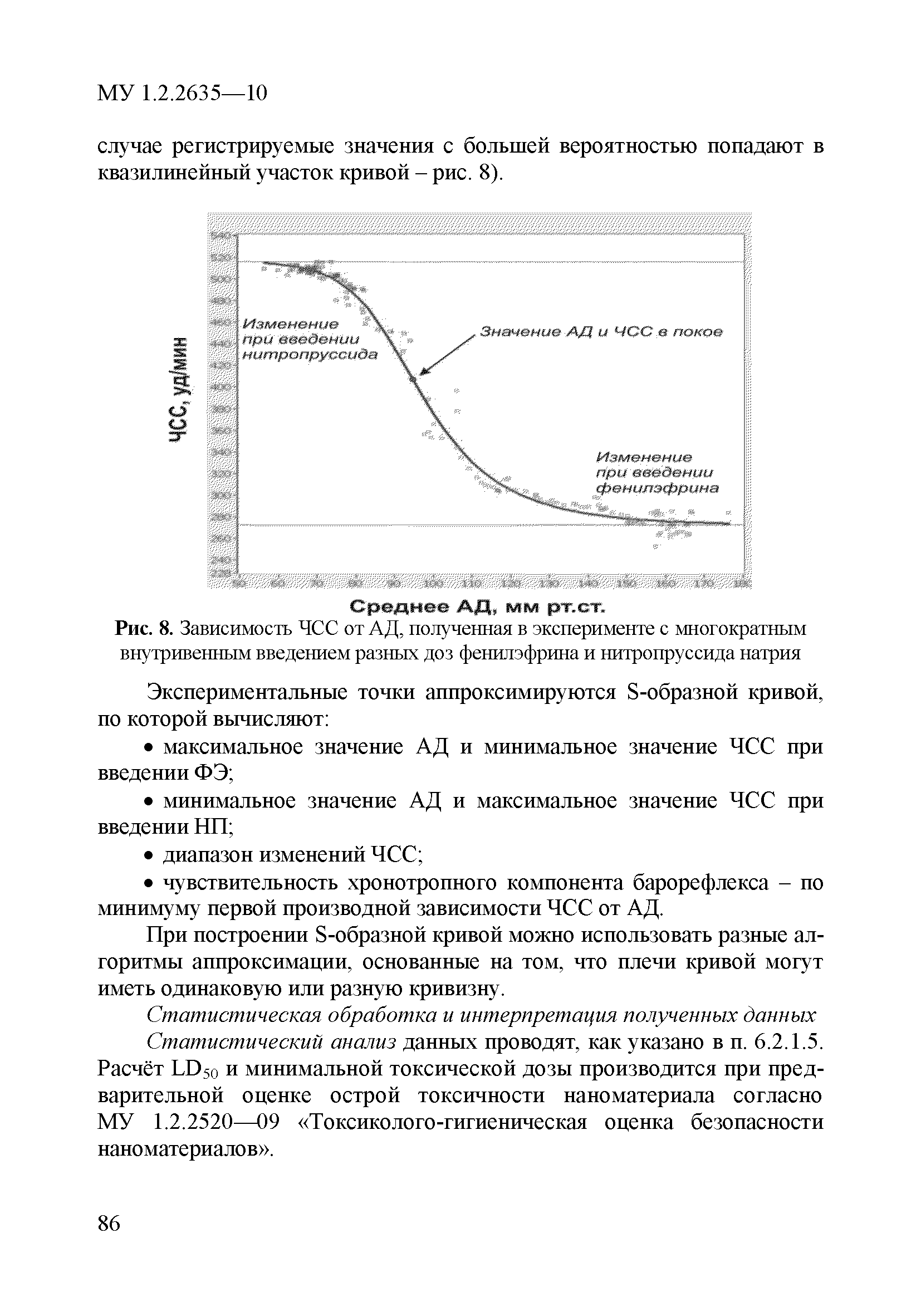
| Оглавление: | 1 Область применения 2 Введение 3 Общие положения 4 Медико-биологическое тестирование безопасности наноматериалов на культурах клеток высших животных 4.1. Требования к используемым культурам клеток 4.2. Схема введения наноматериалов животным и сроки наблюдения 4.3. Подготовка аэрозольно обработанных наноматериалами животных 4.4. Приборы и оборудование 4.5. Материалы и реактивы 4.6. Приготовление растворов и сред 4.7. Получение и культивирование клеточных культур 4.7.1. Получение первичных клеточных культур 4.7.2. Ведение и подготовка перевиваемых клеточных культур к тестированию 4.8. Проведение тестирования безопасности наноматериалов in vitro с использованием клеточных культур 4.8.1. Подготовка клеточных культур и образцов наноматериалов к тестированию и внесение образца наноматериала в культуру 4.8.2. Ход тестирования 4.9. Оценка цитотоксических свойств наноматериалов 4.9.1. Оценка цитотоксичности с помощью МТТ 4.9.2. Оценка цитотоксичности путем определения активности лактатдегидрогеназы 4.9.3. Оценка цитотоксичности путем определения концентрации АТФ в лейкоцитах 4.9.4. Оценка влияния наноматериалов на функциональную активность макрофагов 4.9.5. Определение активности ферментов, участвующих в "респираторном взрыве" 4.9.6. Оценка влияния наноматериалов на ФМА-индуцированную дифференцировку моноцитарных клеточных культур в макрофаги 4.9.7. Оценка влияния наноматериалов на продукцию макрофагами фактора некроза опухоли-альфа 4.10. Оценка иммунотропного действия наноматериалов 4.10.1. Оценка влияния наноматериалов на поликлональную активацию лимфоцитов в реакции бласттрансформации лимфоцитов 4.10.2. Оценка влияния наноматериалов на продукцию лимфоцитами интерферона-гамма методом ИФА 4.11. Оценка безопасности наноматериалов методом проточной цитофлюориметрии по качественным и количественным изменениям в клетках высших животных 4.11.1. Определение содержания Т- и В-лимфоцитов и соотношения Т-хелперов и цитотоксических Т-лимфоцитов 4.11.2. Выявление маркера ранней активации лимфоцитов 4.11.3. Оценка апоптотической и пролиферативной активности лейкоцитов 4.11.4. Оценка цитотоксического действия наноматериалов на лейкоциты периферической крови человека 4.11.5. Определение цитолитической активности лимфоцитов 4.11.6. Оценка фагоцитарной активности перитонеальных макрофагов животных 5. Оценка безопасности наноматериалов с использованием 5.1. Принцип биотестирования на проростках высших растений 5.2. Оборудование, материалы, реактивы 5.3. Характеристика тест-систем 5.4. Условия тестирования 5.5. Подготовка к проведению тестов 5.5.1. Подготовка посуды для биотестирования 5.5.2. Подготовка субстрата для проращивания семян высших растений 5.5.3. Приготовление исследуемых проб наноматериалов 5.5.4. Подготовка семян 5.6. Процедура биотестирования 5.7. Оценка и интерпретация результатов биотестирования 6. Оценка безопасности наноматериалов с использованием интегральных тестов на лабораторных животных 6.1. Предварительные замечания 6.2. Методики измерения легочной функции 6.2.1. Методика измерения легочной функции in vivo - электроплетизмография 6.3. Методики измерения функций сердечно-сосудистой системы 6.3.1. Тестирование безопасности наноматериалов на инвазивной модели тромбогенеза 6.3.2. Методика электроплетизмографического измерения артериального давления в хвостовой артерии 6.3.3. Методика регистрации АД с использованием имплантируемых катетеров 6.3.4. Методика регистрации ЭКГ у бодрствующих крыс в покое и при стрессирующем воздействии 6.4. Тестирование безопасности наноматериалов на основе определения гематологических показателей лабораторных животных 6.4.1. Определение кинетики агрегации и дезагрегации эритроцитов 6.4.2. Оценка деформационных свойств эритроцитов и вязкости крови 6.5. Оценка безопасности наноматериалов по интегральным показателям системы детоксикации ксенобиотиков 6.5.1. Метод гексеналовой пробы 6.5.2. Метод пробы с бромсульфалеином 6.6. Оценка безопасности наноматериалов по интенсивности местных воспалительных реакций 6.6.1. Методика накожных аппликаций 6.6.2. Методика конъюнктивальной пробы 6.7. Тестирование безопасности наноматериалов по поведенческим реакциям животных 6.7.1. Методика теста "открытое поле" 6.7.2. Методика теста "приподнятый крестообразный лабиринт" 6.7.3. Методика условного рефлекса пассивного избегания 6.8. Тестирование безопасности наноматериалов на основе определения физической выносливости животных 6.8.1. Метод истощающего плавания 6.8.2. Методика динамометрического измерения произвольной силы скелетных мышц передних конечностей Приложение 1. Нормативные ссылки |
| Разработан: | ФГУП ВНИИМС НИИ питания РАМН Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека ФГУН Государственный научный центр прикладной микробиологии и биотехнологии Роспотребнадзора ООО Интерлаб НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН Биологический факультет МГУ им. М.В. Ломоносова Центр Биоинженерия РАН |
| Утверждён: | 24.05.2010 Главный государственный санитарный врач Российской Федерации |
| Издан: | Роспотребнадзор (2010 г. ) |
| Расположен в: | |
| Нормативные ссылки: |
|



















































































































© 2013 Ёшкин Кот :-) Карта сайта

 Федеральный закон 52-ФЗ «О санитарно-эпидемиологическом благополучии населения»
Федеральный закон 52-ФЗ «О санитарно-эпидемиологическом благополучии населения»