Информационная система |
| Карта сайта |
Скачать Р 1.2.3156-13 Оценка токсичности и опасности химических веществ и их смесей для здоровья человека
Дата актуализации: 10.08.2017

 Р 1.2.3156-13
Р 1.2.3156-13
Оценка токсичности и опасности химических веществ и их смесей для здоровья человека
| Обозначение: |  Р 1.2.3156-13 Р 1.2.3156-13 |
| Обозначение англ: |  R 1.2.3156-13 R 1.2.3156-13 |
| Статус: | действует |
| Название рус.: | Оценка токсичности и опасности химических веществ и их смесей для здоровья человека |
| Дата добавления в базу: | 21.05.2015 |
| Дата актуализации: | 05.05.2017 |
| Дата введения: | 27.12.2013 |
| Область применения: | Руководство применяется для выполнения исследований по оценке токсичности и опасности химических веществ и их смесей для здоровья человека в соответствии с международными требованиями Организации экономического сотрудничества и развития (далее - ОЭСР) с целью обеспечения качества испытаний, отвечающих требованиям надлежащей лабораторной практики, осуществления классификации их опасности и маркировки с использованием Согласованной на глобальном уровне системы классификации и маркировки химической продукции (далее - СГС), разработки эффективных профилактических мероприятий по минимизации риска воздействия химического фактора. |
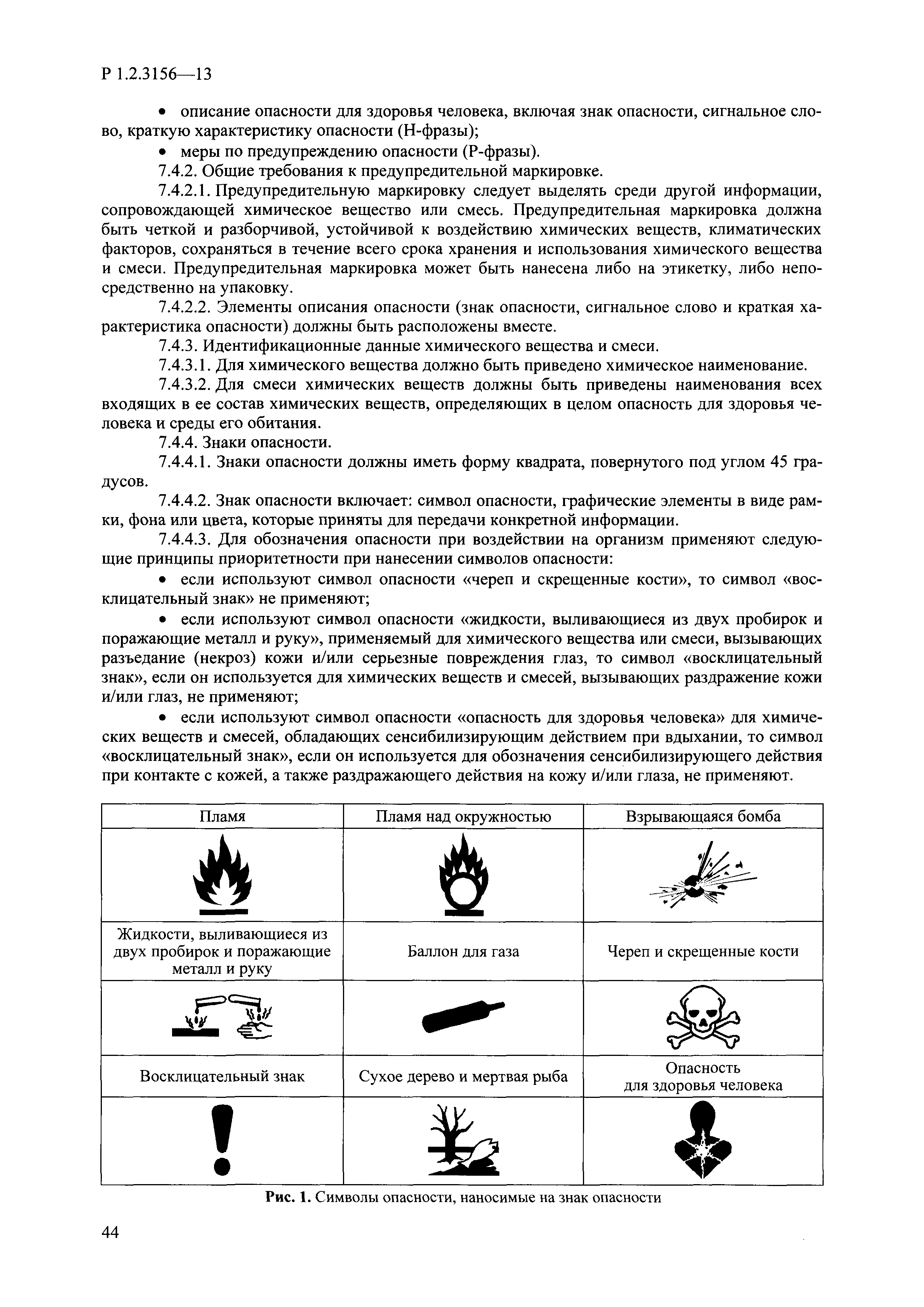
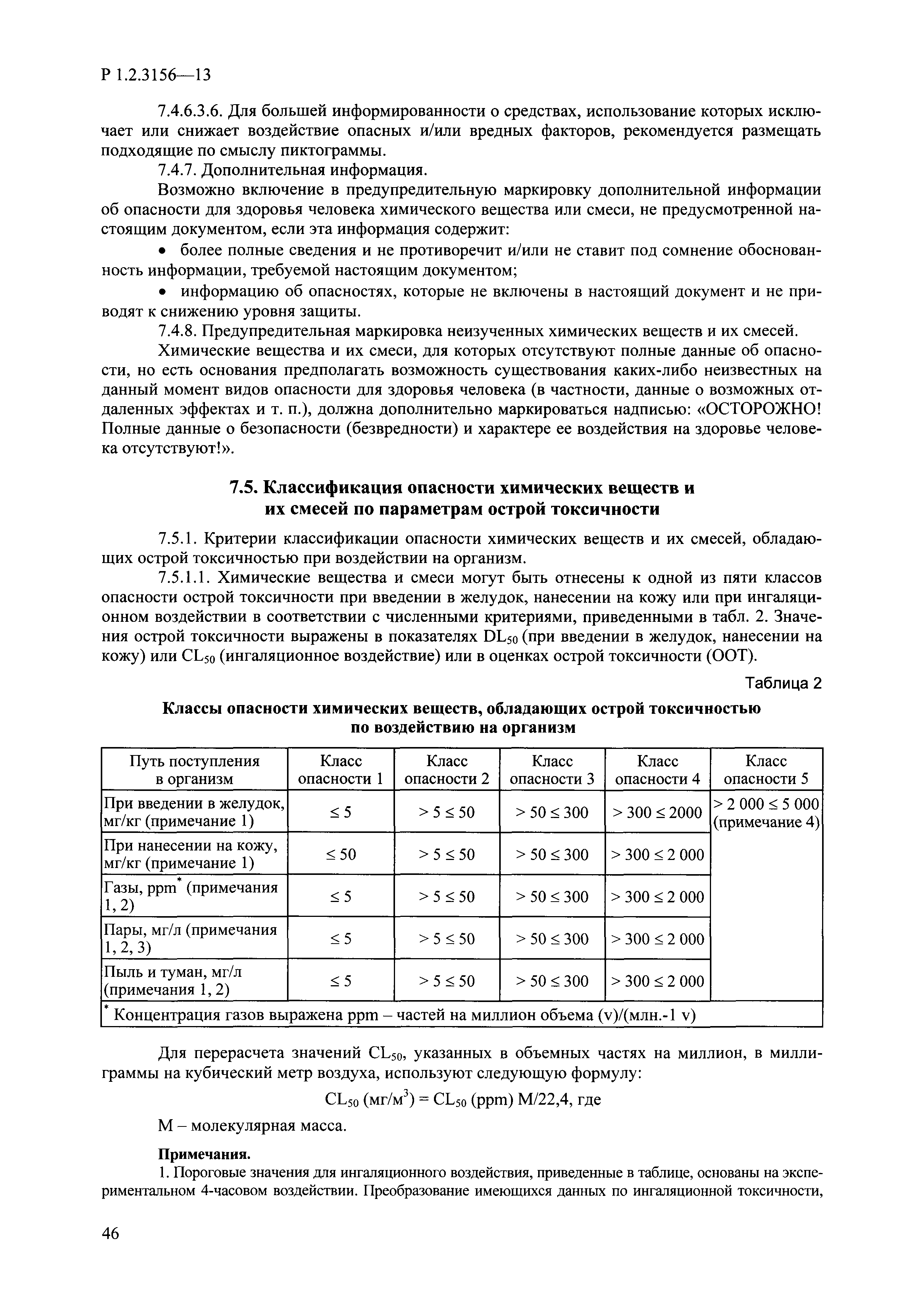
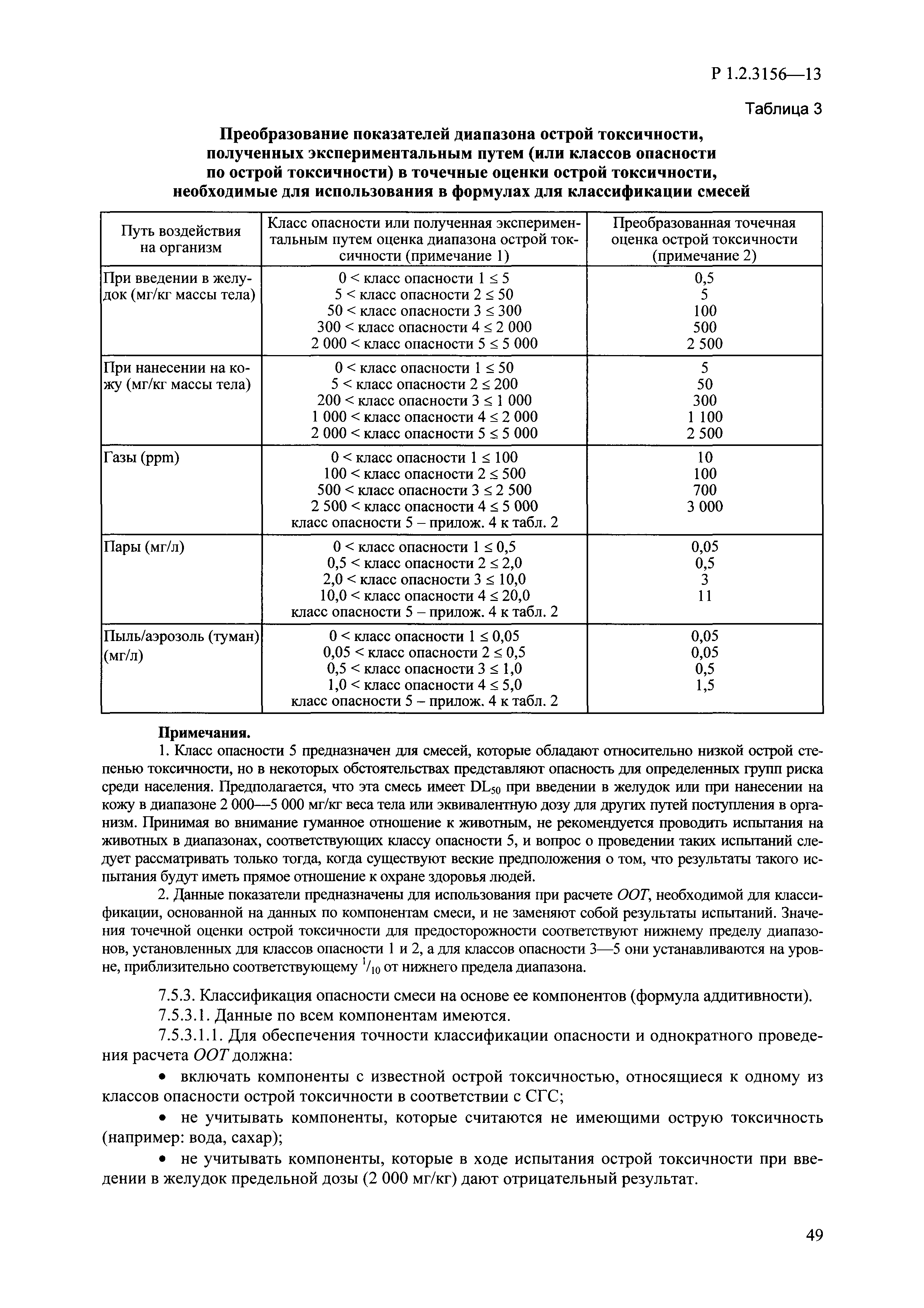
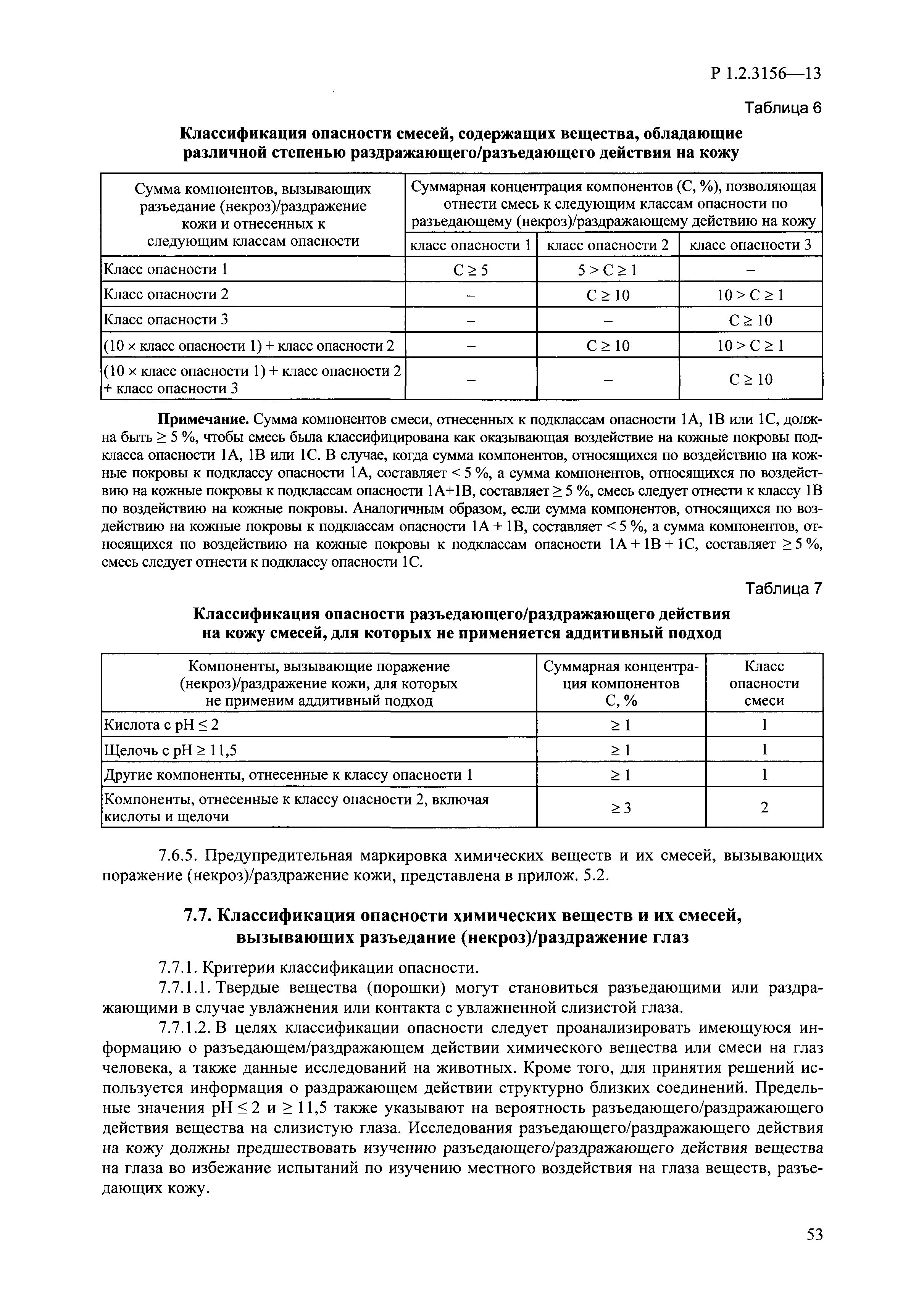
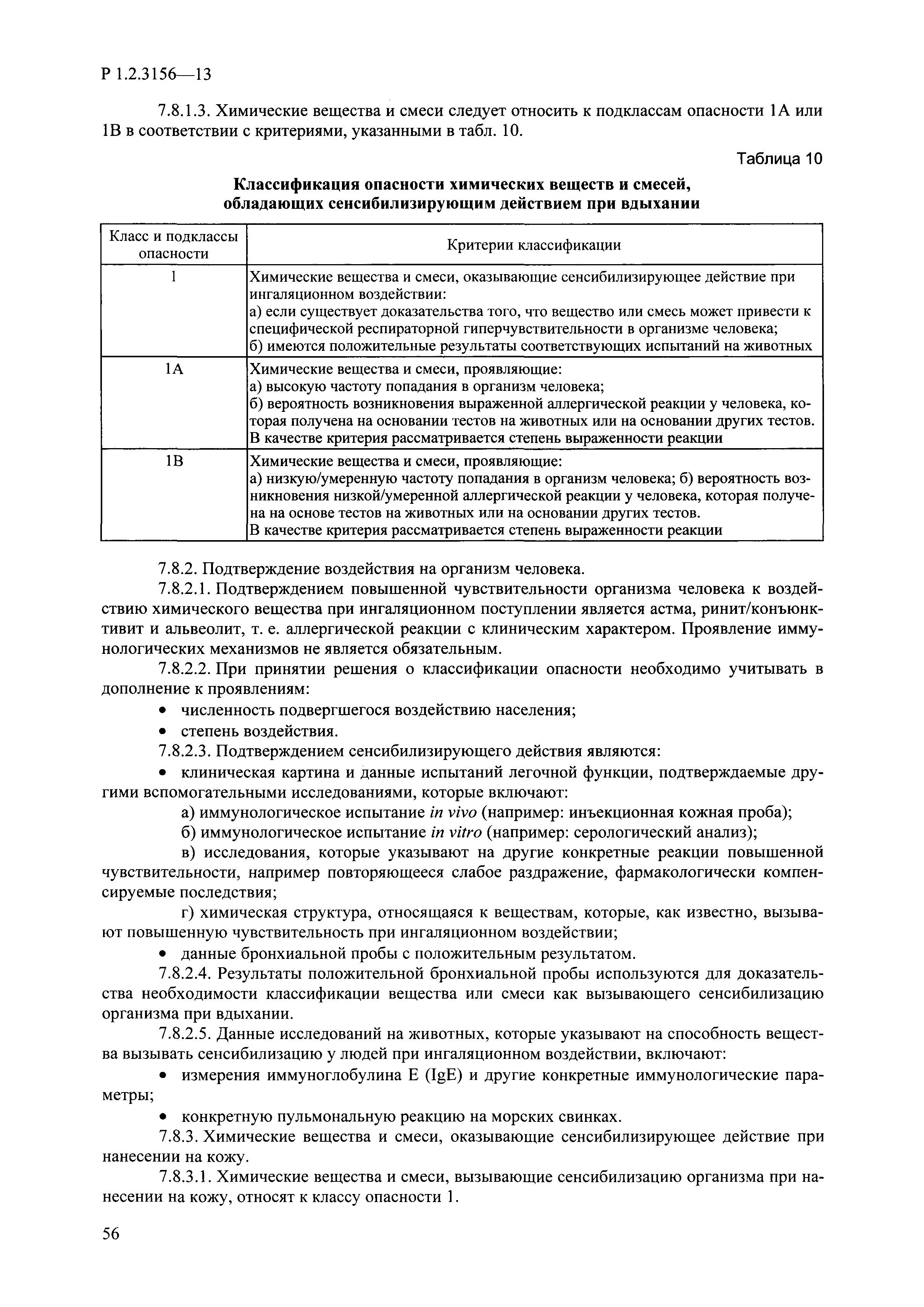
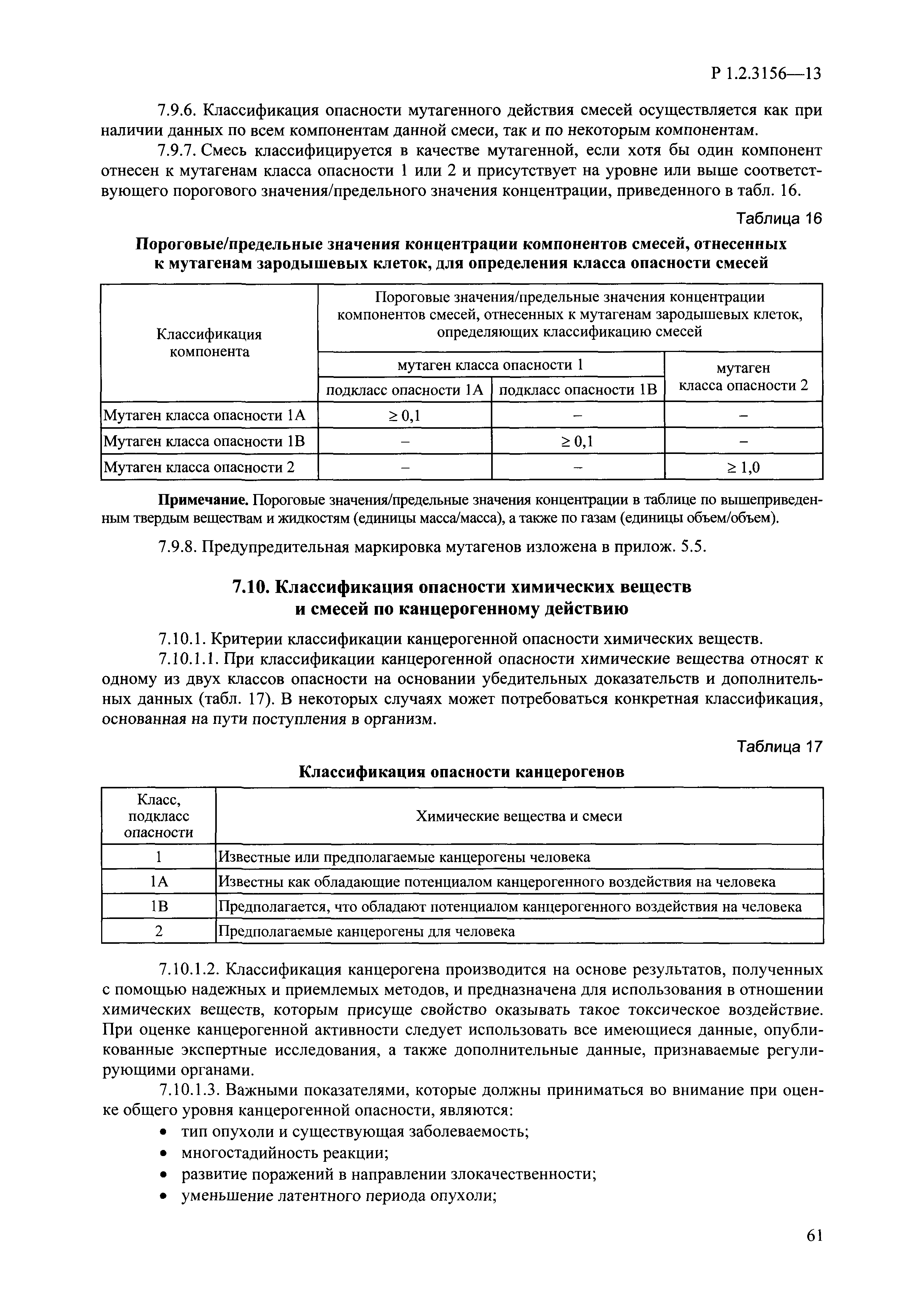
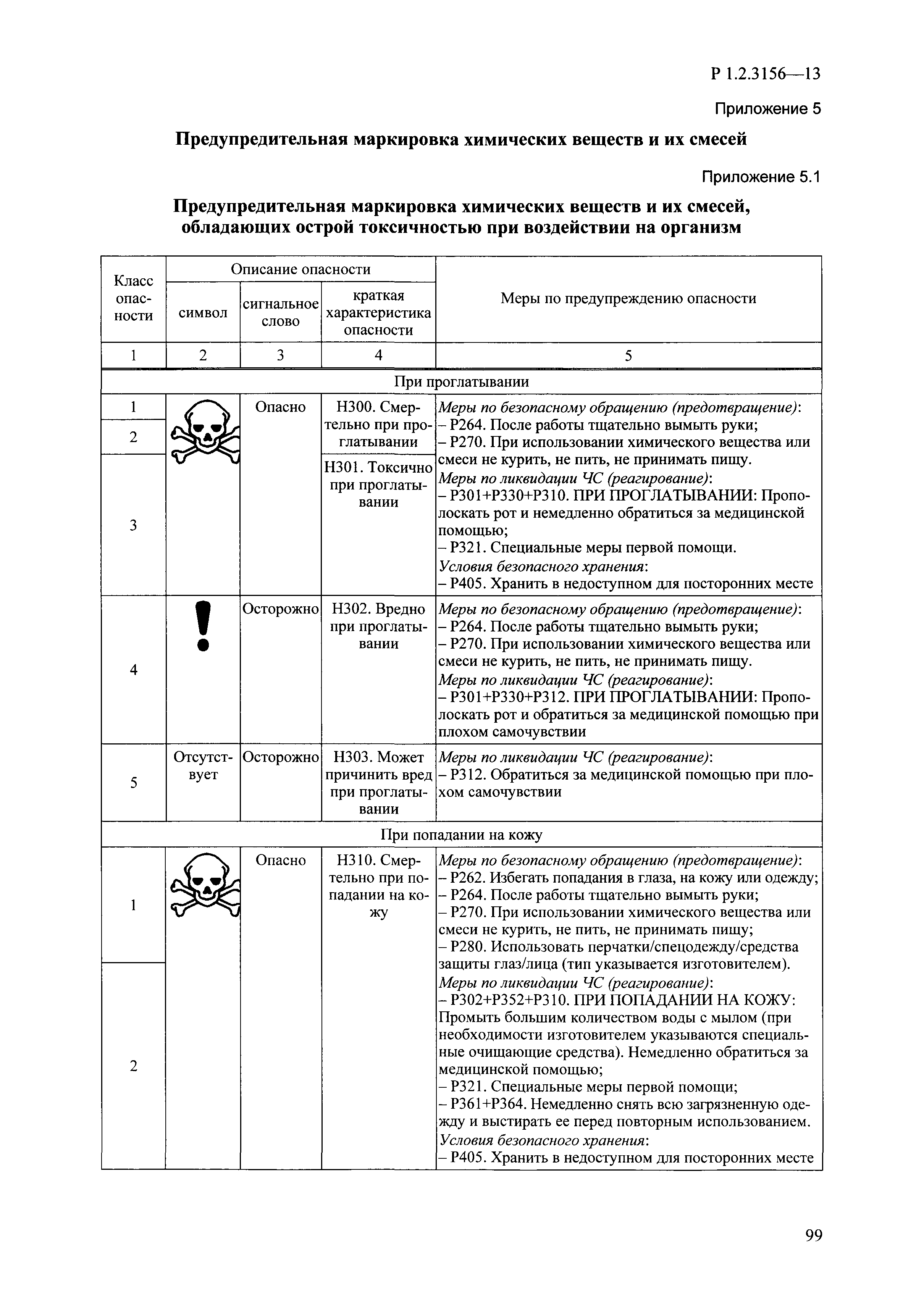
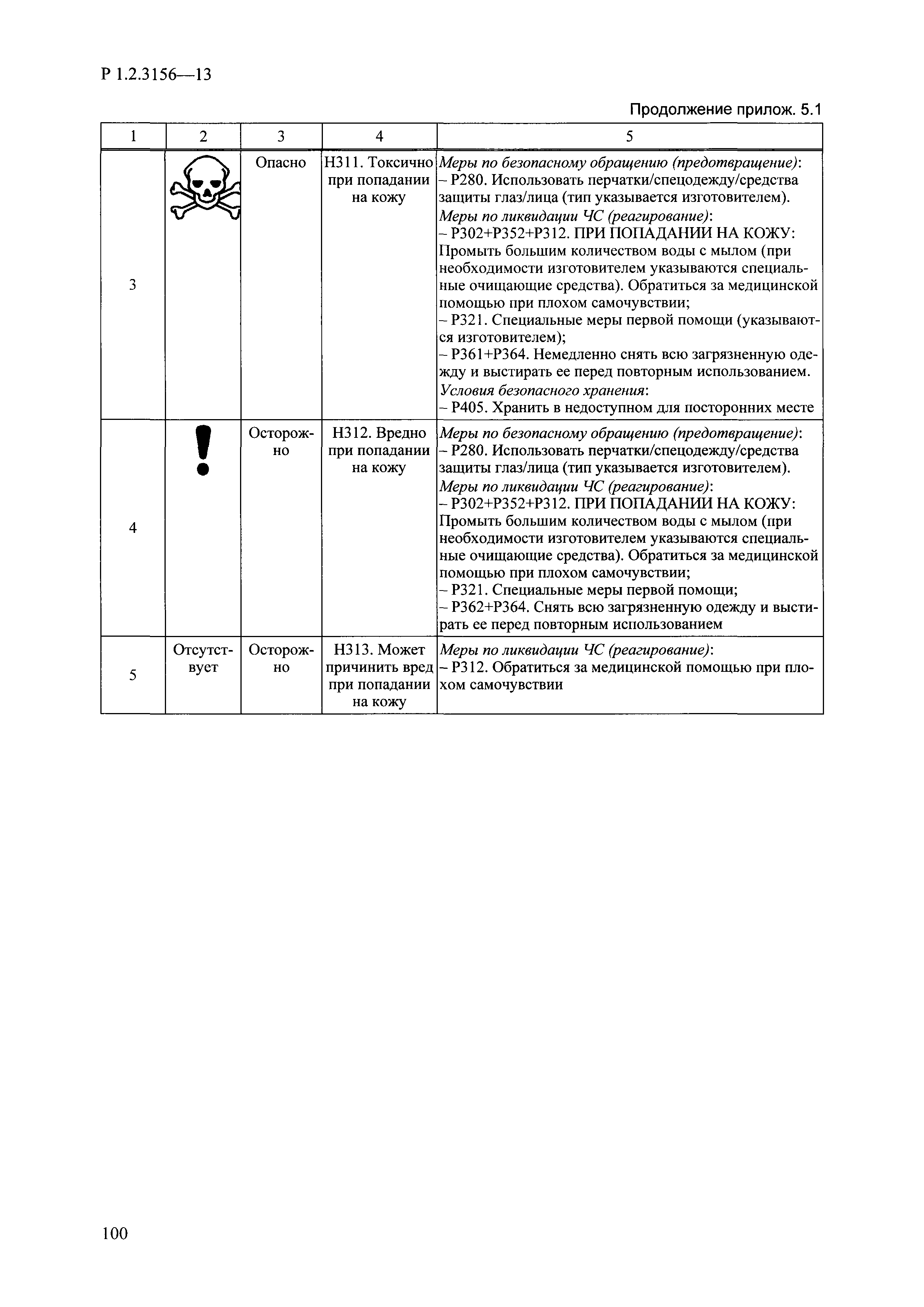
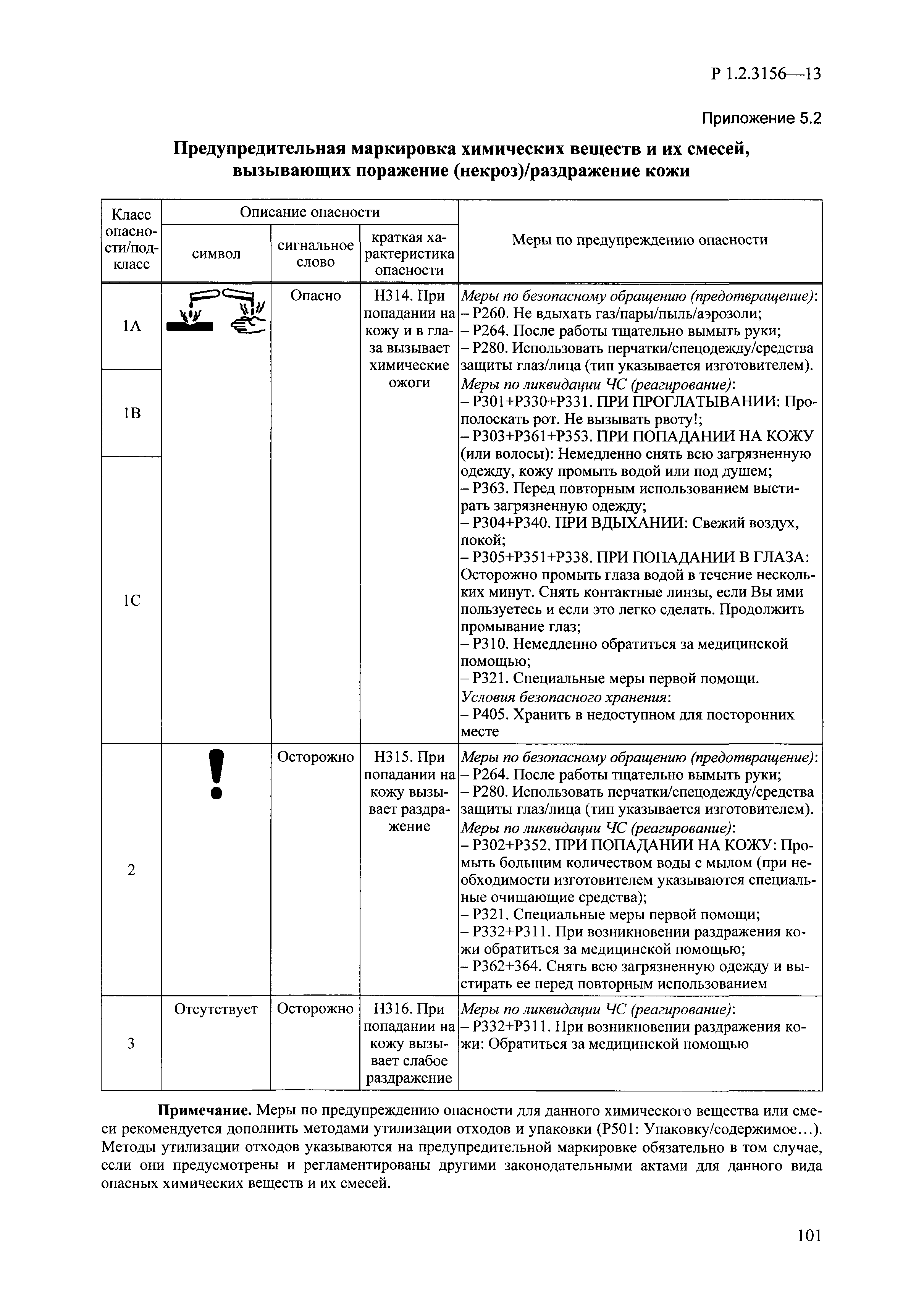
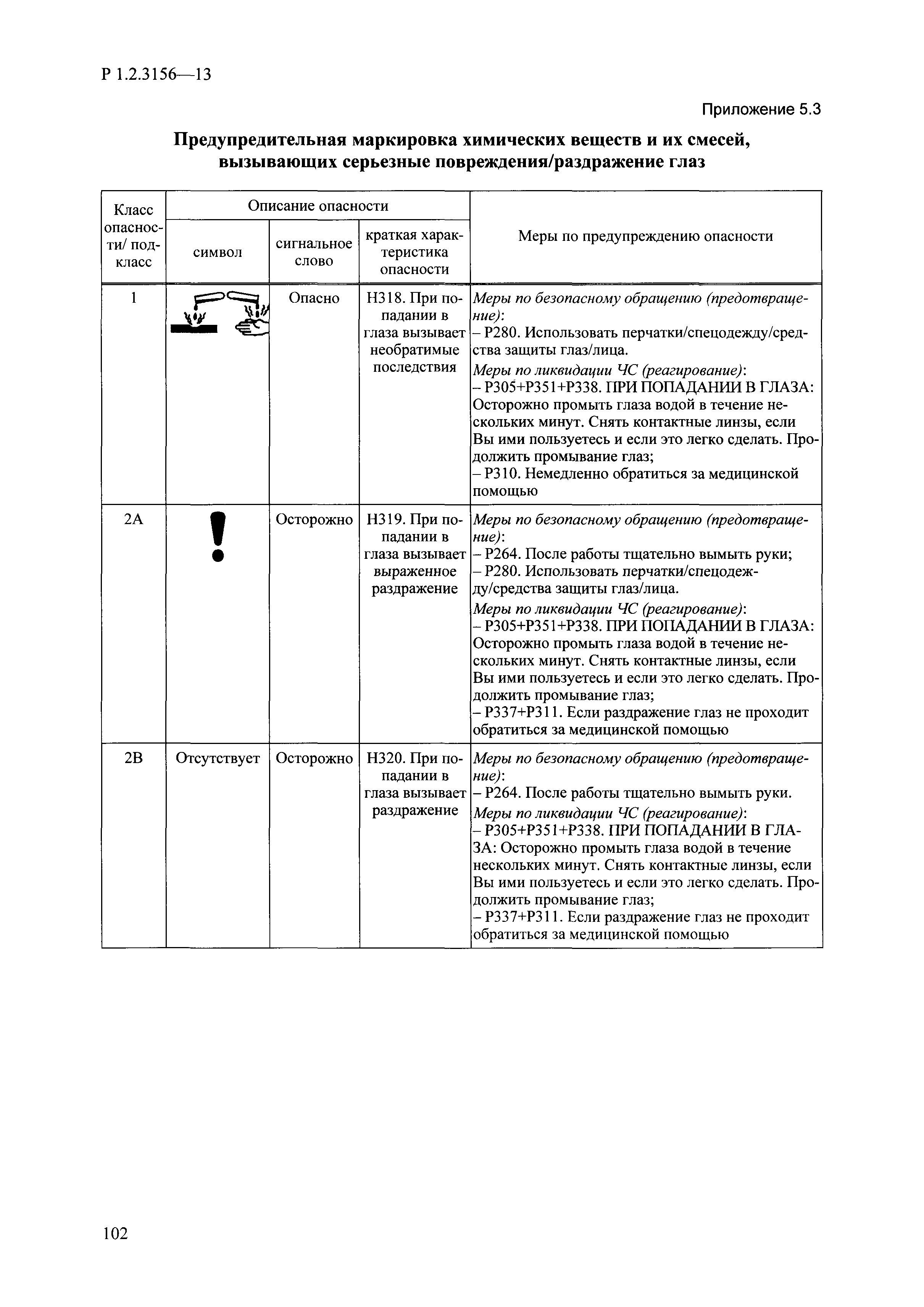
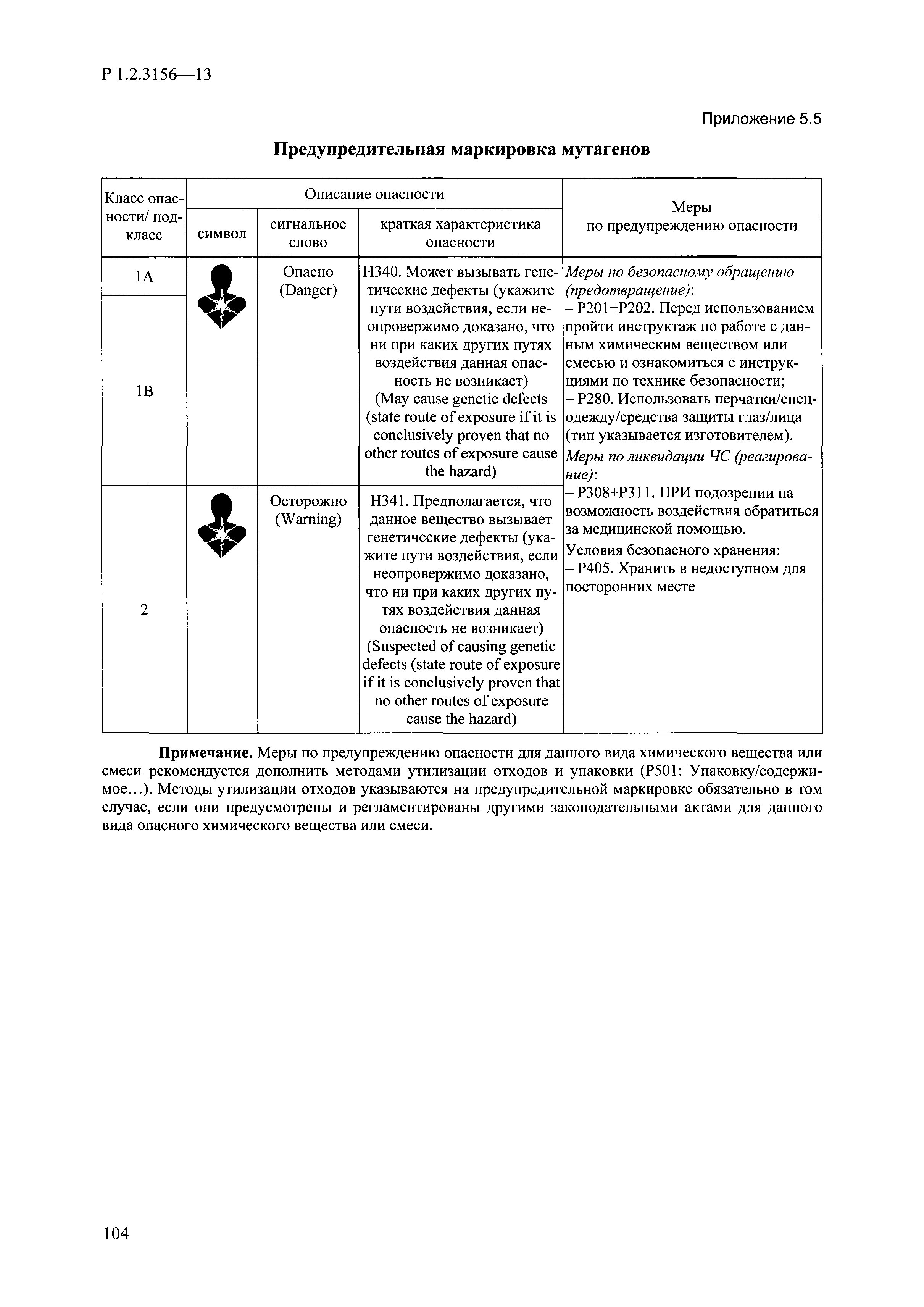
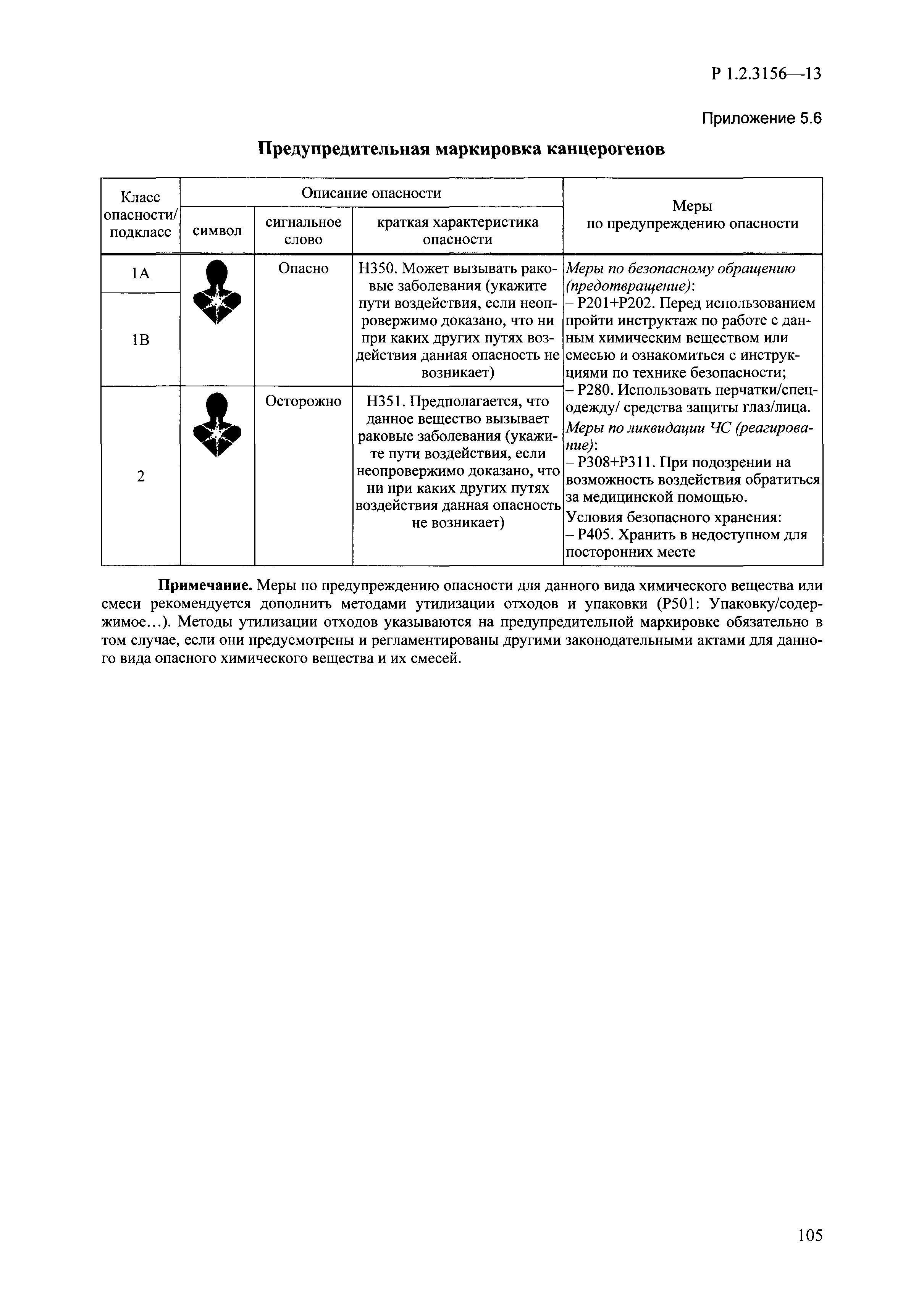
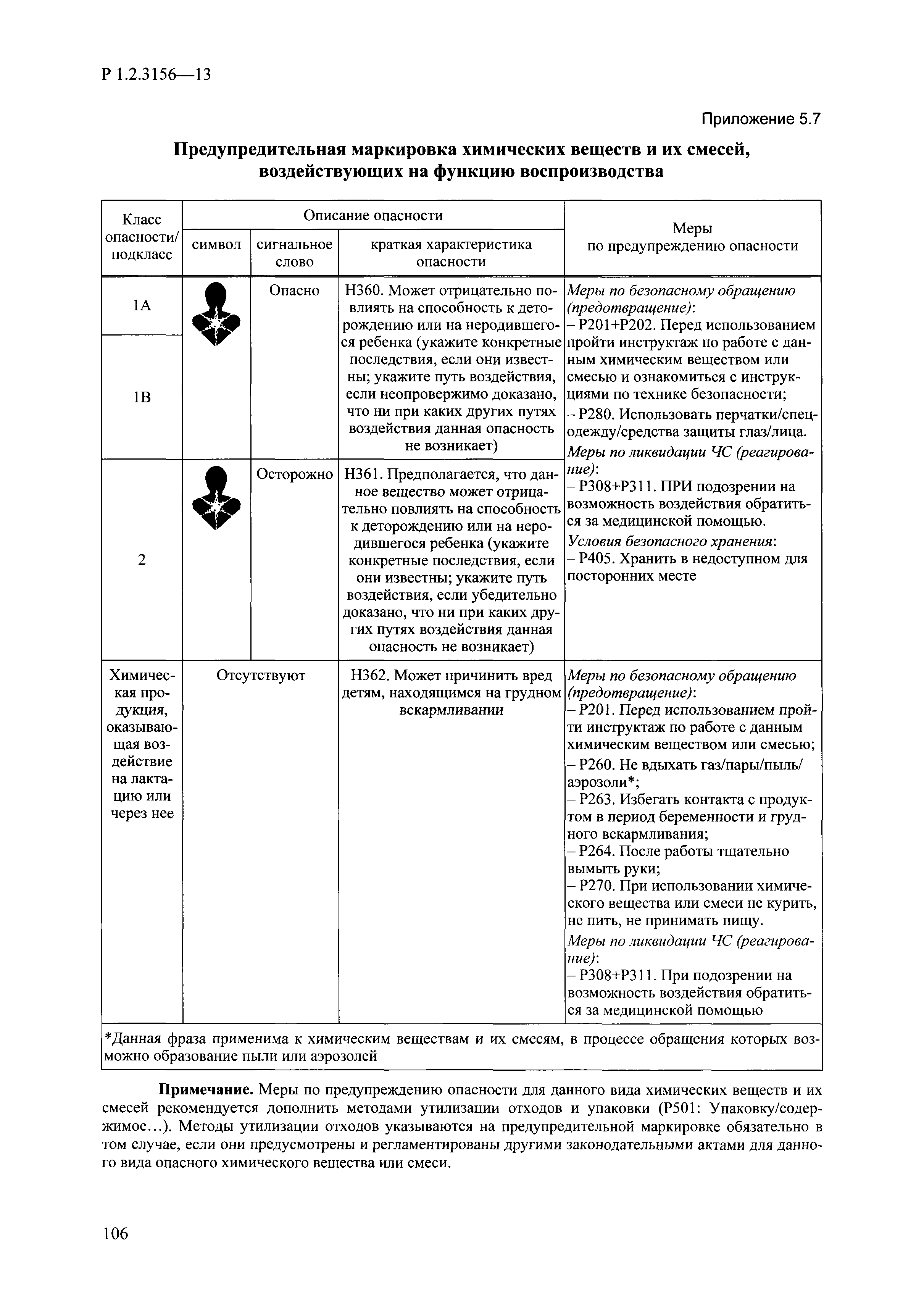
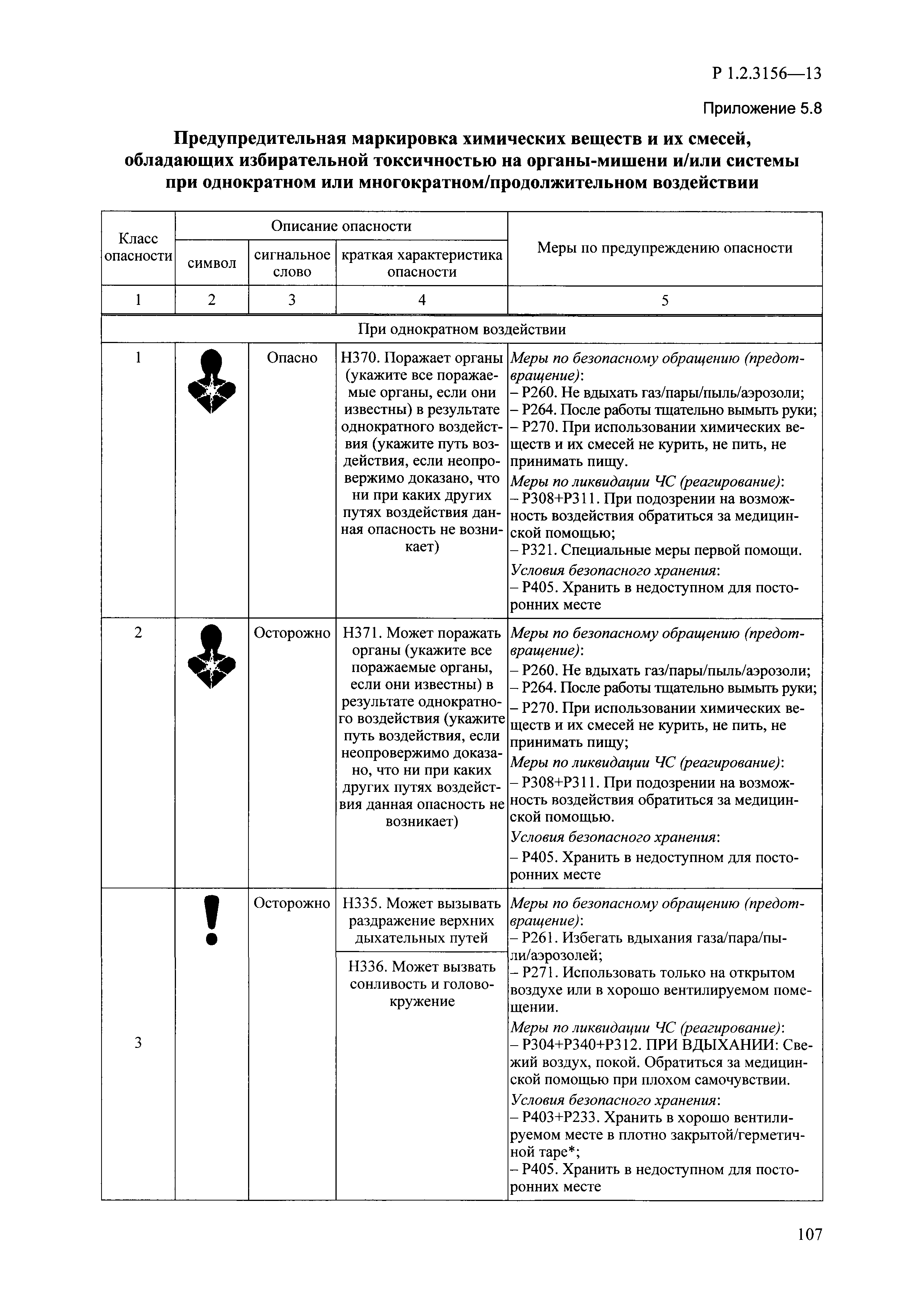
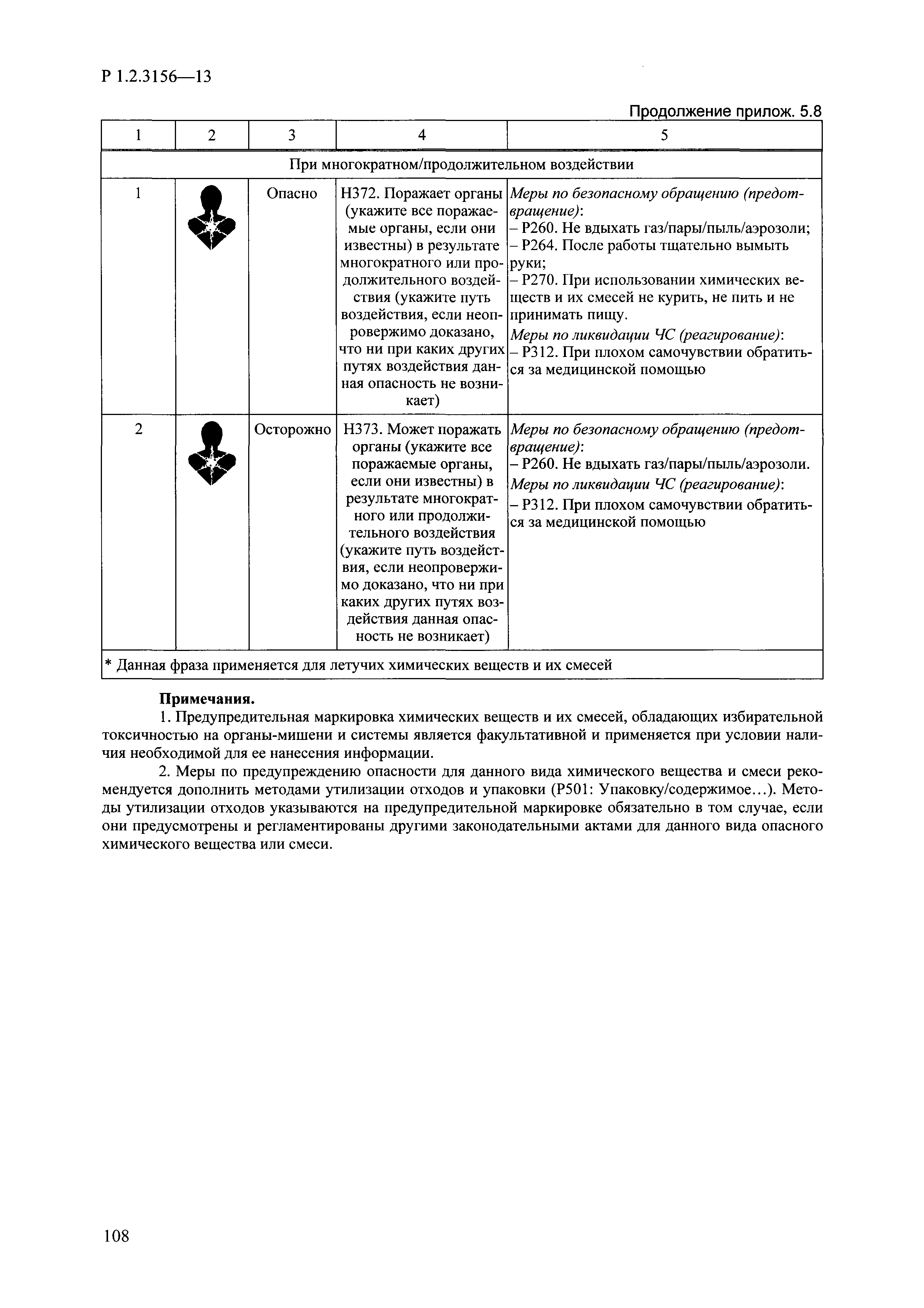
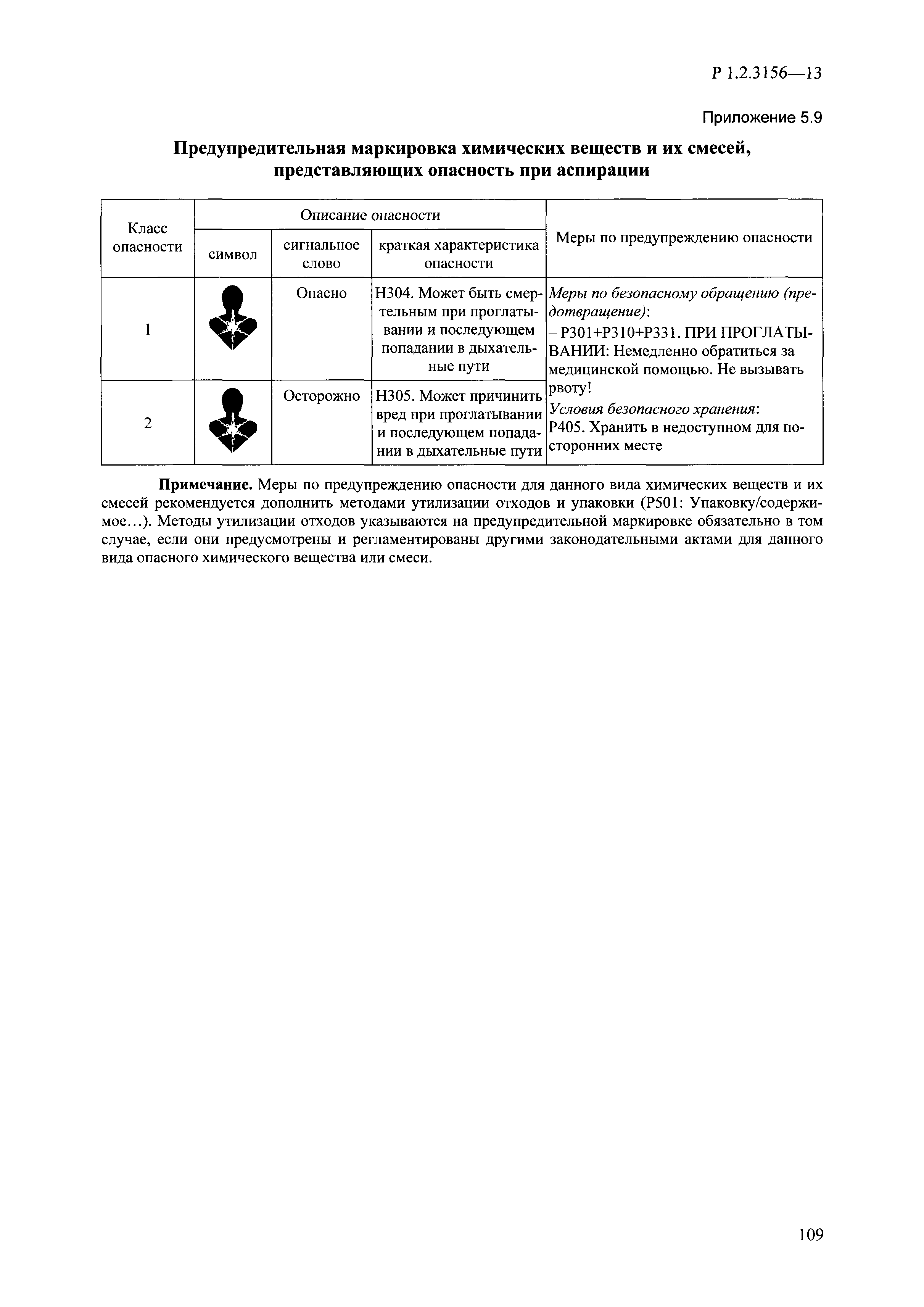
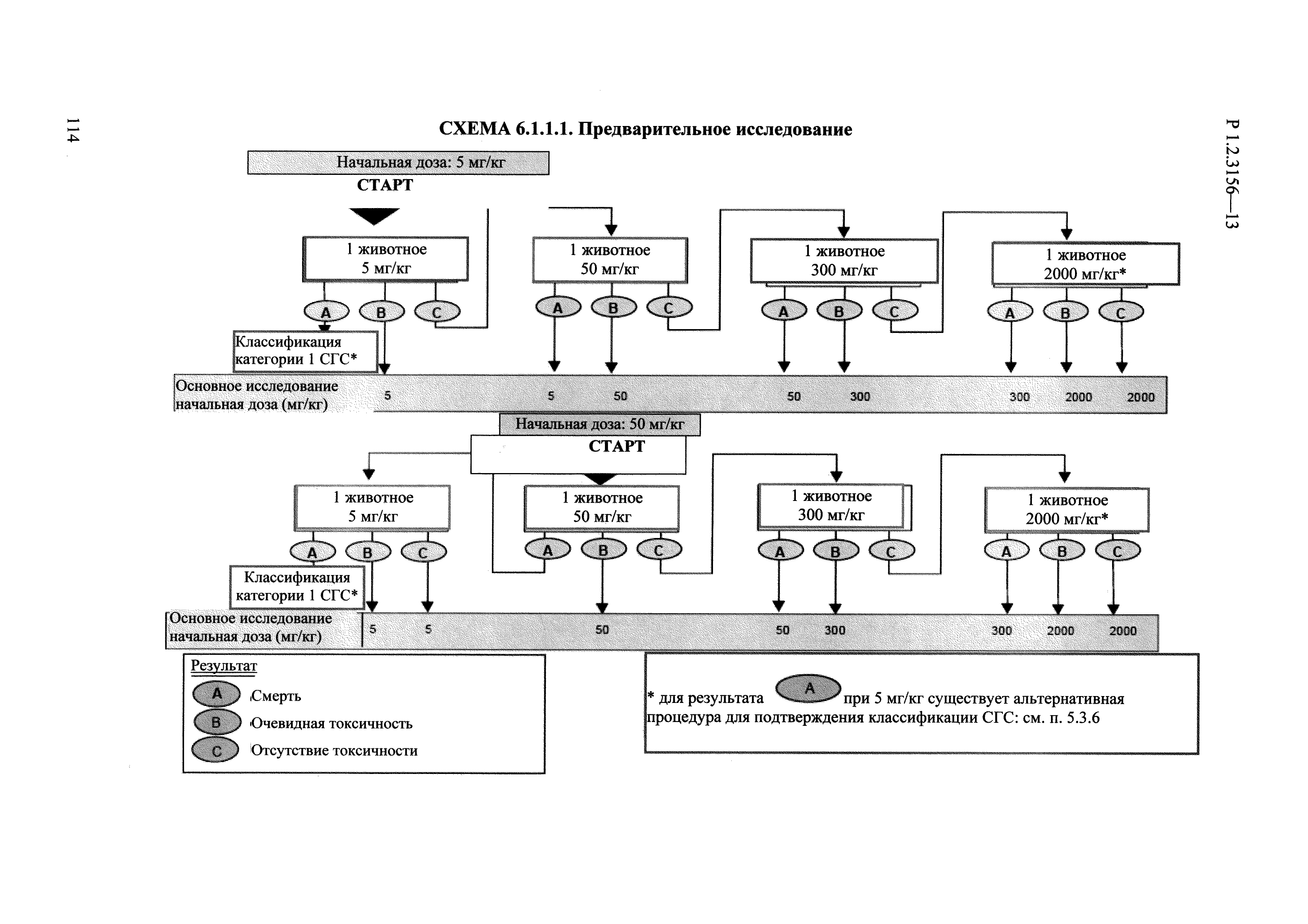
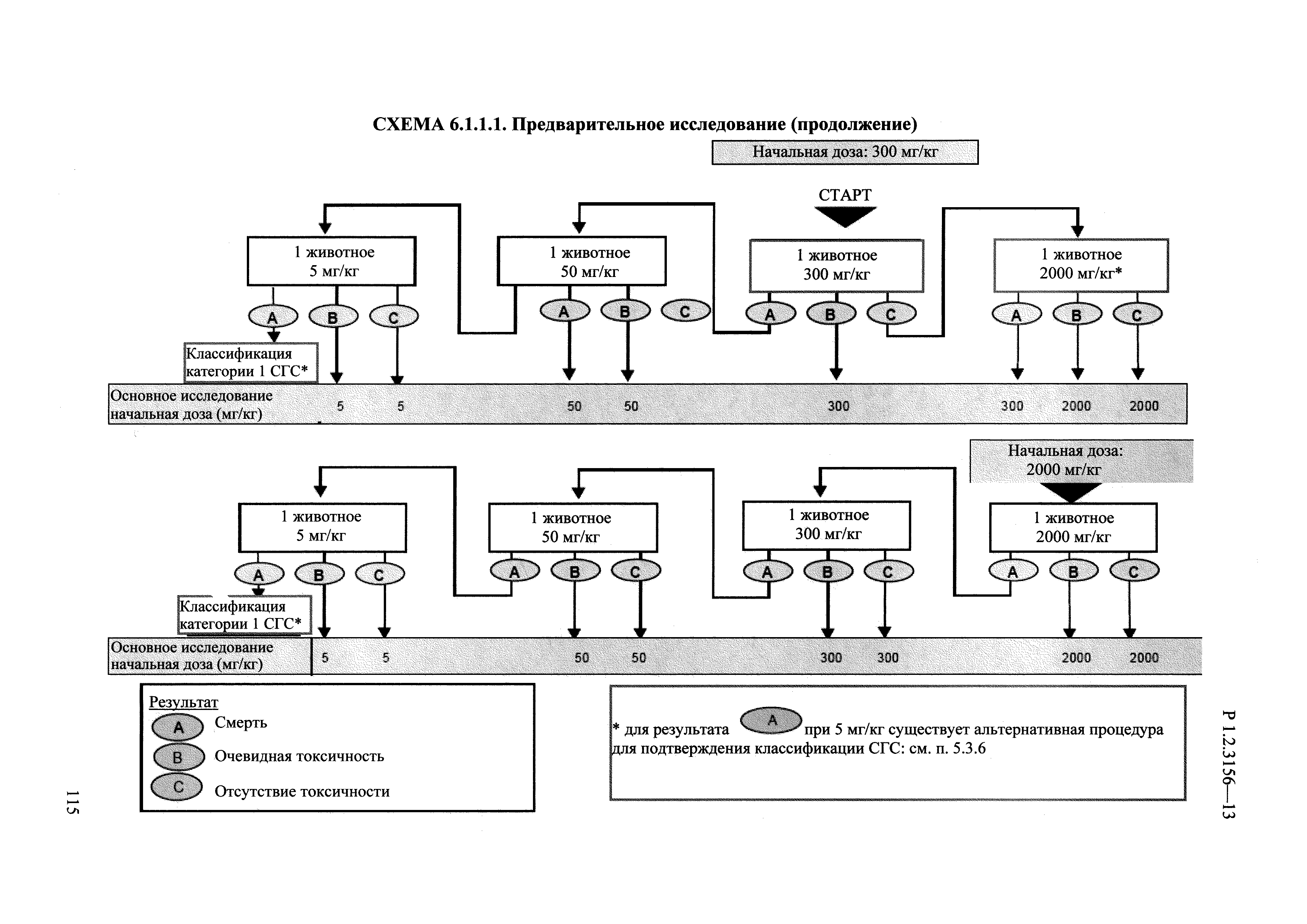
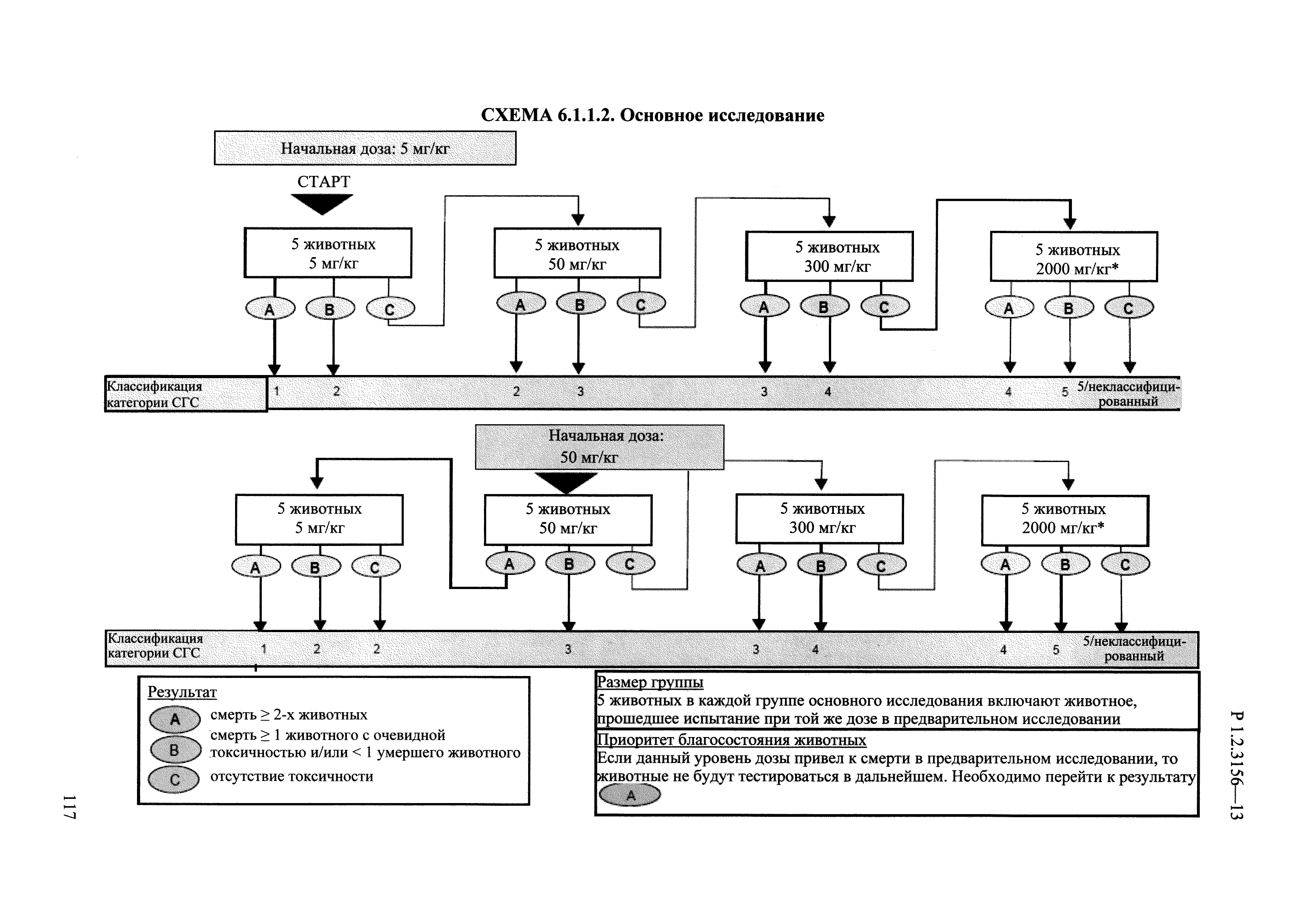
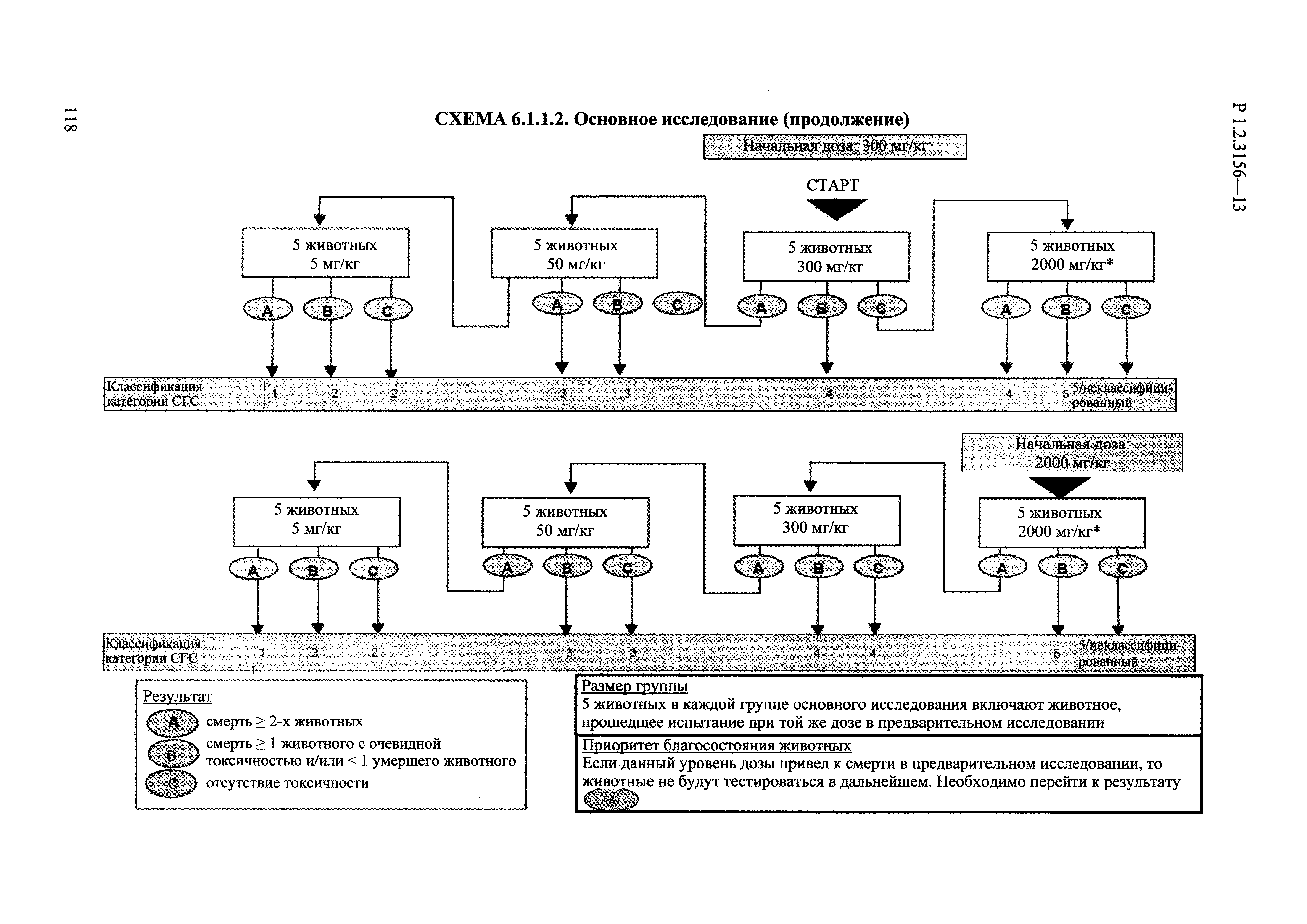
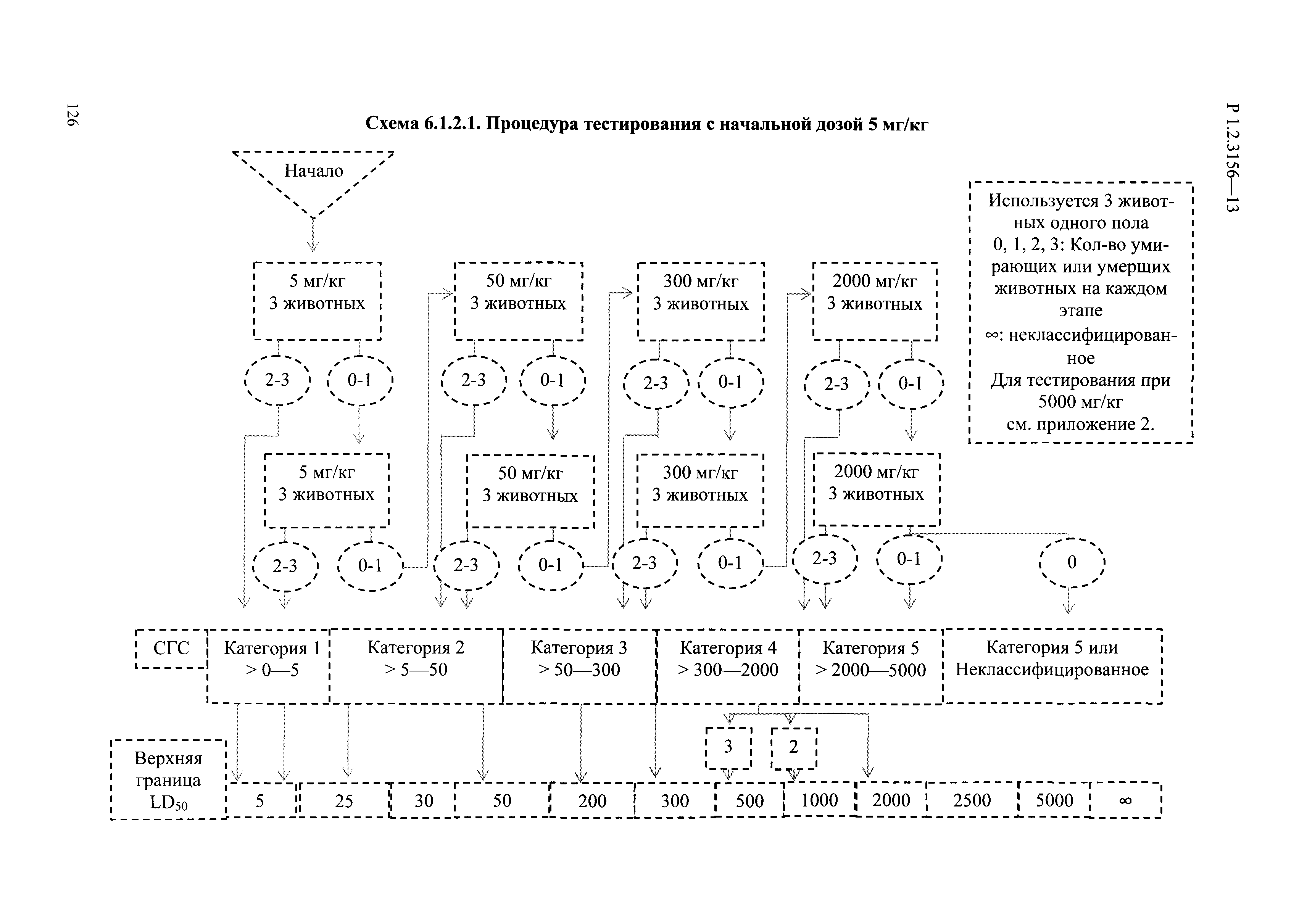
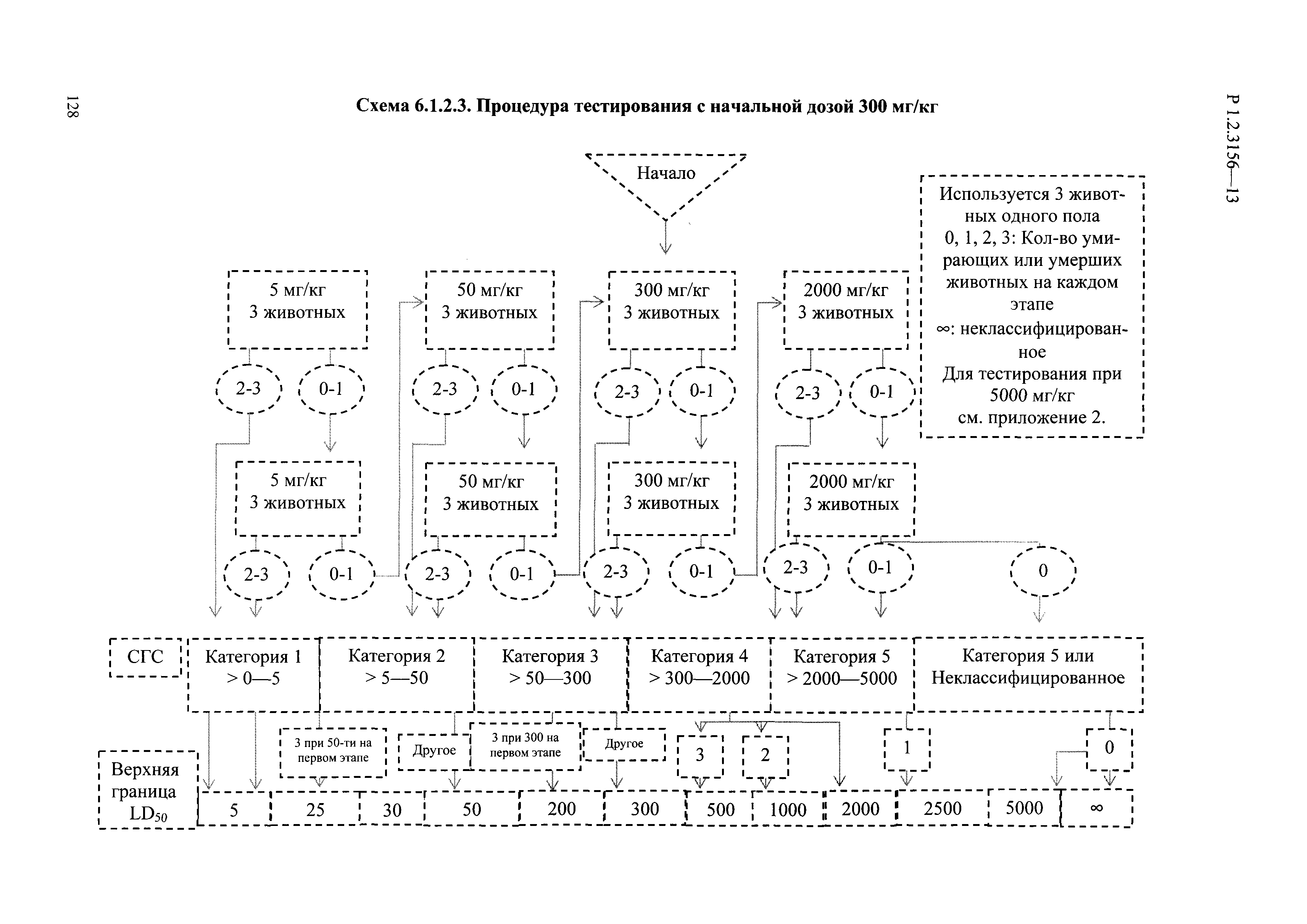
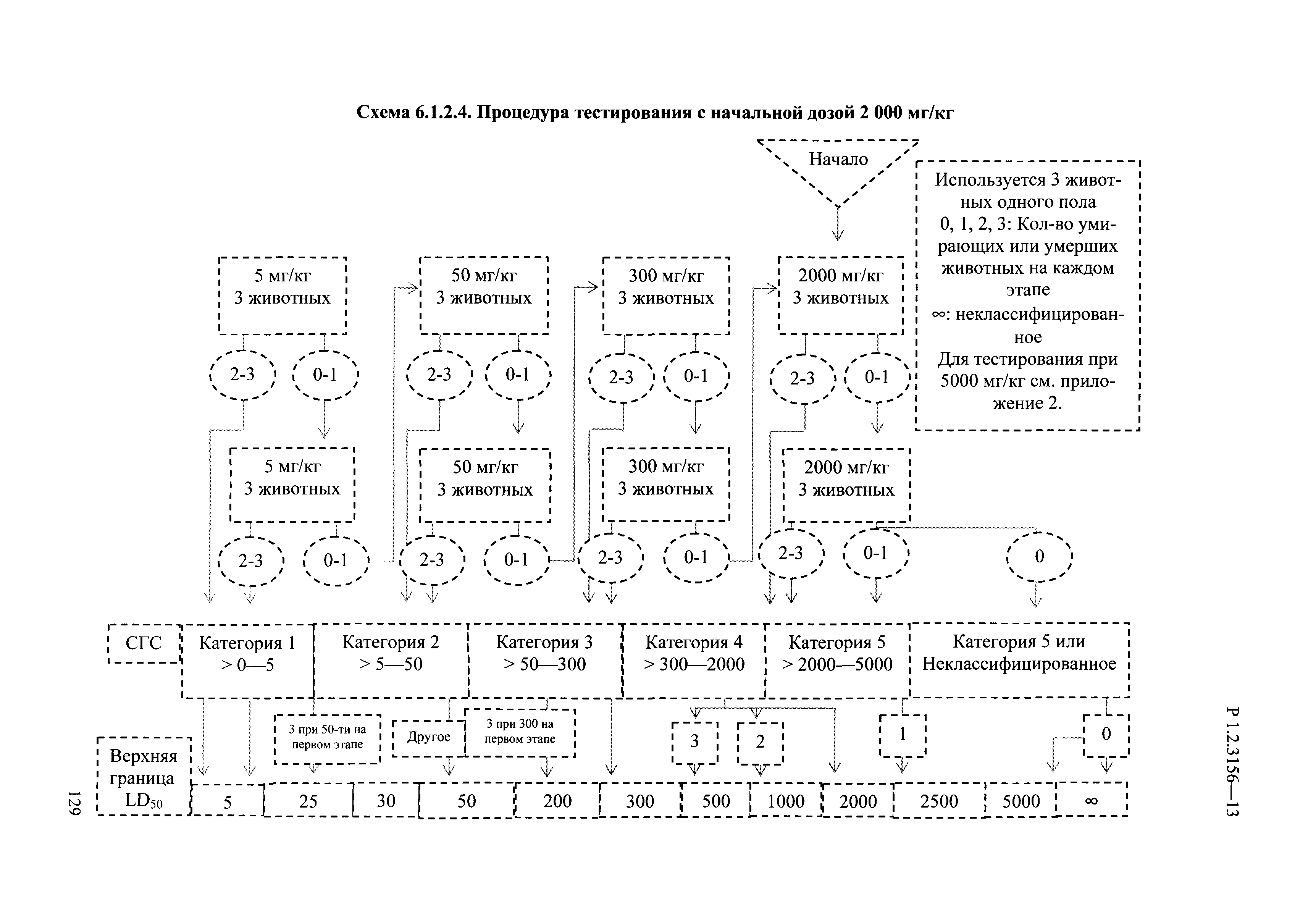
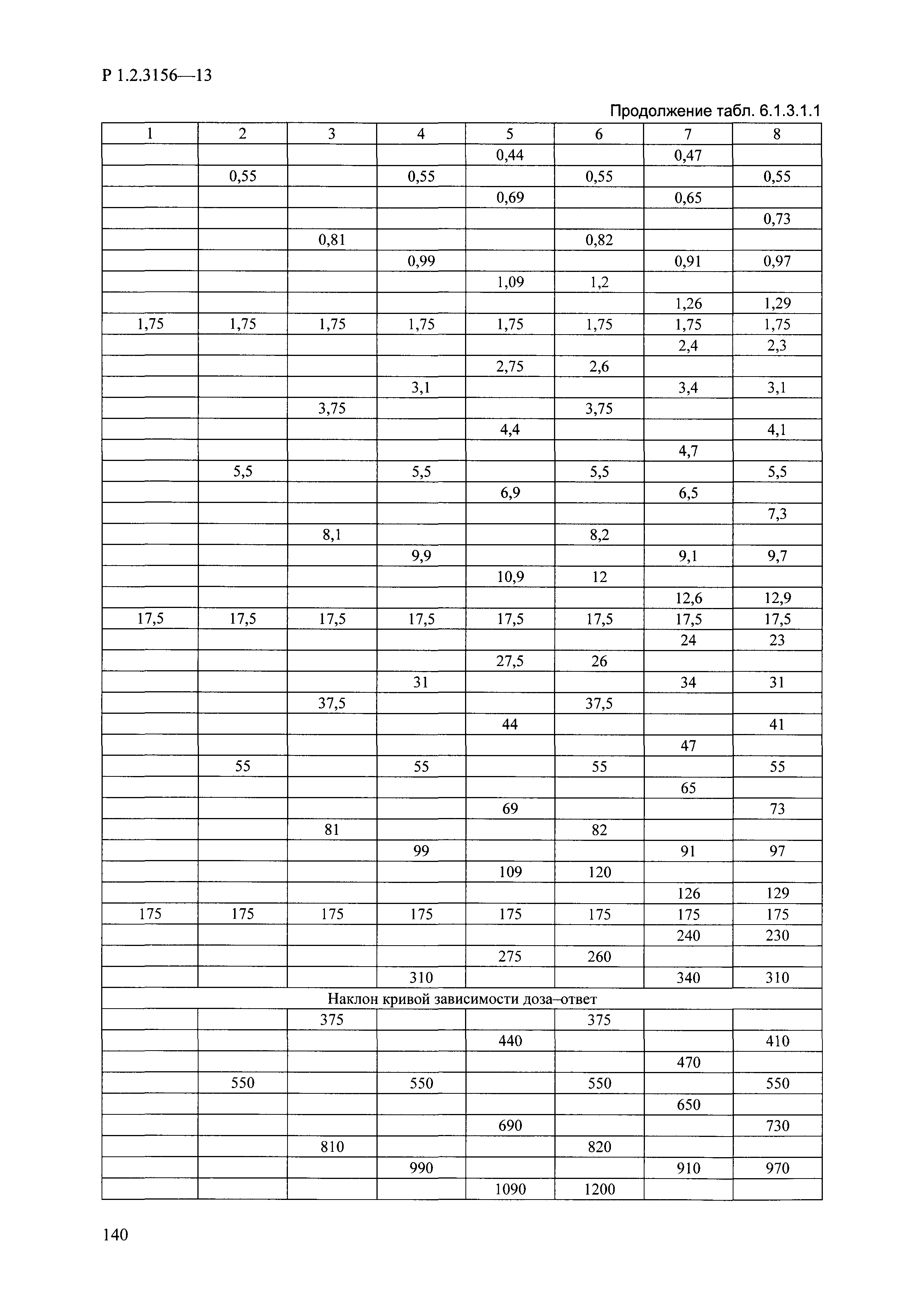
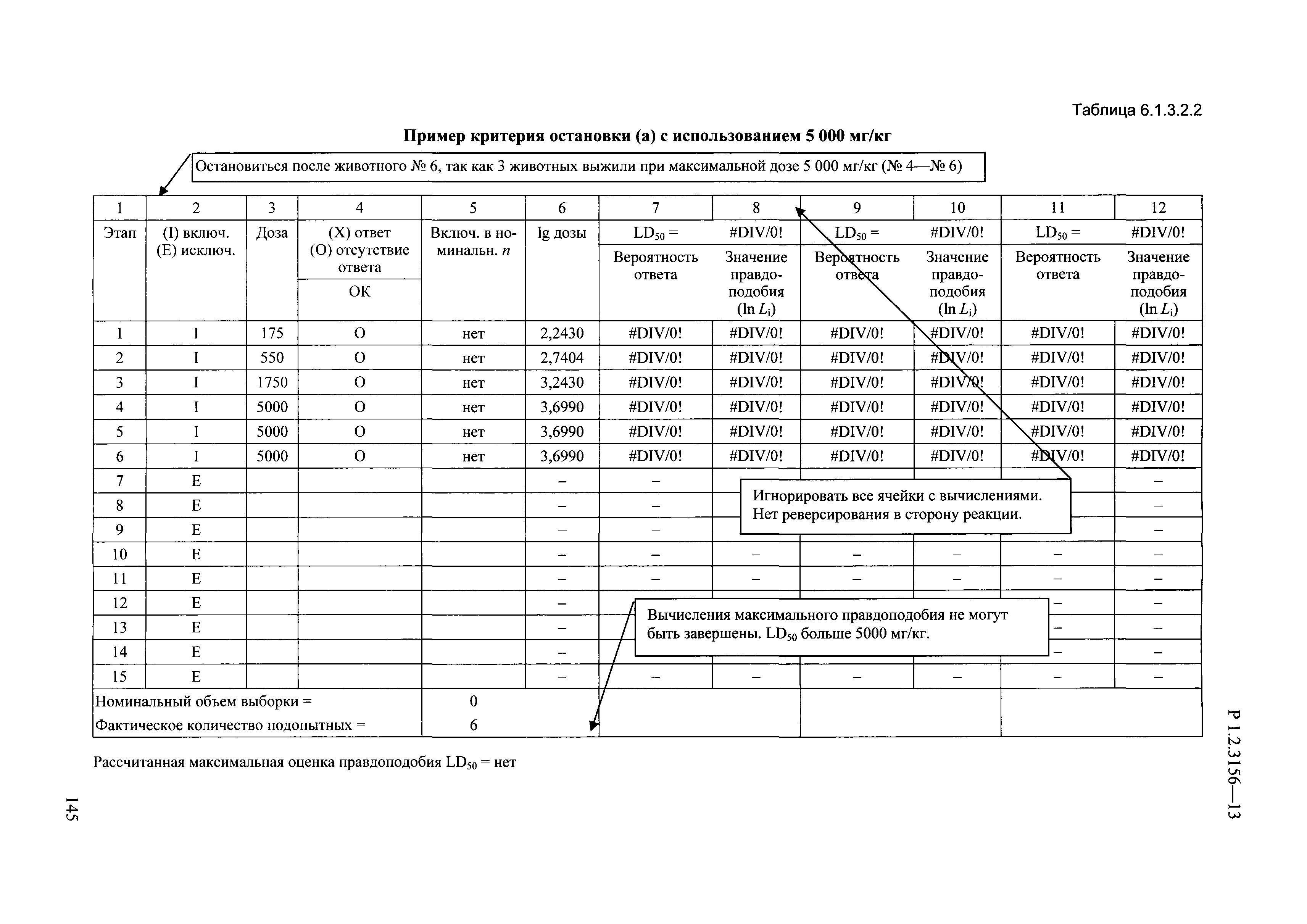
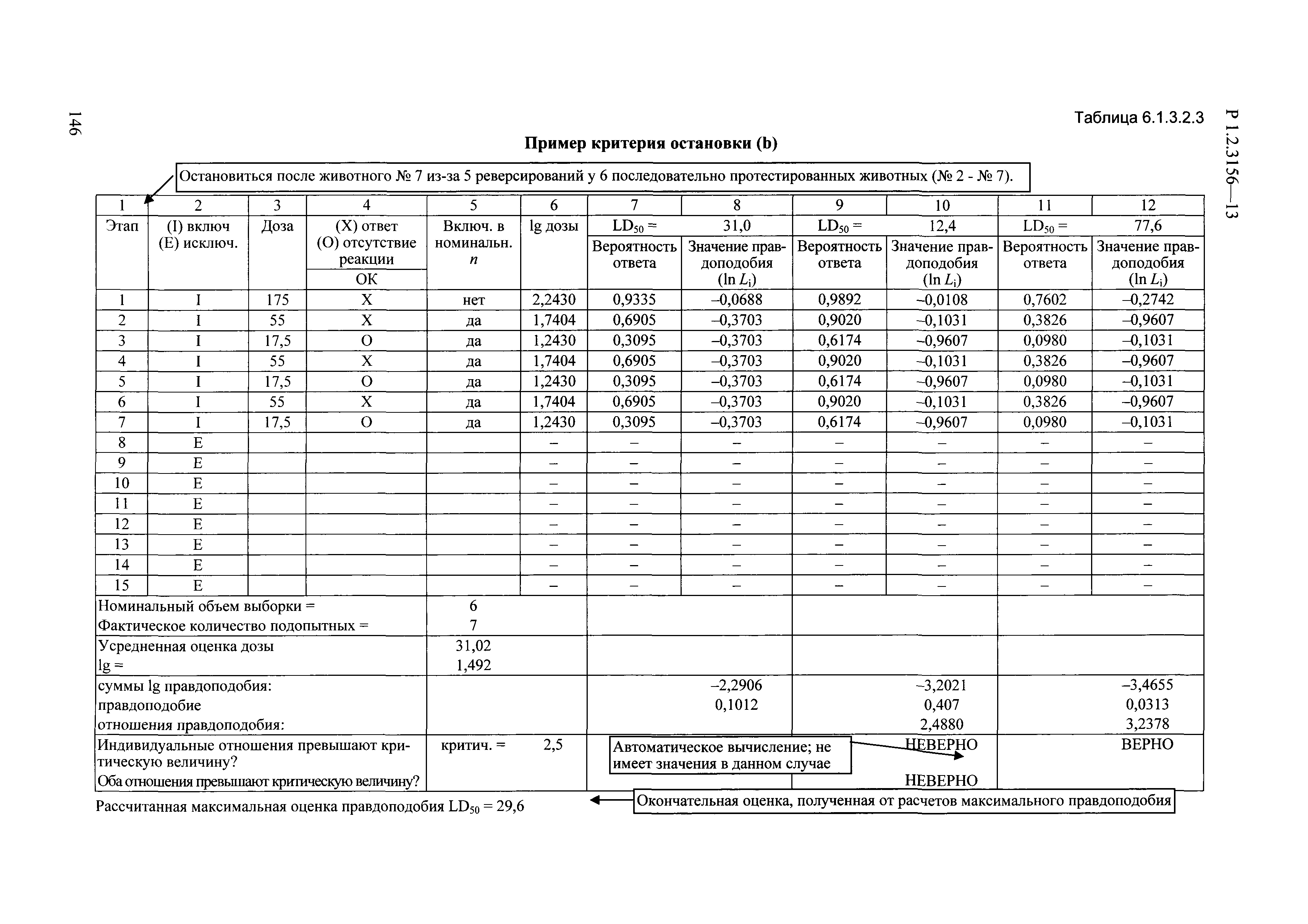
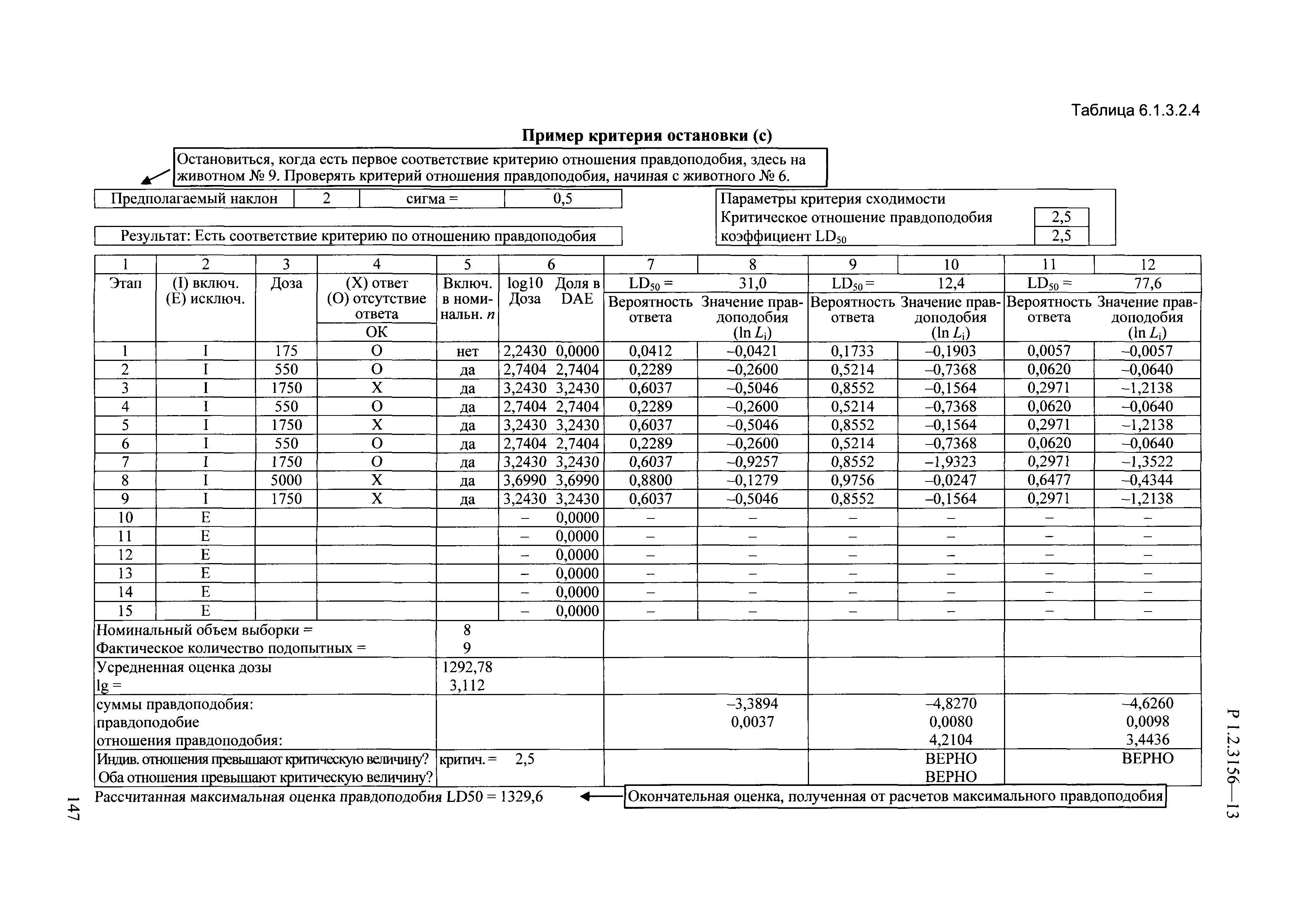
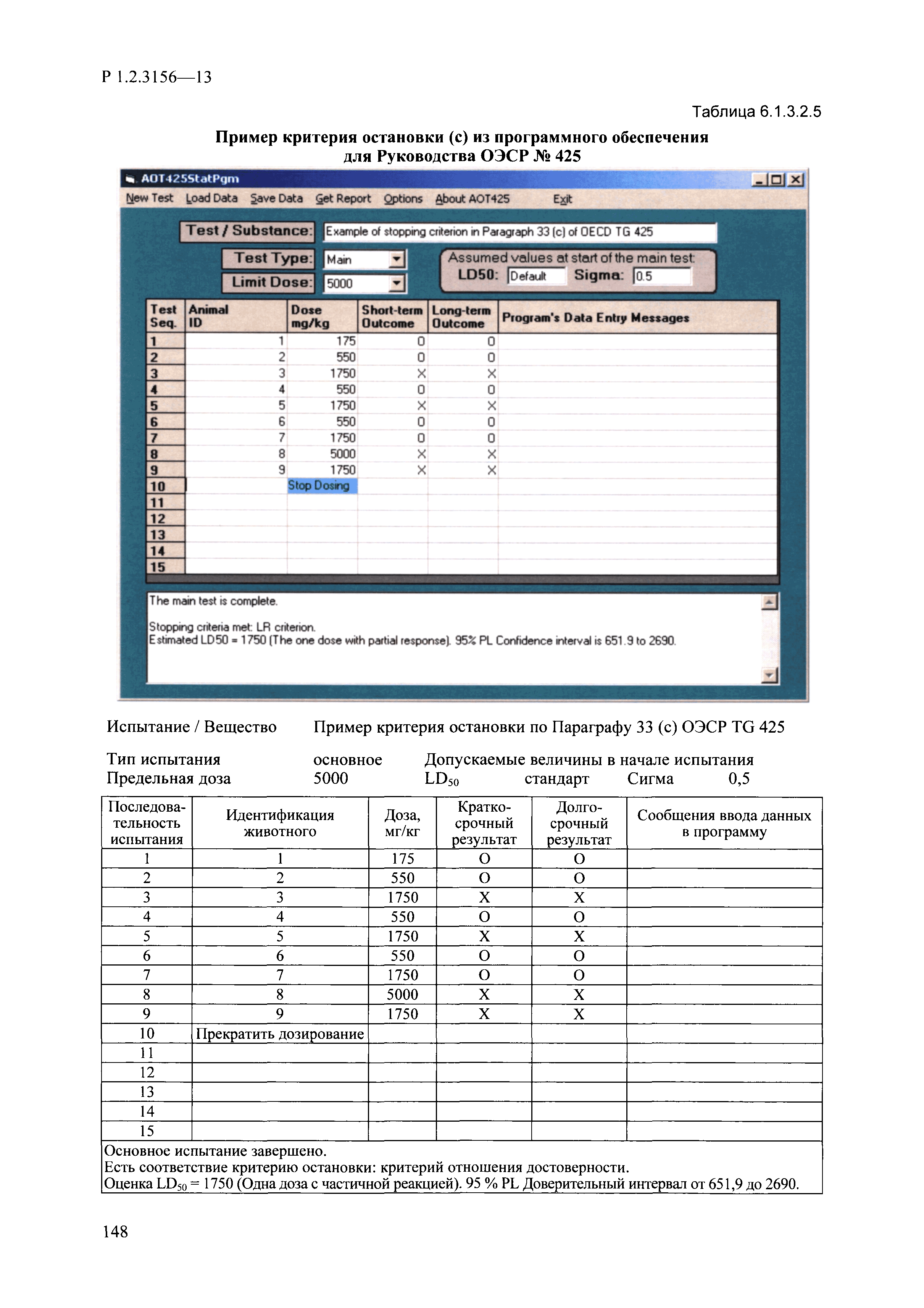
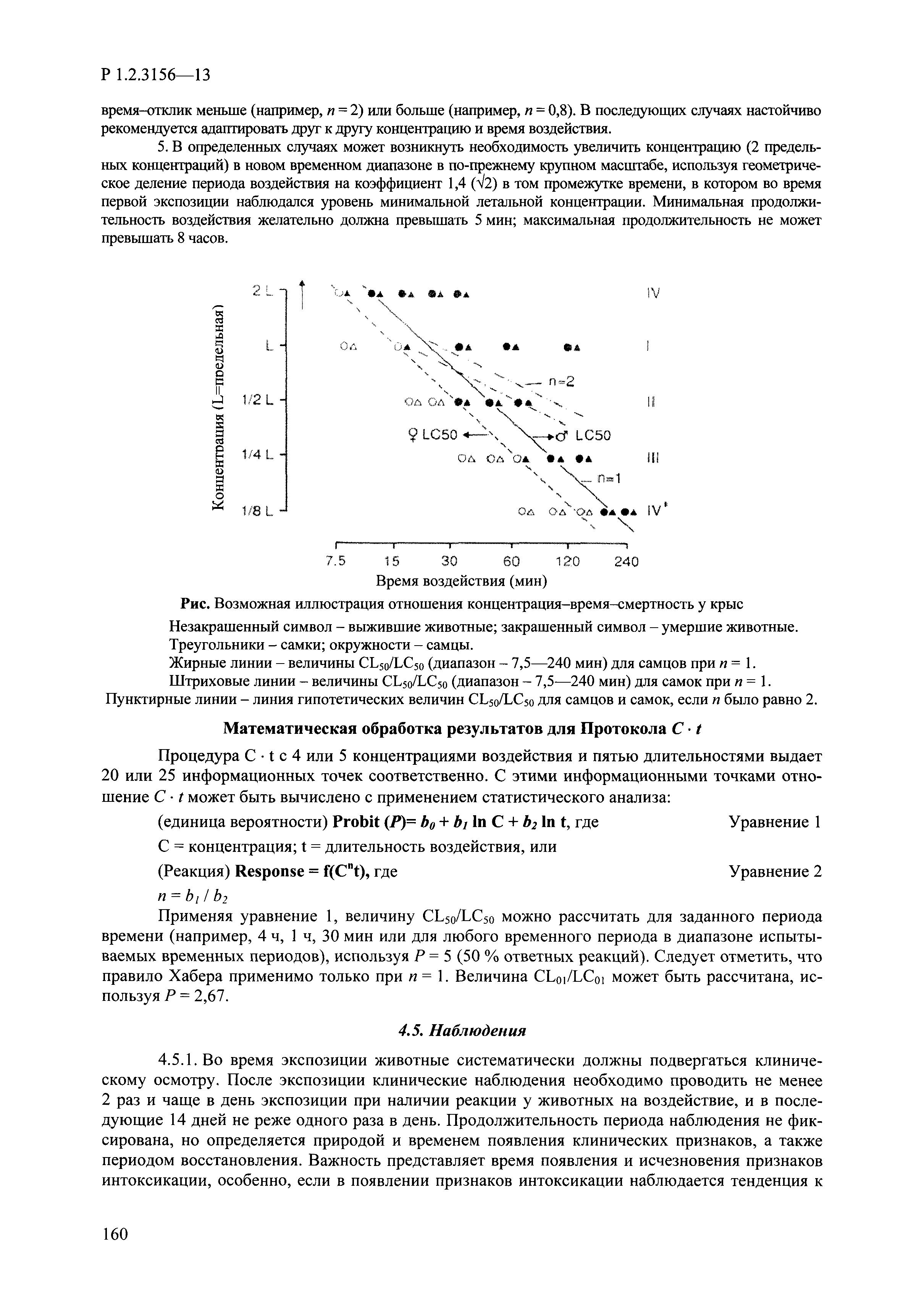
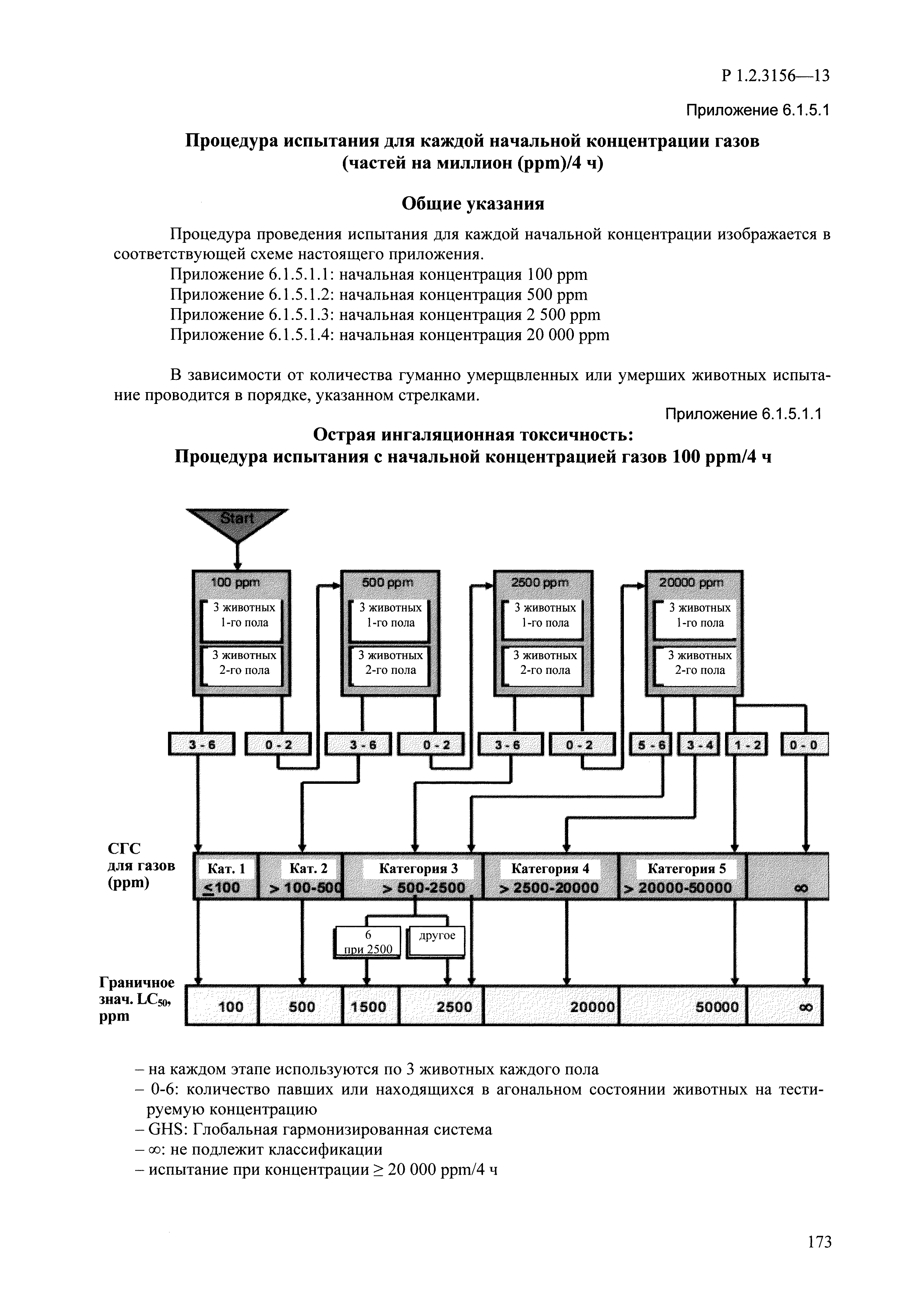
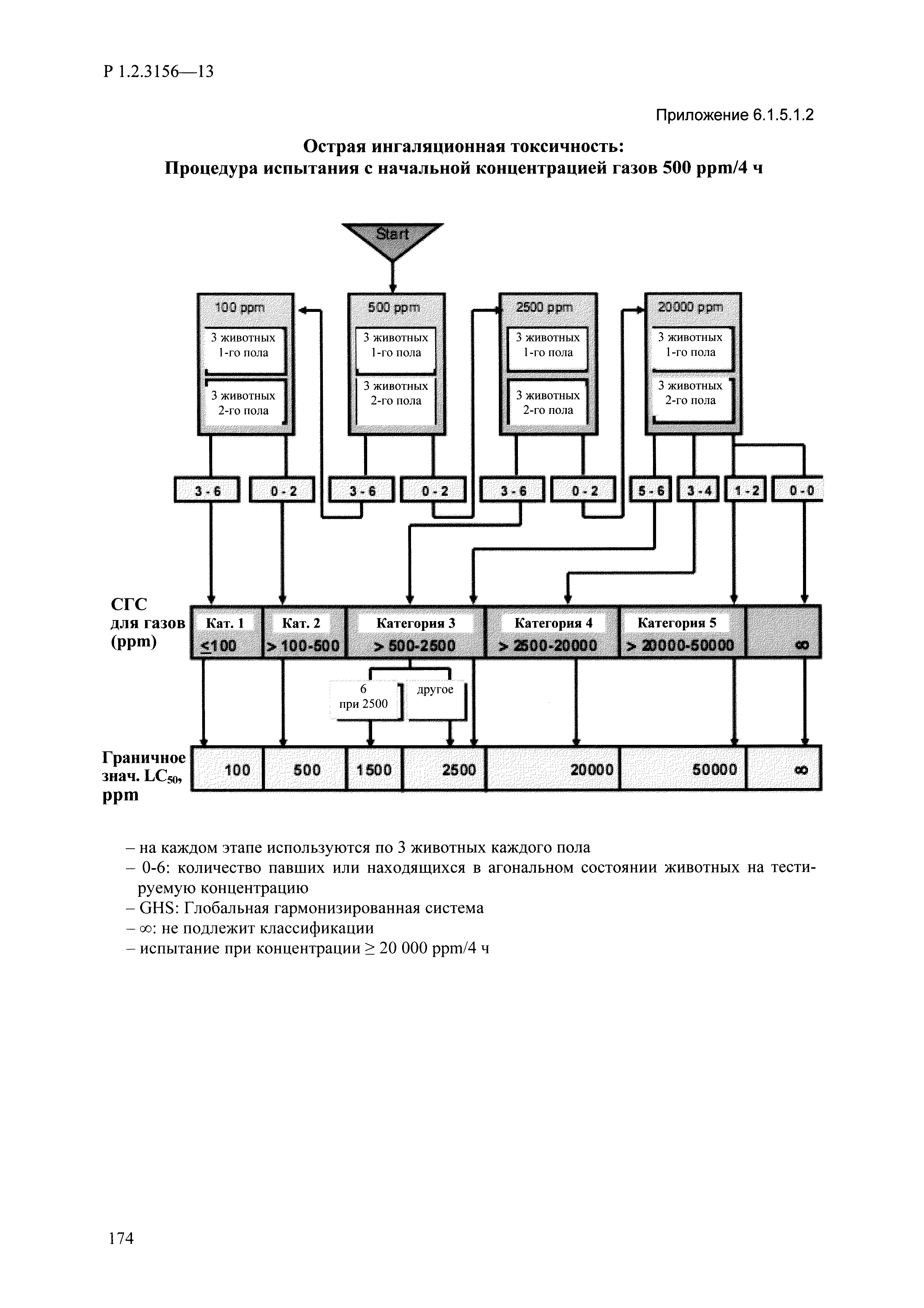
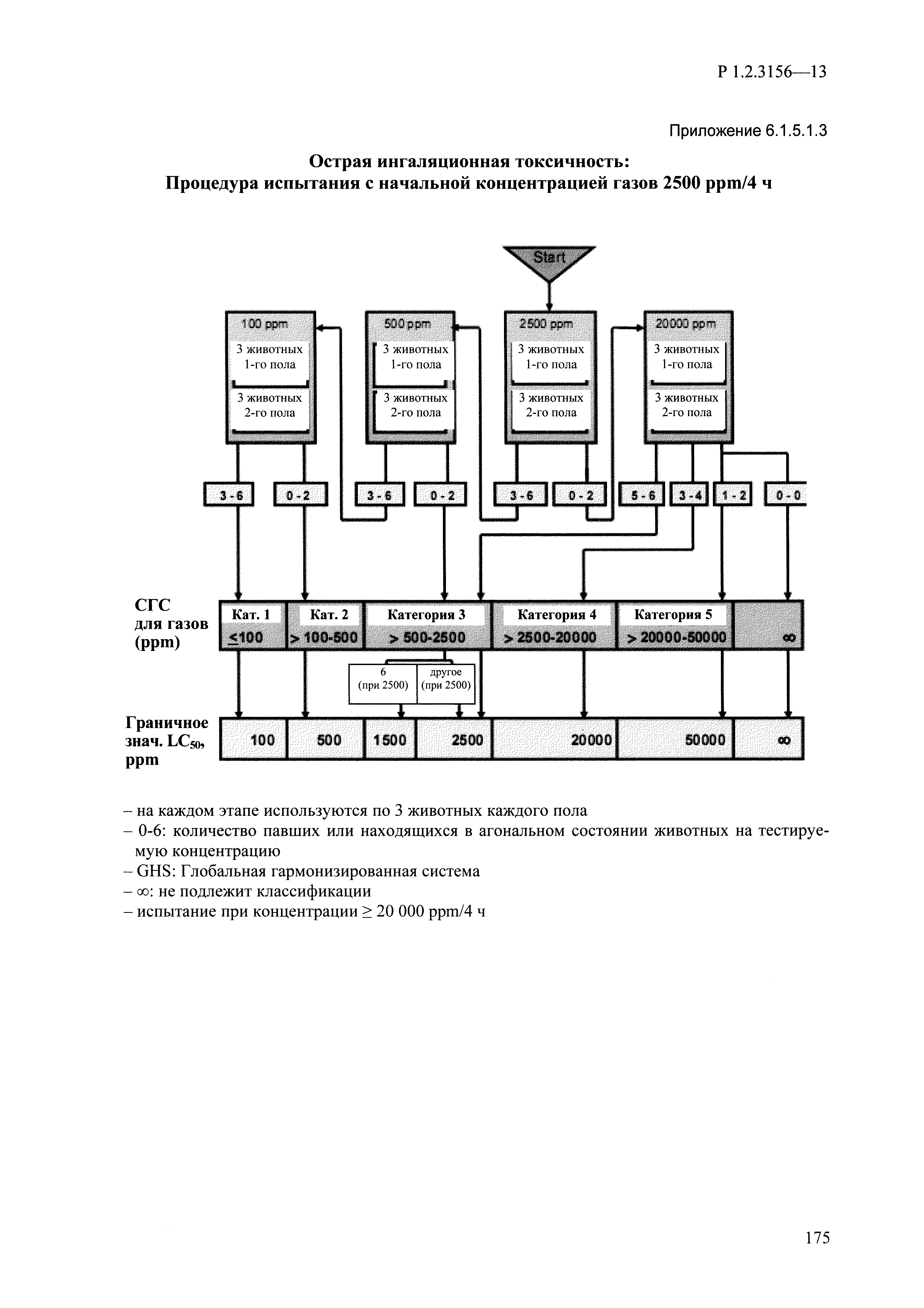
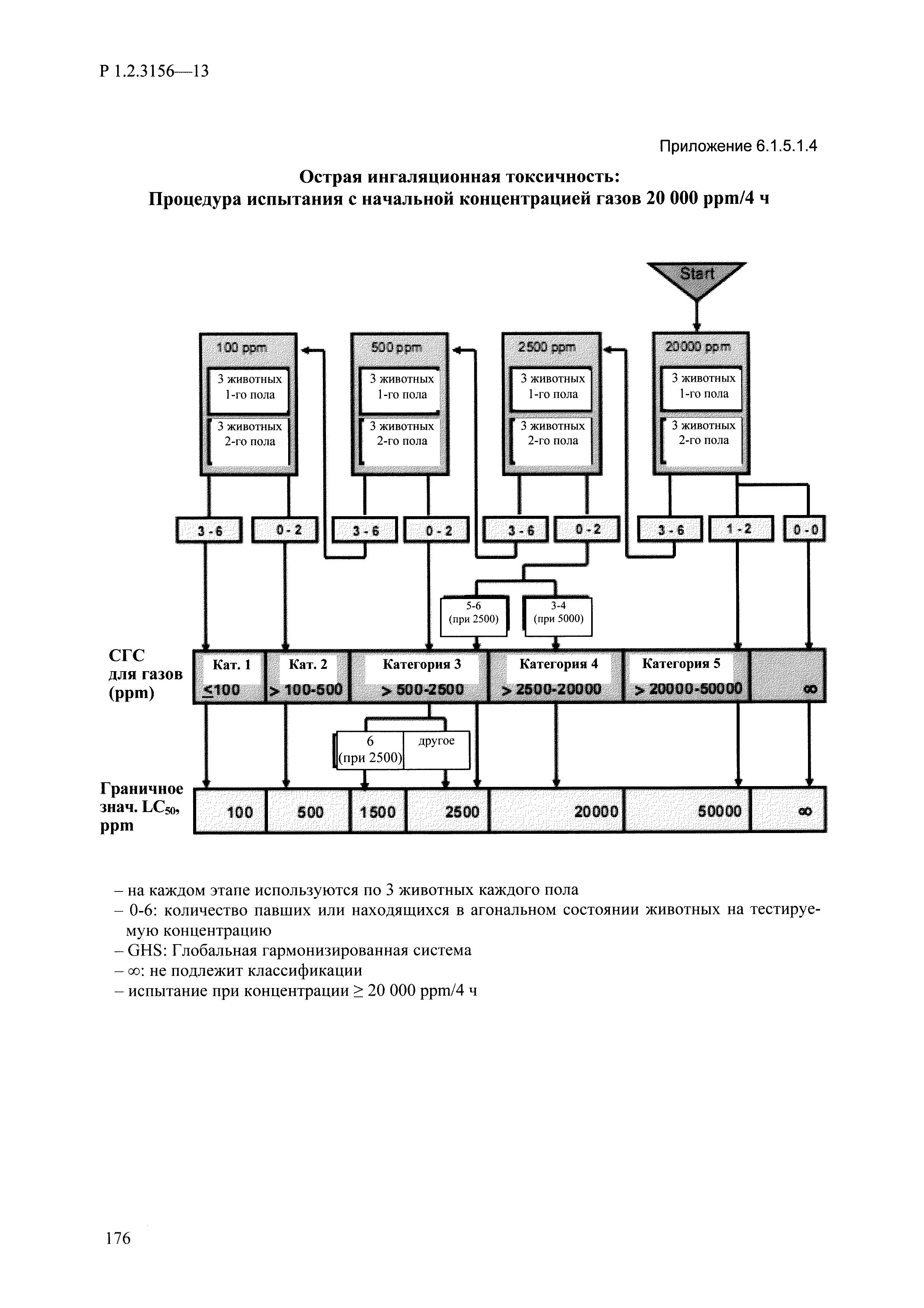
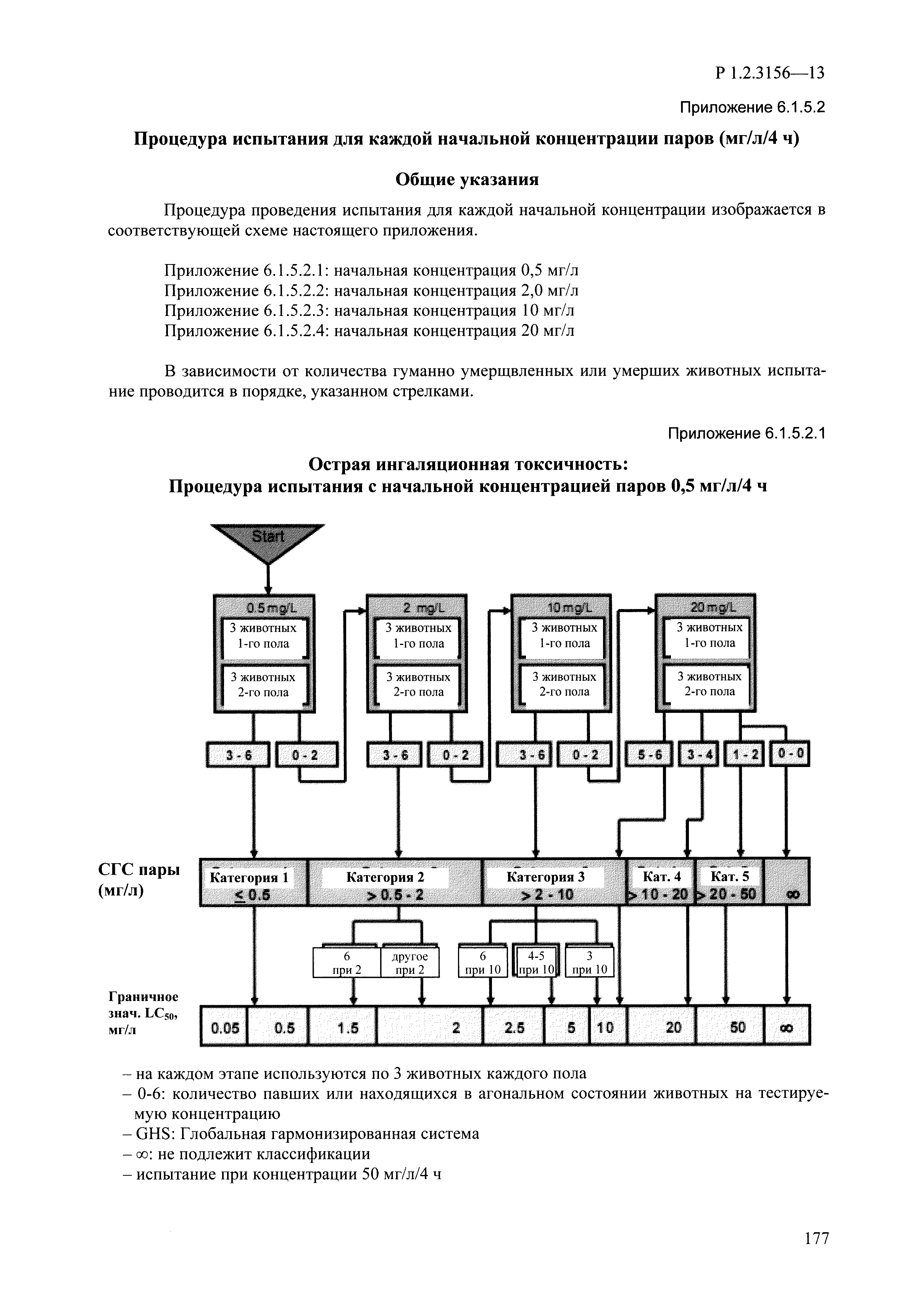
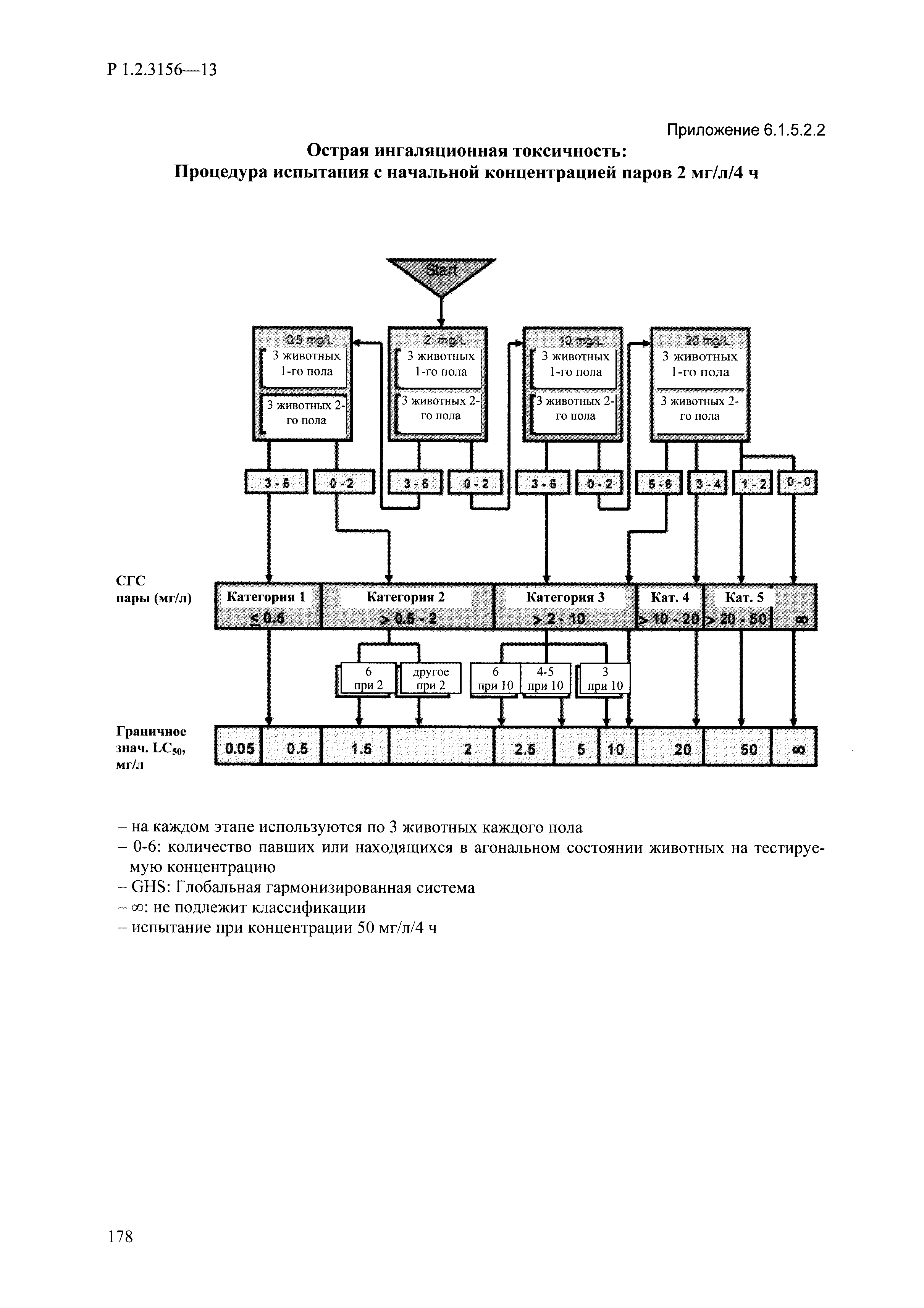
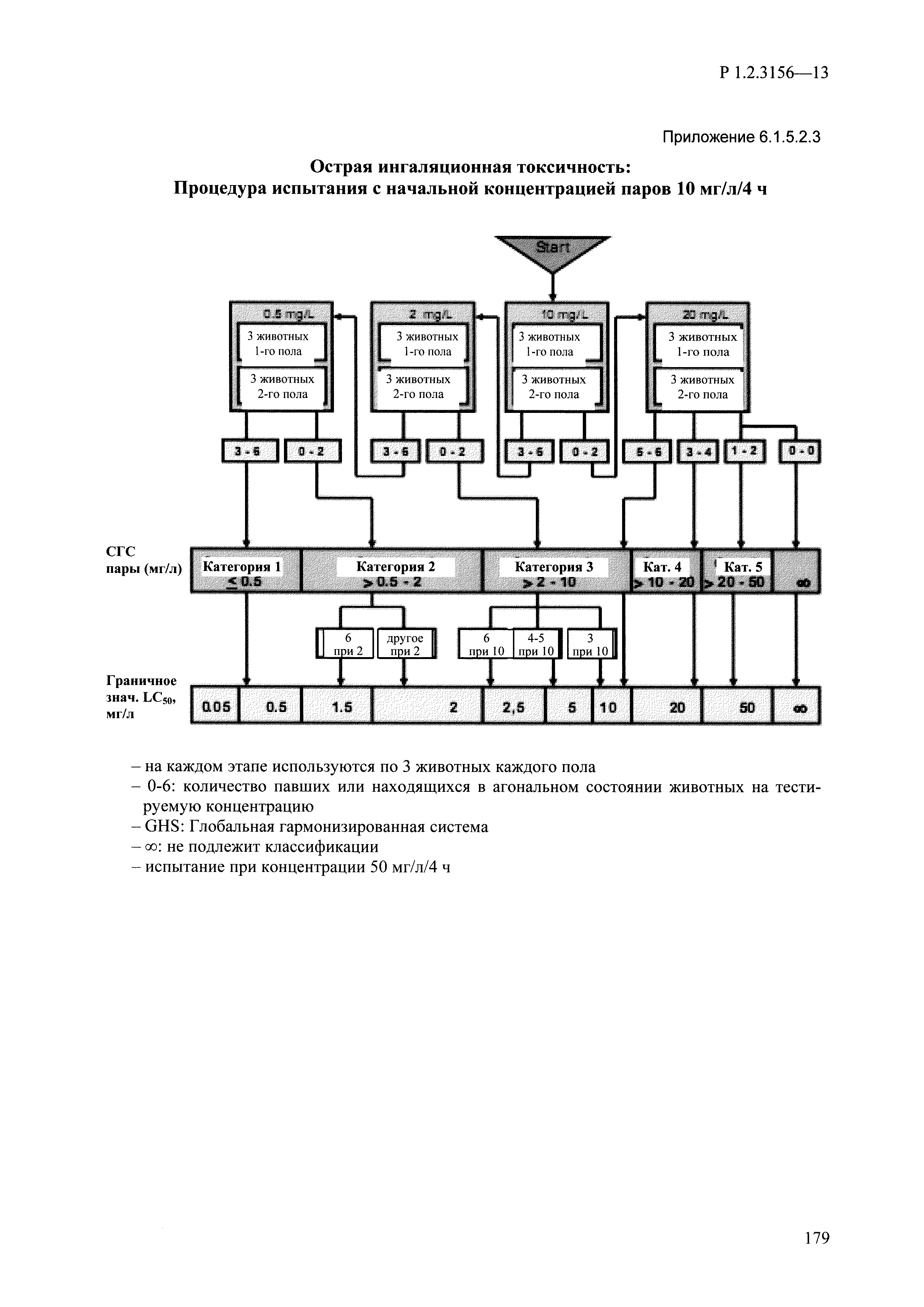
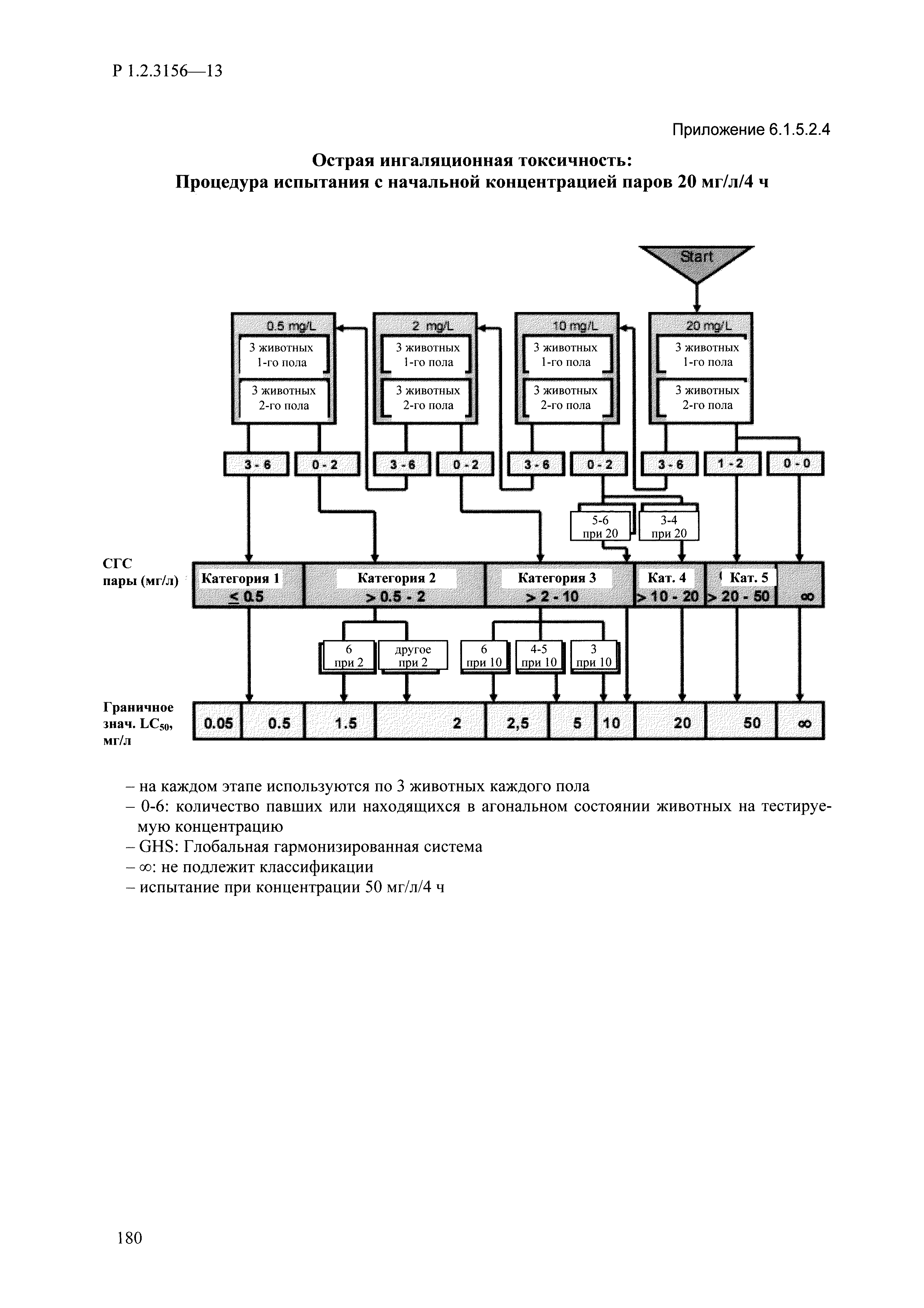
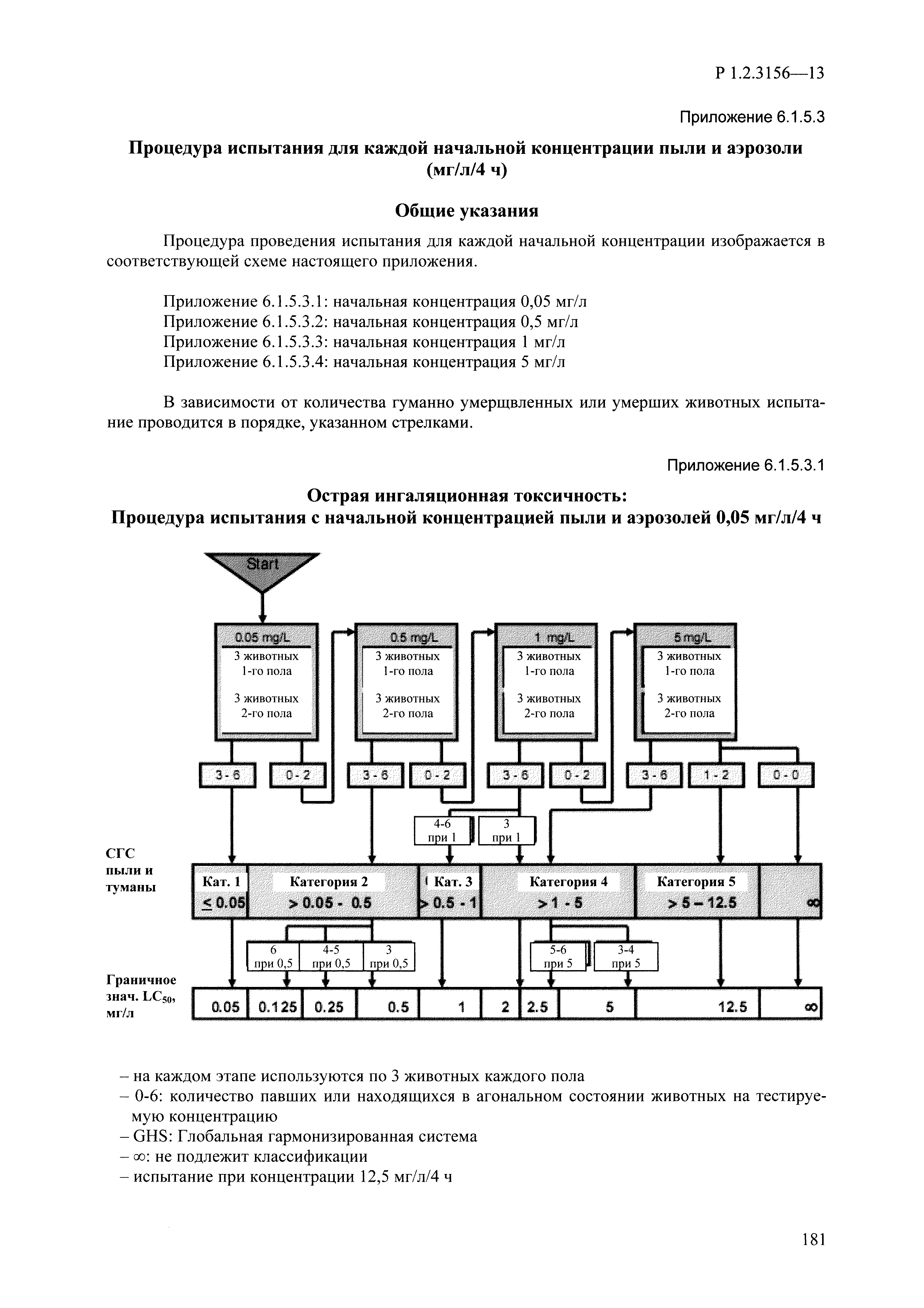
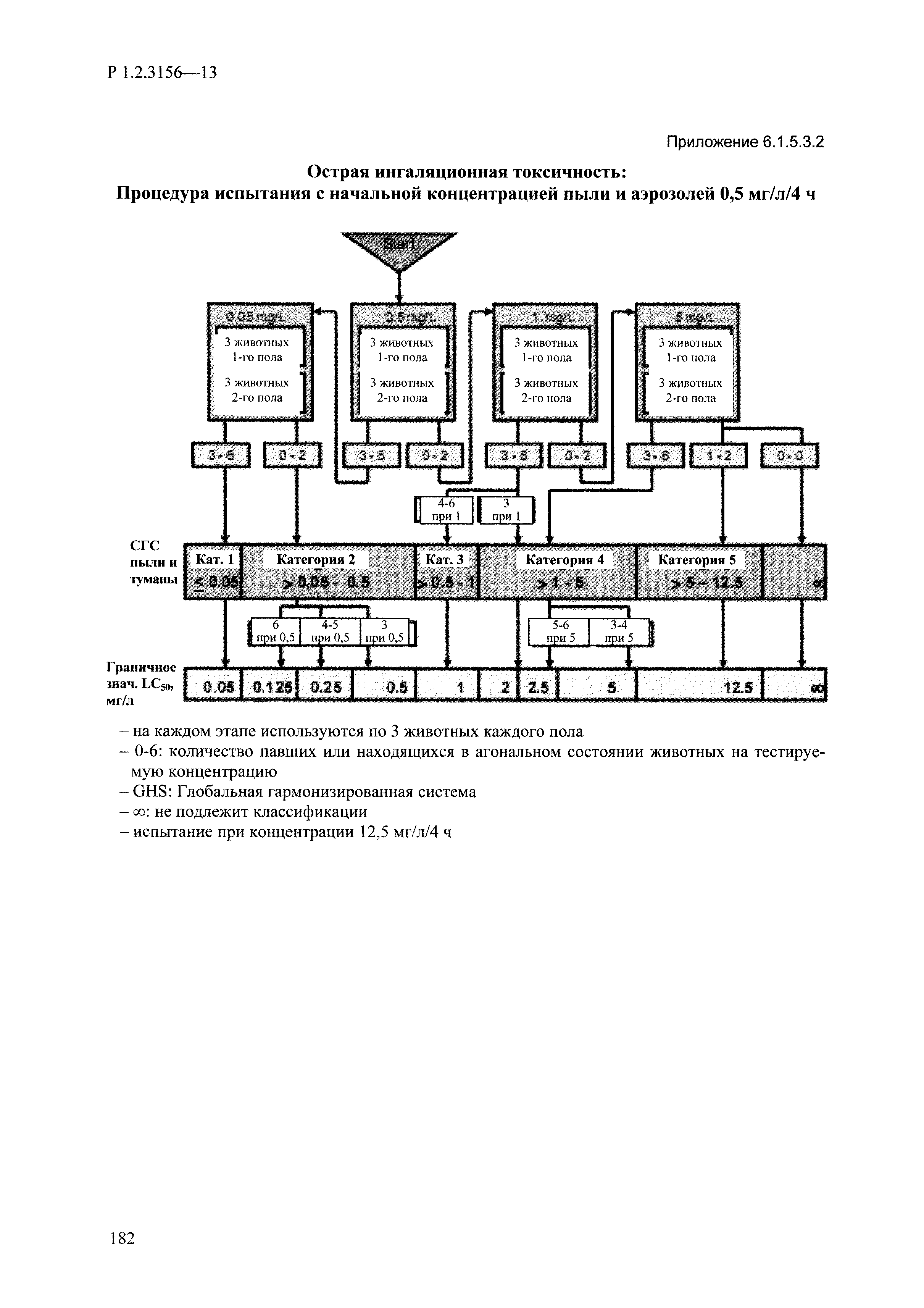
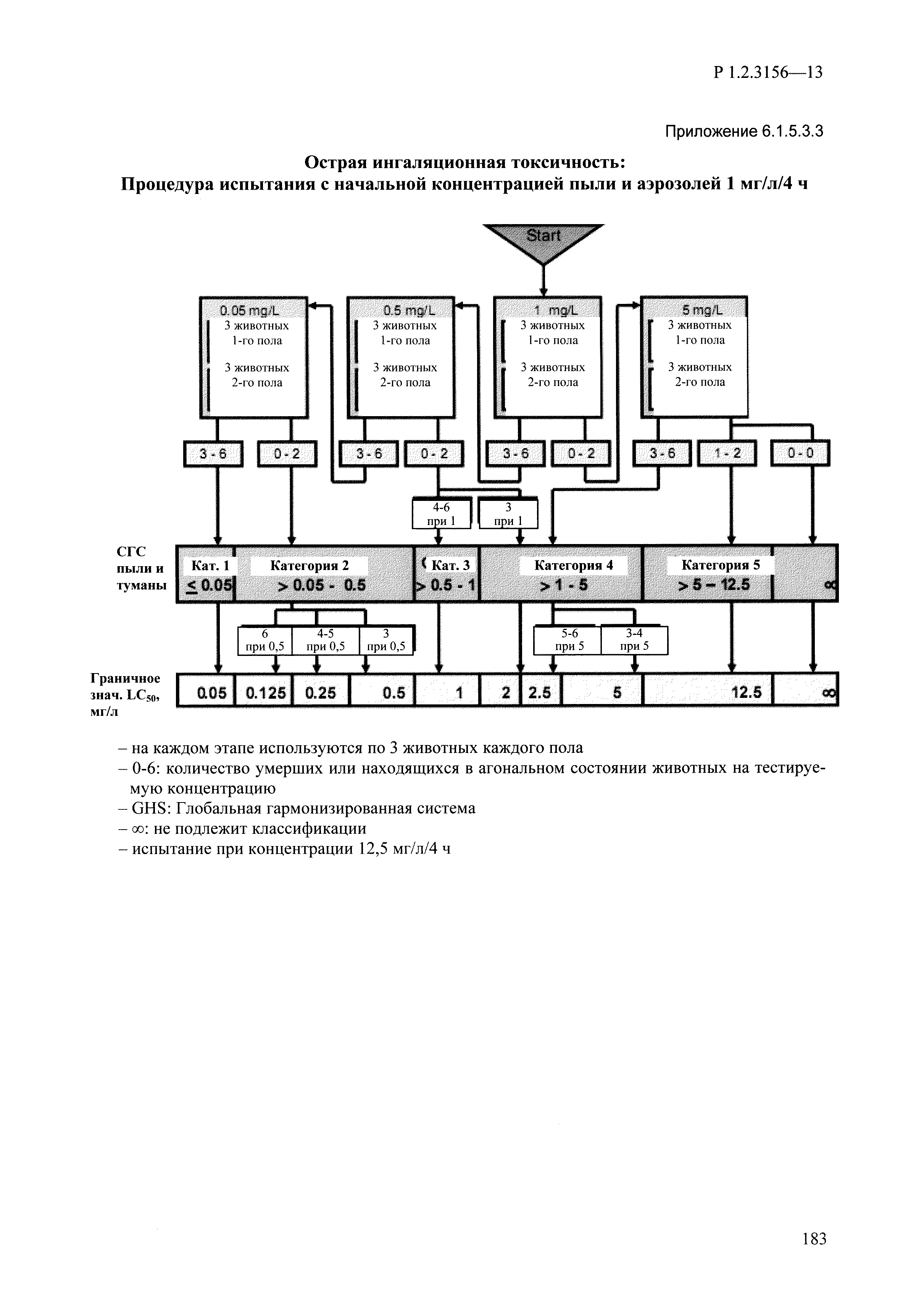
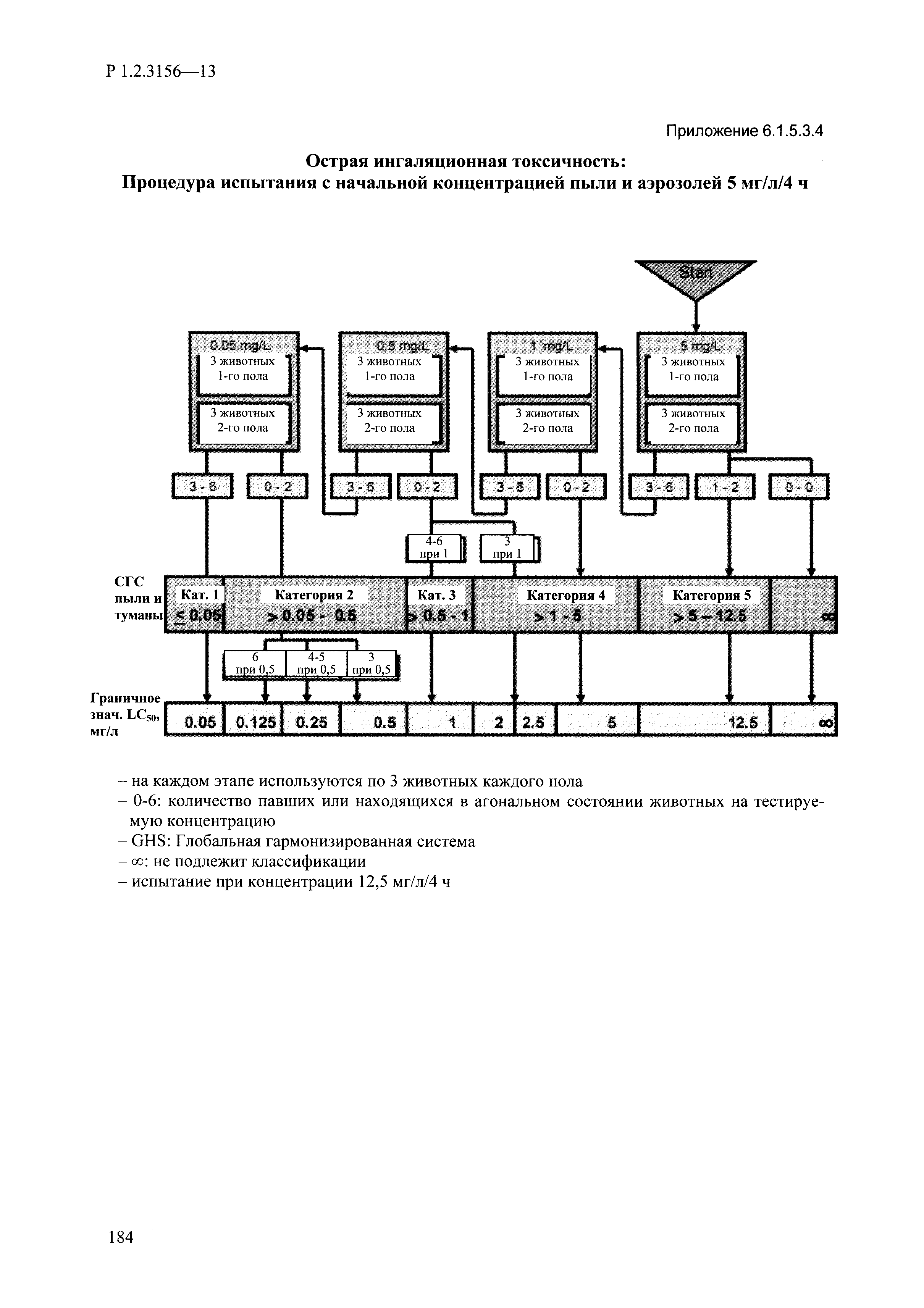
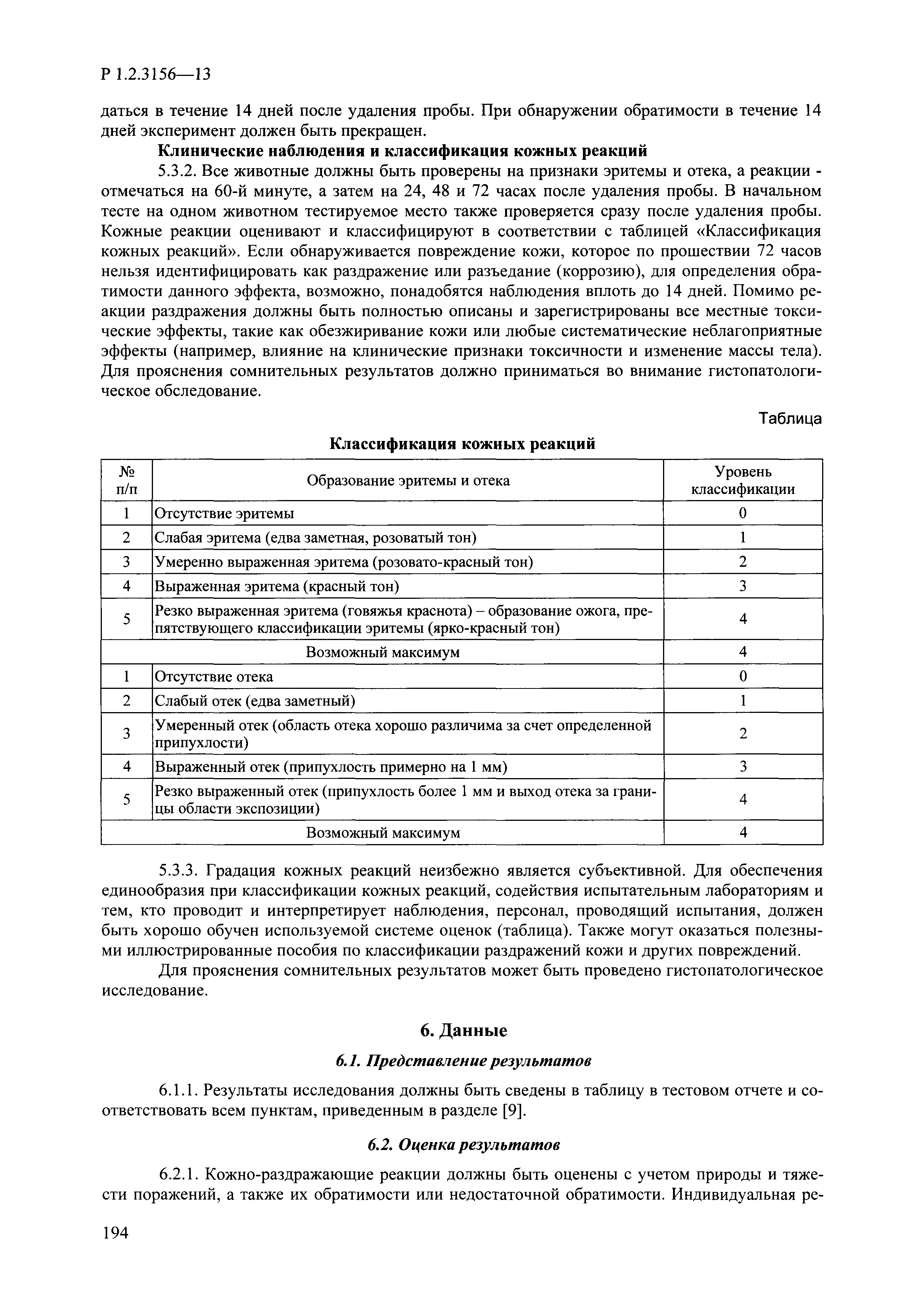
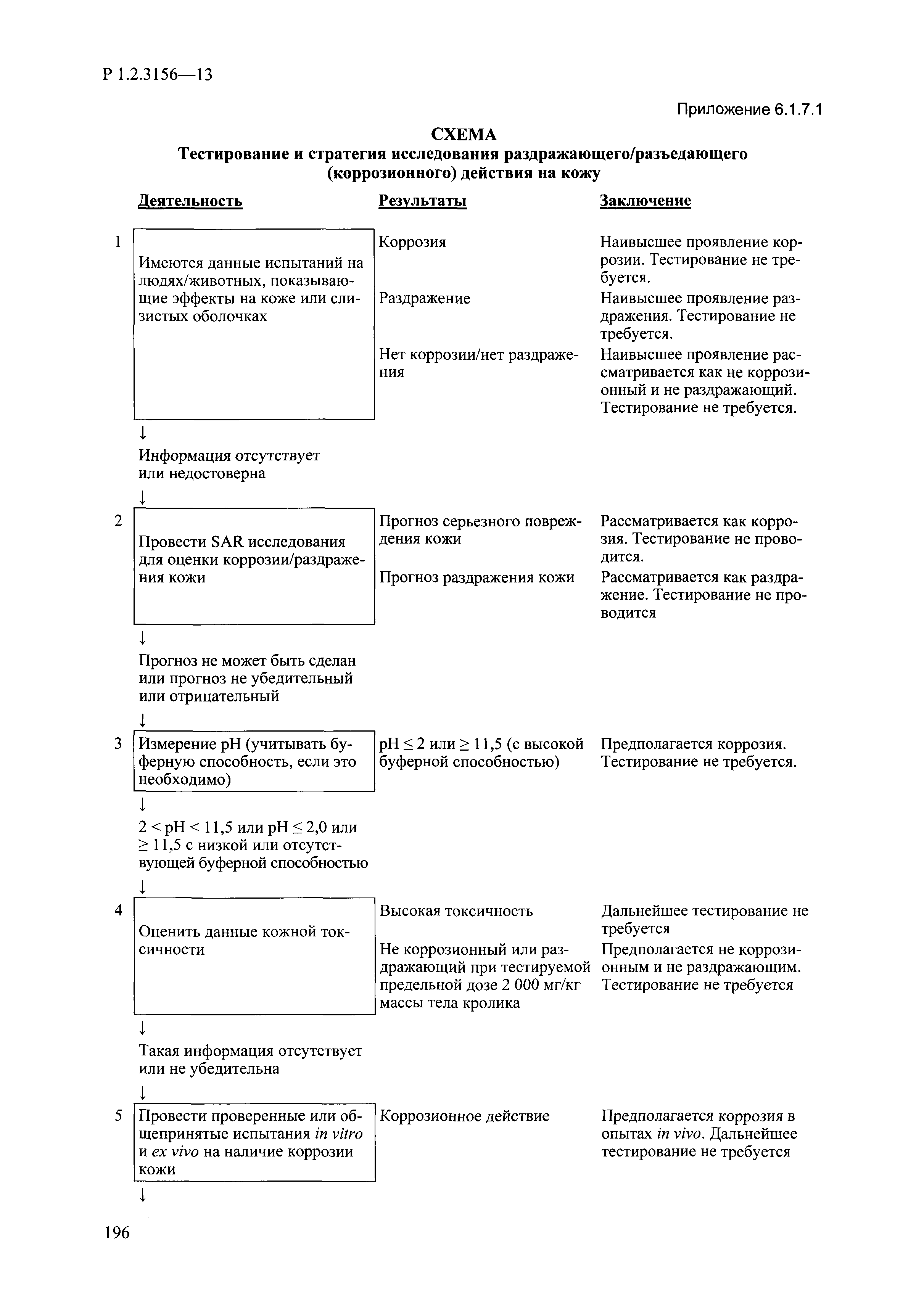
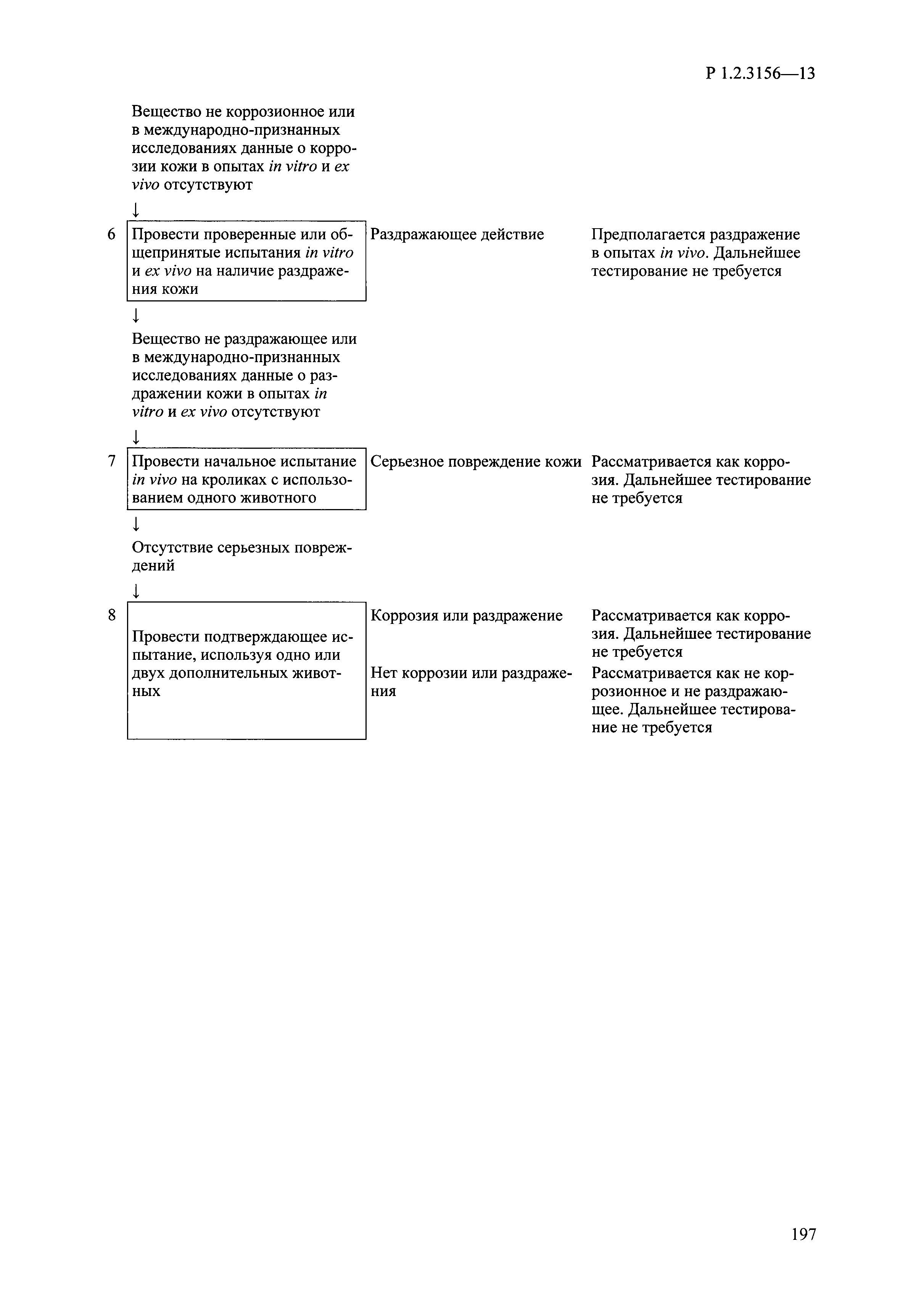
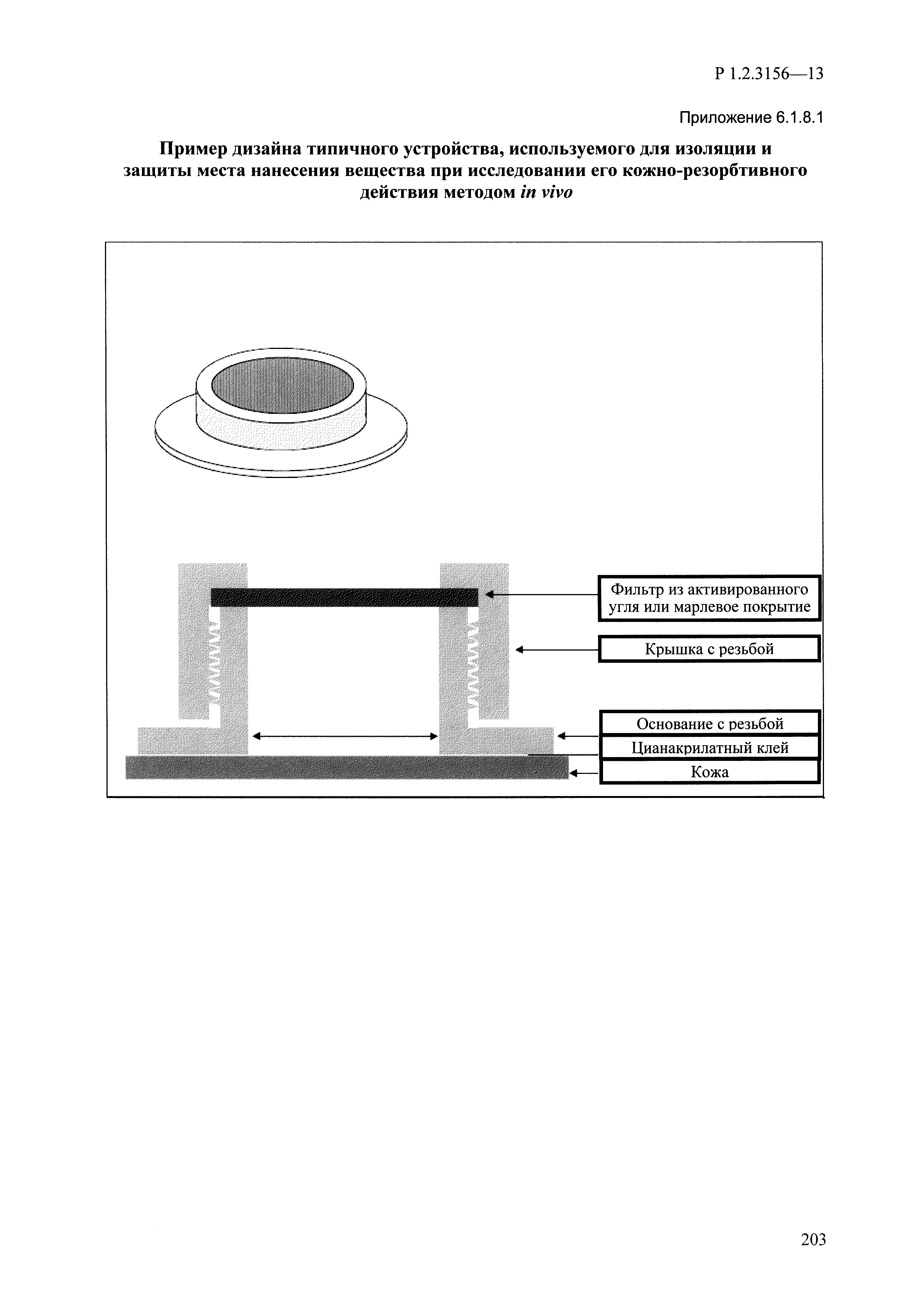
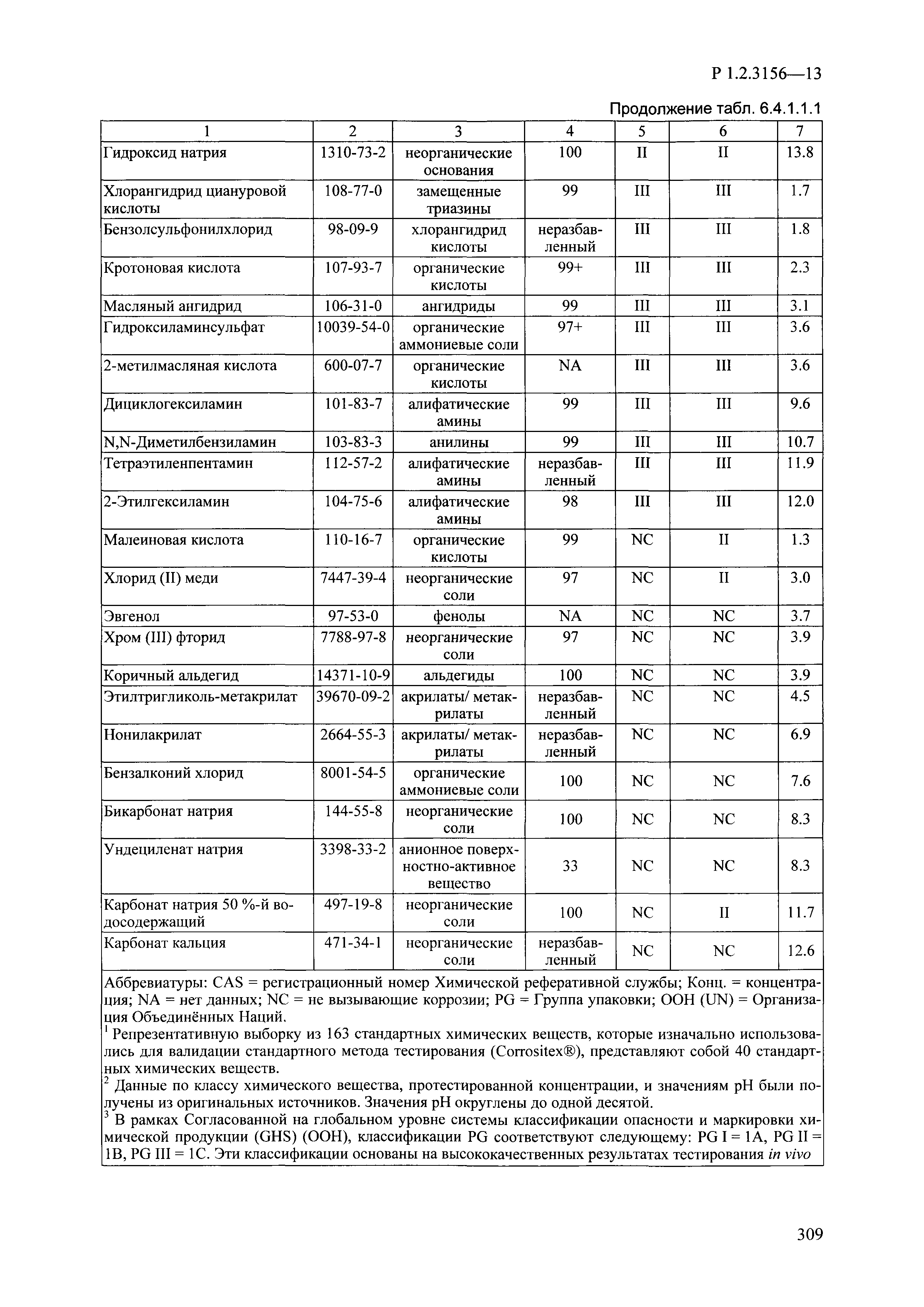
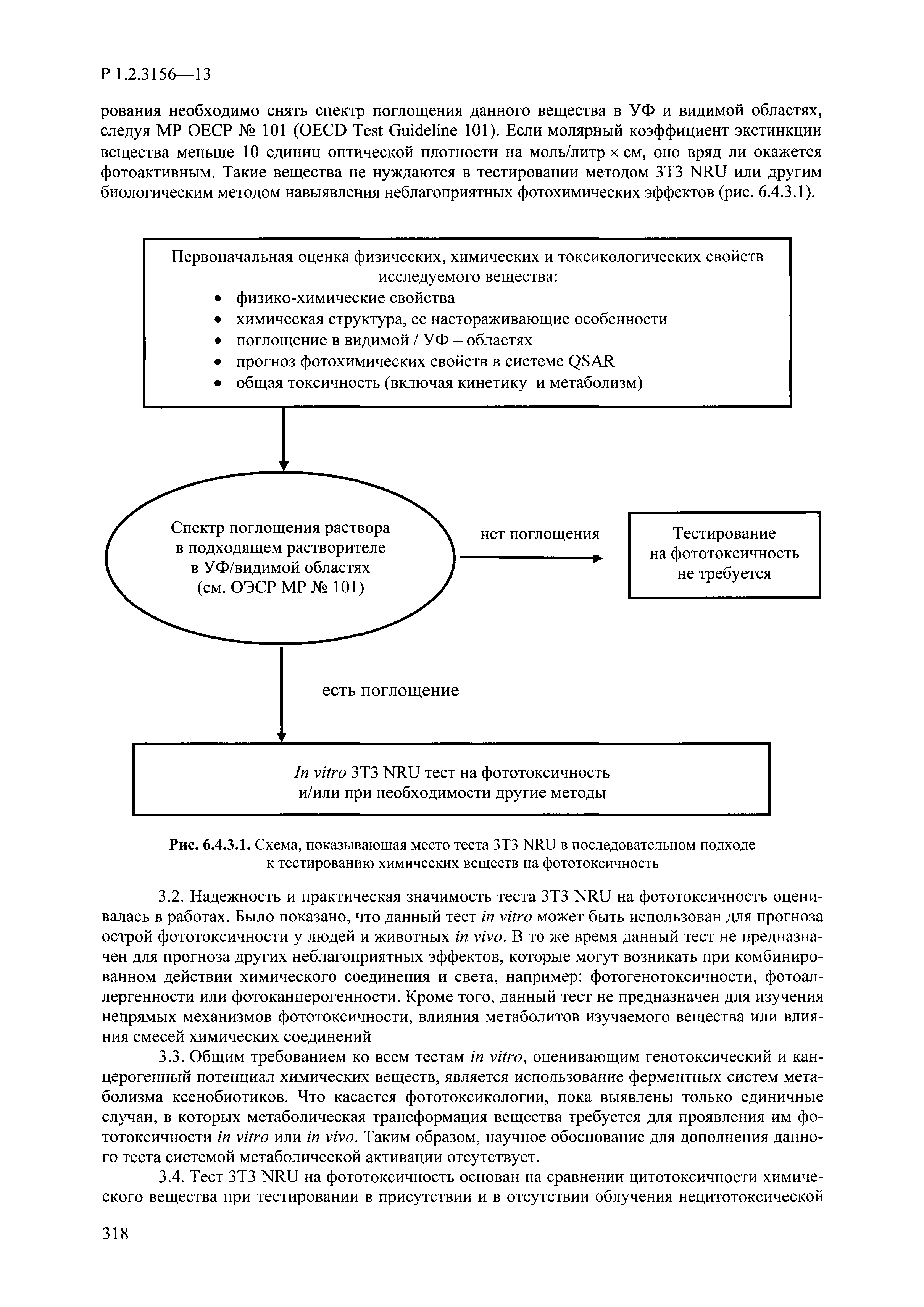
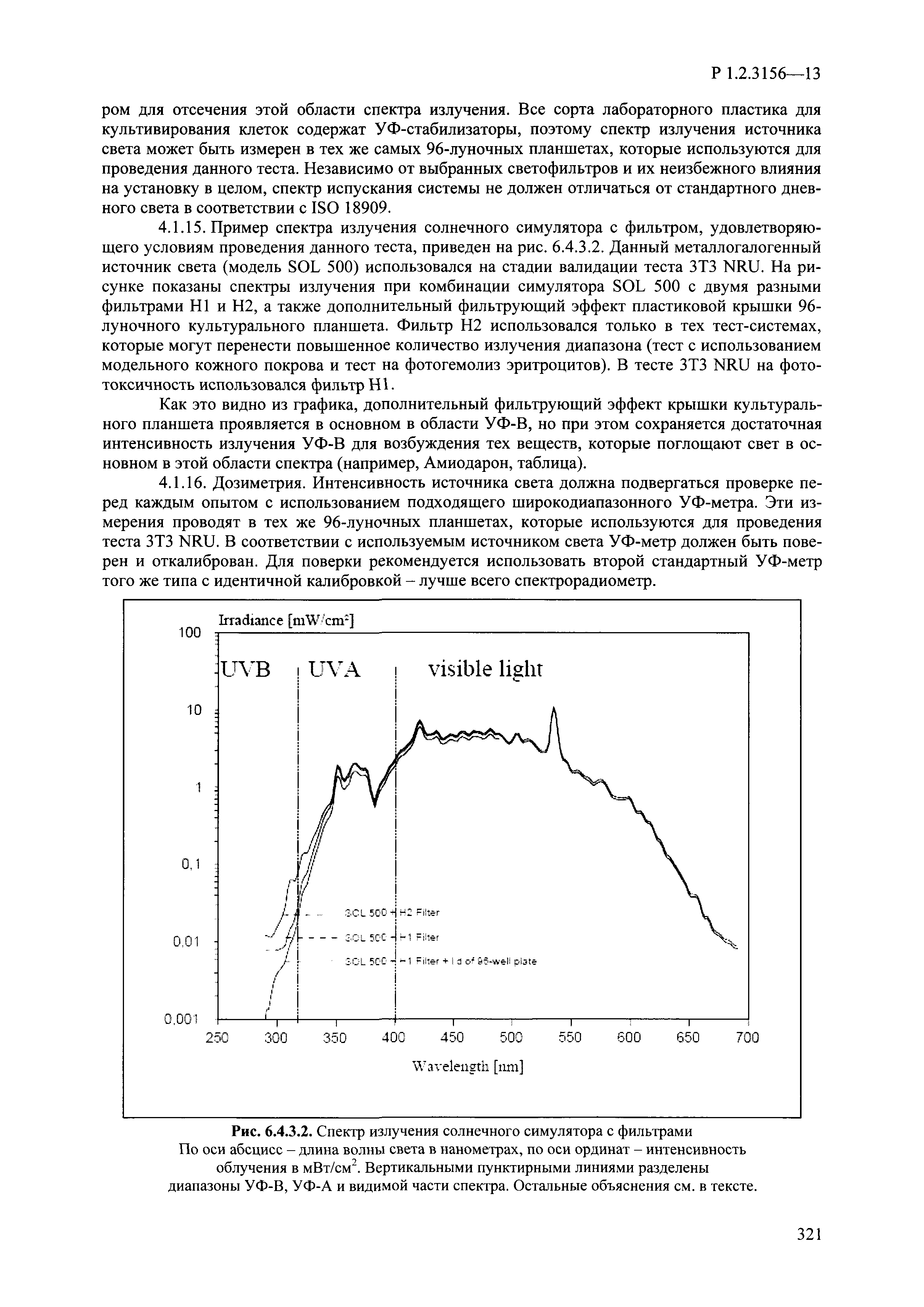
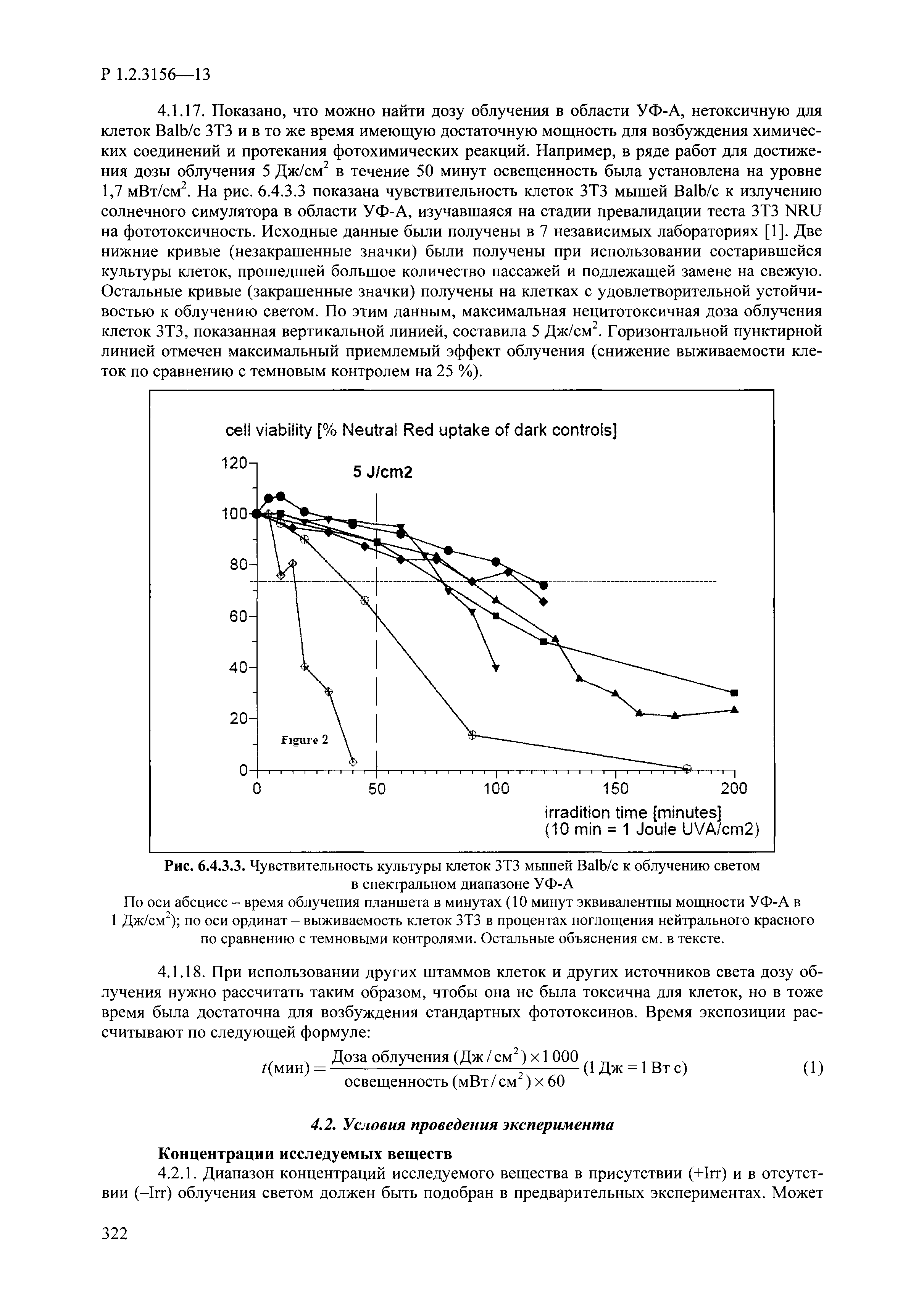
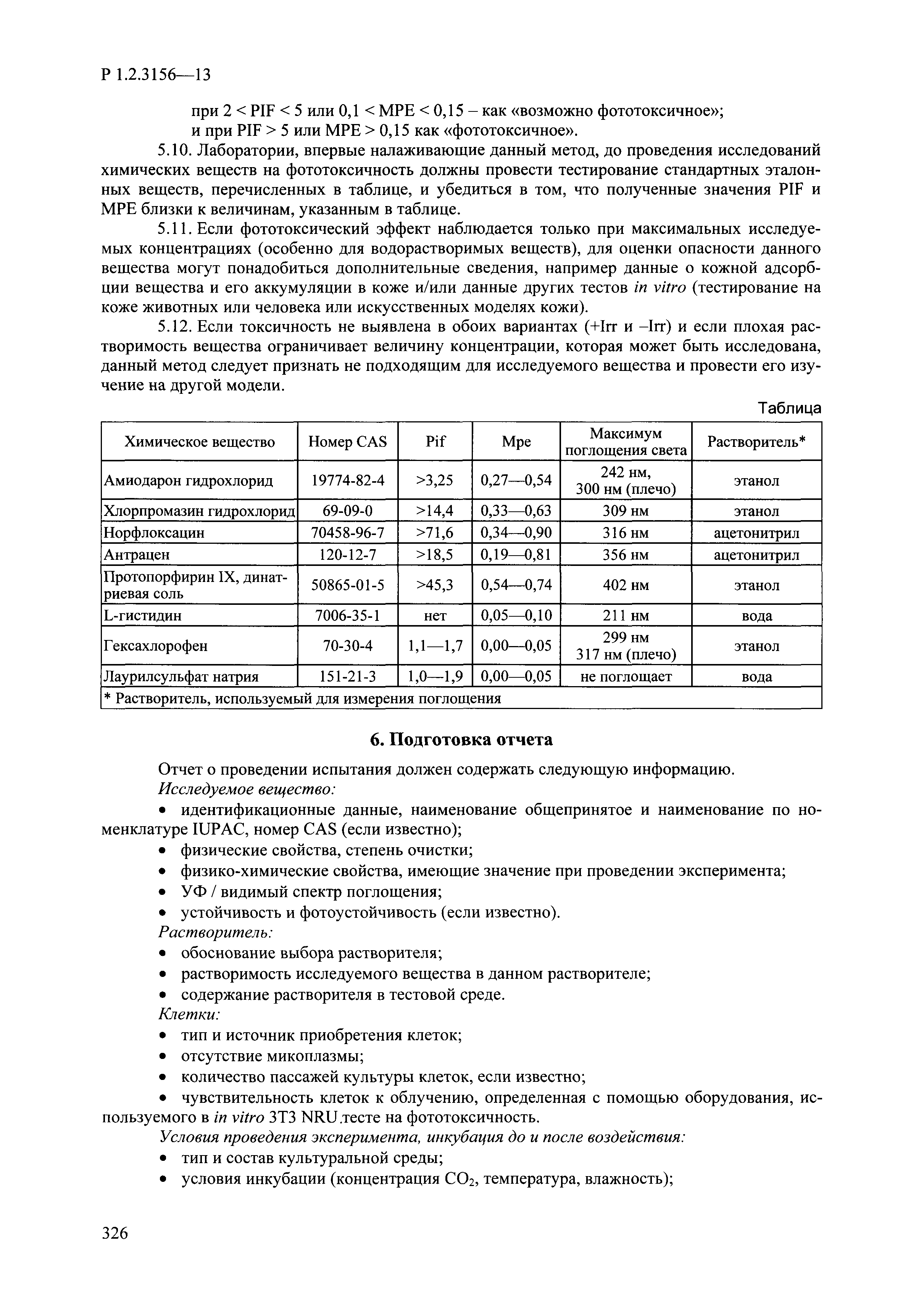
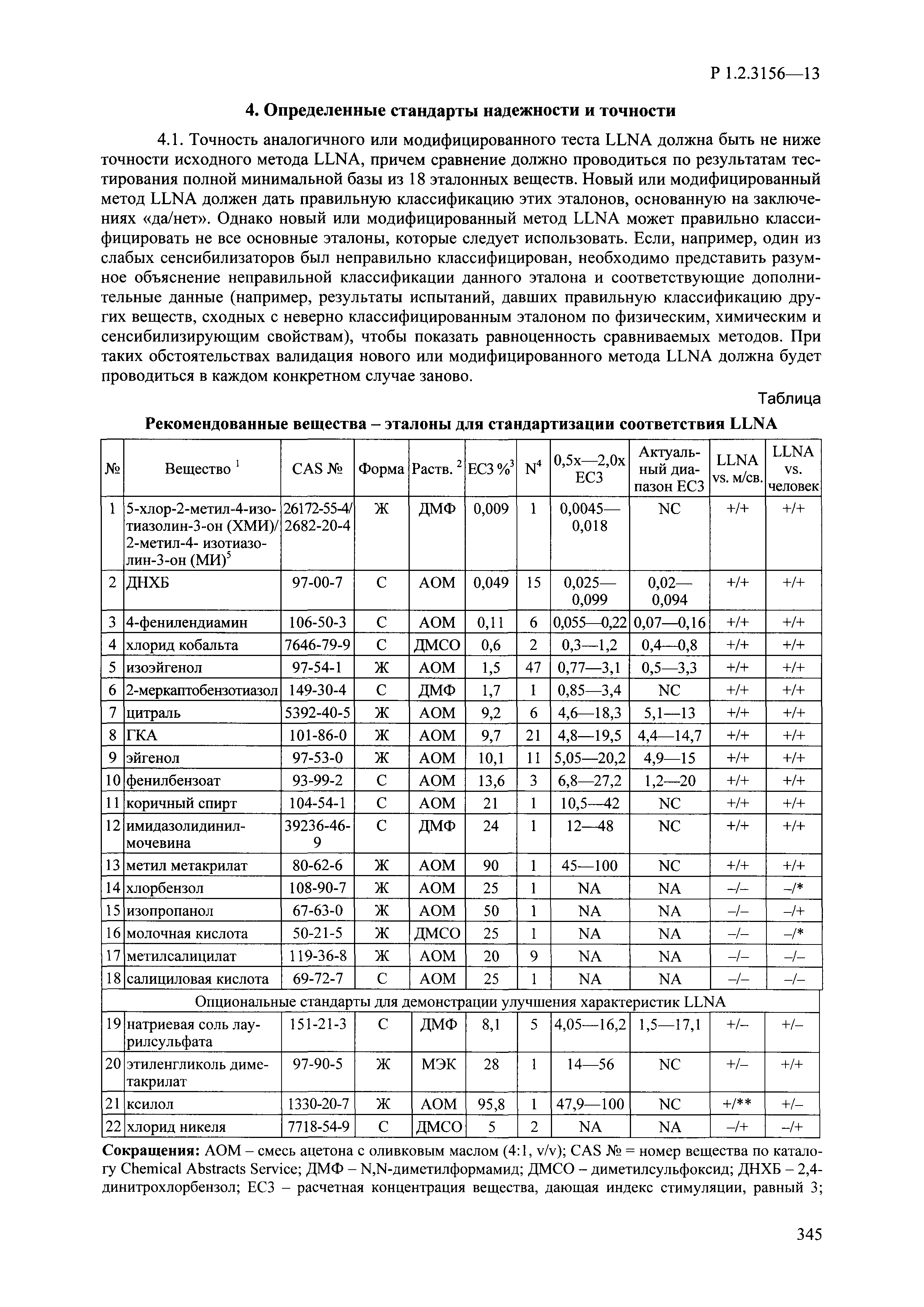
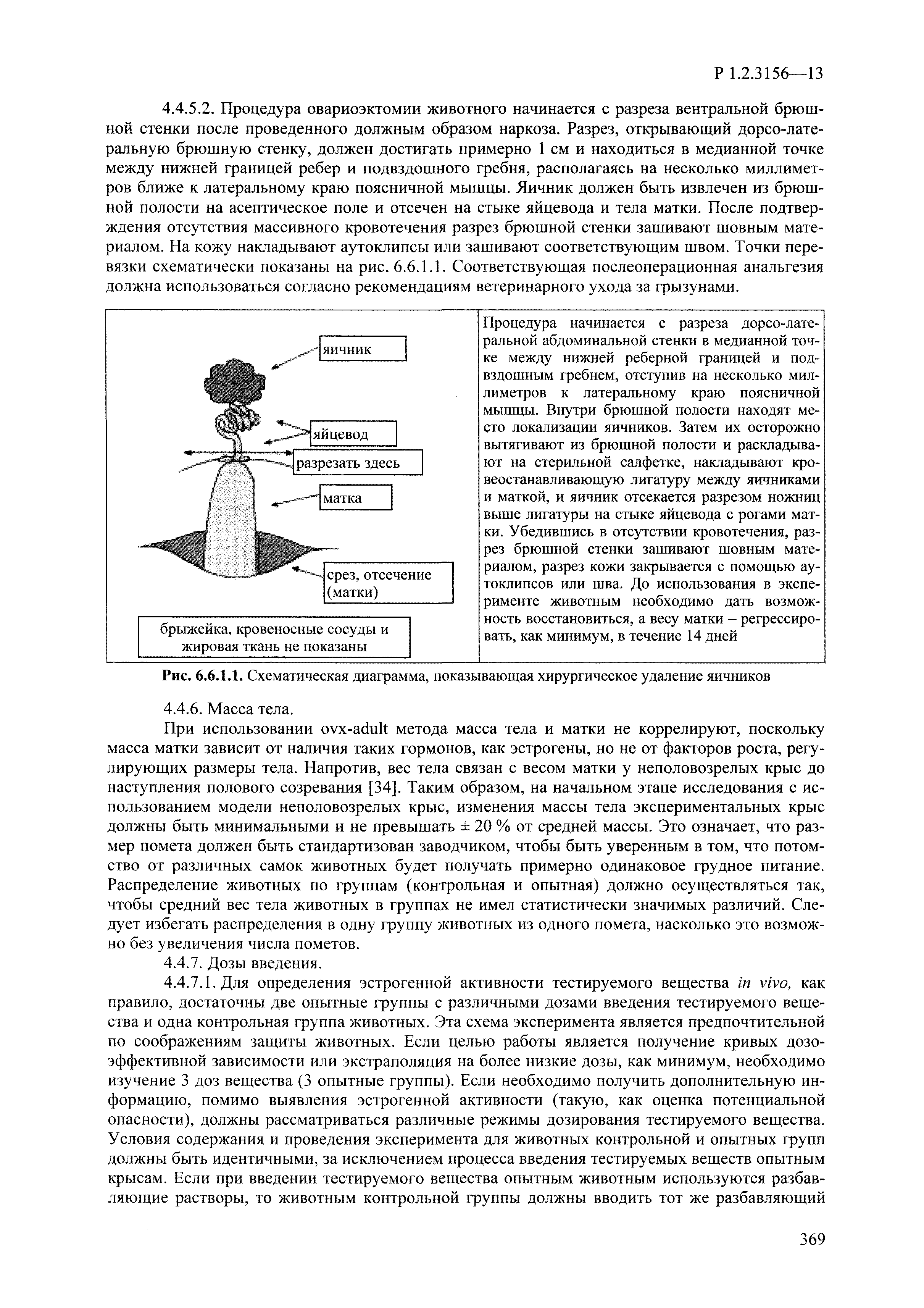
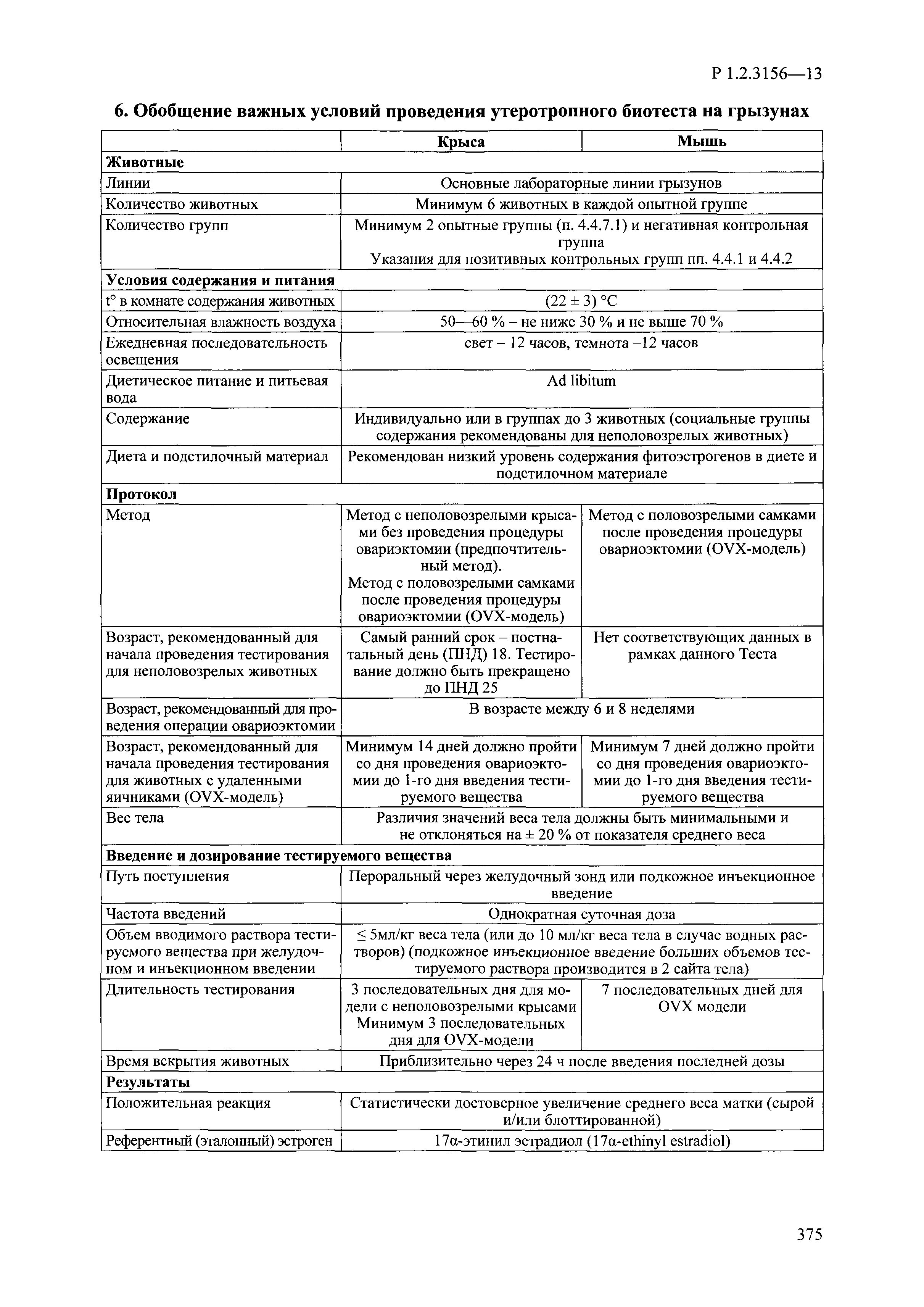
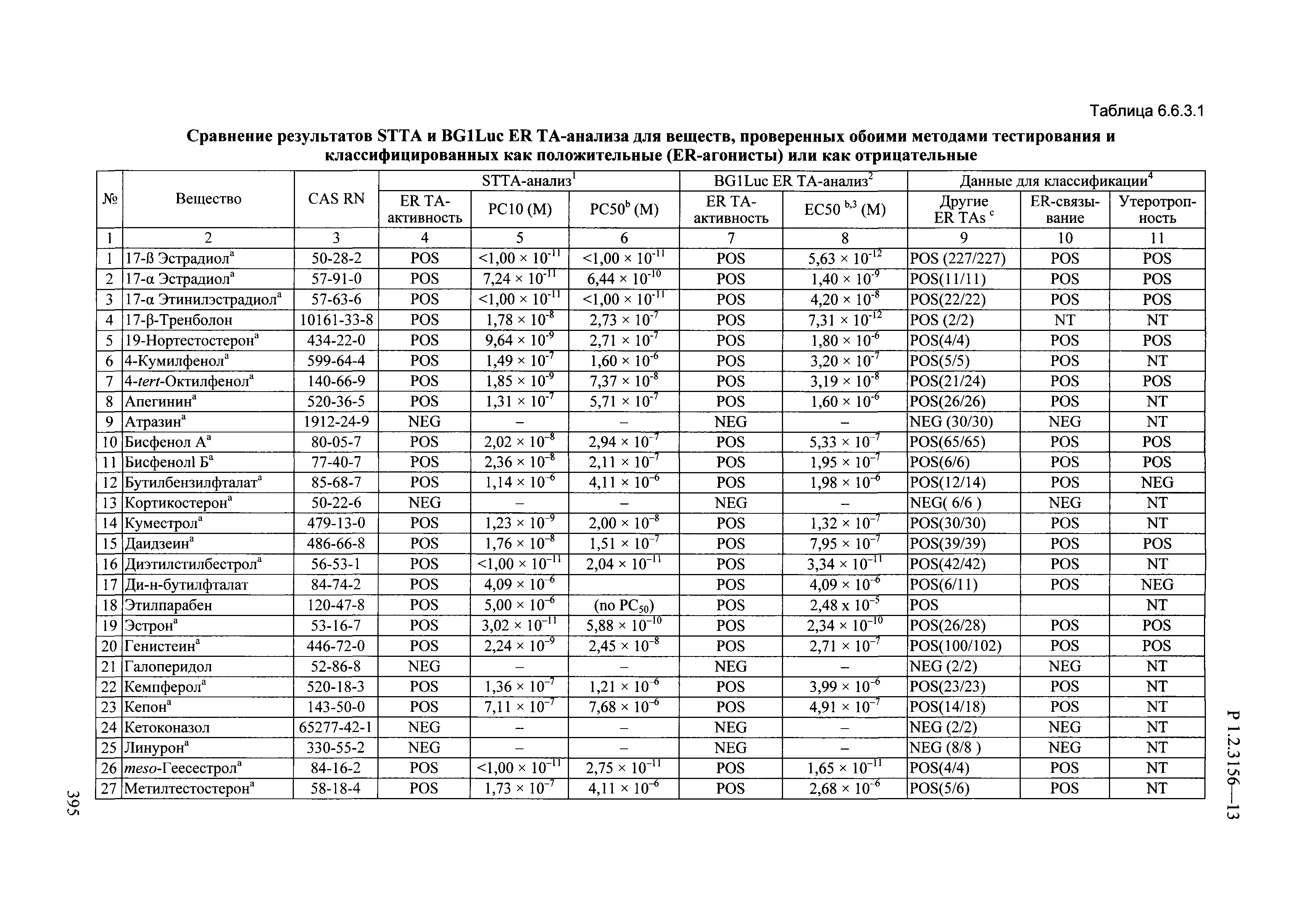
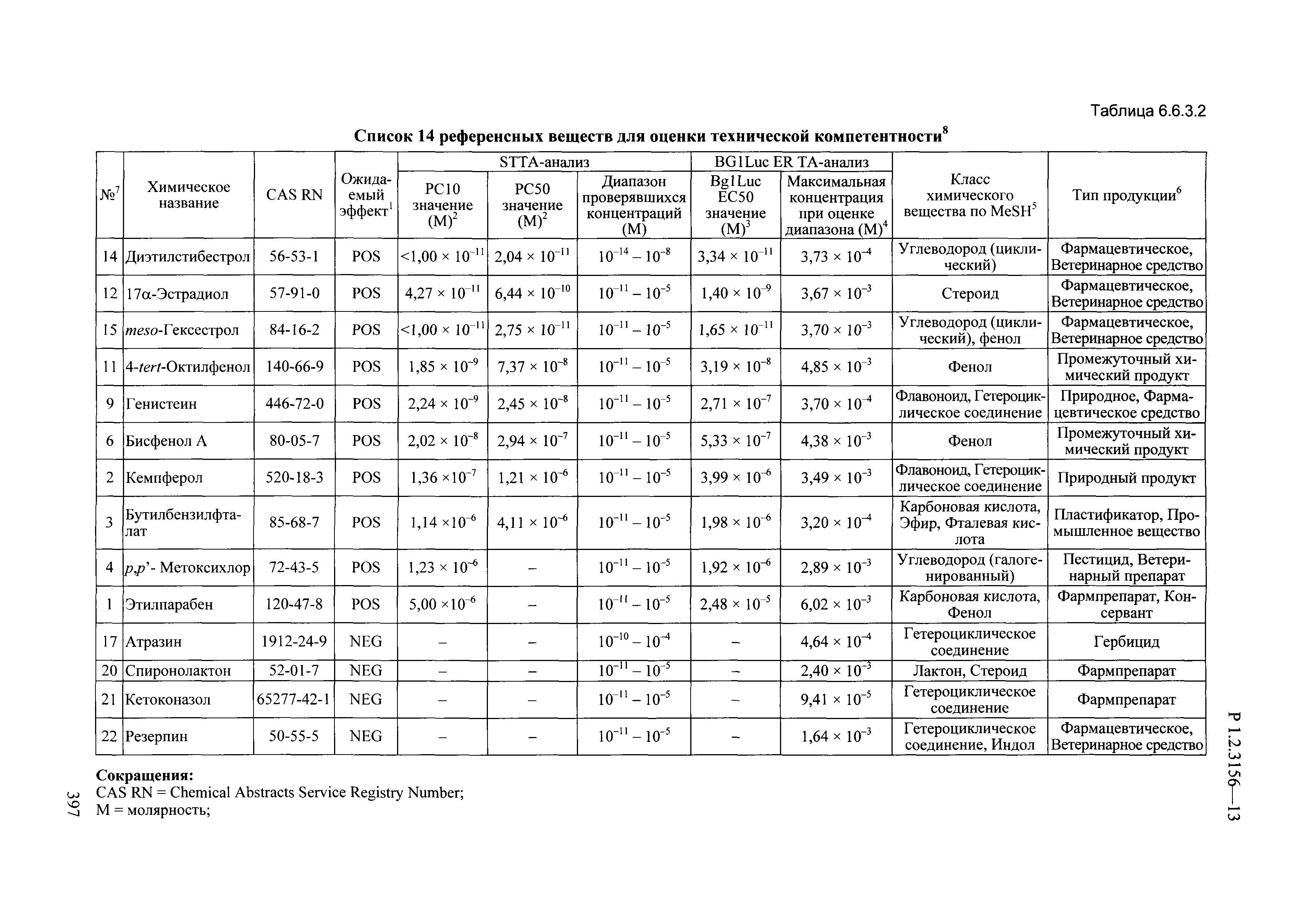
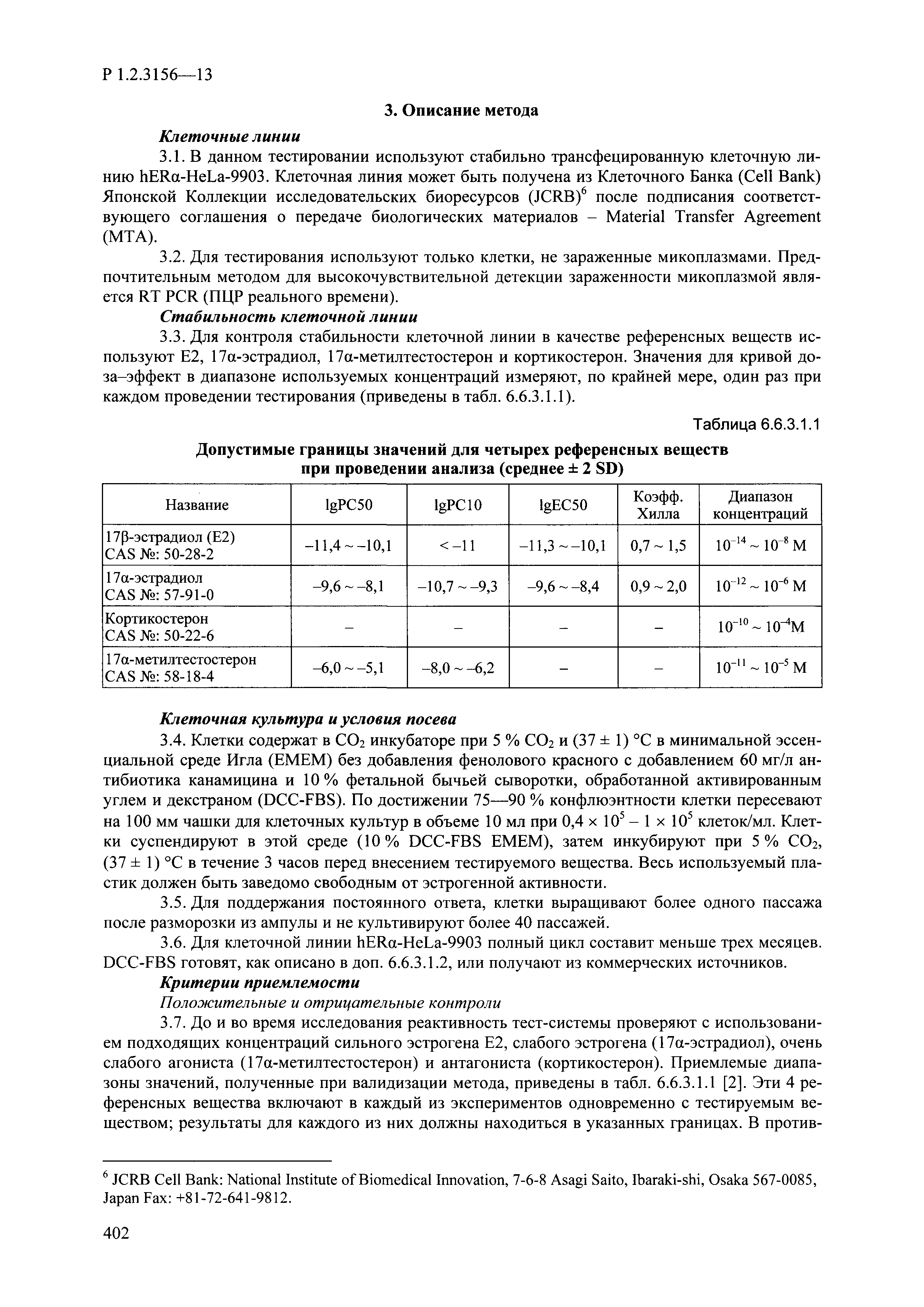
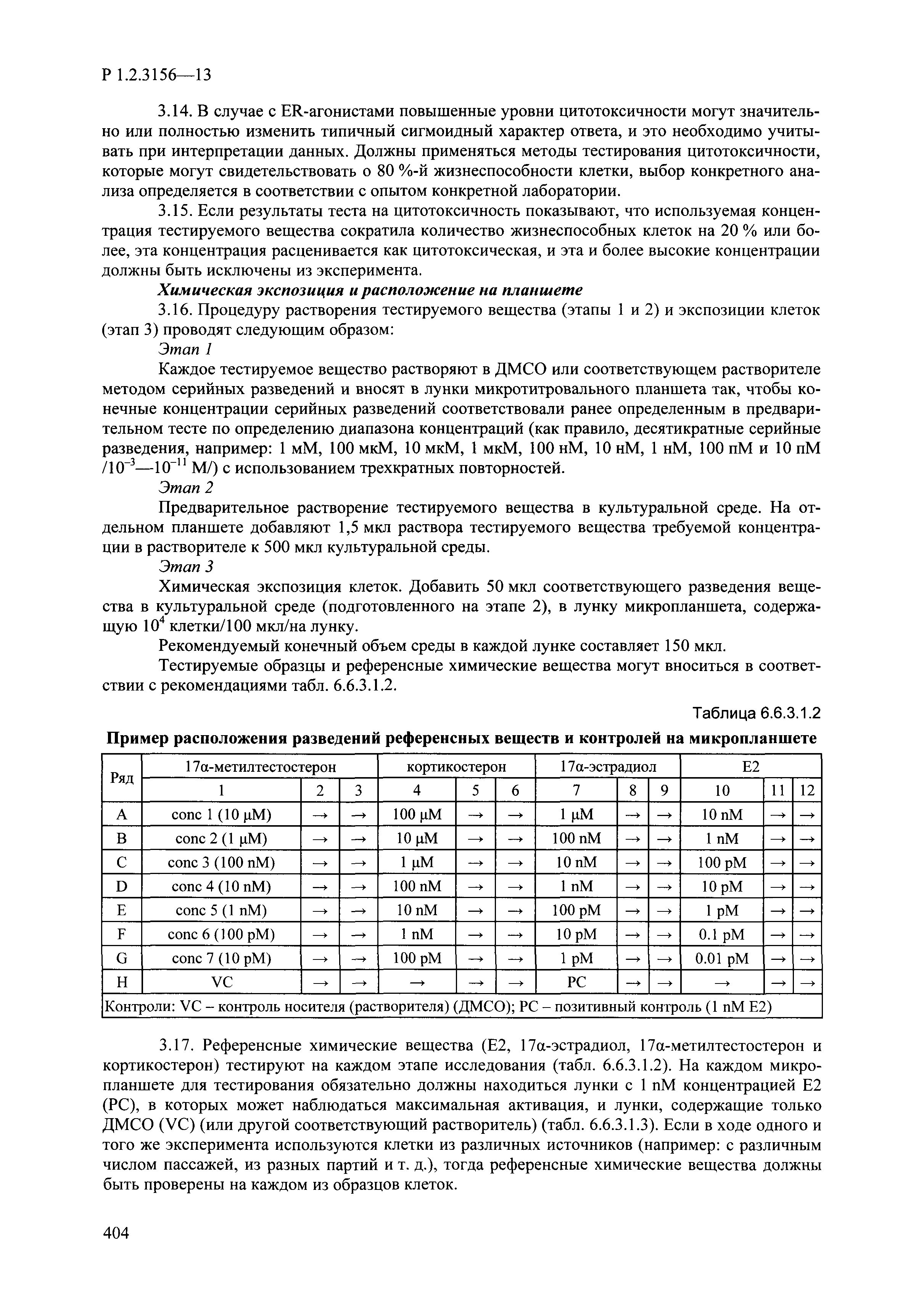
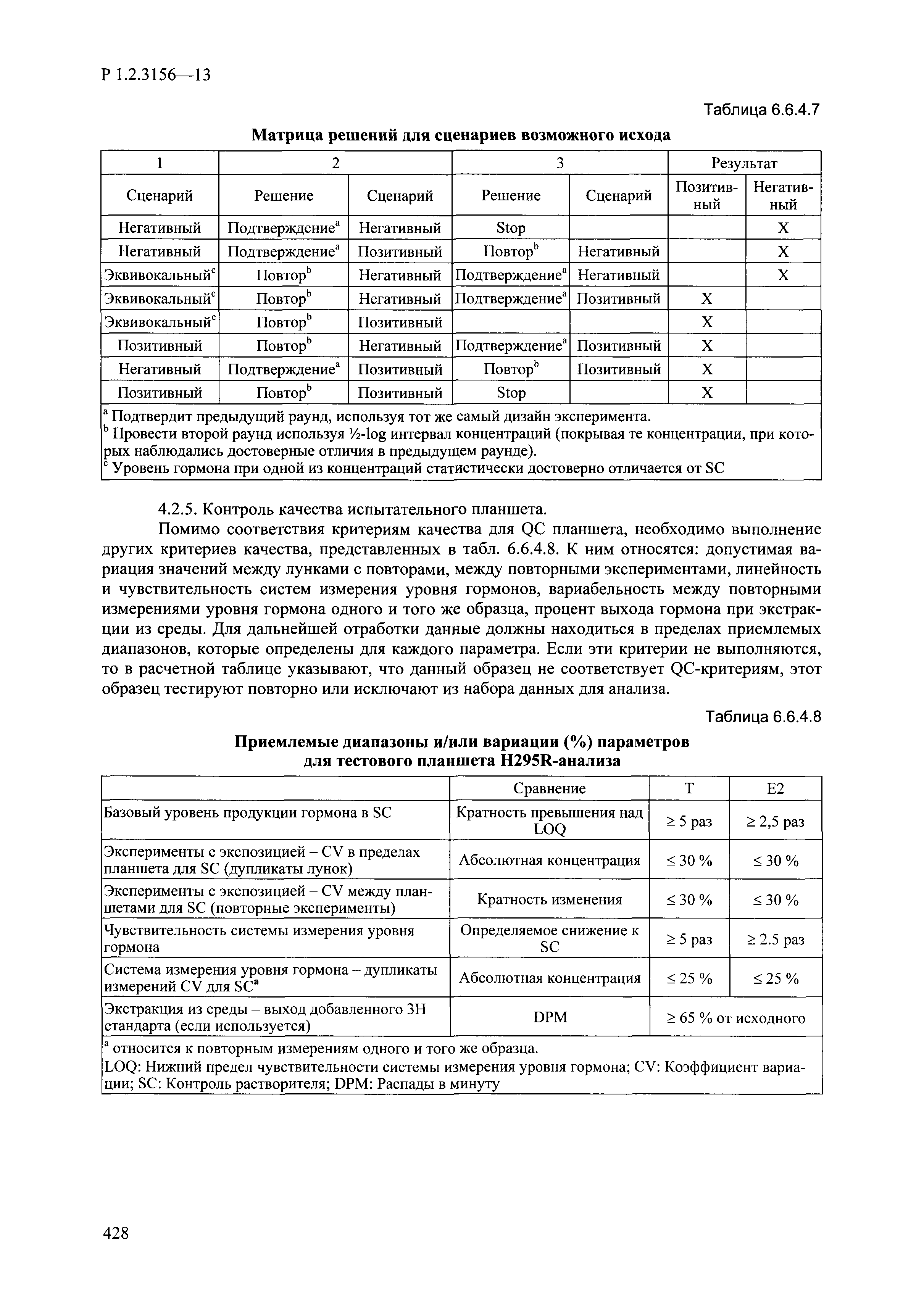
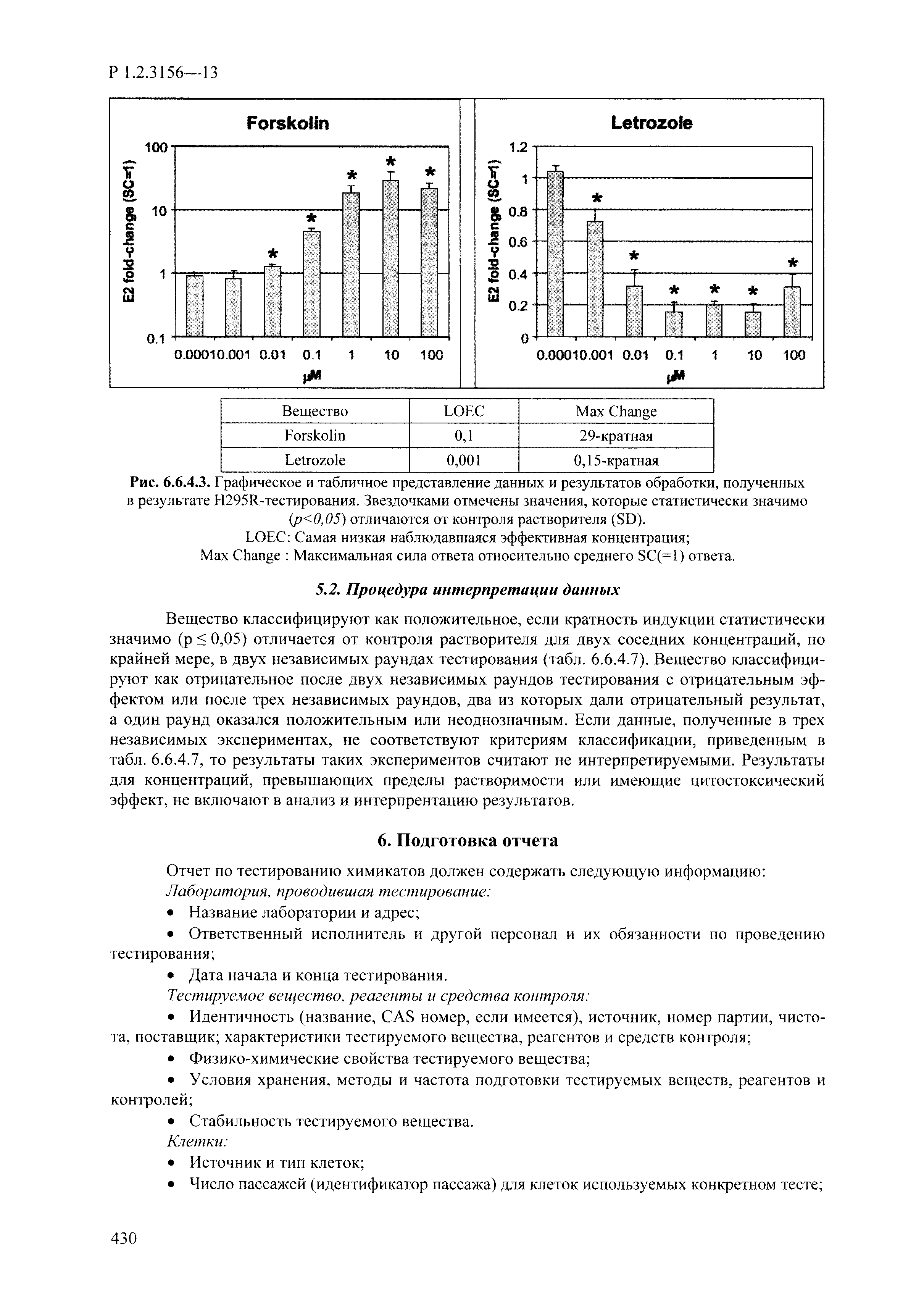
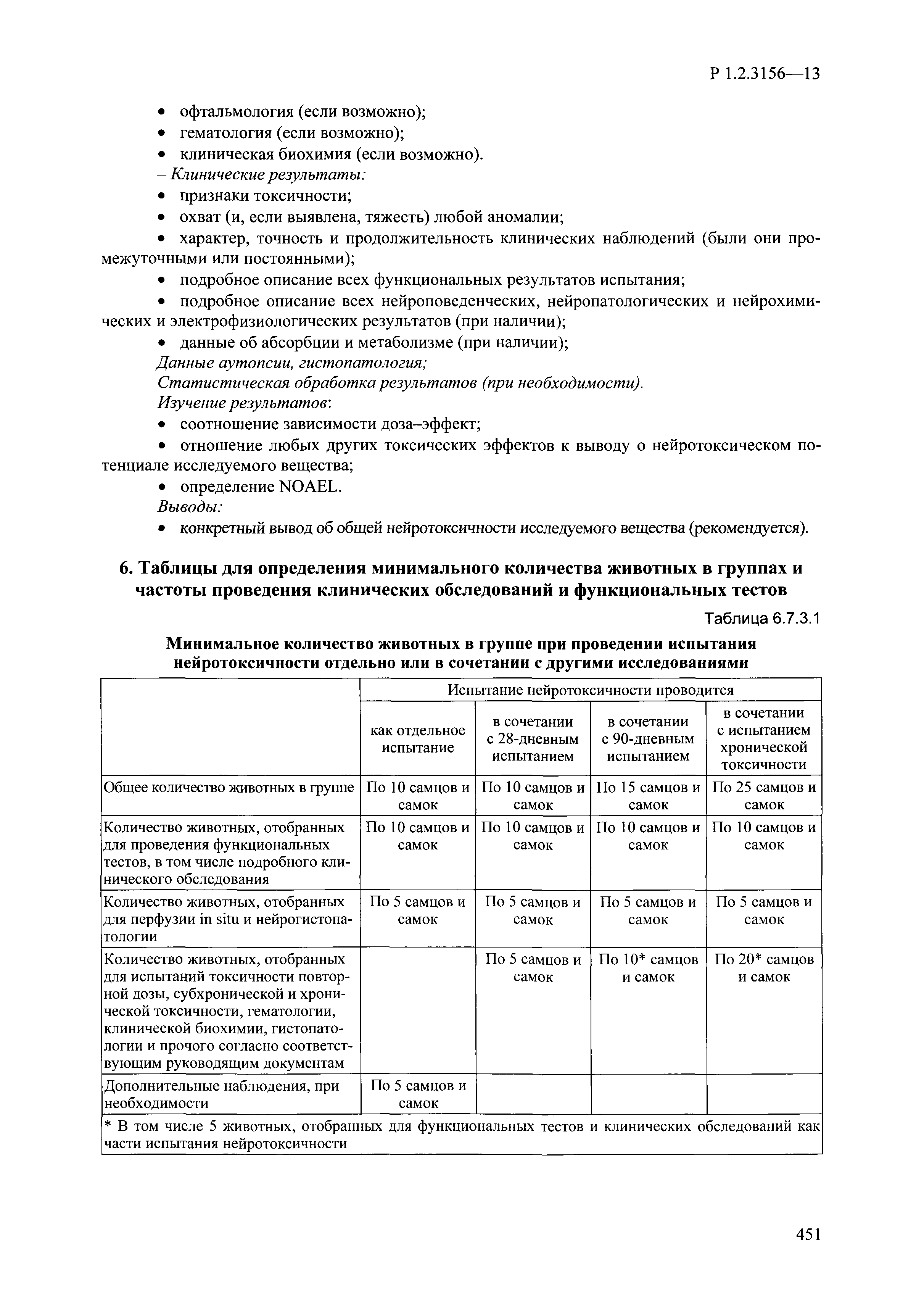
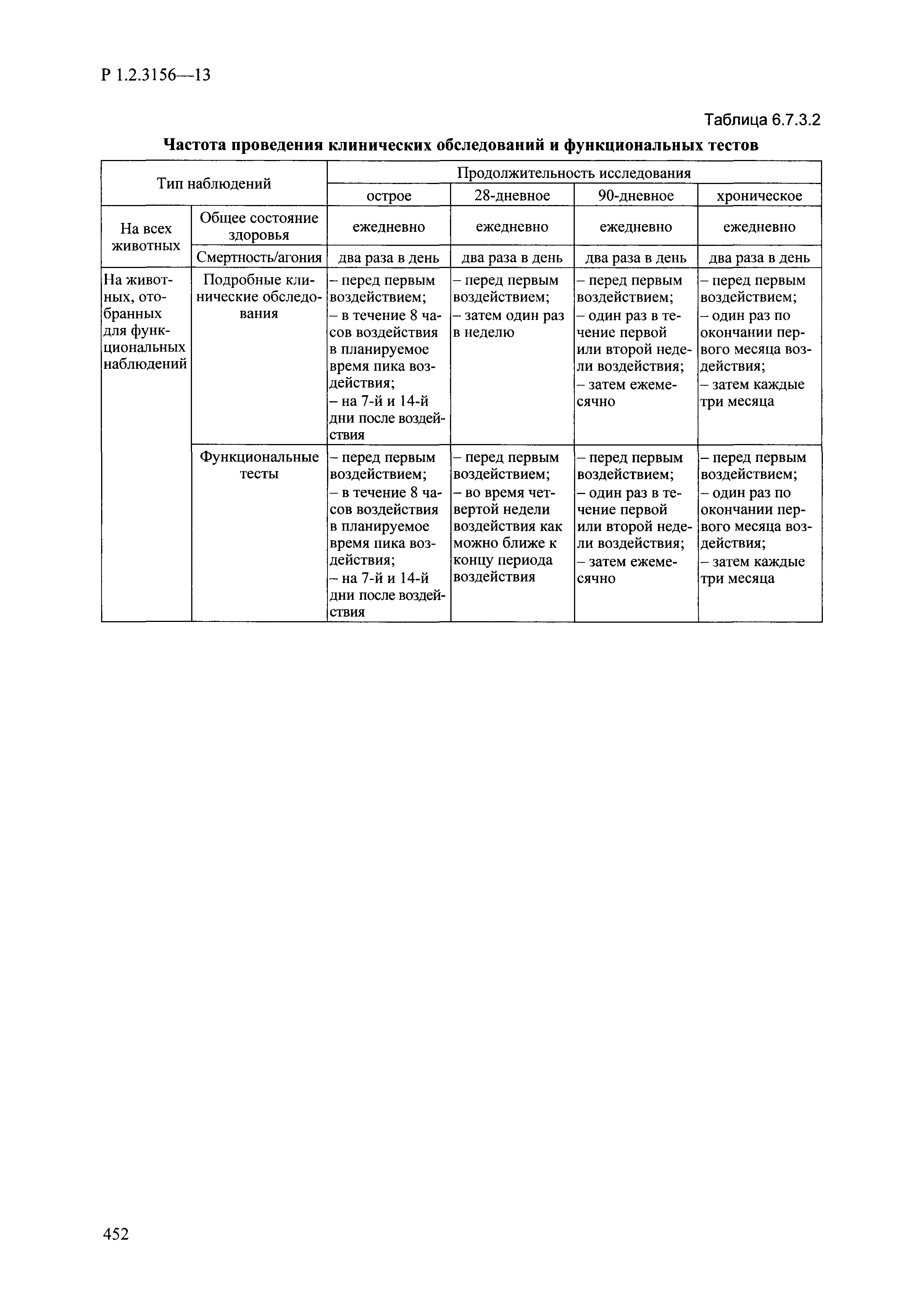
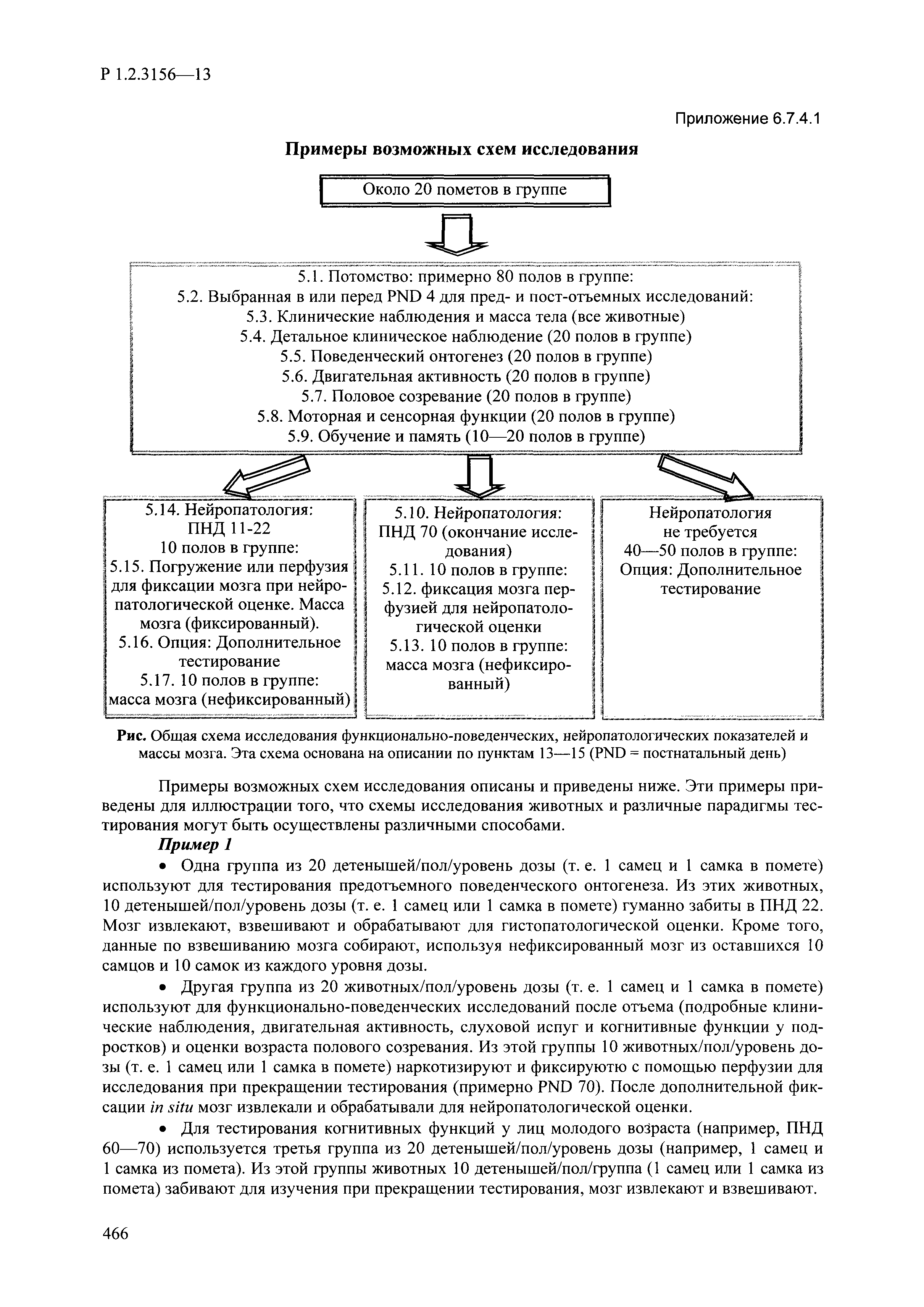
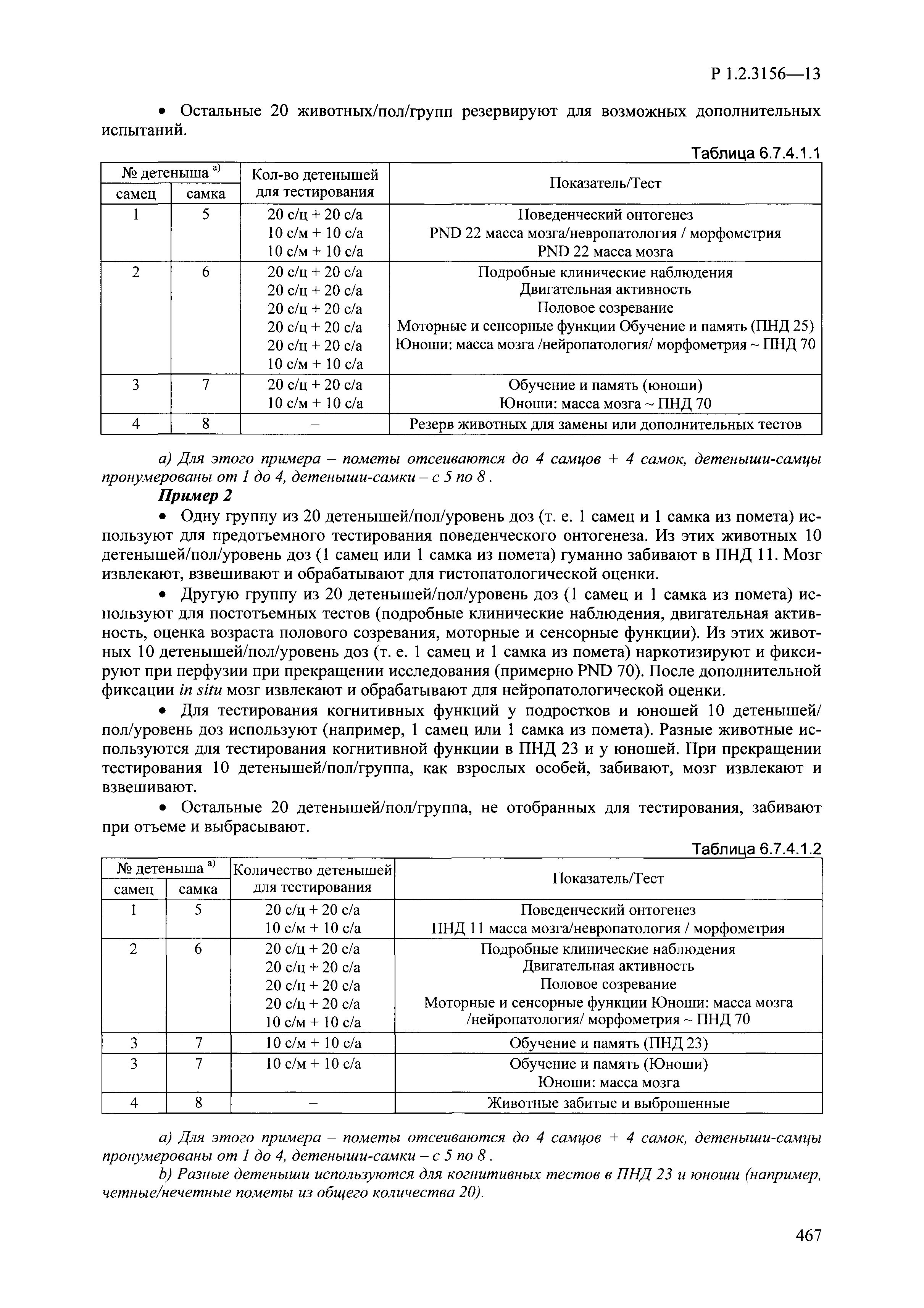
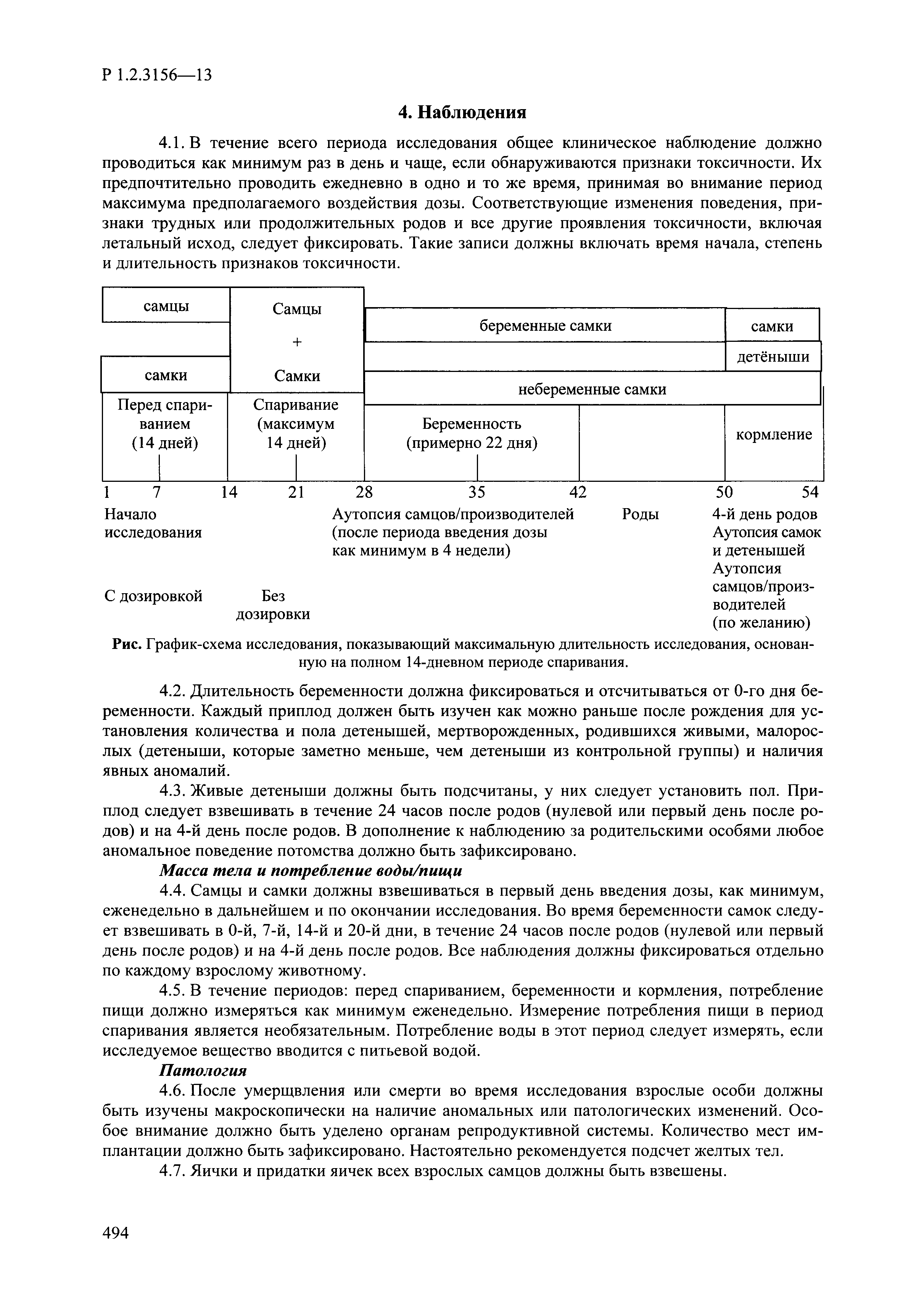
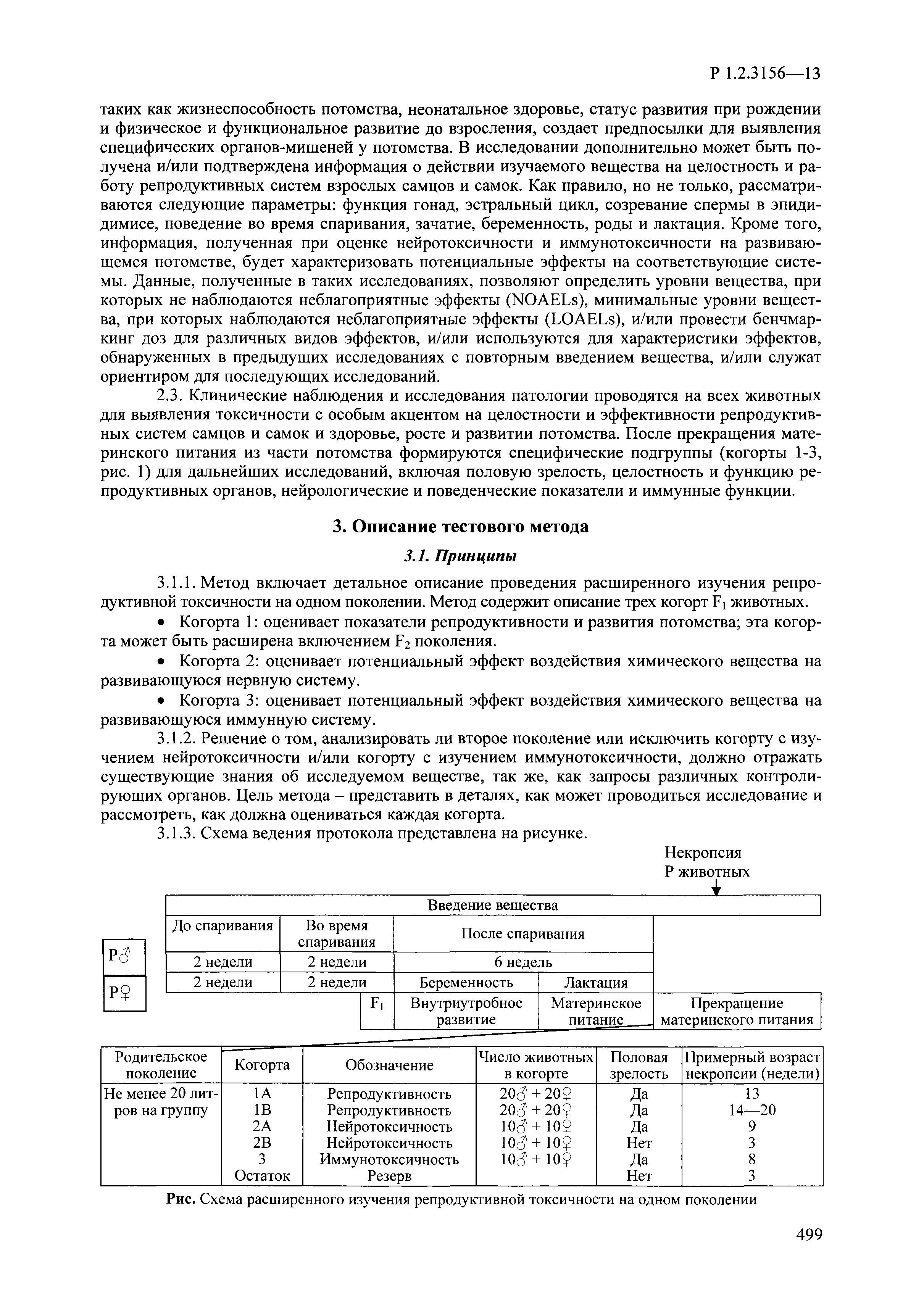
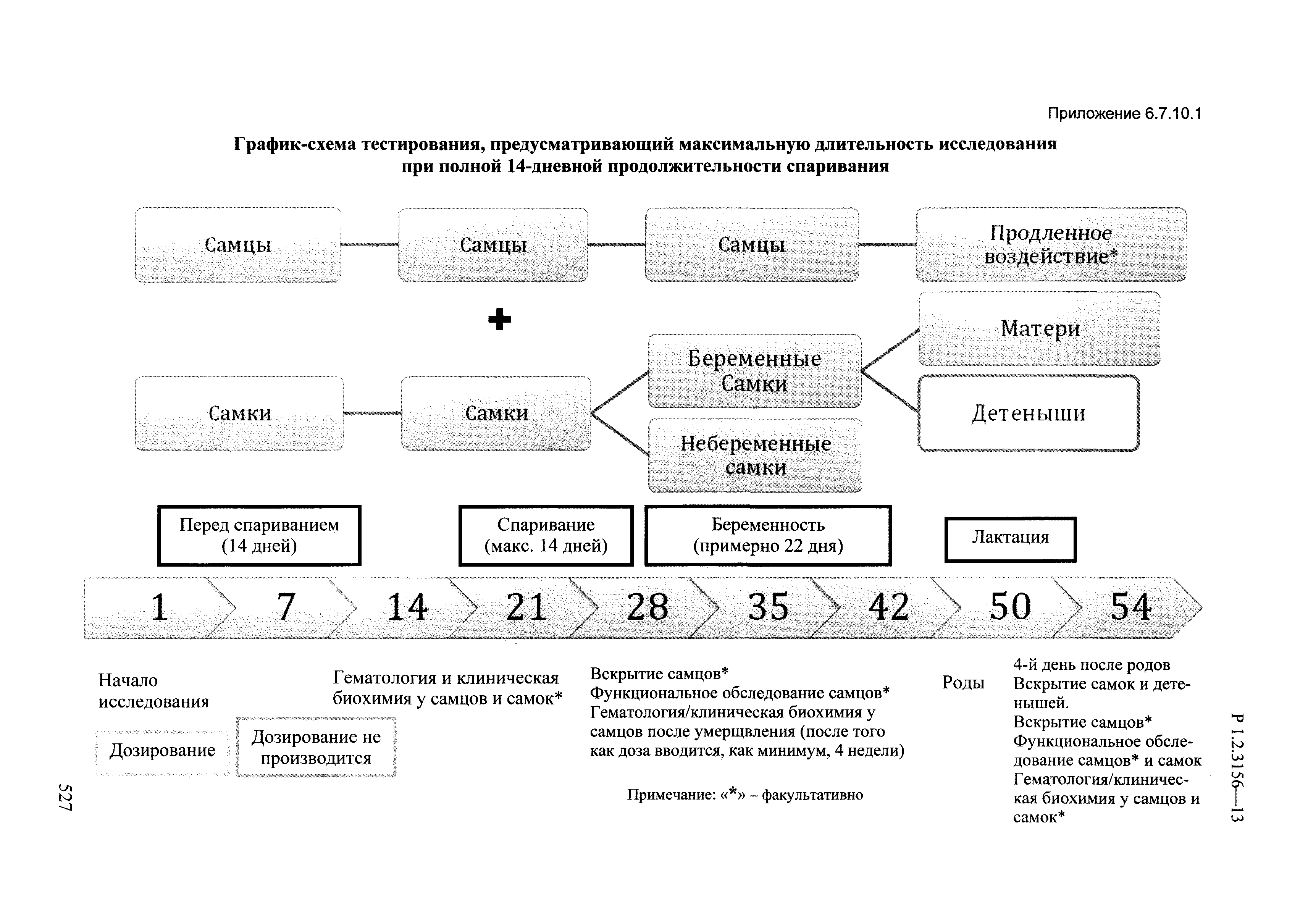
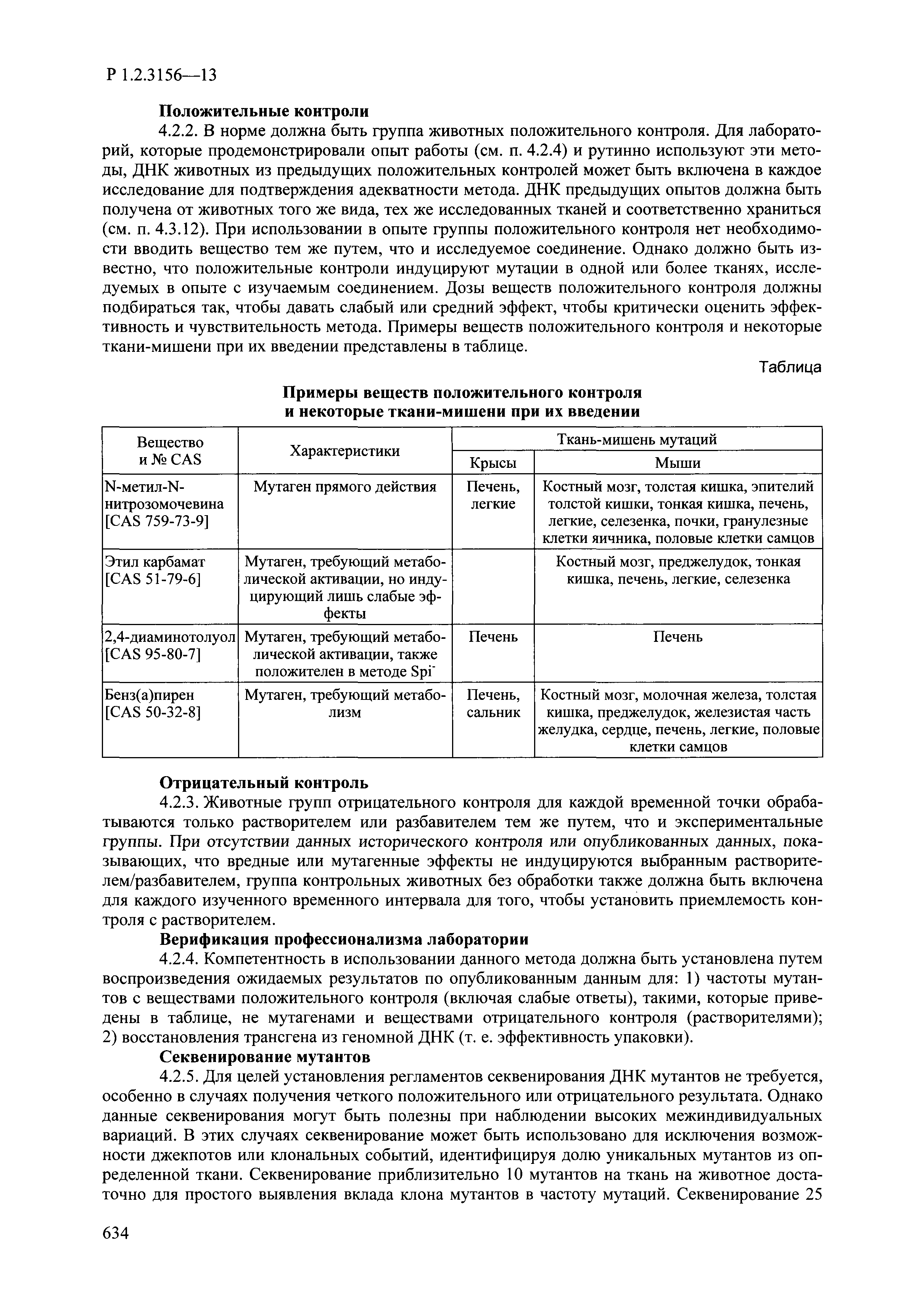
| Оглавление: | I. Область применения и общие положения II. Введение III. Основные термины, определения, аббревиатуры и сокращения 3.1. Термины и определения (справочно) 3.2. Аббревиатуры и сокращения IV. Основные требования надлежащей лабораторной практики 4.1. Требования к исследуемым химическим веществам и их смесям 4.2. Требования к лабораторным животным и уходу за ними 4.3. Требования к помещениям, кормам и инвентарю 4.4. Требования к используемому оборудованию 4.5. Планирование и проведение исследований 4.6. Требования к оформлению отчета 4.7. Система обеспечения качества токсиколого-гигиенических исследований по оценке безопасности химических веществ и их смесей 4.8. Стандартные операционные процедуры 4.9. Меры конфиденциальности 4.10. Обучение (переобучение) персонала, принимающего участие в исследованиях токсичности химических веществ и смесей на их основе V. Основные требования к испытательным центрам (лабораториям), выполняющим исследования по токсикологической оценке химических веществ и продукции на их основе 5.1. Требования к помещениям 5.2. Оборудование, инструменты, материалы и реагенты 5.3. Тест-системы (испытательные системы) VI. Общая характеристика экспериментально-биологических клиник (вивариев) с учетом требований ОЭСР 6.1. Общие положения 6.2. Характеристика помещений, оборудования вивария и условия размещения животных 6.3. Прием животных в клинику (виварий) 6.4. Основные правила содержания лабораторных животных 6.5. Биоэтические аспекты работы с лабораторными животными 6.6. Правила личной гигиены персонала 6.7. Правила гуманного обращения с лабораторными животными VII. Классификация опасности химических веществ и смесей при воздействии на организм человека. 7.1. Область применения 7.2. Общие положения 7.3. Общие принципы классификации опасности смесей химических веществ при воздействии на организм 7.4. Требования к предупредительной маркировке 7.5. Классификация опасности химических веществ и их смесей по параметрам острой токсичности 7.6. Классификация опасности химических веществ и их смесей, вызывающих разъедание (некроз)/раздражение кожи 7.7. Классификация опасности химических веществ и их смесей, вызывающих разъедание (некроз)/раздражение глаз 7.8. Классификация опасности химических веществ и их смесей, обладающих сенсибилизирующим действием 7.9. Классификация опасности мутагенной активности химических веществ и смесей 7.10. Классификация опасности химических веществ и смесей по канцерогенному действию 7.11. Классификация опасности химических веществ и смесей по воздействию на репродуктивную систему 7.12. Классификация опасности химических веществ и их смесей, обладающих избирательным действием на органы-мишени и/или системы при однократном воздействии 7.13. Классификация опасности химических веществ и их смесей, обладающих избирательным действием на органы-мишени и/или системы при многократном/продолжительном воздействии 7.14. Классификация опасности химических веществ и их смесей, представляющих опасность при аспирации VIII. Принципы этапности при изучении токсичности и опасности химических веществ и их смесей Список литература Приложение 1. Перечень актов, регламентирующих исследования токсичности и опасности химических веществ и их смесей Приложение 2. Основные положения надлежащей лабораторной практики (перечень ГОСТ) Приложение 3. Порядок обучения (переобучения) персонала, принимающего участие в исследованиях токсичности химических веществ и смесей на их основе Приложение 4. Приборно-инструментальное обеспечение токсикологических исследований воздействия химических веществ и смесей на их основе Приложение 5. Предупредительная маркировка химических веществ и их смесей Приложение 5.1. Предупредительная маркировка химических веществ и их смесей, обладающих острой токсичностью при воздействии на организм Приложение 5.2. Предупредительная маркировка химических веществ и их смесей, вызывающих поражение (некроз)/раздражение кожи Приложение 5.3. Предупредительная маркировка химических веществ и их смесей, вызывающих серьезные повреждения/раздражение глаз Приложение 5.4. Предупредительная маркировка химических веществ и их смесей, обладающих сенсибилизирующим действием Приложение 5.5. Предупредительная маркировка мутагенов Приложение 5.6. Предупредительная маркировка канцерогенов Приложение 5.7. Предупредительная маркировка химических веществ и их смесей, воздействующих на функцию воспроизводства Приложение 5.8. Предупредительная маркировка химических веществ и их смесей, обладающих избирательной токсичностью на органы-мишени и/или системы при однократном или многократном/продолжительном воздействии Приложение 5.9. Предупредительная маркировка химических веществ и их смесей, представляющих опасность при аспирации Приложение 6. Методы исследования токсичности химических веществ и их смесей Приложение 6.1. Изучение острой, подострой токсичности в опытах in vivo Приложение 6.1.1. Оценка острой токсичности при внутрижелудочном поступлении методом фиксированной дозы Приложение 6.1.2. Оценка острой токсичности при внутрижелудочном поступлении методом определения классов острой токсичности Приложение 6.1.3. Оценка острой токсичности при внутрижелудочном поступлении методом «вверх-вниз» Приложение 6.1.3.1. Методика дозирования. Последовательность доз для основного исследования Приложение 6.1.3.2. Расчеты для правила остановки по отношению правдоподобия Приложение 6.1.3.3. Критерии для классификации исследуемых веществ с ожидаемыми величинами LD50, превышающими 2000 мг/кг, без необходимости испытаний Приложение 6.1.4. Оценка острой токсичности при ингаляционном поступлении Приложение 6.1.5. Оценка острой токсичности при ингаляционном поступлении с определением класса острой токсичности Приложение 6.1.5.1. Процедура испытания для каждой начальной концентрации газов (частей на миллион (ppm)/4 ч) Приложение 6.1.5.2. Процедура испытания для каждой начальной концентрации паров (мг/л/4 ч) Приложение 6.1.5.3. Процедура испытания для каждой начальной концентрации пыли и аэрозоли (мг/л/4 ч) Приложение 6.1.6. Оценка острой токсичности при накожном поступлении Приложение 6.1.7. Оценка острого раздражения/разъедания (коррозии) кожи Приложение 6.1.7.1. Тестирование и стратегия исследования раздражающего/разъедающего (коррозионного) действия на кожу (схема) Приложение 6.1.8. Кожно-резорбтивное действие: метод in vivo Приложение 6.1.8.1. Пример дизайна типичного устройства, используемого для изоляции и защиты места нанесения вещества при исследовании его кожно-резорбтивного действия методом in vivo Приложение 6.1.9. Изучение пероральной токсичности при повторном воздействии в 28-дневных опытах на грызунах Приложение 6.1.10. Оценка подострой токсичности при ингаляционном поступлении в 28-дневном исследовании Приложение 6.1.11. Оценка кожной токсичности при повторном воздействии в 21/28 дневном исследовании Приложение 6.2. Изучение субхронической токсичности в опытах in vivo Приложение 6.2.1. Изучение пероральной токсичности при повторном воздействии в 90-дневных опытах на грызунах Приложение 6.2.2. Изучение пероральной токсичности при повторном воздействии в 90-дневных опытах на негрызунах Приложение 6.2.3. Оценка субхронической токсичности при ингаляционном поступлении в 90-дневном исследовании Приложение 6.2.4. Оценка субхронической токсичности при накожном поступлении в 90-дневном исследовании Приложение 6.3. Изучение хронической токсичности в опытах in vivo Приложение 6.3.1. Изучение хронической токсичности при внутрижелудочном поступлении Приложение 6.3.2 .Изучение хронической токсичности при ингаляционном поступлении Приложение 6.3.3. Изучение хронической токсичности при накожном поступлении Приложение 6.3.4. Токсикокинетические исследования Приложение 6.4. Изучение токсичности при воздействии на кожу в опытах in vitro Приложение 6.4.1. Метод мембранного барьера для тестирования коррозии кожи in vitro Приложение 6.4.1.1. Оценка характеристик эффективности предлагаемого метода тестирования коррозии кожи in vitro с использованием мембранного барьера Приложение 6.4.2. Кожно-резорбтивное действие: метод in vitro Приложение 6.4.2.1. Стратегия тестирования и проведения испытаний раздражающего/разъедающего действия на кожу Приложение 6.4.3. Оценка фототоксичности in vitro в тесте поглощения нейтрального красного клетками 3Т3 (3Т3 NRU) Приложение 6.5. Изучение сенсибилизирующих свойств в опытах in vivo и in vitro Приложение 6.5.1. Испытания по оценке кожной сенсибилизации Приложение 6.5.2. Оценка кожной сенсибилизации по реакции региональных лимфоузлов Приложение 6.5.2.1. Стандарты соответствия для оценки кожной сенсибилизации в предложенном или модифицированном тесте LLNA Приложение 6.5.3. Оценка кожной сенсибилизации по реакции региональных лимфоузлов путем измерения содержания АТФ (метод LLNA:DA) Приложение 6.5.4. Оценка кожной сенсибилизации по реакции региональных лимфоузлов методом иммуноферментного анализа скорости включения бромдезоксиуридина в ДНК (метод LLNA:BrdU:ELISA) Приложение 6.6. Изучение влияния на половые гормоны Приложение 6.6.1. Утеротропный биотест на грызунах: краткосрочный скрининг-тест для выявления эстрогенной активности Приложение 6.6.1.1. Концептуальная модель ОЭСР-тестирования и оценки химических веществ, повреждающих эндокринную систему (OECD Conceptual Framework for the Testing and Assessment of Endocrine Disrupting Chemicals) Приложение 6.6.2. Тест Хешбергера на крысах: краткосрочное скрининговое исследование для выявления (анти)андрогенных свойств Приложение 6.6.3. Исследование транскрипционной активации, опосредованной стабильно трансфицированным человеческим альфа-рецептором эстрогена, для выявления эстроген-агонистической активности веществ Приложение 6.6.3.1. Выявление эстроген-агонистической активности веществ методом транскрипционной активации, опосредованной стабильно трансфецированным человеческим альфа-рецептором эстрогена в клеточной линии hERальфа-HeLa-9903 Приложение 6.6.3.2. Выявление эстроген-агонистической активности веществ методом ER-опосредованной транскрипционной активации стабильно трансфецированной люциферазы в клеточной линии BG1Luc Приложение 6.6.4. H295R in vitro тест на стероидогенез с использованием человеческой клеточной линии адренокарциномы Приложение 6.7. Изучение специфических и отдаленных эффектов Приложение 6.7.1. Исследование отдаленного нейротоксического действия фосфорорганических соединений после острого воздействия Приложение 6.7.2. Исследование отдаленного нейротоксического действия фосфорорганических соединений при 28-дневном повторном введении Приложение 6.7.3. Исследование нейротоксичности на грызунах Приложение 6.7.4. Исследование нейротоксичности в процессе онтогенеза Приложение 6.7.5. Оценка токсического действия на пренатальное развитие Приложение 6.7.6. Оценка репродуктивной токсичности на одном поколении Приложение 6.7.7. Исследование репродуктивной токсичности на двух поколениях Приложение 6.7.8. Оценка репродуктивной/эмбриональной токсичности (скрининговый метод) Приложение 6.7.9. Расширенное изучение репродуктивной токсичности на одном поколении Приложение 6.7.9.1. Измерения и наблюдения, включенные в батарею функциональных наблюдений (когорта 2А) Приложение 6.7.10. Совместное исследование токсичности при повторном воздействии с репродуктивной/эмбриональной токсичностью (скрининговый метод) Приложение 6.7.10.1. График-схема тестирования, предусматривающий максимальную длительность исследования при полной 14-дневной продолжительности спаривания Приложение 6.7.10.2. Пример сводного отчета об эффектах воздействия на репродуктивность/развитие Приложение 6.7.11. Испытания по оценке канцерогенной активности Приложение 6.7.12. Комбинированные исследования хронической токсичности и канцерогенной активности Приложение 6.8. Генетическая токсикология Приложение 6.8.1. Метод оценки обратных мутаций на бактериях Приложение 6.8.2. Метод оценки хромосомных аберраций в клетках млекопитающих in vitro Приложение 6.8.3. Микроядерный тест на эритроцитах млекопитающих Приложение 6.8.4. Метод оценки хромосомных аберраций в клетках костного мозга млекопитающих Приложение 6.8.5. Метод оценки генных мутаций на клетках млекопитающих in vitro Приложение 6.8.6. Генетическая токсикология: Метод оценки сцепленных с полом рецессивных летальных мутаций у Drosophila melanogaster Приложение 6.8.7. Генетическая токсикология: Метод доминантных деталей на грызунах Приложение 6.8.8. Генетическая токсикология: Сестринские хроматидные обмены в клетках млекопитающих in vitro Приложение 6.8.9. Генетическая токсикология: Метод оценки генных мутаций на Saccharomyces cerevisiae Приложение 6.8.10. Генетическая токсикология: Метод оценки митотической рекомбинации на Saccharomyces cerevisiae Приложение 6.8.11. Генетическая токсикология: Повреждения ДНК и репаративный/внеплановый синтез ДНК в клетках млекопитающих in vitro Приложение 6.8.12. Метод оценки хромосомных аберраций в сперматогониях млекопитающих Приложение 6.8.13. Генетическая токсикология: Спот-тест на мышах Приложение 6.8.14. Генетическая токсикология: Метод оценки наследуемых транслокаций у мышей Приложение 6.8.15. Генетическая токсикология: Метод оценки внепланового синтеза ДНК (ВСД) в клетках печени млекопитающих in vivo Приложение 6.8.16. Генетическая токсикология: Микроядерный тест на клетках млекопитающих in vitro. Приложение 6.8.17. Генетическая токсикология: Методы оценки генных мутаций в соматических и половых клетках трансгенных грызунов |
| Разработан: | Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека |
| Утверждён: | 27.12.2013 Главный государственный санитарный врач РФ (Russian Federation Chief Public Health Officer ) |
| Издан: | Роспотребнадзор (2014 г. ) Федеральный центр гигиены и эпидемиологии Роспотребнадзора |
| Расположен в: | |
| Нормативные ссылки: |
|























































































































































































































































































































































































































































































































































































© 2013 Ёшкин Кот :-) Карта сайта

 Приказ 224 «О санитарно-эпидемиологических экспертизах, обследованиях, исследованиях, испытаниях и токсикологических, гигиенических и иных видах оценок»
Приказ 224 «О санитарно-эпидемиологических экспертизах, обследованиях, исследованиях, испытаниях и токсикологических, гигиенических и иных видах оценок»