Информационная система |
| Карта сайта |
Скачать ГОСТ Р ИСО 25424-2013 Стерилизация медицинских изделий. Стерилизация низкотемпературная пароформальдегидная. Требования к разработке, валидации и рутинному контролю процесса стерилизации
Дата актуализации: 10.08.2017

 ГОСТ Р ИСО 25424-2013
ГОСТ Р ИСО 25424-2013
Стерилизация медицинских изделий. Стерилизация низкотемпературная пароформальдегидная. Требования к разработке, валидации и рутинному контролю процесса стерилизации
| Обозначение: |  ГОСТ Р ИСО 25424-2013 ГОСТ Р ИСО 25424-2013 |
| Обозначение англ: |  GOST R ISO 25424-2013 GOST R ISO 25424-2013 |
| Статус: | введен впервые |
| Название рус.: | Стерилизация медицинских изделий. Стерилизация низкотемпературная пароформальдегидная. Требования к разработке, валидации и рутинному контролю процесса стерилизации |
| Название англ.: | Sterilization of medical devices. Low temperature steam and formaldehyde. Requirements for development, validation and routine control of a sterilization process for medical devices |
| Дата добавления в базу: | 21.05.2015 |
| Дата актуализации: | 05.05.2017 |
| Дата введения: | 01.01.2015 |
| Область применения: | Стандарт определяет требования к разработке, валидации и текущему контролю низкотемпературного пароформальдегидного процесса стерилизации (LTSF) медицинских изделий. Стандарт предназначен для применения разработчиками процессов, изготовителями стерилизационного оборудования, изготовителями медицинских изделий, подлежащих стерилизации, а также организациями, ответственными за стерилизацию медицинских изделий |
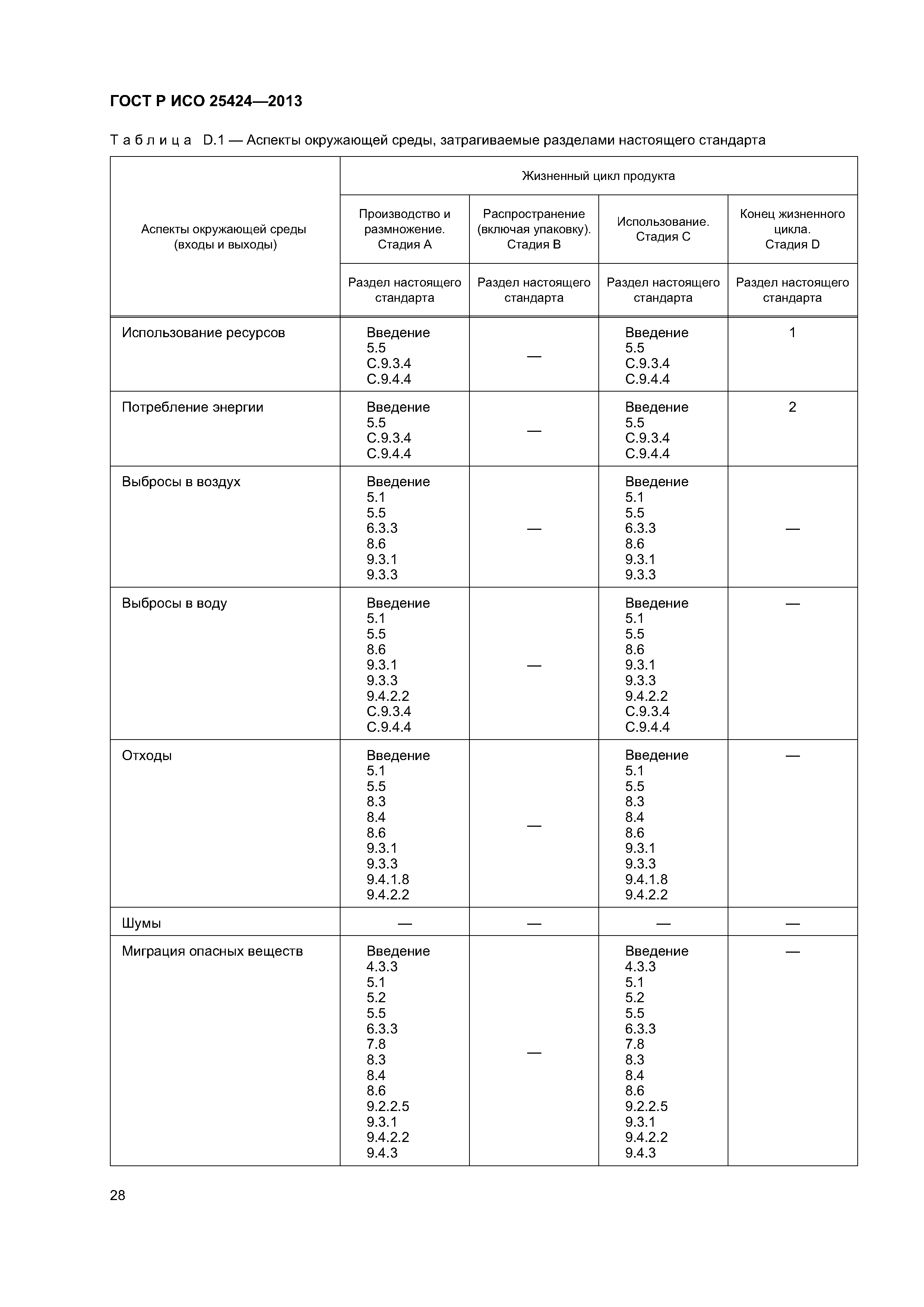
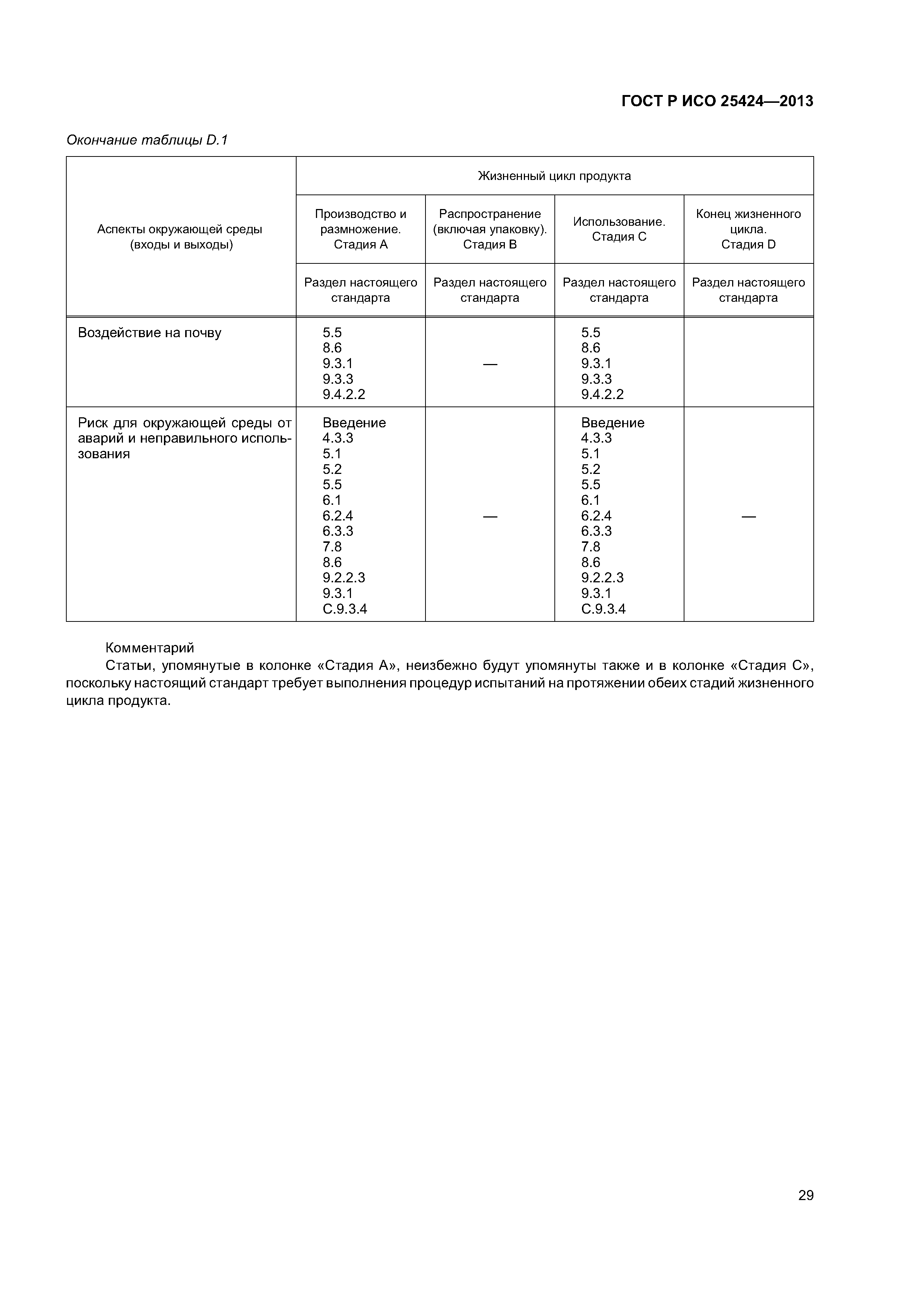
| Оглавление: | 1 Область применения 1.1 Включения 1.2 Исключения 2 Нормативные ссылки 3 Термины и определения 4 Элементы системы управления качеством 4.1 Документирование 4.2 Ответственность за управление 4.3 Реализация продукции 4.4 Контроль несоответствующей продукции 5 Характеристики стерилизующего агента 5.1 Общая информация 5.2 Стерилизующий агент 5.3 Микробоцидная эффективность 5.4 Воздействие на материалы 5.5 Воздействие на окружающую среду 6 Характеристики процесса и оборудования 6.1 Общая информация 6.2 Процесс 6.3 Оборудование 7 Определение продукта 8 Определение процесса 9 Валидация 9.1 Общая информация 9.2 Аттестация монтажа (IQ) 9.3 Аттестация эксплуатации (OQ) 9.4 Аттестация эксплуатируемого оборудования (PQ) 9.5 Анализ и утверждение валидации 10 Рутинный (текущий) мониторинг и контроль. 10.1 Общая информация 10.2 Биологические индикаторы 10.3 Химические индикаторы 10.4 Записи 11 Выпуск продукта после стерилизации 12 Поддержание эффективности процесса 12.1 Общая информация 12.2 Обслуживание оборудования 12.3 Реаттестация (повторная аттестация) 12.4 Оценка изменений Приложение А (обязательное) Определение процесса, основанное на инактивации контрольных микроорганизмов и знании бионагрузки на изделиях, подлежащих стерилизации Приложение В (обязательное) Определение процесса, основанное на инактивации контрольных микроорганизмов Приложение С (справочное) Руководство по применению настоящего стандарта Приложение D (справочное) Учет аспектов защиты окружающей среды при разработке, валидации и рутинном контроле процессов низкотемпературной пароформальдегидной стерилизации Приложение ДА (справочное) Сведения о соответствии ссылочных европейских региональных стандартов национальным стандартам Российской Федерации Библиография |
| Разработан: | ООО ФАРМСТЕР |
| Утверждён: | 07.05.2013 Федеральное агентство по техническому регулированию и метрологии (73-ст) |
| Издан: | Стандартинформ (2014 г. ) |
| Расположен в: |






































© 2013 Ёшкин Кот :-) Карта сайта