Информационная система |
| Карта сайта |
Скачать ГОСТ Р ИСО 11137-1-2008 Стерилизация медицинской продукции. Радиационная стерилизация. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий
Дата актуализации: 10.08.2017

 ГОСТ Р ИСО 11137-1-2008
ГОСТ Р ИСО 11137-1-2008
Стерилизация медицинской продукции. Радиационная стерилизация. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий
| Обозначение: |  ГОСТ Р ИСО 11137-1-2008 ГОСТ Р ИСО 11137-1-2008 |
| Обозначение англ: |  GOST R ISO 11137-1-2008 GOST R ISO 11137-1-2008 |
| Статус: | отменен |
| Название рус.: | Стерилизация медицинской продукции. Радиационная стерилизация. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий |
| Название англ.: | Sterilization of health care products. Radiation. Part 1. Requirements for development, validation and routine control of a sterilization process for medical devices |
| Дата добавления в базу: | 01.09.2013 |
| Дата актуализации: | 05.05.2017 |
| Дата введения: | 01.01.2013 |
| Область применения: | Стандарт содержит требования к разработке, валидации и текущему контролю процесса радиационной стерилизации медицинских изделий. Стандарт охватывает радиационные процессы с облучателями на основе: a) радионуклидов 60Со или 137Cs; b) генератора пучка электронов; c) рентгеновской установки. Стандарт не содержит требования к разработке, валидации и текущему контролю процесса инактивации агентов, вызывающих спонгиформные энцефалопатии, такие как скрепи, губчатая энцефалопатия крупного рогатого скота и болезнь Крейцфельда-Якоба. В отдельных странах разработаны особые рекомендации по обработке материалов, потенциально зараженных этими агентами. Стандарт не содержит требований для обозначения стерильных медицинских изделий. Настоящий стандарт не уточняет систему управления качеством на всех стадиях производства медицинских изделий. Стандарт не требует обязательного применения биологических индикаторов для валидации или контроля радиационной стерилизации, а также не требует проведения фармакопейных испытаний на стерильность для выпуска продукции в обращение. Стандарт не содержит требований к безопасности населения, связанной с конструкцией и работой радиационных установок. Стандарт не содержит требований к стерилизации использованных или переработанных изделий |
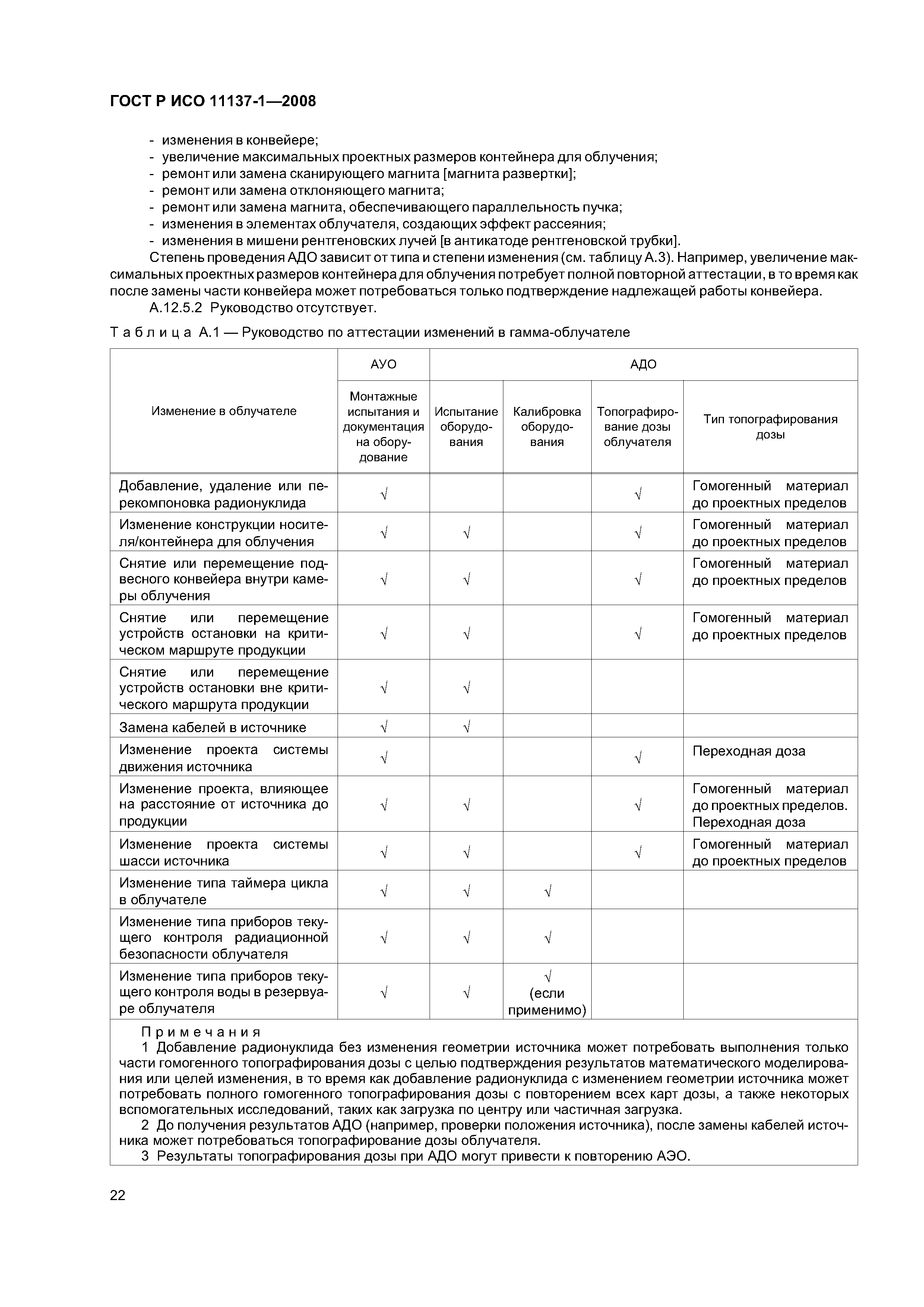
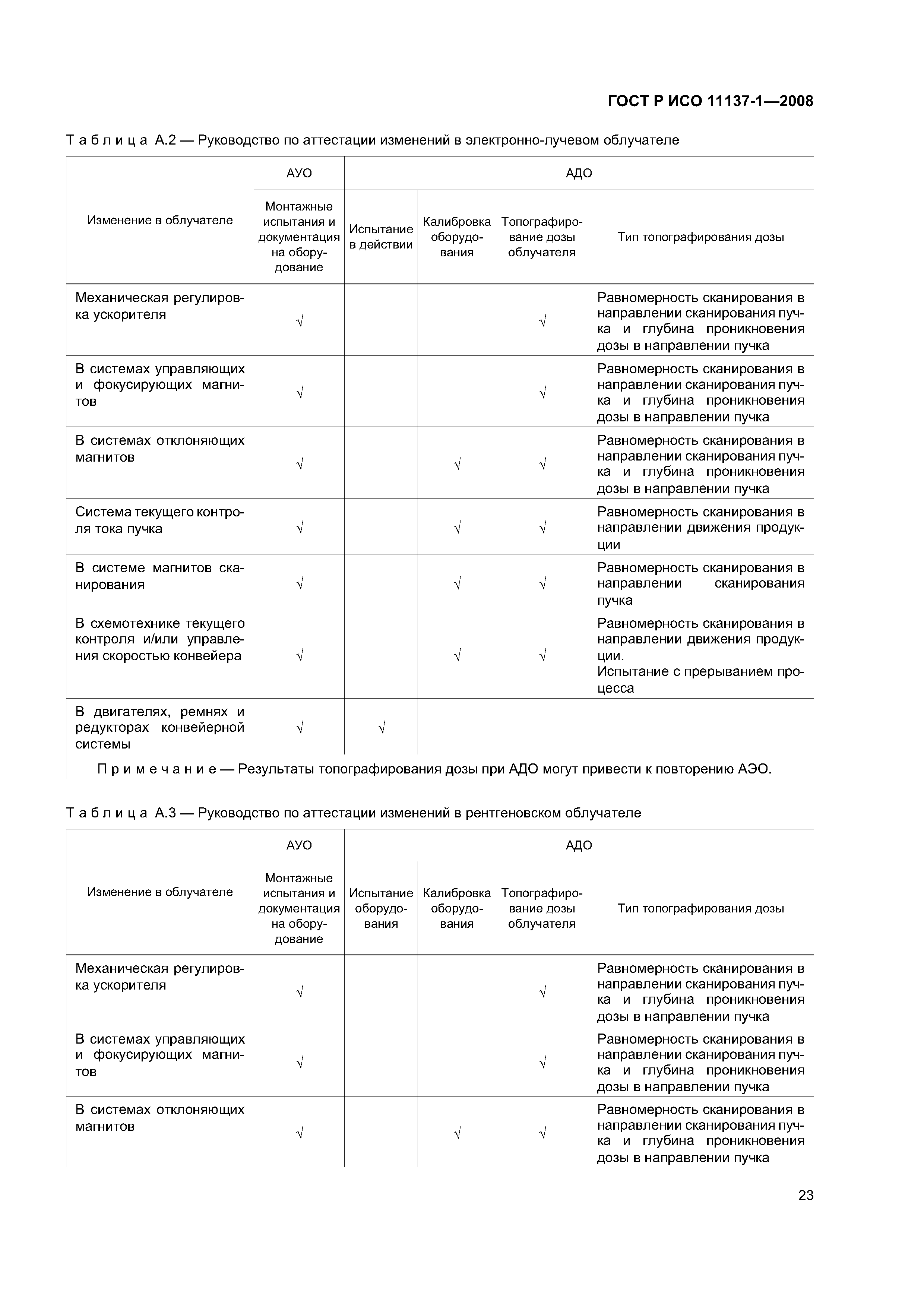
| Оглавление: | 1 Область применения 2 Нормативные ссылки 3 Термины и определения 4 Элементы системы управления качеством 4.1 Документация 4.2 Ответственность управления 4.3 Реализация продукции 4.4 Измерение, анализ и исправление. Управление несоответствующей продукцией 5 Составление технических требований на стерилизующий агент 5.1 Стерилизующий агент 5.2 Микробоцидная эффективность 5.3 Влияние материалов 5.4 Вопросы охраны окружающей среды 6 Составление технических требований на процесс и оборудование 6.1 Процесс 6.2 Оборудование 7 Определение продукции 8 Определение процесса 8.1 Определение максимально допустимой дозы 8.2 Определение стерилизующей дозы 8.3 Установление максимально допустимой дозы и стерилизующей дозы 8.4 Перенос значений максимально допустимой, проверочной и стерилизующей дозы с одного источника облучения на другой 9 Валидация 9.1 Аттестация установленного оборудования 9.2 Аттестация действующего оборудования 9.3 Аттестация эксплуатируемого оборудования 9.4 Анализ и утверждение валидации 10 Текущий контроль и управление 11 Выпуск продукции после стерилизации 12 Поддержание эффективности процесса 12.1 Демонстрация сохранения эффективности 12.2 Повторная калибровка 12.3 Обслуживание оборудования 12.4 Повторная аттестация оборудования 12.5 Оценка изменений Приложение А (рекомендуемое) Руководство Приложение В (справочное) Сведения о соответствии национальных стандартов Российской Федерации ссылочным международным стандартам Библиография |
| Разработан: | ООО ФАРМСТЕР |
| Утверждён: | 18.12.2008 Федеральное агентство по техническому регулированию и метрологии (573-ст) |
| Издан: | Стандартинформ (2009 г. ) |
| Расположен в: | |
| Нормативные ссылки: |
|





























© 2013 Ёшкин Кот :-) Карта сайта
 ГОСТ Р ИСО 11737-2-2003 «Стерилизация медицинских изделий. Микробиологические методы. Часть 2. Испытания на стерильность, проводимые при валидации процессов стерилизации»
ГОСТ Р ИСО 11737-2-2003 «Стерилизация медицинских изделий. Микробиологические методы. Часть 2. Испытания на стерильность, проводимые при валидации процессов стерилизации»