Информационная система |
| Карта сайта |
Скачать ГОСТ Р 52379-2005 Надлежащая клиническая практика
Дата актуализации: 10.08.2017

 ГОСТ Р 52379-2005
ГОСТ Р 52379-2005
Надлежащая клиническая практика
| Обозначение: |  ГОСТ Р 52379-2005 ГОСТ Р 52379-2005 |
| Обозначение англ: |  GOST R 52379-2005 GOST R 52379-2005 |
| Статус: | действует |
| Название рус.: | Надлежащая клиническая практика |
| Название англ.: | Good clinical practice (GCP) |
| Дата добавления в базу: | 01.09.2013 |
| Дата актуализации: | 05.05.2017 |
| Дата введения: | 01.04.2006 |
| Область применения: | Стандарт необходимо соблюдать при проведении клинических исследований, данные которых запланировано представить в уполномоченные органы. |
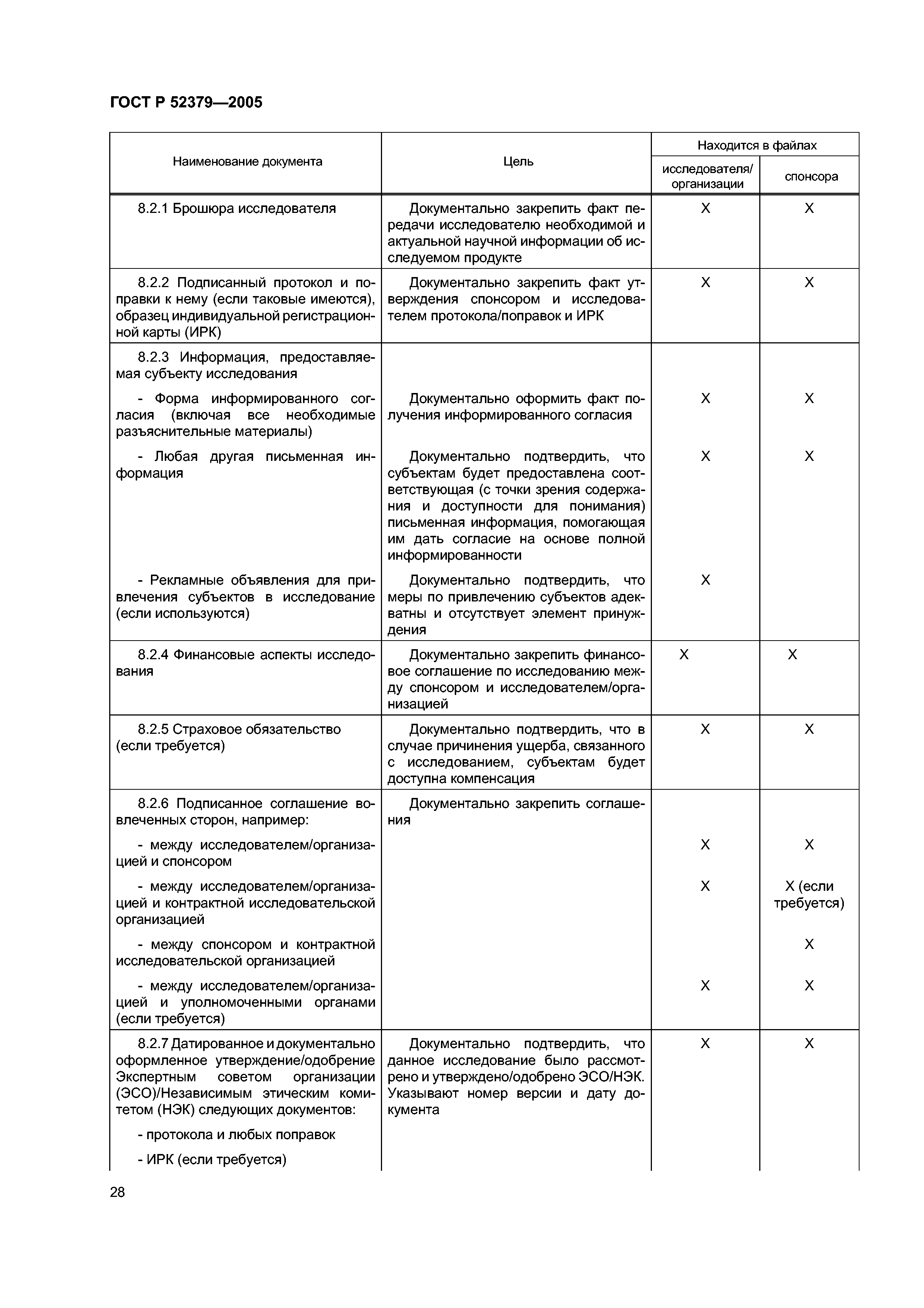
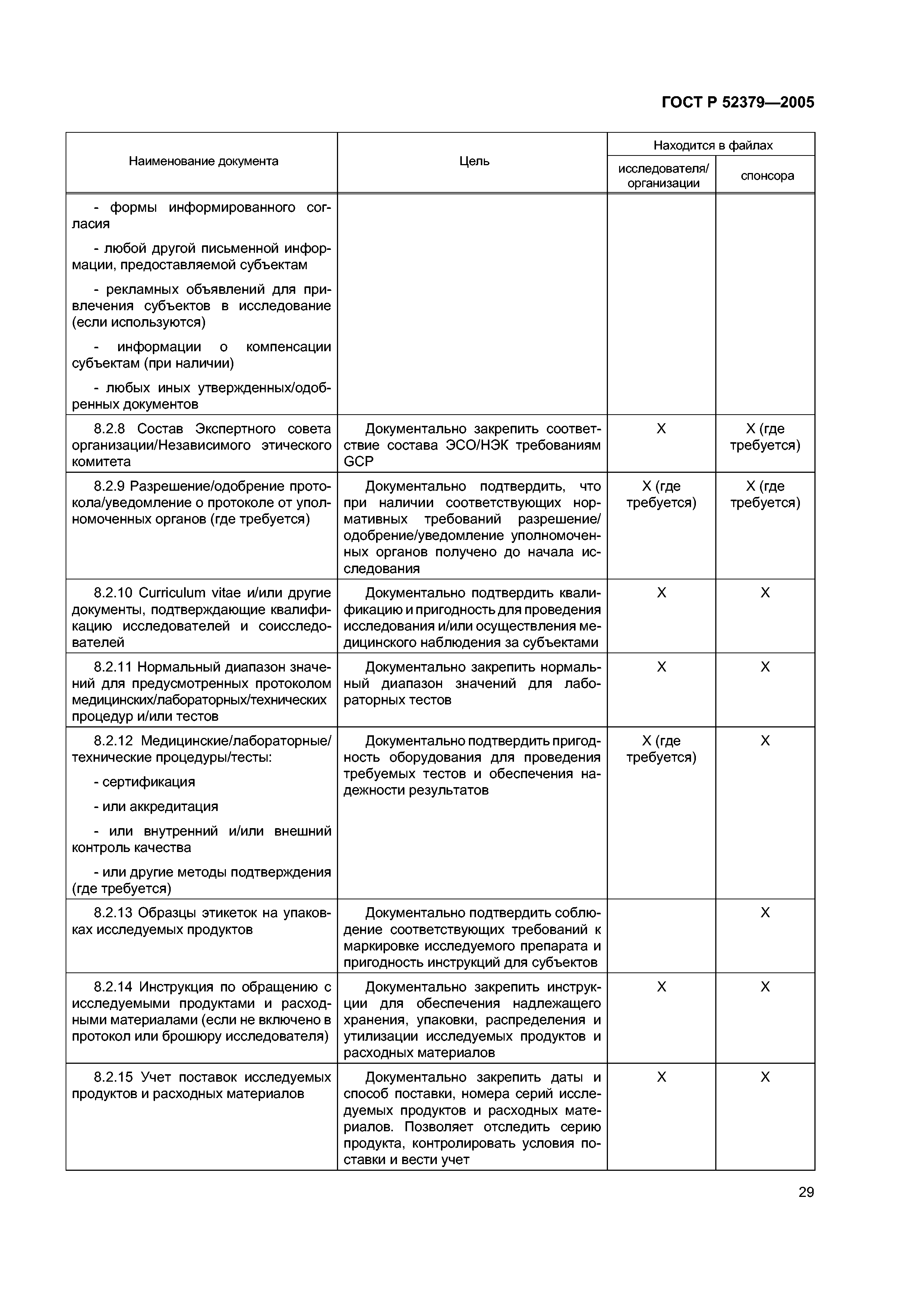
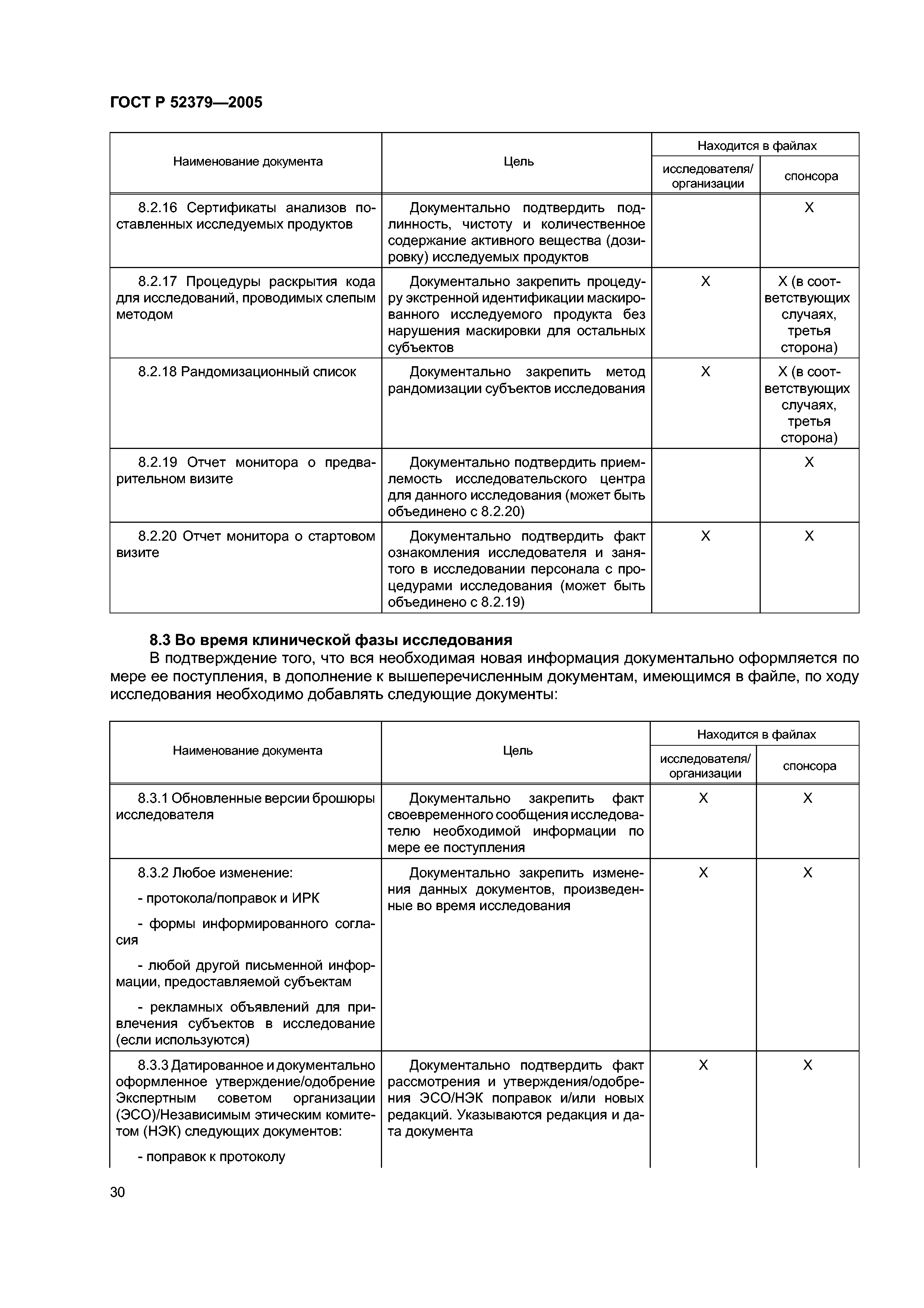
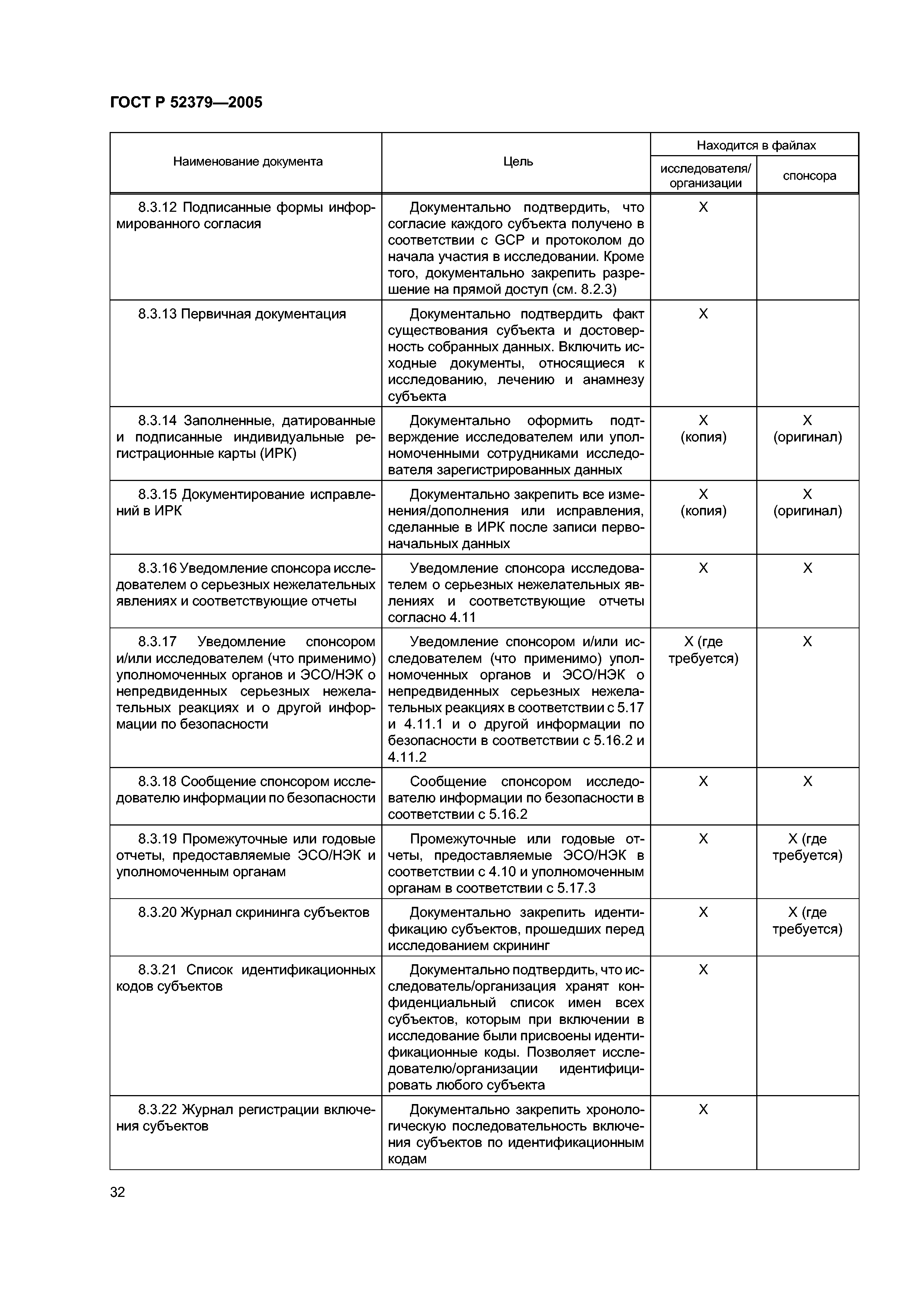
| Оглавление: | Область применения 1 Термины и определения 2 Принципы надлежащей клинической практики (GCP) 3 Экспертный совет организации/Независимый этический комитет (ЭСО/НЭК) 3.1 Обязанности 3.2 Состав, функции и порядок работы 3.3 Процедуры 3.4 Документация 4 Исследователь 4.1 Квалификация и обязательства исследователя 4.2 Соответствующие ресурсы 4.3 Оказание медицинской помощи субъектам исследования 4.4 Контакты с ЭСО/НЭК 4.5 Соблюдение протокола 4.6 Исследуемые продукты 4.7 Рандомизация и раскрытие кода 4.8 Информированное согласие субъектов исследования 4.9 Записи и отчеты 4.10 Отчеты о ходе исследования 4.11 Отчетность по безопасности 4.12 Преждевременное пркращение или приостановка исследования 4.13 Итоговый отчет исследователя 5 Спонсор 5.1 Обеспечение качества и контроль качества 5.2 Контрактная исследовательская организация 5.3 Медицинская квалификация 5.4 Дизайн исследования 5.5 Менеджмент исследования, работа с данными и ведение документации 5.6 Выбор исследователя 5.7 Распределение обязанностей 5.8 Компенсации субъектам и исследователям 5.9 Финансирование 5.10 Уведомление уполномоченных органов/подача заявки в уполномоченные органы 5.11 Подтверждение рассмотрения ЭСО/НЭК 5.12 Информация об исследуемых продуктах 5.13 Производство, упаковка, маркировка и кодирование исследуемых продуктов 5.14 Поставка исследуемых продуктов и правила обращения с ними 5.15 Доступ к записям 5.16 Информация, относящаяся к безопасности 5.17 Сообщения о нежелательных реакциях 5.18 Мониторинг 5.19 Аудит 5.20 Несоблюдение применимых требований 5.21 Досрочное прекращение или приостановка исследования 5.22 Отчет о клиническом исследовании/испытании 5.23 Многоцентровые исследования 6 Протокол клинического исследования и поправки к протоколу 6.1 Общая информация 6.2 Обоснование исследования 6.3 Цели и задачи исследования 6.4 Дизайн исследования 6.5 Отбор и исключение субъектов 6.6 Лечение субъектов 6.7 Оценка эффективности 6.8 Оценки безопасности 6.9 Статистика 6.10 Прямой доступ к первичным данным/документации 6.11 Контроль качества и обеспечние качества 6.12 Этика 6.13 Работа с данными и ведение записей 6.14 Финансирование и страхование 6.15 Публикации 6.16 Приложения 7 Брошюра исследователя 7.1 Введение 7.2 Общие положения 7.3 Содержание брошюры исследователя 7.4 Приложение 1 7.5 Приложение 2 8 Основные документы для проведения клинического исследования 8.1 Введение 8.2 Перед началом клинической фазы исследования 8.3 Во время клинической фазы исследования 8.4 После завершения или прекращения исследования |
| Разработан: | РАМН AIPM КонфОП |
| Утверждён: | 27.09.2005 Федеральное агентство по техническому регулированию и метрологии (232-ст) |
| Издан: | Стандартинформ (2005 г. ) Стандартинформ (2006 г. ) |
| Расположен в: |



































© 2013 Ёшкин Кот :-) Карта сайта