Информационная система |
| Карта сайта |
Скачать ГОСТ Р ИСО 13022-2016 Продукты медицинские, содержащие жизнеспособные человеческие клетки. Применение менеджмента риска и требований к методикам обработки
Дата актуализации: 10.08.2017

 ГОСТ Р ИСО 13022-2016
ГОСТ Р ИСО 13022-2016
Продукты медицинские, содержащие жизнеспособные человеческие клетки. Применение менеджмента риска и требований к методикам обработки
| Обозначение: |  ГОСТ Р ИСО 13022-2016 ГОСТ Р ИСО 13022-2016 |
| Обозначение англ: |  GOST R ISO 13022-2016 GOST R ISO 13022-2016 |
| Статус: | введен впервые |
| Название рус.: | Продукты медицинские, содержащие жизнеспособные человеческие клетки. Применение менеджмента риска и требований к методикам обработки |
| Название англ.: | Medical products containing viable human cells. Application of risk management and requirements for processing practices |
| Дата добавления в базу: | 01.02.2017 |
| Дата актуализации: | 05.05.2017 |
| Дата введения: | 01.01.2017 |
| Область применения: | В стандарте определены требования и руководство по методикам обработки и управлению рисками, связанными с жизнеспособными клеточными компонентами продуктов, относящихся к медицинским продуктам, биопрепаратам, медицинским изделиям и активным имплантируемым медицинским изделиям, а также их комбинациям. Стандарт включает жизнеспособные как аутологичные, так и аллогенные ткани человека, полученные от живых и трупных доноров. |
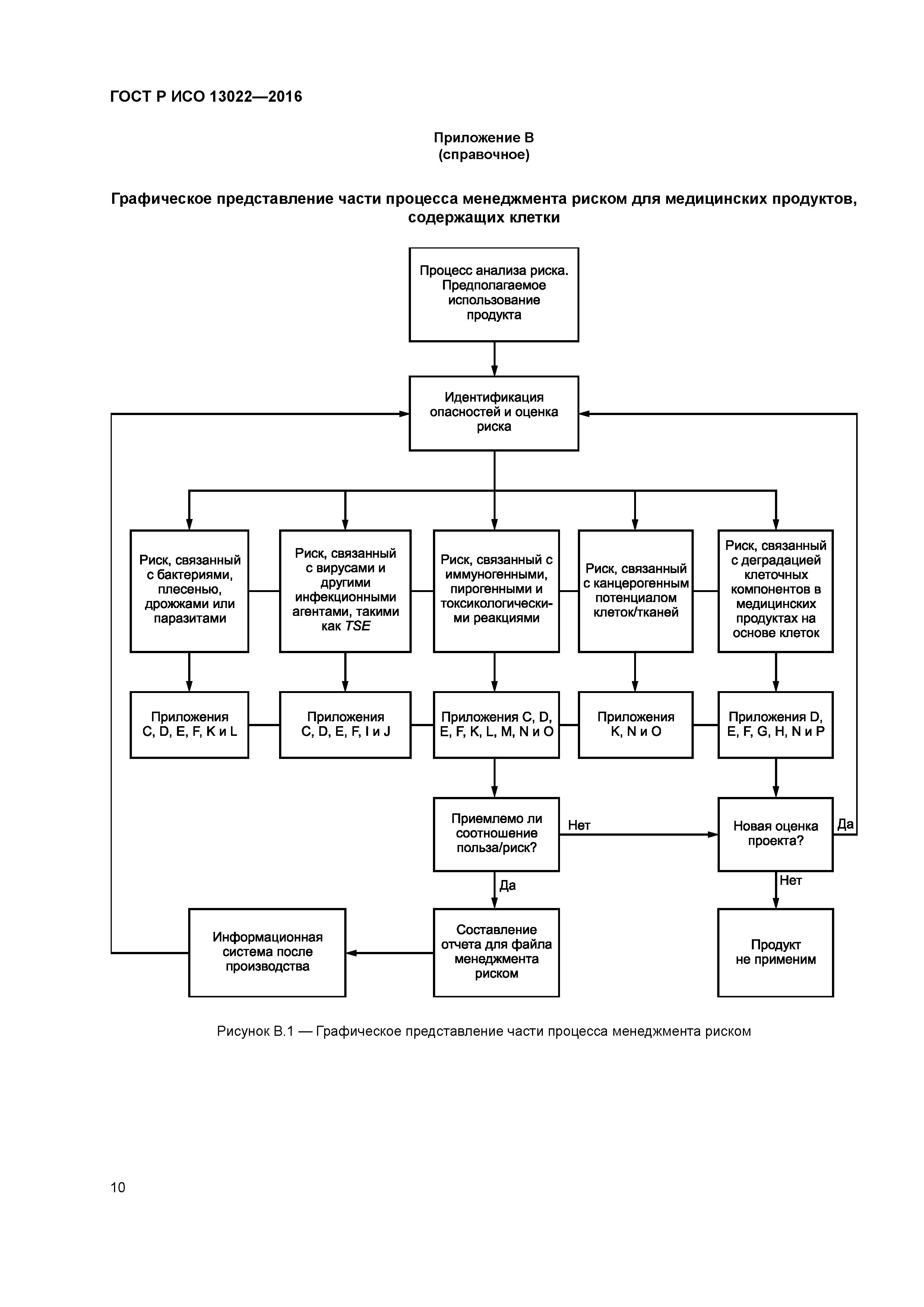
| Оглавление: | 1 Область применения 2 Нормативные ссылки 3 Термины и определения 4 Процесс менеджмента риска 4.1 Общие положения 4.2 Опасности, связанные с клеточными компонентами 4.3 Анализ риска 4.4 Оценивание риска 4.5 Контроль риска 4.6 Оценивание допустимости общего остаточного риска 4.7 Система получения информации на этапе производства и после производства Приложение А (справочное) Руководство по применению ИСО 13022 Приложение В (справочное) Графическое представление части процесса менеджмента риском для медицинских продуктов, содержащих клетки Приложение С (обязательное) Требования к выбору доноров и испытания Приложение D (справочное) Руководство по забору тканей Приложение Е (обязательное) Требования к обращению с клетками и тканями во время производства Приложение F (обязательное) Требования к упаковке и маркировке Приложение G (справочное) Руководство по транспортированию Приложение H (справочное) Руководство по хранению Приложение I (обязательное) Требования к системе контроля Приложение J (обязательное) Меры по снижению риска, связанного с заражением вирусами и другими инфекционными агентами, такими как ТЕ Приложение К (справочное) Руководство, касающееся опасностей, вызванных канцерогенным потенциалом человеческих клеток или тканей, используемых при производстве медицинских продуктов Приложение L (справочное) Руководство, касающееся микробиологической контаминации Приложение М (справочное) Руководство, касающееся потенциального негативного влияния неклеточных остатков продукта Приложение N (обязательное) Требования, касающиеся потенциального негативного влияния клеточных компонентов на медицинский продукт Приложение О (справочное) Руководство по описанию клеточных компонентов медицинских продуктов Приложение Р (справочное) Клиническая оценка и испытания Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов национальным и межгосударственным стандартам Библиография |
| Разработан: | АНО ИМБИИТ |
| Утверждён: | 01.03.2016 Федеральное агентство по техническому регулированию и метрологии (102-ст) |
| Издан: | Стандартинформ (2016 г. ) |
| Расположен в: | |
| Нормативные ссылки: |
|
















































© 2013 Ёшкин Кот :-) Карта сайта
 ГОСТ Р ИСО 22442-1-2011 «Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 1. Менеджмент риска»
ГОСТ Р ИСО 22442-1-2011 «Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 1. Менеджмент риска»