Информационная система |
| Карта сайта |
Скачать ГОСТ Р 52249-2004 Правила производства и контроля качества лекарственных средств
Дата актуализации: 10.08.2017


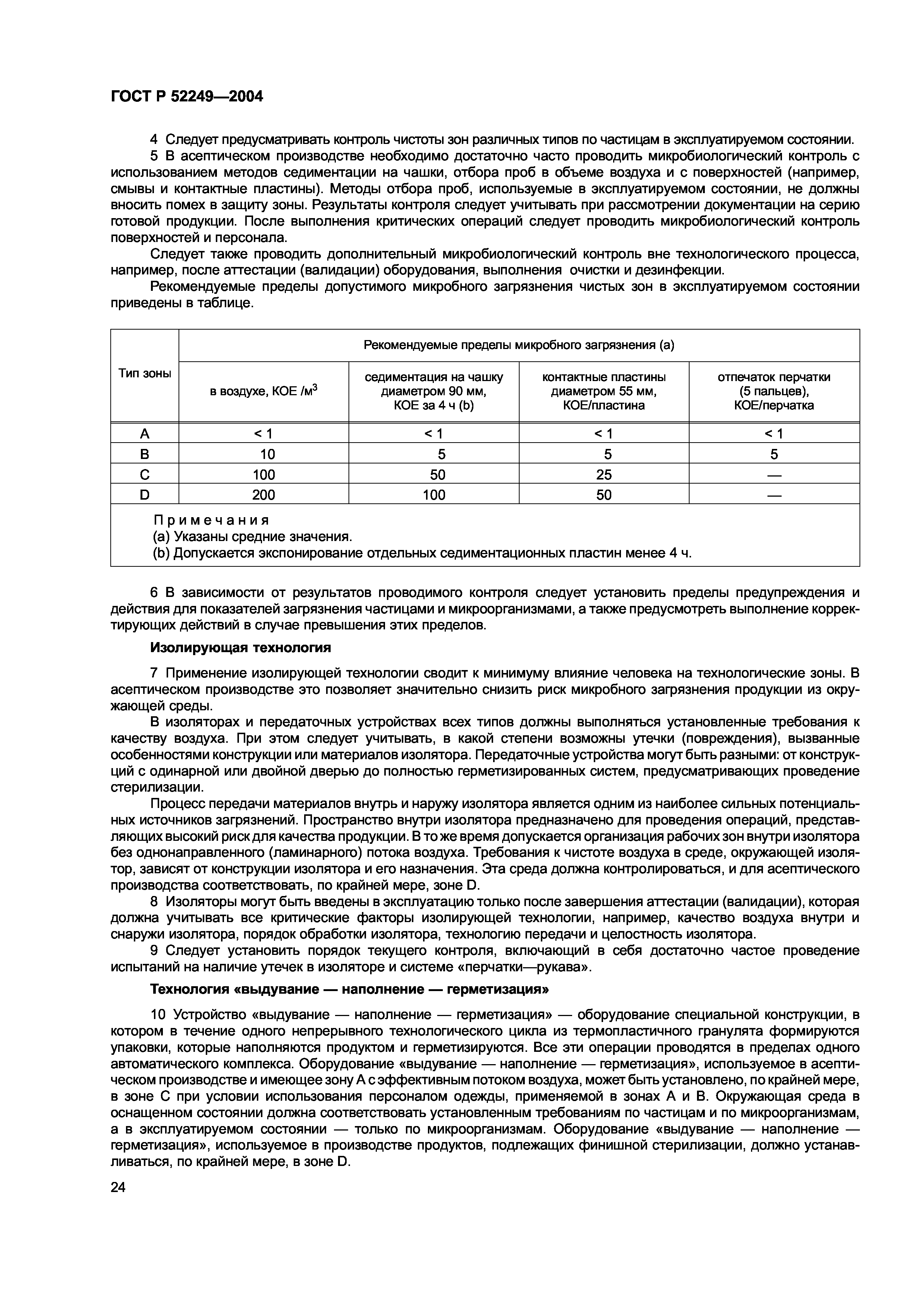
 ГОСТ Р 52249-2004
ГОСТ Р 52249-2004
Правила производства и контроля качества лекарственных средств
| Обозначение: |   ГОСТ Р 52249-2004 ГОСТ Р 52249-2004 |
| Обозначение англ: |   GOST R 52249-2004 GOST R 52249-2004 |
| Статус: | не действует |
| Название рус.: | Правила производства и контроля качества лекарственных средств |
| Название англ.: | Good manufacturing practice for medicinal products (GMP) |
| Дата добавления в базу: | 01.09.2013 |
| Дата актуализации: | 05.05.2017 |
| Дата введения: | 01.01.2005 |
| Дата окончания срока действия: | 01.01.2010 |
| Область применения: | Стандарт устанавливает требования к производству и контролю качества лекарственных средств для человека и животных. Стандарт распространяется на все виды лекарственных средств и устанавливает общие требования к их производству и контролю качества, а также специальные требования к производству отдельных видов лекарственных средств. Стандарт не распространяется на обеспечение промышленной безопасности, пожарной безопасности, взрывобезопасности, химической безопасности и безопасности других видов при производстве лекарственных средств, требования к которым приведены в других нормативных документах. |
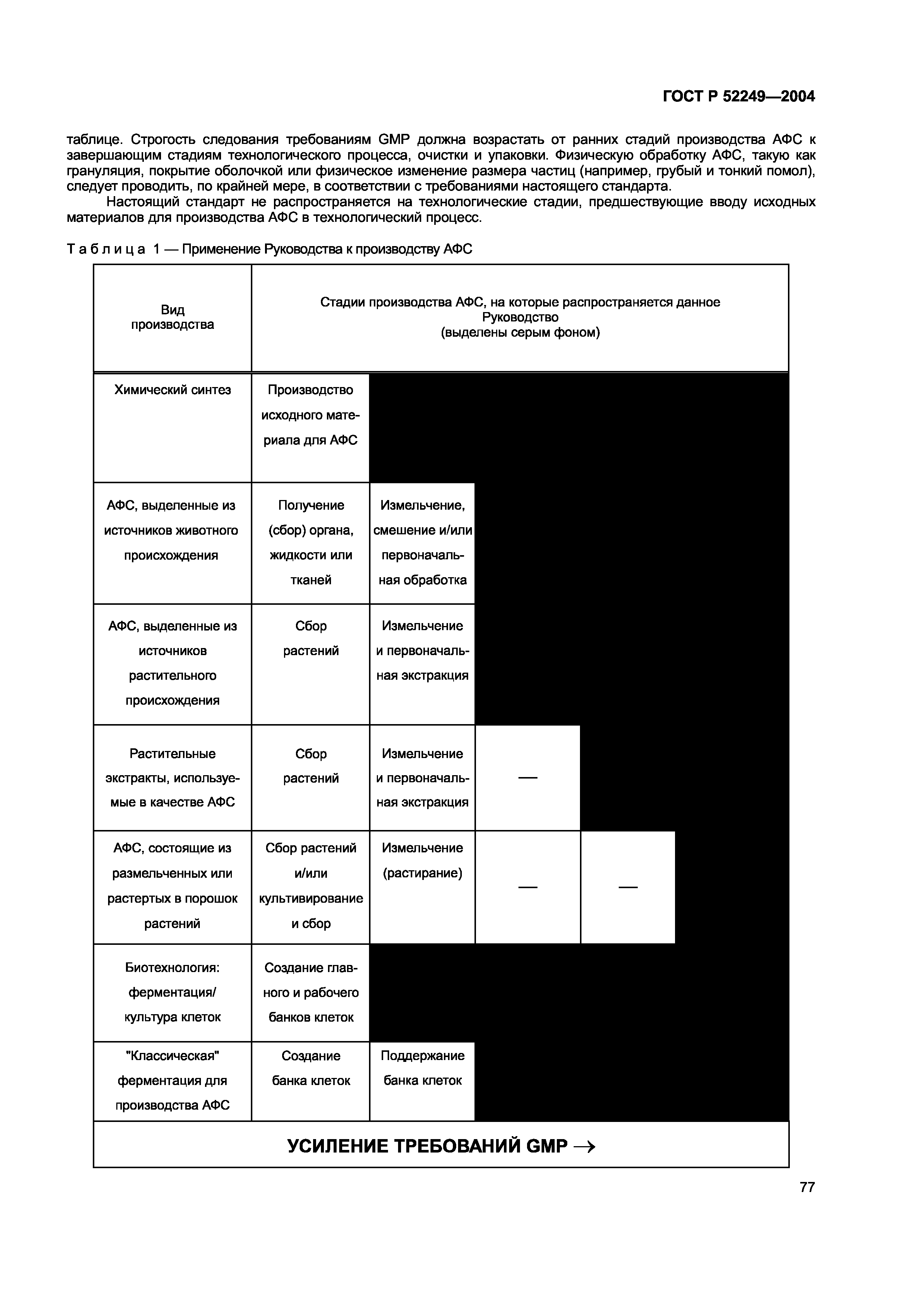
| Оглавление: | Область применения Основные требования 1 Управление качеством 2 Персонал 3 Помещения и оборудование 4 Документация 5 Производство 6 Контроль качества 7 Работа по контрактам на производство продукции и проведение анализов 8 Рекламации и отзыв продукции 9 Самоинспекция Приложение 1 Производство стерильных лекарственных средств Приложение 2 Производство медицинских биологических препаратов Приложение 3 Производство радиофармацевтических препаратов Приложение 4 Производство лекартсвенных средств для животных (кроме имунных препаратов) Приложение 5 Производство иммунных лекарственных средств для животных Приложение 6 Производство медицинских газов Приложение 7 Производство лекарственных средств из растительного сырья Приложение 8 Отбор проб исходных и упаковочных материалов Приложение 9 Производство жидкостей. Кремов и мазей Приложение 10 Производство аэрозолей для ингаляций Приложение 11 Системы с компьютерным управлением и контролем Приложение 12 Использование ионизирующего излучения в производстве лекарственных средств Приложение 13 Производство лекарственных средств для клинических исследований Приложение 14 Производство лекарственных средств из крови или плазмы человека Приложение 15 Аттестация процессов и оборудования Приложение 16 Подтверждение соответствия серии продукции с целью ее выпуска, выполняемое Уполномоченным лицом Приложение 17 Выпуск по параметрам Приложение 18 Руководство по производству активных фармацевтических субстанций (АФС) Общие термины и определения |
| Разработан: | АСИНКОМ ТК 458 Производство и контроль качества лекарственных средств |
| Утверждён: | 10.03.2004 Госстандарт России (Russian Federation Gosstandart 160-ст) |
| Издан: | ИПК Издательство стандартов (2004 г. ) ИПК Издательство стандартов (2005 г. ) |
| Расположен в: | |
| Чем заменён: | |
| Нормативные ссылки: |
|















































































































© 2013 Ёшкин Кот :-) Карта сайта
 ГОСТ Р 52249-2009 «Правила производства и контроля качества лекарственных средств»
ГОСТ Р 52249-2009 «Правила производства и контроля качества лекарственных средств»