 | Информационная система |  |
РД 52.24.515-2005
Федеральная
служба по гидрометеорологии и мониторингу
окружающей среды
РУКОВОДЯЩИЙ ДОКУМЕНТ
МАССОВАЯ
КОНЦЕНТРАЦИЯ ДИОКСИДА УГЛЕРОДА В
ПОВЕРХНОСТНЫХ ВОДАХ СУШИ. МЕТОДИКА
ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ ТИТРИМЕТРИЧЕСКИМ И
РАСЧЕТНЫМ МЕТОДАМИ
Предисловие
1 РАЗРАБОТАН ГУ «Гидрохимический институт»
2 РАЗРАБОТЧИКИ Л.В. Боева, канд. хим. наук, Е.Л. Селютина
3 УТВЕРЖДЕН Заместителем Руководителя Росгидромета 15.06.2005 г.
4 СВИДЕТЕЛЬСТВО ОБ АТТЕСТАЦИИ МВИ Выдано ГУ «Гидрохимический институт» 30.12.2004 г. № 169.24-2004
5 ЗАРЕГИСТРИРОВАН ГУ ЦКБ ГМП за номером РД 52.24.515-2005 от 30.06.2005 г.
6 ВВЕДЕН ВПЕРВЫЕ
СОДЕРЖАНИЕ
Введение
Диоксид углерода имеет исключительно важное значение для растительных организмов (как источник углерода). В то же время повышенные концентрации СО2 угнетающе действуют на живые организмы.
При высоких концентрациях СО2 воды становятся агрессивными по отношению к металлам и бетону в результате образования растворимых гидрокарбонатов, нарушающих структуру этих материалов.
Одним из основных источников поступления диоксида углерода в поверхностные воды являются процессы биохимического распада органических остатков, окисления органических веществ, дыхания водных организмов, которые протекают как в воде, так и в илах, донных отложениях и почвах, с которыми соприкасается вода.
Повышение концентрации диоксида углерода в подземных водах обусловлено выделением вулканических газов, образующихся в недрах земли при отсутствии контакта с атмосферой.
Одновременно с процессами поступления значительная часть диоксида углерода в водном объекте потребляется при фотосинтезе, а также расходуется на растворение карбонатов и алюмосиликатов:
СаСО3 + СO2 + Н2О ↔ Са(НСО3)2; (1)
![]()
Уменьшение концентрации диоксида углерода в воде происходит также в результате выделения его в атмосферу.
Диоксид углерода содержится в основном в виде растворенных молекул CO2 и лишь малая часть его (около 1 %) при взаимодействии с водой образуют угольную кислоту
CO2 + H2O ↔ H2CO3 (2)
Содержание диоксида углерода в воде в значительной мере определяется величиной рН. При рН ниже 4,5 из всех компонентов карбонатного равновесия в воде присутствует практически только диоксид углерода и угольная кислота. При рН 8,3 и выше содержанием диоксида углерода можно пренебречь. Соотношения концентраций производных угольной кислоты в зависимости от величины рН приведены в таблице 1.
Таблица 1 - Мольные доли, %, производных угольной кислоты, в зависимости от величины рН (без учета коэффициентов активности)
|
pН |
|||||||||
|
4 |
5 |
6 |
7 |
8 |
8,3 |
9 |
10 |
11 |
|
|
H2CO3 + C |
99,5 |
95,4 |
87,7 |
17,3 |
2,0 |
1,0 |
0,2 |
- |
- |
|
O2 |
0,5 |
4,6 |
32,3 |
82,7 |
87,4 |
97,8 |
94,1 |
62,1 |
14,3 |
|
HCO3- CO32- |
- |
|
|
- |
0,6 |
1,2 |
5,7 |
37,5 |
85,7 |
Концентрация диоксида углерода в природных водах колеблется от нескольких десятых долей до 3 - 4 мг/дм3, изредка достигает 10 - 20 мг/дм3. В глубинных подземных водах концентрация диоксида углерода нередко гораздо выше.
Содержание диоксида углерода в воде зависит как от времени года, так и времени суток. Обычно весной и летом оно понижается, а в конце зимы достигает максимума. В меньшей степени выражены суточные колебания концентрации СO2.
РД 52.24.515-2005
РУКОВОДЯЩИЙ ДОКУМЕНТ
|
МАССОВАЯ КОНЦЕНТРАЦИЯ
ДИОКСИДА УГЛЕРОДА В |
Дата введения 2005-07-01
1 Область применения
Настоящий руководящий документ устанавливает методику выполнения измерений (далее - методика) массовой концентрации диоксида углерода в пробах поверхностных вод суши в диапазоне от 1 до 30 мг/дм3 титриметрическим методом и методику расчета массовой концентрации диоксида углерода на основании известных значений массовой концентрации гидрокарбонатов, рН, температуры и суммы ионов.
2 Характеристики погрешности измерений
2.1 При соблюдении всех регламентируемых методикой условий проведения измерений характеристики погрешности результата измерения с вероятностью 0,95 не должны превышать значений, приведенных в таблицах 2, 3.
Предел обнаружения диоксида углерода титриметрическим методом составляет 0,6 мг/дм3.
2.2 Значения показателя точности методики используют при:
- оформлении результатов измерений, выдаваемых лабораторией;
- оценке деятельности лабораторий на качество проведения измерений;
- оценке возможности использования результатов измерений при реализации методики в конкретной лаборатории.
Таблица 2 - Диапазон измерений, значения характеристик погрешности и ее составляющих при выполнении измерений титриметрическим методом
|
Диапазон измерений массовой концентрации диоксида углерода X, мг/дм3 |
Показатель повторяемости (среднеквадратическое отклонение повторяемости) σr, мг/дм3 |
Показатель воспроизводимости (среднеквадратическое отклонение воспроизводимости) σR, мг/дм3 |
Показатель правильности (границы систематической погрешности при вероятности Р = 0,95) ± Δc, мг/дм3 |
Показатель точности (границы погрешности при вероятности Р = 0,95) ± Δ, мг/дм3 |
|
От 1,0 до 12,0 включ. |
0,3 |
0,4 |
0,2 |
0,8 |
|
Св. 12,0 до 30,0 включ. |
0,3 |
0,6 |
0,4 |
1,3 |
Таблица 3 - Значения характеристик погрешности при вычислении массовой концентрации диоксида углерода расчетом (Р = 0,95)
|
Показатель точности расчета массовой концентрации X диоксида углерода (границы погрешности при вероятности Р = 0,95) ± δ, % |
||
|
При измерении массовой концентрации гидрокарбонатов методом обратного титрования |
При измерении массовой концентрации гидрокарбонатов потенциометрическим титрованием |
|
|
От 10 до 20 включ. |
28 |
26 |
|
Св. 20 до 30 включ. |
19 |
17 |
|
Св. 30 до 50 включ. |
17 |
15 |
|
Св. 50 до 100 включ. |
15 |
14 |
|
Св. 100 |
13 |
12 |
3 Выполнение измерений массовой концентрации диоксида углерода титриметрическим методом
3.1 Средства измерений, вспомогательные устройства, реактивы, материалы
3.1.1 При выполнении измерений применяют следующие средства измерений и вспомогательные устройства
3.1.1.1 Весы аналитические 2 класса точности по ГОСТ 24104-2001.
3.1.1.2 Весы технические лабораторные 4 класса точности по ГОСТ 24104-2001 с пределом взвешивания 500 г.
3.1.1.3 Термометр по ГОСТ 29224-91 с ценой деления не более 0,2 °С.
|
3.1.1.4 Колбы мерные не ниже 2 класса точности по ГОСТ 1770-74 вместимостью: |
100 см3 - 2 шт. |
|
250 см3 - 1 шт. |
|
|
500 см3 - 1 шт. |
|
|
5 см3 - 1 шт. |
|
|
3.1.1.5 Пипетки градуированные не ниже 2 класса точности по ГОСТ 29227-91 вместимостью: |
1 см3 - 1 шт. |
|
2 см3 - 1 шт. |
|
|
3.1.1.6 Пипетки с одной отметкой не ниже 2 класса точности по ГОСТ 29169-91 вместимостью: |
20 см3 -1 шт. |
|
25 см3 - 1 шт. |
|
|
3.1.1.7 Микробюретки не ниже 2 класса точности по ГОСТ 29251-91 или пипетки градуированные стеклянные по ГОСТ 29227-91 (исполнения 4, 6) или пластиковые вместимостью: |
1 см3 - 1 шт. |
|
2 см3 - 1 шт. |
|
|
5 см3 - 1 шт. |
|
|
3.1.1.8 Колбы мерные по ГОСТ 1770 -74 вместимостью: |
200 (250) см3 - 6 шт. |
|
или колбы конические или склянки с притертыми пробками калиброванные (3.6.3) вместимостью: |
200 - 250 см3 - 6 шт. |
|
3.1.1.9 Стаканчики для взвешивания (бюксы) по ГОСТ 25336 -82 |
- 2 шт. |
|
3.1.1.10 Воронки лабораторные по ГОСТ 25336-82 диаметром: |
56 мм - 1 шт. |
|
75 мм - 1 шт. |
|
|
3.1.1.11 Чашка фарфоровая по ГОСТ 9147-80 вместимостью: |
50 см3 - 1 шт. |
|
3.1.1.12 Эксикатор по ГОСТ 2533-88 |
- 1 шт. |
3.1.1.13 Шкаф сушильный общелабораторного назначения.
3.1.1.14 Плитка электрическая с закрытой спиралью по ГОСТ 14919-83.
3.1.1.15 Флакон пластиковый вместимостью 0,25 - 0,5 дм3 или шприц пластиковый вместимостью 100 - 150 см3 или ампулы стеклянные вместимостью 5 см3.
3.1.1.16 Соединительные трубки резиновые (силиконовые) с зажимами и стеклянные.
Допускается использование других типов средств измерений, посуды и вспомогательного оборудования, в том числе импортных, с характеристиками не хуже, чем у приведенных в 3.1.1.
3.1.2 При выполнении измерений применяют следующие реактивы и материалы
3.1.2.1 Натрий углекислый безводный (карбонат натрия) по ГОСТ 83-79, х.ч.
3.1.2.2 Кислота соляная по ГОСТ 3118-77, ч.д.а.
3.1.2.3 Медь (II) сернокислая 5-водная (сульфат меди) CuSO4 · 5H2O по ГОСТ 4165-78, ч.д.а.
3.1.2.4 Кобальт хлористый 6-водный (хлорид кобальта) СоСl2 · 6Н2O по ГОСТ 4525-77, ч.д.а.
3.1.2.5 Калий-натрий виннокислый 4-водный (тартрат калия-натрия, тетрагидрат, сегнетова соль) KNaH4C4O6 · 4 Н2O, по ГОСТ 5845-79, ч.д.а.
3.1.2.6 Фенолфталеин по ТУ 6-09-05-629-77, ч.д.а.
3.1.2.7 Натронная известь по ГОСТ 22688-77 или аскарит по МРТУ 6-09-6592.
3.1.2.8 Спирт этиловый по ГОСТ 18300-87 (допустима замена на спирт пропиловый по ТУ 6-09-4344-77, ч.).
3.1.2.9 Вода дистиллированная по ГОСТ 6709-72.
Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных, с квалификацией не ниже указанной в 3.1.2.
3.2 Метод измерений
Выполнение измерений массовой концентрации диоксида углерода титриметрическим методом основано на количественном переводе растворенного СO2 (угольной кислоты) в гидрокарбонат-ионы НСО3- при титровании пробы воды карбонатом натрия Na2CO3 до рН 8,3 в присутствии индикатора фенолфталеина:
Н2СO3 + Со32- = 2НСO3- (3)
Индикация конечной точки титрования производится по специально приготовленному свидетелю (раствору сравнения) на основе раствора сульфата меди и хлорида кобальта. Выполнению измерений могут мешать высокая минерализация воды (более 1 г/дм3), повышенное содержание ионов Са2+ и Mg2+ (жесткость более 10 ммоль/дм3), взвешенные и окрашенные вещества (цветность выше 100 градусов), а также другие слабые кислоты, присутствующие в высоких концентрациях (кремневая и др.). При наличии мешающих веществ следует проводить расчетное определение концентрации диоксида углерода.
3.3 Требования безопасности, охраны окружающей среды
3.3.1 При выполнении измерений массовой концентрации диоксида углерода в пробах поверхностных вод суши соблюдают требования безопасности, установленные в государственных стандартах и соответствующих нормативных документах.
3.3.2 По степени воздействия на организм вредные вещества, используемые при выполнении измерений, относятся к 3, 4 классам опасности по ГОСТ 12.1.007-76.
3.3.3 Содержание используемых вредных веществ в воздухе рабочей зоны не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005-88.
3.3.4 Особых требований по экологической безопасности не предъявляется.
3.4 Требования к квалификации операторов
К выполнению измерений и обработке их результатов допускаются лица со средним профессиональным образованием или без профессионального образования, но имеющие стаж работы не менее года, освоившие методику.
3.5 Условия выполнения измерений
Условия выполнения измерений массовой концентрации диоксида углeрoдa не регламентируются поскольку измерение проводится на месте отбора проб.
Отбор проб из водного объекта производят в соответствии с ГОСТ 17.1.5.05-85 и ГОСТ Р 51592-2000. Отбор аликвот пробы для определения диоксида углерода следует проводить немедленно после отбора пробы (после отбора аликвот для определения кислорода). Отбор аликвот производится с помощью сифона в две мерные колбы вместимостью 200 или 250 см3. При этом следует (во избежание перемешивания воды с воздухом) опустить стеклянный наконечник (нижний конец сифона) до дна колбы и приподнимать к поверхности воды в колбе по мере ее наполнения. Колбы наполняют до метки и закрывают пробкой. Предварительно, перед заполнением, мерные колбы 2 - 3 раза ополаскивают анализируемой водой. Анализ пробы выполняют сразу после отбора, хранить пробы недопустимо.
При выполнении работ на лодках или небольших судах, где возможна сильная качка, допускается отбор аликвот пробы для титрования производить не в мерные колбы, а в более устойчивые конические колбы вместимостью 250 см3 со шлифом и пластиковой пробкой или склянки той же вместимости с притертой пробкой. Предварительно эти колбы или склянки должны быть откалиброваны (см. 3.7.3).
3.7 Подготовка к выполнению измерений
3.7.1 Приготовление растворов и реактивов
3.7.1.1 Раствор карбоната натрия, NaСО3
Раствор карбоната натрия является неустойчивым. Во избежание изменения концентрации карбоната за счет поглощения диоксида углерода из воздуха, контакт раствора с атмосферой следует свести к минимуму. Допускаются три варианта приготовления, хранения и использования раствора, позволяющие устранить возможность изменения концентрации карбоната натрия:
а) в полевых условиях раствор карбоната натрия готовят из навески 0,40 - 0,45 г карбоната натрия, взвешенной с точностью до четвертого знака после запятой и помещенной в запаянную ампулу. Навески готовятся в лаборатории из карбоната натрия, предварительно высушенного при температуре 270 °С.
Перед выполнением анализа содержимое одной ампулы количественно переносят в мерную колбу вместимостью 200 или 250 см3, несколько раз ополаскивая ампулу, и растворяют в дистиллированной воде, свободной от СO2 (см. 3.7.1.5). Точную концентрацию раствора карбоната натрия Ск, моль/ дм3, рассчитывают по формуле
![]() (4)
(4)
где m - навеска карбоната натрия, г;
М - масса моля карбоната натрия, равная 106 г/моль;
V - вместимость мерной колбы, см3
Раствор карбоната натрия используют не более суток. Хранят в плотно закрытой посуде;
б) в том случае, когда приготовление раствора карбоната натрия по варианту а) затруднительно, его готовят в лаборатории из высушенного при 270 °C карбоната натрия на дистиллированной воде, свободной от СO2. Приготовленный раствор немедленно переносят в пластиковый флакон вместимостью 0,25 - 0,5 дм3 (рисунок 1) так, чтобы уровень раствора примерно на 0,5 - 1 см не доходил до пробки (раствор следует приготовить с избытком).
1, 2 - зажимы; 3 - резиновые (силиконовые) трубки; 4 - стеклянные трубки; 5 - хлоркальциевая трубка; 6 - флакон
Рисунок 1 - Схема приспособления для хранения раствора карбоната натрия
Склянку плотно закрывают резиновой пробкой, в которую вставлены две стеклянные трубки, одна из которых опущена до дна, а сверху соединена с резиновой (силиконовой) трубкой с зажимом 1. Вторая трубка должна находиться над раствором и соединяться с помощью резиновой трубки с хлоркальциевой трубкой, заполненной натронной известью или аскаритом. Пробка и стеклянные трубки должны быть предварительно тщательно вымыты и высушены. Открывают зажим 1 и сливают примерно 1/10 часть раствора (для того, чтобы при транспортировании раствор не заливал верхнюю трубку). После этого резиновую трубку перед хлоркальциевой трубкой перекрывают зажимом 2 и в таком виде хранят и транспортируют раствор.
ВНИМАНИЕ! ХЛОРКАЛЬЦИЕВАЯ ТРУБКА НЕ ДОЛЖНА НАХОДИТЬСЯ НАД РАСТВОРОМ!
Хранят раствор в течение месяца. Для заполнения микробюретки убирают зажим 2, затем открывают зажим 1, сливают немного раствора для промывания трубки, а затем заполняют баллон микробюретки. Если используется микробюретка, приготовленная из пипетки, можно трубку присоединить к верхнему концу пипетки, убрать зажим 1 и, отжимая бусинку, заполнить пипетку, после чего перекрыть трубки зажимами. При титровании трубка должна быть удалена с пипетки. После работы раствор карбоната натрия из микробюретки удаляют и ополаскивают ее дистиллированной водой;
в) наиболее простым способом хранения небольшого количества раствора является помещение его сразу после приготовления в пластиковый шприц вместимостью 100 - 150 см3. Новый шприц следует тщательно вымыть и выдержать с разбавленным раствором карбоната натрия несколько дней, затем вымыть дистиллированной водой. Перед заполнением ополоснуть тем раствором, которым шприц будет заполнен. Заполнять шприц следует не более, чем на 2/3 объема. После заполнения на шприц надевают резиновую трубку с зажимом. Для транспортирования шприц помещают в пластиковый или жесткий картонный футляр (коробку), чтобы случайно не нажать на поршень. Для заполнения микробюретки к ней присоединяют трубку, открывают зажим и, надавливая поршень шприца, подают раствор в микробюретку. После заполнения зажимают трубку и отсоединяют ее от микробюретки. Поршень возвращать на место не следует!
3.7.1.2 Раствор фенолфталеина, 1 мг/см3
0,10 г фенолфталеина растворяют в 100 см3 96 %-ного этилового или пропилового спирта. Раствор хранят в плотно закрытой склянке в темноте.
3.7.1.3 Раствор сравнения (свидетель)
Для приготовления основного раствора отвешивают 5,0 г хлорида кобальта СоСl2 · 6Н2O и 5,0 г сульфата меди CuSO4 · 5H2O и растворяют навески в дистиллированной воде в мерной колбе вместимостью 500 см3, добавляют 5 см3 концентрированной соляной кислоты и доводят раствор до метки дистиллированной водой.
Для приготовления рабочего раствора 20 см3 (при использовании мерных колб вместимостью 200 см3) или 25 см3 (при использовании мерных колб вместимостью 250 см3) основного раствора помещают в мерную колбу и доводят до метки дистиллированной водой. Для приготовления рабочего раствора свидетеля должны использоваться мерные колбы той же вместимости и такого же стекла, что и колбы, используемые для титрования проб воды. Рабочий раствор готовят перед применением.
3.7.1.4 Раствор сегнетовой соли
50 г сегнетовой соли KNaH4C4O6 · 4H2O растворяют в 100 см3 дистиллированной воды. Раствор хранят до помутнения.
3.7.1.5 Дистиллированная вода, свободная от СO2
Дистиллированную воду кипятят 15 - 20 мин и охлаждают до комнатной температуры в колбе, закрытой пробкой, в которую вставлена хлоркальцивая трубка с натронной известью или аскаритом.
3.7.2 Приготовление микробюретки из градуированной пипетки
При выполнении измерений в полевых условиях не всегда возможно использование стандартных стеклянных микробюреток вследствие их хрупкости. В таких случаях удобно использовать микробюретки, изготовленные из градуированных пипеток (предпочтительно - пластиковых) вместимостью 1, 2 или 5 см3.
Для этого лучше использовать пипетки исполнения 4 или 6 (т.е. рассчитанные не на полный слив). Носик пипетки следует обрезать так, чтобы диаметр отверстия был примерно 2 - 3 мм, а затем отшлифовать срез с помощью мелкозернистой наждачной бумаги. После этого на оба конца пипетки надеть резиновые трубки подходящего диаметра. Нижняя трубка должна быть длиной около 8 см, верхняя - 12 - 15 см. В нижнюю трубку помещают стеклянный шарик (бусинку) и присоединяют капилляр (стеклянную трубку длиной 4 - 5 см с оттянутым концом). Заполнение такой микробюретки проводится засасыванием раствора карбоната натрия из колбы или стакана вместимостью 25 - 50 см3 через капилляр с помощью груши, подсоединенной к верхней части микробюретки или как описано в 3.7.1.1.
3.7.3 Калибрование конических колб или склянок
Подбирают несколько (не менее 6) колб или склянок вместимостью 200 - 250 см3, имеющих одинаковые форму, размер и изготовленных из одинакового стекла, моют их, высушивают и взвешивают на технических весах с точностью до 0,01 г вместе с пробками. Заполняют колбы (склянки) дистиллированной водой до уровня пробки, а затем отбирают из колбы пипеткой 15 - 20 см3 воды, закрывают пробкой, обтирают снаружи досуха и вновь взвешивают. Рассчитывают массу воды в граммах и переводят ее в объем в кубических сантиметрах, разделив на коэффициент 0,9976 при температуре от 15 °C до 20 °C и 0,9963 при температуре от 21 °C до 27 °С. На уровне нижнего мениска воды наносят на колбу (склянку) несмываемую метку и указывают объем, которому она соответствует.
3.8 Выполнение измерений
В наполненную до метки колбу с пробой воды (см. 3.6) градуированной пипеткой вместимостью 2 - 5 см3 приливают 2 см3 (при объеме пробы 200 см3) или 2,5 см3 (при объеме пробы 250 см3) раствора фенолфталеина, закрывают ее пробкой и жидкость перемешивают, переворачивая колбу, но не взбалтывая. Если после перемешивания с фенолфталеином вода приняла розовую окраску равную или более интенсивную, чем окраска рабочего раствора свидетеля, то отмечают, что диоксид углерода отсутствует. Если же вода сохранила естественный цвет или появился розовый оттенок, но более слабый, чем у раствора свидетеля, следует приступить к определению диоксида углерода, титруя пробу раствором карбоната натрия из микробюретки. Титрование следует производить по каплям, каждый раз закрывая колбу и выжидая, пока не исчезнет розовая окраска.
Вначале при перемешивании окраска исчезает быстро. При последующем приливании раствора карбоната натрия скорость исчезновения окраски замедляется и в конце определения появляется устойчивая светло-розовая окраска, сохраняющаяся в течение продолжительного времени. Если при добавлении первой капли карбоната натрия окраска исчезает мгновенно, то можно добавлять раствор по несколько капель сразу, но при замедлении исчезновения окраски продолжать титрование, добавляя раствор по одной капле. Интенсивность окраски пробы сравнивается с окраской рабочего раствора свидетеля. Титрование считается законченным, когда достигается одинаковая со свидетелем окраска, не изменяющаяся в течение 5 мин. Сравнение окрасок следует проводить при рассеянном освещении на белом фоне. По окончании титрования отсчитывают по микробюретке объем раствора карбоната натрия, пошедший на титрование. Титрование пробы в первой колбе проводят медленно, что может привести к искажению результата из-за потерь диоксида углерода, поэтому оно является ориентировочным. Для точного титрования берут вторую колбу, добавляют фенолфталеин и приливают такой объем раствора карбоната натрия, чтобы до установленного раствора карбоната натрия, чтобы до установленной при первом титровании точки эквивалентности оставалось еще примерно 0,3 - 0,5 см3, после чего продолжают титрование, добавляя раствор по 1 капле. По окончании титрования отсчитывают по микробюретке количество затраченного на титрование раствора карбоната натрия с точностью 0,01 см3 или 0,02 см3 в зависимости от вместимости используемой микробюретки.
Если анализируемая вода имеет естественную окраску, мешающую определению, то рабочий раствор свидетеля следует готовить на анализируемой воде. Однако, если при добавлении основного раствора свидетеля к анализируемой воде образуется осадок, то прямое титриметрическое определение использовать не следует. В таких случаях проводят определение концентрации диоксида углерода расчетом. В случае анализа окрашенной воды, в конце титрования окраска пробы будет не розовой, а желтовато-розовой, как и окраска свидетеля, приготовленного на анализируемой воде.
Если при приливании раствора карбоната натрия вода в колбе начнет мутнеть, то определение следует повторить, добавив после наполнения колбы водой 1 см3 раствора сегнетовой соли.
3.9 Вычисление и оформление результатов измерений
3.9.1 Массовую концентрацию диоксида углерода в анализируемой пробе воды X, мг/дм3, находят по формуле
![]() (5)
(5)
где 44,0 - масса моля диоксида углерода, г/моль;
Ск - молярная концентрация раствора карбоната натрия, моль/дм3;
Vк - объем раствора карбоната натрия, израсходованный на титрование, см3;
V - объем пробы воды, взятый для титрования, см3.
3.9.2 Результат измерений X в документах, предусматривающих
Х ± Δ, мг/дм3 (Р = 0,95), (6)
где ± Δ - границы характеристик погрешности измерений для данной массовой концентрации диоксида углерода (таблица 2).
Численные значения результата измерений должны оканчиваться цифрой того же разряда, что и значения характеристики погрешности.
3.9.3 Допустимо представлять результат в виде:
X ± Δл (Р = 0,95) при условии Δл < Δ, (7)
где ± Δл - границы характеристик погрешности результатов измерений, установленные при реализации методики в лаборатории и обеспечиваемые контролем стабильности результатов измерений.
Примечание - Допустимо характеристику погрешности результатов измерений при внедрении методики в лаборатории устанавливать на основе выражения Δл = 0,84 · Δ с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов измерений.
3.10 Контроль качества результатов измерений при реализации методики
3.10.1 Контроль качества результатов измерений по методике предусматривает:
- оперативный контроль исполнителем процедуры выполнения измерений (на основе оценки повторяемости при реализации отдельно взятой контрольной процедуры);
- контроль стабильности результатов измерений (на основе контроля стабильности среднеквадратического отклонения повторяемости).
3.10.2 Алгоритм контроля повторяемости измерений с использованием рабочих проб
3.10.2.1 Для проведения контроля отбирают основную (в две колбы, одна из которых предназначена для оценочного титрования) и две контрольные пробы (две колбы). Выполняют измерение массовой концентрации диоксида углерода одновременно в основной и одной из контрольных проб.
3.10.2.2 Процедура контроля предусматривает сравнение абсолютного расхождения rк между двумя результатами анализа рабочих проб (основной и контрольной) с пределом повторяемости r:
rк = Х1 - Х2 < r, (8)
где r = 2,77 · σr. Значения σr, приведены в таблице 2.
3.10.2.3 Если условие (8) не выполнено, процедуру измерения повторяют, используя вторую контрольную пробу. При повторном превышении предела повторяемости выясняют причины, приводящие к неудовлетворительным результатам, и устраняют их.
3.10.3 Периодичность оперативного контроля и процедуры контроля стабильности результатов выполнения измерений регламентируют в Руководстве по качеству лаборатории.
4 Определение массовой концентрации диоксида углерода расчетным методом
Расчетный метод предназначен для вычисления массовой концентрации диоксида углерода по измеренным величинам рН и концентрациям НСO3- с учетом минерализации и температуры пробы. Диапазон вычисляемых концентраций зависит от значений перечисленных показателей.
Точность расчетного метода в значительной мере зависит от того, насколько правильно определена величина рН. Определение величины рН должно производиться на рН-метре с точностью не более 0,05 ед. рН (ошибка при определении величины рН равная 0,1 при расчете приводит к погрешности более 10 %). Если определить рН с указанной точностью невозможно, целесообразно проводить прямое титриметрическое определение.
На точность расчета могут также повлиять большие количества буферных веществ, органических анионов и свободных кислот.
Расчет массовой концентрации диоксида углерода проводят по уравнению первой ступени диссоциации угольной кислоты, молярная концентрация которой отождествляется с молярной концентрацией СО2. Такое допущение правомерно, поскольку существующее между ними в растворе равновесие сильно сдвинуто в сторону СO2 и в растворе его имеется примерно 99 % и лишь 1 % - в виде угольной кислоты. Второй ступенью диссоциации угольной кислоты при расчете массовой концентрации диоксида углерода можно пренебречь.
Из уравнения первой степени диссоциации угольной кислоты следует:
 (9)
(9)
или
где ![]() - активности
угольной кислоты, ионов водорода и ионов гидрокарбоната, соответственно;
- активности
угольной кислоты, ионов водорода и ионов гидрокарбоната, соответственно;
К1 - константа первой ступени диссоциации угольной кислоты.
Для вычисления молярной концентрации Н2СO3 по данному соотношению следует учесть, что активность ионов «а» не равна молярной концентрации ионов, а отличается от нее на определенную величину f, называемую коэффициентом активности
aи = Mи · f, (11)
где аи - активность иона, моль/дм3;
Ми - молярная концентрация иона, моль/дм3.
Таким образом, уравнение (10) принимает вид:
Примечание - Символ иона или молекулы, помещенный в квадратные скобки, означает молярную концентрацию иона или молекулы соответственно.
В уравнении (12) необходимо учитывать только коэффициент при НСО3-, т.к. для недиссоциированной формы коэффициент активности принимают равным единице, а активность ионов водорода находится непосредственно при определении pH электрометрическим методом. Следовательно, уравнение (12) принимает следующий вид:
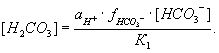 (13)
(13)
Для определения коэффициентов активности необходимо рассчитать величину, характеризующую интенсивность общего силового поля в растворе, называемую ионной силой μ. Она пропорциональна сумме произведений молярной концентрации ионов М на квадраты их зарядов z и вычисляется по формуле
μ = 0,5 · (M1z12 + M2z22 + M3z32 + ... Mnzn2) (14)
или по формуле
μ = 0,5 · (k1c1 + k2c2 + k3c3 + ... kncn) · 103, (15)
где c1, c2, c3 ... cn - массовая концентрация ионов, мг/дм3;
k1, k2, k3 ... kn - коэффициенты пересчета, определяемые по таблице 4.
Таблица 4 - Коэффициенты пересчета
|
Ca2+ |
Mg2+ |
Na+ |
К+ |
Cl- |
SO42- |
НСО3 |
NO3- |
|
|
Коэффициент k |
0,10 |
0,17 |
0,043 |
0,026 |
0,028 |
0,042 |
0,016 |
0,016 |
Таблица для перевода величины рН в аH+ приведена в приложении А. В таблице 5 приведены значения коэффициентов активности для гидрокарбонат-иона в зависимости от величины ионной силы раствора до значения последней 0,060, что примерно соответствует величине минерализации 1 - 1,2 г/дм3. Величина константы К1 в зависимости от температуры воды (in situ) приведена в таблице 6.
Таблица 5 - Коэффициенты активности гидрокарбонат-ионов при различных значениях ионной силы
|
|
Ионная сила, μ |
|
Ионная сила, μ |
|
|
|
0,0005 |
0,98 |
0,007 |
0,92 |
0,030 |
0,84 |
|
0,001 |
0,97 |
0,008 |
0,91 |
0,035 |
0,83 |
|
0,002 |
0,95 |
0,009 |
0,91 |
0,040 |
0,83 |
|
0,003 |
0,95 |
0,010 |
0,90 |
0,045 |
0,82 |
|
0,004 |
0,94 |
0,015 |
0,88 |
0,050 |
0,81 |
|
0,005 |
0,93 |
0,020 |
0,87 |
0,055 |
0,80 |
|
0,006 |
0,92 |
0,025 |
0,86 |
0,060 |
0,80 |
Таблица 6 - Значения константы первой ступени диссоциации угольной кислоты К1 при различной температуре воды
|
t, °C |
К1 · 106 |
t, °C |
К1 · 106 |
t, °C |
К1 · 106 |
t, °C |
К1 · 106 |
t, °C |
К1 · 106 |
|
0 |
0,264 |
6 |
0,312 |
12 |
0,360 |
18 |
0,402 |
24 |
0,440 |
|
1 |
0,272 |
7 |
0,320 |
13 |
0,367 |
19 |
0,409 |
25 |
0,445 |
|
2 |
0,280 |
8 |
0,328 |
14 |
0,374 |
20 |
0,416 |
26 |
0,451 |
|
3 |
0,288 |
9 |
0,336 |
15 |
0,381 |
21 |
0,422 |
27 |
0,461 |
|
4 |
0,296 |
10 |
0,344 |
16 |
0,388 |
22 |
0,428 |
28 |
0,466 |
|
5 |
0,304 |
11 |
0,352 |
17 |
0,395 |
23 |
0,434 |
30 |
0,471 |
Результат расчета массовой концентрации диоксида углерода X' в документах, предусматривающих его использование, представляют в виде:
X' ± 0,01 · δ · X', мг/дм3 (Р = 0,95), (16)
где ± δ - границы относительной погрешности расчета массовой концентрации диоксида углерода, % (таблица 3).
Численные значения результата расчета массовой концентрации диоксида углерода должны оканчиваться цифрой того же разряда, что и значения характеристики погрешности (значение характеристики погрешности может содержать не более двух значащих цифр).
Пример расчета массовой концентрации диоксида углерода приведен в приложении Б.
Приложение А
(рекомендуемое)
Перевод величины pH в 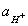 и обратно
и обратно 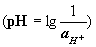
|
pH-Q |
|
pH-Q |
|
pH-Q |
|
|
0,00 |
1,000 |
0,34 |
0,457 |
0,67 |
0,214 |
|
0,01 |
0,977 |
0,35 |
0,447 |
0,68 |
0,209 |
|
0,02 |
0,955 |
0,36 |
0,437 |
0,69 |
0,204 |
|
0,03 |
0,933 |
0,37 |
0,427 |
0,70 |
0,200 |
|
0,04 |
0,912 |
0,38 |
0,417 |
0,71 |
0,195 |
|
0,05 |
0,891 |
0,39 |
0,407 |
0,72 |
0,191 |
|
0,06 |
0,871 |
0,40 |
0,398 |
0,73 |
0,186 |
|
0,07 |
0,851 |
0,41 |
0,389 |
0,74 |
0,182 |
|
0,08 |
0,832 |
0,42 |
0,380 |
0,75 |
0,178 |
|
0,09 |
0,813 |
0,43 |
0,372 |
0,76 |
0,174 |
|
0,10 |
0,794 |
0,44 |
0,363 |
0,77 |
0,170 |
|
0,11 |
0,776 |
0,45 |
0,355 |
0,78 |
0,166 |
|
0,12 |
0,759 |
0,46 |
0,347 |
0,79 |
0,162 |
|
0,13 |
0,741 |
0,47 |
0,339 |
0,80 |
0,158 |
|
0,14 |
0,725 |
0,48 |
0,331 |
0,81 |
0,155 |
|
0,15 |
0,709 |
0,49 |
0,324 |
0,82 |
0,151 |
|
0,16 |
0,692 |
0,50 |
0,316 |
0,83 |
0,148 |
|
0,17 |
0,676 |
0,51 |
0,309 |
0,84 |
0,144 |
|
0,18 |
0,661 |
0,52 |
0,302 |
0,85 |
0,141 |
|
0,19 |
0,646 |
0,53 |
0,295 |
0,86 |
0,138 |
|
0,20 |
0,631 |
0,54 |
0,288 |
0,87 |
0,135 |
|
0,21 |
0,617 |
0,55 |
0,282 |
0,88 |
0,132 |
|
0,22 |
0,603 |
0,56 |
0,275 |
0,89 |
0,129 |
|
0,23 |
0,589 |
0,57 |
0,269 |
0,90 |
0,126 |
|
0,24 |
0,575 |
0,58 |
0,263 |
0,91 |
0,123 |
|
0,25 |
0,562 |
0,59 |
0,257 |
0,92 |
0,120 |
|
0,26 |
0,549 |
0,60 |
0,251 |
0,93 |
0,117 |
|
0,27 |
0,537 |
0,61 |
0,245 |
0,94 |
0,115 |
|
0,28 |
0,525 |
0,62 |
0,240 |
0,95 |
0,112 |
|
0,29 |
0,513 |
0,63 |
0,234 |
0,96 |
0,110 |
|
0,30 |
0,501 |
0,64 |
0,229 |
0,97 |
0,107 |
|
0,31 |
0,490 |
0,65 |
0,224 |
0,98 |
0,105 |
|
0,22 |
0,479 |
0,66 |
0,219 |
0,99 |
0,102 |
|
0,33 |
0,468 |
|
|
|
|
Пример пользования таблицей
1. Найти ![]() , если pH равно 8,33,
где характеристика логарифма Q = 8, мантисса pH-Q = 0,33. По
мантиссе 0,33 находим во второй графе коэффициент 0,468, который множим на 10 со
степенью, равной характеристике Q, но с обратным
знаком. Следовательно,
, если pH равно 8,33,
где характеристика логарифма Q = 8, мантисса pH-Q = 0,33. По
мантиссе 0,33 находим во второй графе коэффициент 0,468, который множим на 10 со
степенью, равной характеристике Q, но с обратным
знаком. Следовательно, ![]()
2. Найти рН, если ![]() По коэффициенту 0,123
находим в первой графе мантиссу 0,91, а за характеристику принимаем степенной
показатель, взятый с обратным знаком. Следовательно, pH = 7,91.
По коэффициенту 0,123
находим в первой графе мантиссу 0,91, а за характеристику принимаем степенной
показатель, взятый с обратным знаком. Следовательно, pH = 7,91.
Приложение Б
(рекомендуемое)
Пример вычисления массовой концентрации диоксида углерода расчетным методом
При анализе воды были установлены следующие величины массовых концентраций ионов (мг/дм3)
|
Ca2+ |
Mg2+ |
Na+ |
НСO3- |
SO42- |
Cl- |
|
47,5 |
19,7 |
34,5 |
170,8 |
71,6 |
38,3 |
Температура воды в момент взятия пробы была 4 °C, рН 7,82.
Переводим найденные массовые концентрации ионов (мг/дм3) в молярные (моль/дм3) путем деления на массу моля иона (г/моль):
|
Ca2+ |
Mg2+ |
Na+ |
НСO3- |
SO42- |
Cl- |
|
1,19 · 10-3 |
0,81 · 10-3 |
1,50 · 10-3 |
2,80 · 10-3 |
0,75 · 10-3 |
1,08 · 10-3 |
Рассчитываем ионную силу μ по формуле (12)
μ = 0,5 · (1,19 · 4 + 0,81 · 4 + 1,50 + 2,80 + 0,74 · 4 + 1,08) · 10-3 = 0,0082.
Этому значению μ (таблица 5)
соответствует ![]()
Активность
ионов водорода ![]() , соответствующая pH 7,82 (приложение А)
равна 1,51 · 10-8.
, соответствующая pH 7,82 (приложение А)
равна 1,51 · 10-8.
Величину К1 при температуре 4 °C находим по таблице 6 равной 0,296 · 10-6.
![]()
или X' = 1,30 · 10-4 · 44,0 · 103 = 5,72 мг/дм3.
Федеральная служба по гидрометеорологии и мониторингу окружающей среды
ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ «ГИДРОХИМИЧЕСКИЙ ИНСТИТУТ»
|
344090, г. Ростов-на-Дону пр. Стачки, 198 |
Факс: (8632) 22-44-70 Телефон (8632) 22-66-68 E-mail ghi@aaanet.ru |
|
Свидетельство № 169.24-2004 МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ массовой концентрации диоксида углерода в поверхностных водах суши разработанная ГУ «Гидрохимический институт» (ГУ ГХИ) и регламентированная РД 52.24.515-2005 аттестована в соответствии с ГОСТ Р 8.563-96 с изменениями 2002 г. Аттестация осуществлена по результатам экспериментальных исследований В результате аттестации установлено, что МВИ соответствует предъявляемым к ней метрологическим требованиям и обладает следующими основными метрологическими характеристиками: 1 Диапазон измерений, значения характеристик погрешности и ее составляющих при выполнении измерений титриметрическим методом
2 Диапазон измерений, значение предела повторяемости при доверительной вероятности Р = 0,95
3 Значения характеристик погрешности при вычислении массовой концентрации диоксида углерода расчетом (Р = 0,95)
4 При реализации методики в лаборатории обеспечивают: - оперативный контроль исполнителем процедуры выполнения измерений (на основе оценки повторяемости при реализации отдельно взятой контрольной процедуры); - контроль стабильности результатов измерений (на основе контроля стабильности среднеквадратического отклонения повторяемости). Алгоритм контроля исполнителем процедуры выполнения измерений приведен в документе, регламентирующим МВИ. Периодичность оперативного контроля и процедуры контроля стабильности результатов выполнения измерений регламентируют в Руководстве по качеству лаборатории. Дата выдачи свидетельства 30.12.2004 г. Главный метролог ГУ ГХИ А.А. Назарова Зам. директора Л.И. Минина |
|||||||||||||||||||||||||||||||||||||||

