 | Информационная система |  |
Государственное санитарно-эпидемиологическое
нормирование
Российской Федерации
2.6.4. ИСТОЧНИКИ
ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ
В НАРОДНОМ ХОЗЯЙСТВЕ
3.5.4. СТЕРИЛИЗАЦИЯ
Общие требования
к технологическому регламенту радиационной
стерилизации изделий медицинского назначения
однократного применения
Руководство
Р 2.6.4/3.5.4.1040-01
Минздрав России
Москва 2001
Общие требования к технологическому регламенту радиационной стерилизации изделий медицинского назначения однократного применения: Руководство. - М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2001.
1. Разработано организационно-методическим Центром Минздрава России «Радиационная стерилизация медицинских изделий» (Пономарев В.Н., Молин А.А., Драбкин Ю.А., Калашников В.В.).
2. Рекомендовано к утверждению Комиссией по госсанэпиднормированию при Минздраве России (прот. № 7 от 28.04.01).
3. Утверждено и введено в действие Главным государственным санитарным врачом Российской Федерации - Первым заместителем Министра здравоохранения Российской Федерации 28 мая 2001 г.
4. Введено впервые.
СОДЕРЖАНИЕ
УТВЕРЖДАЮ
Главный государственный
санитарный врач Российской
Федерации - Первый заместитель
Министра здравоохранения
Российской Федерации
Г.Г. Онищенко
28 мая 2001 г.
Дата введения: 1 сентября 2001 г.
2.6.4. ИСТОЧНИКИ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ В НАРОДНОМ ХОЗЯЙСТВЕ
3.5.4. СТЕРИЛИЗАЦИЯ
Общие требования к технологическому регламенту радиационной стерилизации изделий медицинского назначения однократного применения
Руководство
Р 2.6.4/3.5.4.1040-01
1. Область применения
1.1. Настоящее руководство устанавливает общие требования к построению, изложению, согласованию и утверждению технологических регламентов радиационной стерилизации изделий медицинского назначения однократного применения, производимых отечественными предприятиями.
1.2. Настоящее руководство предназначено для предприятий и организаций Российской Федерации, осуществляющих разработку, производство и радиационную стерилизацию изделий медицинского назначения однократного применения, независимо от их формы собственности и ведомственной принадлежности.
1.3. Руководство разработано в соответствии с «Основами законодательства Российской Федерации об охране здоровья граждан», федеральным законом «О санитарно-эпидемиологическом благополучии населения», Положением о Министерстве здравоохранения Российской Федерации, Положением о государственной санитарно-эпидемиологической службе и Положением о государственном санитарно-эпидемиологическом нормировании.
2. Нормативные ссылки
2.1. «Основы законодательства Российской Федерации об охране здоровья граждан» от 22 июля 1993 г. № 5487-1 (Ведомости съезда народных депутатов Российской Федерации и Верховного Совета Российской Федерации, 1993, № 33, ст. 1318).
2.2. Федеральный закон «О санитарно-эпидемиологическом благополучии населения» (Собрание законодательства РФ № 14, от 05.04.99, ст. 1650).
2.3. Положение о Министерстве здравоохранения Российской Федерации, утвержденное постановлением Правительства Российской Федерации от 3 июня 1997 г. № 659 с изменениями и дополнениями (Собрание законодательства Российской Федерации, 1997, № 23, ст. 2691, № 51 ст. 5809, 1999, № 47 ст. 5706).
2.4. Положение о государственной санитарно-эпидемиологической службе и Положение о государственном санитарно-эпидемиологическом нормировании (утвержденные Постановлением Правительства РФ от 24.07.00 № 554) (Собрание законодательства Российской Федерации, 2000, № 31, ст. 3295).
3. Цели и задачи
Руководство Р 2.6.4/3.5.4.1040-01 создано с целью нормативного обеспечения радиационной стерилизации, являющейся финишной технологической операцией производства изделий медицинского назначения однократного применения категории «стерильно».
Руководство разработано для решения задачи установления единых требований к порядку разработки, построению, изложению и оформлению технологического регламента радиационной стерилизации изделий медицинского назначения однократного применения, что, в свою очередь, позволяет унифицировать требования надежности, санитарно-гигиенического контроля и безопасности производства.
4. Термины и определения
В этом разделе приведены наиболее употребляемые термины и определения.
4.1. Радиационная стерилизация медицинских изделий
Необратимая инактивация микроорганизмов всех видов, находящихся на всех стадиях развития, на и в изделиях медицинского назначения, осуществляемая с помощью ионизирующего излучения.
4.2. Технологический процесс радиационной стерилизации
Совокупность технологических операций и последовательность их выполнения при осуществлении радиационной стерилизации медицинских изделий, как часть процесса производства стерильных изделий.
4.3. Технологический регламент радиационной стерилизации
Нормативный документ, устанавливающий методы, технические средства, и нормы процесса радиационной стерилизации изделий медицинского назначения, обеспечивающие безопасность ведения работ и достижение требуемых технико-экономических показателей.
4.4. Радиационная установка для стерилизации
Техническое устройство, обеспечивающее безопасное и надежное проведение процесса стерилизации, имеющее в своем составе источник ионизирующего излучения, транспортную систему и приводные механизмы управления источниками, систему обеспечения и контроля безопасности.
4.5. Радионуклидная установка
Радиационная установка, в которой источником ионизирующих излучений является закрытый радионуклидный источник.
4.6. Электрофизическая радиационная установка
Радиационная установка, в которой источником ионизирующих излучений является электрофизический (генерирующий) источник ионизирующего излучения.
В тексте документа используются следующие сокращения:
PC - радиационная стерилизация;
РД - радиационная деконтаминация;
ТР - технологический регламент;
РТУ - радиационно-технологическая установка;
ОМЦ PC - организационно-методический центр «Радиационная стерилизация медицинских изделий» Минздрава России.
5. Общие положения
5.1. Технологический регламент радиационной стерилизации - нормативный документ, устанавливающий метод, технические средства, условия и порядок технологического процесса радиационной стерилизации изделий медицинского назначения однократного применения в целях обеспечения санитарно-гигиенических условий, безопасности ведения работ и качества изделий, соответствующего требованиям нормативно-технической документации на продукцию, а также достижения оптимальных технико-экономических показателей процесса радиационной стерилизации.
5.2. Технологический регламент радиационной стерилизации используют при отработке технологии и при осуществлении промышленного процесса радиационной стерилизации изделий медицинского назначения.
5.3. Технологический регламент на стадии отработки технологии радиационной стерилизации имеет срок действия не более 1 года. Его составляют на основе данных проектной и иной технической документации на процесс стерилизации данного вида изделий, а также на основании данных эксплуатации аналогичных существующих производств с учетом вида источника излучения и технологических особенностей радиационно-технологической установки (РТУ) стерилизации. Освоение производства считается законченным, когда достигнуто стабильное выполнение требований нормативно-технической документации на продукцию, а также достигнуты воспроизводимость технологического процесса по мощности и основным технико-экономическим показателям производства.
5.4. Технологический регламент действующего процесса радиационной стерилизации составляют с учетом изменений и дополнений, принятых при освоении производства. Установленный срок действия регламента производства - 5 лет. Порядок внесения, согласования и утверждения изменений в регламент тот же, что и для самого регламента.
5.5. Технологический регламент допускается составлять на стерилизацию однородного типа продукции, например, на шприцы однократного применения разных типоразмеров и емкости.
5.6. Технологический регламент составляют только для конкретной РТУ с определенным типом источника излучения, соответствующего ГОСТам 27632, 27212 и 30392. Запрещается переносить условия процесса, определяемые технологическим регламентом на конкретной РТУ, на процесс стерилизации на иной РТУ с другими характеристиками источника и технологической оснастки.
6. Требования к построению технологического регламента
Нормы и требования, включаемые в технологические регламенты радиационной стерилизации медицинских изделий, должны соответствовать требованиям действующих стандартов, нормативно-технических документов на продукцию, правил и норм Минздрава России, Госатомнадзора, отраслевых и межотраслевых правил и норм техники безопасности, санитарных правил обеспечения радиационной безопасности и норм радиационной безопасности, а также других нормативных документов, в части организации и проведения радиационной стерилизации медицинских изделий.
6.1. Содержание регламента
6.1.1. Технологический регламент процесса радиационной стерилизации должен состоять из следующих разделов:
· характеристика конечной продукции производства;
· технологическая схема производства;
· спецификация оборудования;
· характеристика сырья и материалов;
· описание технологического процесса;
· нормы технологического процесса;
· неполадки в работе и способы их устранения;
· переработка и обезвреживание отходов производства;
· контроль производства и управление технологическим процессом;
· техника безопасности, пожарная безопасность и производственная санитария;
· перечень производственных инструкций;
· технико-экономические нормативы.
6.1.2. Характеристика конечной продукции процесса должна содержать:
· наименование продукции;
· категорию действующей нормативно-технической документации, номер действующих ГОСТов, технических условий, инструкций и т.п.;
· регистрационный номер Минздрава России;
· основное назначение продукции, краткое описание внешнего вида, потребительских свойств;
· основные микробиологические характеристики изделия (инициальная контаминация, требования к стерильности после обработки в технологическом цикле стерилизации);
· требования к упаковке, маркировке, транспортированию, условиям хранения и срокам годности изделия;
· объемную плотность упаковки с медицинскими изделиями (для РТУ с ускорителями электронов).
6.1.3. Технологическую схему процесса выполняют в виде блок-схемы отображающей последовательность выполнения работ в процессе радиационной стерилизации. Обозначение стадий: ВР - вспомогательные работы, ТП - стадии основного технологического процесса.
6.1.4. В раздел «Спецификация оборудования» включают перечень, тип, обозначение конструкторско-технической документации всего оборудования, используемого в технологическом процессе:
· источника излучения;
· транспортного устройства;
· контрольно-измерительной аппаратуры;
· дозиметрического оборудования;
· вспомогательного оборудования;
· оборудования, обеспечивающего радиационную безопасность процесса.
Для источника излучения указывают: тип радионуклида и его активность для РТУ с изотопным источником, или мощность источника излучения, ток пучка, частоту импульсов и т.д. для РТУ с ускорителем электронов.
6.1.5. В раздел «Характеристика сырья и материалов» включают наименование и тип всех вспомогательных материалов, используемых для упаковки, крепежа, изоляции и т.п., а также индикаторных и дозиметрических материалов для контроля облучения.
6.1.6. Раздел «Описание технологического процесса» излагают последовательно по стадиям с учетом проведения операций, в точном соответствии с технологической схемой производства, причем описание должно обеспечить всеми необходимыми данными воспроизводимость процесса и безопасность работ.
6.1.7. В описании подраздела «Входной контроль» предусматривают описание процедур проверки поступающей на стерилизацию продукции:
· соответствия требованиям нормативно-технической документации на продукцию по форме, упаковке, габаритам, весу, маркировке;
· наличия сопроводительной документации на партию изделий;
· необходимости дополнительных мер контроля нестерильной продукции, например, по параметру инициальной контаминации изделий.
6.1.8. В описании операций по выводу РТУ на режим указывают порядок работ, обеспечивающий параметры процесса, определенные регламентом, в т.ч. источника излучения, транспортного устройства, контрольно-измерительной аппаратуры и защитных устройств.
6.1.9. Описание порядка загрузки изделий на транспортное устройство, подающее их в камеру облучения, дают в подразделе «Загрузка изделий».
6.1.10. Порядок проведения облучения для обеспечения стерилизующей дозы на каждом изделии, не допускающим превышение максимально допустимой дозы, соблюдение и контроль за режимом работы источника излучения и транспортного устройства описывают в подразделе «Стерилизация».
6.1.11. Порядок выгрузки изделий, проведения контрольных дозиметрических измерений и контроля за индикаторами дозы описывают в подразделе «Выгрузка изделий».
6.1.12. В подразделе «Приемочный контроль» дают описание контроля за правильностью облучения изделий, процедуры оформления необходимой документации, отправки изделий предприятию-изготовителю или иному заказчику.
6.1.13. В разделе «Нормы технологического процесса» приводят по операциям процесса нормы технологического режима, необходимые элементы работы для их обеспечения и контрольные точки режима, в т.ч. допустимого диапазона доз облучения изделий, которые контролируются персоналом РТУ и которые обеспечивают качество и безопасность процесса стерилизации. Раздел выполняют в виде таблицы (приложение 4).
6.1.14. В разделе «Неполадки в работе и способы их устранения» дают описание возможных неполадок (отклонений от нормального хода технологического процесса), возникающих в ходе технологического процесса, приводят меры предупреждения и перечень мероприятий, их устраняющих, или перечень инструкций, где указан порядок проведения этих мероприятий.
6.1.15. В разделе «Переработка и обезвреживание отходов производства» указывают перечень и краткую санитарно-гигиеническую характеристику отходов процесса стерилизации, в т.ч. газообразных, порядок их обезвреживания, методы устранения.
6.1.16. Контроль производства и управление технологическим процессом описывают в отдельном разделе регламента, где указывают перечень контрольных точек, приведенных в разделе «Нормы технологического режима», методы их контроля на всех стадиях работы РТУ - выводе на режим, облучении, выводе из эксплуатации, а также перечень процедур, проводимых на каждой стадии процесса для поддержания оптимального технологического режима, обеспечивающего высокое качество стерилизации.
Порядок проверки правильности контроля должен регламентироваться документами, приведенными в разделе «Перечень производственных инструкций».
6.1.17. В разделе «Техника безопасности, пожарная безопасность и производственная санитария» дают в виде таблиц:
· описание аварийных состояний процесса, способов их предупреждения и устранения, порядок повторного пуска установки;
· пожаро- и взрывоопасные и токсичные свойства сырья, готового продукта и отходов производства радиационной стерилизации, с учетом требований ГОСТа 12.1.004 «Пожарная безопасность. Общие требования» и ГОСТа 12.1.044 «Пожаровзрывоопасность веществ и материалов»;
· категории по взрывопожароопасности, классы производственных помещений и наружных установок, категории и группы радиационно-опасных и взрывоопасных мест, установленных по НПБ 105-95/МВД;
· перечень наиболее опасных мест процесса, меры предосторожности для персонала;
· санитарно-гигиеническую характеристику производственных процессов, составленную на основе гигиенического заключения на производство радиационной стерилизации медицинских изделий (в соответствии с приказом Минздрава России от 20.07.98 № 217);
· требования по предупреждению микробной загрязненности продукции в процессе стерилизации, при хранении и транспортировании;
· средства групповой и индивидуальной защиты работников РТУ и вспомогательного персонала.
6.1.18. В перечне производственных инструкций приводят инструкции по эксплуатации источников, транспортного устройства, дозиметрической аппаратуры, а также по технике безопасности.
6.1.19. В разделе «Технико-экономические нормативы» указывают ежегодные нормы расхода технологических материалов и энергозатрат (воды, электроэнергии, сжатого воздуха, инертных газов и т.п.), принципы определения стоимости процесса и нормативы экономической эффективности его проведения.
6.2. Оформление регламента
6.2.1. Регламент печатают с одной стороны листа через 1, 5 интервала на бумаге формата А4 по ГОСТу 2.301. Листы нумеруют порядковым номером и брошюруют.
Ошибки, опечатки в тексте не допускаются. Оформление регламента допускается с использованием компьютеров или другой техники.
6.2.2. Текст регламента должен отвечать требованиям ГОСТа 2.105, быть предельно ясным и лаконичным.
6.2.3. Разделы регламента нумеруют цифрами, а наименования разделов записывают прописными буквами. Наименование подразделов записывают строчными буквами без нумерации и выделяют или подчеркивают.
6.2.4. Нумерацию пунктов производят арабскими цифрами по разделам, например: 1.1, 1.2., ... 1.1.1., 1.1.2., где на первом месте указан номер раздела, на втором - номер пункта, на третьем - подпункта. Цифры разделяют точкой.
6.2.5. Титульный лист является первым листом регламента и оформляется в соответствии с приложением 1. За титульным листом должен следовать лист с заглавием «Содержание регламента».
6.2.6. Последний лист технологического регламента подписывается основными разработчиками регламента, с указанием должности и наименования отдела (лаборатории).
6.2.6.1. Последний лист регламента подписывают: начальник отдела (лаборатории), разработавшего регламент, руководитель группы разработчиков регламента, непосредственные разработчики регламента, руководитель микробиологической службы, ответственный за технику безопасности в организации.
7. Порядок разработки, согласования и утверждения регламента
7.1. Технологические регламенты радиационной стерилизации медицинских изделий разрабатываются предприятием радиационной стерилизации в соответствии с настоящим руководством. Разрешается разработка технологического регламента организационно-методическим Центром Минздрава России «Радиационная стерилизация медицинских изделий» (ОМЦ PC).
Технологические регламенты стерилизации являются неотъемлемой частью комплекта технической документации на медицинское изделие, выпускаемое по категории «Стерильное».
7.2. Разработанный технологический регламент утверждается предприятием-производителем медицинского изделия, подвергаемого радиационной стерилизации. Один экземпляр утвержденного технологического регламента передается предприятию-производителю изделия.
7.3. По поручению Департамента Минздрава России научно-техническую экспертизу проектов технологических регламентов осуществляет ГНЦ - Институт биофизики.
7.4. Проекты технологических регламентов радиационной стерилизации изделий медицинского назначения должны проходить научно-техническую экспертизу на соответствие требованиям действующих нормативных документов, стандартов, правил и норм.
7.5. Эксперты несут ответственность за:
· объективность, компетентность, достоверность и обоснованность проводимой экспертизы;
· независимость и гласность принимаемых решений и выдаваемых рекомендаций;
· соблюдение при рассмотрении документов и материалов конфиденциальности в отношении вопросов, защищаемых авторским правом и правом коммерческой тайны.
7.6. Научно-техническая экспертиза осуществляется на договорной основе и завершается согласующей подписью руководителя экспертной организации на титульном листе регламента. Срок экспертизы не должен превышать одного месяца.
7.7. Технологические регламенты утверждаются руководителем предприятия радиационной стерилизации после утверждения предприятием-производителем изделий и согласования экспертной организацией.
7.8. Технологические регламенты радиационной стерилизации по поручению Департамента Минздрава России регистрирует ГНЦ - Институт биофизики.
Обозначение регламента должно состоять: из типа регламента ТР - технологический регламент; номера регламента, присваиваемого при регистрации: - 001, 002 ...; типа процесса - PC - радиационная стерилизация, РДК - радиационная деконтаминация; года утверждения регламента - 2000-00, 2001-01 ...
Пример: ТР-003 PC-00.
7.9. Регистрация утвержденных технологических регламентов производится в специальном регистрационном журнале.
7.10. Технологические регламенты после их утверждения и регистрации представляются по одному экземпляру по месту регистрации в ГНЦ - Институт биофизики.
Регистрационные журналы и регламенты хранятся отдельно от другой технической документации на правах служебных документов.
7.11. Изменения к регламенту оформляются в виде ведомости изменений с приложением пояснительной записки. Согласование, утверждение, регистрация изменений технологических регламентов и их хранение производится в том же порядке, что и для самих регламентов.
7.12. Срок действия технологического регламента подтверждается каждые 5 лет. Подтверждение действия регламента оформляется протоколом, который согласуется и утверждается в том же порядке, что и сам регламент.
Приложение 1
(обязательное)
Форма титульного листа технологического регламента радиационной стерилизации изделий медицинского назначения однократного применения
|
УТВЕРЖДАЮ Директор (Главный инженер, технолог) предприятия-производителя медицинского изделия _____________________ /Ф. И. О./ «_____» ________________ 200___ г. |
УТВЕРЖДАЮ Директор предприятия, на котором осуществляется радиационная стерилизация _______________________ /Ф. И. О./ «____» ________________ 200_____ г. |
ТЕХНОЛОГИЧЕСКИЙ РЕГЛАМЕНТ
на
радиационную стерилизацию
(название медицинского изделия, его обозначение, марка)
(название предприятия-производителя медицинского изделия, его обозначение)
(Обозначение регламента и его регистрационный номер, например, ТР-001 РС-01)
Срок действия регламента до «___» _______________ 200__ г.
СОГЛАСОВАНО
Руководитель (Директор, заместитель) ГНЦ
- Институт биофизики
__________________ /Ф. И. О./
«_____» ____________ 200___ г.
Москва 200 ____ г.
Приложение 2
(рекомендуемое)
Образец описания технологического регламента
Технологический регламент
на радиационную
стерилизацию (наименование изделия) однократного применения по ТУ (№
ТУ) производства (наименование предприятия-производителя)
Разработан предприятием радиационной стерилизации медицинских изделий однократного применения - (наименование предприятия радиационной стерилизации).
Радиационная стерилизация указанных выше (наименование изделий) в соответствии с настоящим нормативным документом проводится только на технологической установке предприятия радиационной стерилизации, физические параметры и технические характеристики которой определены настоящим технологическим регламентом.
Осуществление радиационной стерилизации (наименование изделия) однократного применения на установках радиационной стерилизации других предприятий с иными физическими параметрами и техническими характеристиками по данному технологическому регламенту запрещается.
Оглавление
1. Характеристика конечной продукции процесса
2. Технологическая схема процесса
3. Спецификация оборудования
4. Характеристика сырья и материалов
5. Описание технологического процесса
6. Нормы технологического процесса
7. Неполадки в работе и способы их устранения
8. Переработка и обезвреживание отходов процесса
9. Контроль производства и управление технологическим процессом
10. Техника безопасности, пожарная безопасность и производственная санитария
11. Перечень производственных инструкций
12. Технико-экономические нормативы
1. Характеристика конечной продукции процесса
Радиационной стерилизации (далее - PC) подвергаются: (наименование изделия в точном соответствии с ТУ), выпускаемого по ТУ (№ ТУ) (наименование предприятия-производителя изделия).
Изделия на радиационную стерилизацию (PC) поступают в транспортной таре - (описание транспортной тары с указанием размеров, в мм) соответствующими (или несоответствующими) ряду размеров, предусмотренных ГОСТ (например, ГОСТ 21140). В таре содержатся изделия (подробно описываются вид индивидуальной упаковки изделия с указанием упаковочных материалов, их ГОСТ, ТУ, наличие или отсутствие групповой упаковки, их количество в транспортной таре, количество изделий в групповой упаковке и т.п.)
Соответствующая масса нетто единицы транспортной тары с (наименование изделия): до (указывается предельная масса тары с изделиями) кг.
Объемная плотность для коробки с (наименование изделий) - до (предельная плотность) г/см3.
Это условие обязательно при использовании для радиационной стерилизации ускорителей электронов типа (указывается тип ускорителя) с энергией (указывается энергия) в режиме (указывается режим одно- или двухстороннего) облучения.
Таблица 1
Характеристики стерильной продукции
|
Наименование показателя |
Продукция / характеристика, норма |
|
(наименование продукции) |
|
|
Внешний вид |
(описывается вид изделия в упаковке) |
|
Цвет |
|
|
Объемная плотность упаковки (коробка), г/см3 |
|
|
Микробиологические нормативы по группам |
|
|
Масса нетто единицы потребительской тары, г |
|
|
Масса брутто единицы транспортной тары с изделиями, кг |
|
|
Размеры транспортной тары, мм |
|
Стерилизация (название изделия) проводится с использованием (указывается тип) источников излучения - (указывается конкретно установка с источником излучения). Процесс является экологически чистым, т. к. при его проведении не происходит образования радиоизотопов, т.е. не имеет место наведенная радиоактивность и изделия не загрязняются радионуклидами.
2. Технологическая схема процесса радиационной стерилизации (название изделия) однократного применения по ТУ (№ ТУ) производства (наименование предприятия-производителя)
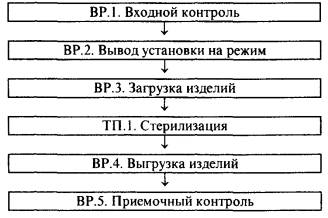
Схема № 1
3. Спецификация оборудования
Таблица 2
|
Наименование |
Количество единиц |
Техническая характеристика |
Документация |
|
Радиационно-технологическая установка (РТУ) в составе: |
|||
|
Источник излучения |
|
|
|
|
Транспортное устройство |
|
|
|
|
Контрольная аппаратура |
|
|
|
4. Характеристика сырья и материалов
(наименования вспомогательных материалов, дозиметрических средств, индикаторов дозы и т.п.)
5. Описание технологического процесса
Стадия ВР.1. Входной контроль
Перед началом техпроцесса необходимо убедиться, что предназначенные для PC (наименование изделий) по физико-механическим параметрам, упаковке и фасовке соответствуют техническим условиям, (см. разд. 1 настоящего регламента), и на них имеется утвержденная соответствующим порядком документация.
К радиационной стерилизации допускаются изделия, прошедшие государственную регистрацию в Минздраве России в установленном порядке.
Партия (наименование изделий) должна иметь сопроводительный документ, в котором указывается государственный регистрационный номер изделия, номер партии и количество изделий, форма потребительской тары, а также результаты определения инициальной контаминации (ИК) изделий (при их наличии).
Описывается процедура контроля данных по инициальной контаминации, соответствующих выходных данных изделия после стадии упаковки, наличие их на этикетке.
Описываются процедуры входного контроля массы упаковки, порядка укладки и т.п. параметров транспортной тары.
Описывается процедура контроля дозиметрических средств и индикаторов дозы.
Стадия ВР.2. Вывод установки на режим
Описывается порядок ввода источников в активное состояние, или порядок приведения ускорителей электронов в рабочий режим.
Описывается процедура контроля дозы в рабочем режиме установки, проведение контрольного измерения дозы в контрольной точке.
Стадия ВР.3. Загрузка изделий
Описывается процедура установки контрольных дозиметров, подачи транспортной тары с изделиями на транспортное устройство и подачи их в зону облучения.
Стадия ТП.1. Стерилизация
Описывается процедура стерилизации с указанием параметров доз облучения, режимов работы РТУ, режимов облучения изделий - кратность проходов, ориентация упаковок с изделиями, порядок дозиметрического контроля в ходе стерилизации.
Данные режима облучения и контроля дозы заносить в контрольный журнал оператора.
При выявлении сбоя режима ускорителя процесс PC прекратить, повторить операции, описанные в разделе ВР.2. Вывод установки на режим, после чего продолжить облучение.
После окончания полного цикла облучения снять коробки с транспортного устройства проверить наличие индикаторов (или детекторов рабочих дозиметров при контрольных измерениях дозы) на коробках, проверить соответствие цвета индикатора установленному контрольному цвету. Коробки, на которых установлено это соответствие, считать прошедшими радиационную стерилизацию и складировать в хранилище готовой продукции. Снять детекторы рабочих дозиметров с коробок (при контрольных измерениях дозы) и провести измерения дозы (указать каким образом, с использованием каких средств). Методику дозиметрического контроля осуществлять в соответствии с ГОСТом 30392-95.
Стадия ВР.5. Приемочный контроль
Определить коробки, прошедшие стерилизацию, в соответствии с п. ВР.4; определить значения дозы излучения по показаниям рабочих дозиметров. Данные контрольных измерений дозы занести в журнал оператора.
Коробки, не прошедшие облучение или недооблученные (что следует установить по показаниям рабочих дозиметров - значение дозы меньше значения стерилизующей дозы) направлять на повторное облучение дозой, равной разнице между стерилизующей дозой и дозой, определенной на поверхности ящика, после полного цикла облучения.
По результатам облучения составить протокол стерилизации партии изделий по установленной форме. Протокол представить предприятию-производителю по завершению процесса PC партии изделий.
Предприятие-производитель контролирует по представленным протоколам качество стерилизации и несет ответственность за качество (название изделий), стерилизованных радиационным методом с регламентированной дозой.
6. Нормы технологического процесса
|
Наименование операции |
Наименование элементов работы |
Технологические показатели |
|
1 |
2 |
3 |
|
ВР.1. Входной контроль |
|
|
|
ВР.2. Вывод установки на режим |
|
|
|
ВР.3. Загрузка изделий |
|
|
|
|
||
|
ТП.1. Стерилизация |
||
|
ВР.4. Выгрузка изделий |
|
|
|
ВР.5. Приемочный контроль |
|
|
7. Неполадки в работе и способы их устранения
Неполадки в работе (название РТУ) - устраняются в соответствии с (наименование инструкции или другого документа).
Неполадки в работе транспортного устройства (наименование устройства) устраняются в соответствии с Инструкцией по эксплуатации и техническими условиями (№ № документов).
8. Переработка и обезвреживание отходов
(Приводится характеристика отходов производства и их вредного воздействия на окружающую среду и человека).
Выбросы в атмосферу и сточные воды не содержат (если содержат то какие) вредных и токсичных веществ. Оценочные (по экспериментальным данным) выбросы по озону составляют: - максимальная разовая приземная концентрация озона в атмосферном воздухе составляет (указываются нормативы для конкретной установки) мг/м3, при допустимой разовой (концентрация указывается) мг/м3 (с вероятностью (указывается цифра) %).
Среднесуточная допустимая концентрация озона в атмосфере населенных пунктов (указывается в соответствии с ПДВ - 83 мг/м3).
9. Контроль и управление технологическим процессом
Входной контроль провести в соответствии с разделом 6.
ВР.2. Вывод установки на режим
Текущий дозиметрический контроль. Проводить согласно ГОСТ Р 30392-95 при совместной работе (указывается тип РТУ) и транспортного устройства. Контролируемые параметры (приводятся конкретные цифры параметров, которые необходимо контролировать при проведении процесса PC).
ТП.1. Облучение изделий
Контролируются параметры при работе (указывается тип РТУ) косвенно, исходя из поглощенной дозы в контрольной точке тары с изделиями после облучения, равной (указывается значение величины дозы) кГр. Контроль провести аналогично разделу ВР.2.
ВР.4. Выгрузка изделий
Объект контроля - цветовой индикатор дозы (указать тип) (или дозиметр (указать тип) при контрольных измерениях дозы). Периодичность контроля - индикатор дозы на каждом ящике с двух сторон, детектор рабочего дозиметра - согласно требованиям ГОСТ 30392-95 «Изделия медицинского назначения. Методика дозиметрии при проведении процесса радиационной стерилизации».
Контролируемый параметр - цвет индикатора. Метод определения цвета - визуально, сравнением с контрольным цветом (возможно по цветовой шкале).
Данные измерений пересчитывают в дозу по калибровочной таблице. Данные заносят в журнал стенда.
ВР.5. Приемочный контроль
Приемочный дозиметрический контроль - аналогично п. ВР.4. Запись о дозиметрическом контроле (в частности, величине средней стерилизующей дозы) вносится в протокол, который подписывается дозиметристом и оператором.
Запись о дозе стерилизации вносится в протокол стерилизации на (наименование изделия), прошедшие PC.
10. Техника безопасности, пожарная безопасность и производственная санитария
10.1. Аварийные состояния процесса и способы их устранения и предупреждения
|
Вид аварийного состояния производства |
Предельно допустимые значения параметров, превышение которых может привести к аварии |
Действия персонала по предотвращению или устранению аварийного состояния |
|
(Наименование источника излучения) |
||
|
(Тип неисправности конкретно) |
|
Отключить установки |
10.2. Пожаро- и взрывоопасные и токсичные свойства сырья, полупродуктов, готового продукта и отходов процесса
Наименование вещества: (указать пожароопасные, токсичные вещества в ходе процесса);
Сырье - нестерильные (название изделий); продукт процесса PC - стерилизованные (название изделий) - нетоксичны.
10.3. Категория по взрывопожароопасности, классы производственных помещений и наружных установок, категории и группы взрывоопасных мест
|
Наименование производственных помещений |
Классификация производств по НПБ 105-95/МВД |
Средство пожаротушения |
Классификация по ПУЭ |
10.4. Перечень наиболее опасных мест процесса
|
Наименование |
Вид опасности |
Меры предосторожности |
10.5. Санитарная характеристика производственных процессов (ПП)
|
Наименование ПП и помещений |
Санитарная характеристика ПП |
Группа ПП для определения специальных бытовых помещений |
10.6. Средства индивидуальной защиты работающих
|
Профессия работающего |
Средство индивидуальной защиты |
Срок носки |
Периодичность замены |
11. Перечень производственных инструкций
|
№ п/п |
Наименование инструкций и документов |
Обозначение |
12. Технико-экономические нормативы
Стоимость радиационной стерилизации (наименование изделий) определена в (указать параметр стоимости в абсолютном или относительном выражении), исходя из стоимости 1 часа облучения на ускорителе, включая стоимость электроэнергии, воды, аренды помещений и других накладных расходов, а также производительности установки при облучении данного вида продукции.
РАЗРАБОТАНО (указать организацию-разработчик ТР)
Подписи разработчиков:
Руководитель подразделения, разработавшего ТР
Ответственный за разработку
Руководитель микробиологической службы
Ответственный за ТБ
Библиографические данные
1. Порядок разработки, экспертизы, утверждения, издания и распространения нормативных и методических документов системы государственного санитарно-эпидемиологического нормирования: Сборник. Р.1.1.001-1.1.005-96: Минздрав России. - М., 1998.
2. ГОСТ 30392-95 «Изделия медицинского назначения. Методика дозиметрии при проведении процесса радиационной стерилизации».
3. ГОСТ 27632-88 «Ускорители заряженных частиц промышленного применения. Общие технические требования».
4. ГОСТ 26278-64 «Ускорители заряженных частиц промышленного применения. Типы и основные параметры».
5. ГОСТ 27212-87 «Источники ионизирующего излучения радионуклидные закрытые. Общие технические требования».
6. ГОСТ Р 50584-93 «Техника радиационная. Радиационно-экологические требования».
7. ГОСТ Р 15.013-94 «СРПП. Медицинские изделия».
8. ГОСТ Р ИСО. 13408-1-2000 «Асептическое производство медицинской продукции. Общие требования».
9. ОСТ 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы».
10. ГОСТ Р ИСО 11137-2000 «Стерилизация медицинских изделий. Требования к валидации и текущему контролю. Радиационная стерилизация».
11. Основные санитарные правила обеспечения радиационной безопасности (ОСПОРБ-99): Санитарные правила. СП 2.6.1.799-99.
12. Нормы радиационной безопасности (НРБ-99): Гигиенические нормативы. ГН 2.6.1.758-99.
13. Определение индивидуальных эффективных и эквивалентных доз и организация контроля профессионального облучения. Общие требования: Методические указания. МУ 2.6.1.016-2000. - М., 2000.
14. Дозиметрический контроль внешнего профессионального облучения. Общие требования: Методические указания. МУ 2.6.1.25-2000. - М., 2000.
15. МИ 2548-99 ГСИ. Установки радиационно-технологические с радионуклидными источниками излучения для стерилизации изделий медицинского назначения. Методика аттестации.
16. МИ 2549-99 ГСИ. Установки радиационно-технологические с ускорителями электронов для стерилизации изделий медицинского назначения. Методика аттестации.