 | Информационная система |  |
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
БИОЛОГИЧЕСКИЕ МЕТОДЫ КОНТРОЛЯ
МЕТОДИКА
ОПРЕДЕЛЕНИЯ ТОКСИЧНОСТИ ВОДЫ
И ВОДНЫХ ВЫТЯЖЕК ИЗ ПОЧВ, ОСАДКОВ СТОЧНЫХ ВОД,
ОТХОДОВ ПО СМЕРТНОСТИ И ИЗМЕНЕНИЮ ПЛОДОВИТОСТИ
ДАФНИЙ
Федеральный реестр (ФР)
Методика допущена для целей государственного экологического контроля
Москва «АКВАРОС» 2007
СОДЕРЖАНИЕ
НАЗНАЧЕНИЕ И ОБЛАСТЬ ПРИМЕНЕНИЯ МЕТОДИКИ
Настоящий документ устанавливает методику определения острой и хронической токсичности растворов отдельных химических веществ, питьевых, грунтовых, поверхностных, сточных вод, а также водных вытяжек из почв, осадков сточных вод и отходов в лабораторных условиях с использованием в качестве тест-объекта низших ракообразных дафний.
1 ПРИНЦИП МЕТОДИКИ
Методика основана на определении смертности и изменений в плодовитости дафний (Daphnia magna Straus, Cladocera, Crustacea) при воздействии токсических веществ, присутствующих в исследуемой водной среде, по сравнению с контрольной культурой в пробах, не содержащих токсических веществ (контроль).
Острое токсическое действие растворов отдельных химических веществ, исследуемой воды или водной вытяжки из почв, осадков сточных вод и отходов на дафний определяется по их смертности (летальности) за определенный период экспозиции. Критерием острой токсичности служит гибель 50 % и более дафний за 96 часов в исследуемой воде при условии, что в контрольном эксперименте гибель не превышает 10 %.
В краткосрочных экспериментах по определению острого токсического действия устанавливают:
- острую токсичность или среднюю летальную концентрацию отдельных веществ (кратность разбавления вод или водной вытяжки из почв, осадков сточных вод и отходов, содержащих смеси веществ), вызывающую гибель 50 % и более тест-организмов (ЛК50-96, ЛКР50-96);
- безвредную (не вызывающую эффекта острой токсичности) концентрацию отдельных веществ (кратность разбавления вод или водной вытяжки из почв, осадков сточных вод и отходов, содержащих смеси веществ), вызывающую гибель не более 10 % тест-организмов (БК10-96, БКР10-96).
Хроническое токсическое действие растворов отдельных химических веществ, исследуемой воды или водной вытяжки из почв, осадков сточных вод и отходов на дафний определяется по смертности и изменению их плодовитости за период до 24 суток в исследуемой воде по сравнению с контрольным экспериментом. Критерием хронической токсичности служит гибель 20 % и более и (или) достоверное отклонение в плодовитости из числа выживших тест-организмов по сравнению с контрольным экспериментом.
2 МЕТРОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ
При соблюдении всех регламентированных условий и проведении анализа в точном соответствии с данной методикой значение погрешности (и ее составляющих) результатов измерений, не превышают значений, приведенных в таблице 1.
Таблица 1 - Значения метрологических характеристик для различных анализируемых объектов
|
Показатель точности (границы относительной погрешности) ±d, %, при Р = 0,95 |
Показатель повторяемости (относительное среднеквадратичное отклонение повторяемости), sr, % |
Показатель воспроизводимости (относительное среднеквадратичное отклонение воспроизводимости), sR, % |
Предел повторяемости, r, %, P = 0,95, n = 2 |
|
|
Вода питьевая и поверхностная пресная, грунтовая, сточная. Водные вытяжки из почв, осадков сточных вод, отходов производства |
40 |
10 |
20 |
28 |
3 ОБОРУДОВАНИЕ, МАТЕРИАЛЫ, РЕАКТИВЫ
Для проведения исследований по данной методике необходимы следующие средства измерений, материалы и реактивы:
весы лабораторные общего назначения, 4 класса точности, с наибольшим пределом взвешивания 200 г (ГОСТ 24104-2001);
весы лабораторные общего назначения, 4 класса точности, с наибольшим пределом взвешивания 1000 г (ГОСТ 24104-2001);
меры массы (ГОСТ 7328-2001);
рН-метр (ГОСТ 25.7416.01-71);
барометр-анероид типа М-67 с пределами измерений от 610 до 790 мм рт.ст.;
люксметр любого типа, например, цифровой ТЮ 1403 (ТУ 4485-0152-05764771-96);
термометр лабораторный шкальный с диапазоном измерения от 0 °С до 50 °С с ценой деления шкалы 0,5 °С (ГОСТ 28498-90);
термометр стеклянный ртутный для точных измерений с диапазоном измерения от -3 °С до +65 °С с ценой деления шкалы 0,5 °С, тип ТМ-14 (ГОСТ 13646-68);
лупа измерительная (ГОСТ 25706-83);
линейка измерительная (ГОСТ 427-75);
оксиметр любого типа, с погрешностью измерения не более 0,5 мг/дм3 кислорода;
груши резиновые разные - пипеточные луковицы (ТУ 38-106003);
пипетки автоматические-дозаторы (любого типа) объемом 0,002 - 0,2 см3, 0,02 - 0,2 см3; 0,1 - 1,0 см3 ± 1,0 %;
пипетки стеклянные объемом 2 см3 с отрезанным и оплавленным концом для пересадки рачков (ГОСТ 29227-91);
микропипетки 0,1 см3, 0,2 см3 с ценой деления 0,01 см3 (ГОСТ 29227-91);
цилиндры вместимостью 25, 50, 100, 1000 см3 второго класса точности (ГОСТ 1770-74);
мензурки вместимостью 0,25; 0,5; 1,0 дм3 (ГОСТ 1770-74);
колбы мерные 2-25-2, 2-50-2, 2-100-2 (ГОСТ 1770-74);
пипетки вместимостью 1, 2, 5, 10 см3 с ценой деления 0,1 см3 (ГОСТ 29227-91);
климатостат (бокс для культивирования дафний) или эквивалентное приспособление, позволяющее поддерживать освещение лампами дневного света от 500 - 1000 лк и температуру окружающего воздуха +20 ± 2 °С;
климатостат (бокс для культивирования водорослей) или эквивалентное приспособление, позволяющее поддерживать освещение лампами дневного света 3000 - 4000 лк и температуру окружающего воздуха от +22 °С до +25 °С;
мешалка лабораторная (ТУ 25-05-2160-76Е), или аппарат для встряхивания (ТУ 25-052160-76), или мешалка магнитная (ТУ 25-11-834-73), или перемешивающее устройство ПЭ-6410 М (ТУ 3614-008-23050963-99);
микроскоп биологический рабочий или исследовательский типов МБР, МБИ, обеспечивающий увеличение в 100 - 200 раз (ТУ 3-3-1210-75);
насос вакуумный любого типа, например, водоструйный стеклянный (ГОСТ 25336-82) с приемником объемом 1000 см3;
аппарат Зейца или другой фильтровальный аппарат, например, отсасыватель хирургический ОХ-10 (ТУ 64-1-2941-81);
центрифуга лабораторная медицинская (ТУ 5-375-4261-76), или типа ЦЛК-1 с комплектом пробирок (ТУ 5-4260);
сушильный электрический шкаф общелабораторного назначения (ТУ 64-1-909-80);
автоклав (ГОСТ 9586-75);
аквариумный микрокомпрессор АЭН-4 (ГОСТ 14087-88);
плитка электрическая (ГОСТ 14919-83);
спиртовка лабораторная стеклянная (ГОСТ 25336-82);
сита почвенные (ТУ 46-47-885-73);
шпатели металлические (ГОСТ 19126-79);
холодильник бытовой, обеспечивающий замораживание (-20 ± 1°С) и хранение проб (от +2 °С до +4 °С);
баня водяная (ТУ 64-1-2850-76);
баня песочная (ТУ 46-775-74);
пробоотборник объемом 500 - 700 см3 (ГОСТ 6859-72);
батометр-бутылка на штанге тип ГР-16М (ТУ 25-04-1749);
дночерпатель любого типа;
буры почвенные (ТУ 2.833.106-89);
ножи почвенные (ГОСТ 23707-95);
лопаты (ГОСТ 19596-87);
совок (ГОСТ 14180-80);
щупы винтообразные с продольным вырезом, поршневые (ГОСТ 2517-85);
долота, колуны; ведра, изготовленные из нержавеющей стали или с тефлоновым покрытием;
ступки и пестики фарфоровые (ГОСТ 9147-80);
мельничное сито или капроновое сито (газ) № 64 - 77 (ГОСТ 4403-91);
ткани шелковые (для муки и крахмала - мельничный газ) № 25 - 43, число отверстий, приходящихся на 1 см, соответствует номеру (ГОСТ 4403-91);
сачки диаметром 1 - 2 см из мельничного газа (изготавливаются кустарно);
фильтры бумажные обеззоленные «белая лента» (ТУ 6-09-1678-77, ГОСТ 12026-76);
фильтры мембранные с диаметром пор 0,45; 3,5 мкм «Владипор» марки МФАС-ОС-2 (ТУ 6-55-221-1029-89), МФАС-П-4 (ТУ 6-55-221-903-88) или аналогичные зарубежного производства, имеющие международный сертификат качества ISO 9000 или EN 29000;
вата хлопковая медицинская гигроскопическая (ГОСТ 5556-81);
бинт марлевый медицинский (ГОСТ 1172-93);
камера для счета форменных элементов крови по Горяеву 0,1 мм глубины (ТУ 42-816);
склянки и банки стеклянные с винтовым горлом, с прокладкой и крышкой или с притертой пробкой для отбора и хранения проб и реактивов вместимостью 500, 1000, 2000, 5000 см3 (ТУ 6-19-6-70);
флаконы и банки цилиндрические полиэтиленовые или политетрафторэтановые с навинчивающимися крышками для отбора и хранения проб и реактивов вместимостью 100, 250, 500, 1000, 2000 см3 (ТУ 6-19-45);
воронки лабораторные (ГОСТ 25336-82);
стаканчики для взвешивания (бюксы) диаметром 30, 40 мм (ГОСТ 25336-82);
эксикаторы с крышкой (ГОСТ 25336-82);
бутыли, кристаллизаторы произвольного объема для замачивания и мытья посуды;
чашки кристаллизационные толстостенные объемом 2, 5, 10 дм3 (ТУ 25-11-1024-75);
стекла покровные для микропрепаратов (ГОСТ 6672-75);
стаканы стеклянные лабораторные вместимостью 150, 200, 250, 1000 см3 (ГОСТ 25336-82);
колбы стеклянные лабораторные вместимостью 0,25, 1 и 2 дм3 (ГОСТ 25336-82);
спирт этиловый (ГОСТ 18300-87);
вода дистиллированная (ГОСТ 6709-72);
вода питьевая (ГОСТ Р 51232-98);
аммоний ванадиевокислый мета х.ч. (ГОСТ 9336-75);
железо (III) сульфат х.ч. (ГОСТ 9485-74);
железо (III) хлорид х.ч. (ГОСТ 4147-74), 6-водное ос.ч. 5-2 (ТУ 6-09-1007-77),
калий двухромовокислый стандарт-титр (ТУ 6-09-2540-87) или х.ч. (ГОСТ 4220-75);
калий фосфорнокислый двузамещенный 3-водный х.ч. (ГОСТ 2493-75);
калий фосфорнокислый однозамещенный 3-водный х.ч. (ГОСТ 4198-75);
калий углекислый х.ч. (ГОСТ 4221-76);
калий азотнокислый х.ч. (ГОСТ 4217-77);
кальций азотнокислый 4-водный х.ч. (ГОСТ 4142-77);
магний сернокислый 7-водный х.ч. (ГОСТ 4523-77) или стандарт-титр (ТУ 6-09-2540-87);
марганец хлористый х.ч. (ГОСТ 612-75);
молибдена окись х.ч. (ТУ 6-09-4471-77);
натрия гидрооксид х.ч. (ГОСТ 4328-77);
цинк сульфат 7-водный ос.ч. 9-2 (ТУ 6-09-4219-76);
кислота азотная х.ч. (ГОСТ 4461-77);
кислота борная х.ч. (ГОСТ 9656-75);
кислота серная х.ч. (ГОСТ 4204-77);
кислота соляная х.ч. (ГОСТ 3118-77);
этилендиамин-N, N, ![]() ,
, ![]() - тетрауксусной
кислоты динатриевая соль двухводная (трилон Б) х.ч. (ГОСТ
10652-73);
- тетрауксусной
кислоты динатриевая соль двухводная (трилон Б) х.ч. (ГОСТ
10652-73);
дрожжи хлебопекарные (ГОСТ 171-81);
культура зеленых водорослей (Chlorella, Scenedesmus или Selenastrum);
культура тест-организмов - Daphnia magna Str. с характеристиками по «Определителю пресноводных беспозвоночных Европейской части СССР» (планктон и бентос). - Л.: Гидрометеоиздат, 1977 (Л.А. Кутикова, Я.И. Старобогатов).
Примечание. Допускается использование средств измерений, вспомогательных устройств и материалов другого типа, имеющих аналогичные метрологические характеристики.
4 УСЛОВИЯ БЕЗОПАСНОГО ПРОВЕДЕНИЯ РАБОТ
4.1 При работе с химическими веществами, загрязненными почвами, осадками сточных вод, отходами и сточными водами соблюдают требования техники безопасности по ГОСТ 12.4.021-75, по ГОСТ 12.1.007-76 «ССВТ. Вредные вещества. Классификация и общие требования безопасности».
4.2 При пробоподготовке загрязненных почв, осадков сточных вод и отходов необходимо пользоваться средствами индивидуальной защиты: специальной одеждой по ГОСТ 14.4.103-83, респираторами по ГОСТ 12.4.034-85, головными уборами по ГОСТ 12.4.128-83, полихлорвиниловыми перчатками по ГОСТ 12.4 013-85.
4.3 К воздуху производственных помещений предъявляют санитарно-гигиенические требования по ГОСТ 12.1.005-88.
4.4 Безопасность при работе с электроустановками обеспечивают по ГОСТ 12.1.019-79 и в соответствии с требованиями инструкций к оборудованию.
4.5 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91, СНиП 21-01-97 «Пожарная безопасность зданий и сооружений».
4.6 Рабочие столы и поверхности содержат в чистоте. В конце дня проводят влажную уборку рабочих поверхностей.
4.7 Организуют обучение работающих безопасности труда по ГОСТ 112.0.004-90.
5 ТРЕБОВАНИЯ К КВАЛИФИКАЦИИ ЛИЦ, ПРОВОДЯЩИХ БИОТЕСТИРОВАНИЕ
К биотестированию допускают специалистов, освоивших методические приемы водной токсикологии, имеющие специальность «биолог», «химик», и уложившиеся в нормативы контроля при освоении методики.
6 УСЛОВИЯ ПРОВЕДЕНИЯ БИОТЕСТИРОВАНИЯ
Биотестирование проводится в нормальных лабораторных условиях. Помещение не должно содержать токсичных паров и газов, а также следов обработки помещений инсектицидами, пестицидами и пр.
Температура окружающего воздуха в лаборатории от +18 °С до +24 °С, в люминостате для биотестирования (20 ± 2) °С.
Атмосферное давление (84 - 106) кПа ((630 - 800) мм рт.ст.).
Освещение помещения естественное или искусственное, не ограничено особыми требованиями. Освещение в люминостате, или эквивалентном приспособлении, лампами дневного света. Освещенность для дафний (500 - 1000) лк, для водорослей (3000 - 4000) лк.
7 ПОДГОТОВКА К ПРОВЕДЕНИЮ БИОТЕСТИРОВАНИЯ
Для проведения биотестирования предварительно разрабатывают программу отбора проб, готовят посуду, оборудование, вспомогательные материалы для отбора проб и проведения биотестирования, пробоотборники, места хранения отобранных проб, а также рабочие места для обработки доставленных в лабораторию проб и исследования их на токсичность. Все процедуры предварительной подготовки должны исключать попадание токсичных, органических и каких-либо других веществ из окружающих предметов или среды в исследуемую воду или в водные вытяжки из почв, осадков сточных вод и отходов.
7.1 Подготовка посуды для отбора, хранения проб и биотестирования
Для отбора проб воды используют посуду из полиэтилена или политетрафторэтана, а при наличии в воде нефтепродуктов, моющих средств и пестицидов - банки из темного стекла.
Для отбора проб почв, осадков сточных вод и отходов используют банки из темного стекла или посуду из нержавеющей стали. Для отбора проб, исследуемых на токсичность, нельзя использовать посуду с хромовым покрытием.
Посуда из полиэтилена и стекла для отбора проб и биотестирования должна быть химически чистой. Посуду промывают раствором азотной кислоты с массовой долей 10 %. Стенки посуды осторожно смачивают этим раствором, после чего на 2 - 3 часа посуду оставляют, затем тщательно промывают водопроводной водой, нейтрализуют раствором пищевой соды и промывают 3 - 4 раза дистиллированной водой. При сильном загрязнении посуды, а также новую посуду промывают водой, заполняют раствором азотной кислоты с массовой долей 10 % и выдерживают не менее суток, затем тщательно промывают водопроводной и не менее 3 - 4 раз дистиллированной водой. Посуду для отбора проб почв, осадков сточных вод и отходов, изготовленную из нержавеющей стали, тщательно моют, очищают пищевой содой, промывают водопроводной водой и ополаскивают 3 - 4 раза дистиллированной водой. Для мытья посуды не разрешается пользоваться хромовой смесью (смесь бихромата калия и серной кислоты), синтетическими поверхностно-активными веществами и органическими растворителями.
Всю грязную посуду, использованную при отборе проб, в процессе пробоподготовки и проведения биотестирования подвергают стерилизации кипячением в течение 1 часа или стерилизуют (за исключением мерной) в сушильном шкафу при 160 °С в течение 1 часа, или подвергают автоклавированию (за исключением мерной) при 121 °С и давлении 1,05 кг/см2 в течение 15 минут. Стекло, полипропилен и тефлон можно подвергать автоклавированию.
Химически чистую посуду для биотестирования хранят с закрытыми стеклянными притертыми пробками или завинчивающимися крышками в защищенных от пыли ящиках лабораторного стола или на закрытых полках, стеллажах и т.п.
7.2 Подготовка культивационной воды
Культивационную воду используют: для культивирования дафний, в качестве контрольной при биотестировании, для разбавления исследуемых вод.
Для подготовки культивационной воды питьевую воду отстаивают и аэрируют в течение 3 - 7 суток (до полного дехлорирования) в бутылях из бесцветного стекла в присутствии высшей водной растительности (2 - 3 г по воздушно-сухой массе любой аквариумной растительности на 1 дм3 питьевой воды).
При отсутствии питьевой воды удовлетворительного качества допускается использование бутилированной негазированной питьевой воды, поверхностной пресной или грунтовой воды, отобранной вне зоны влияния источников загрязнения и профильтрованной через мембранный фильтр с размером пор 3,5 мкм. Мембранные фильтры перед употреблением тщательно промывают и кипятят в дистиллированной воде не менее 10 мин.
Культивационная вода должна удовлетворять следующим требованиям:
- отсутствие органических загрязняющих веществ, хлора, токсических веществ, антагонистических для дафний организмов (сине-зеленых водорослей) и пищевых конкурентов (простейших, многоклеточных);
- рН - 7,0 - 8,5;
- жесткость общая от 80 до 250 мг/дм3 (выраженная в СаСО3);
- отсутствие углекислого газа, метана и др. газов (при наличии газов для их удаления культивационную воду кипятят 30 мин, затем охлаждают и аэрируют);
- концентрация растворенного кислорода - не менее 6 мг/дм3 (если концентрация растворенного кислорода в контрольной и разбавляющей воде ниже 6 мг/дм3, последнюю аэрируют при помощи аквариумного компрессора до начала биотестирования);
- температура (+20 ± 2) °С.
При исследовании вод с повышенным солесодержанием (содержание сухого остатка выше 1 г/дм3) проводят предварительную постепенную адаптацию культуры тест-объектов, добавляя небольшими порциями хлористый натрий в культивационную воду (содержание солей по сухому остатку не должно превышать 6 г/дм3). При невозможности успешно адаптировать имеющуюся культуру, а также при содержании сухого остатка в исследуемой воде более 6 г/дм3 используют тест-объекты, применяемые в биотестировании морских вод (Artemia salina, Acartia clausi, морские водоросли и простейшие).
При использовании в силу необходимости культивационной воды, не отвечающей требованиям установленного качества, все отклонения отмечают в протоколе испытаний.
7.3 Получение исходного материала, транспортировка, содержание и кормление дафний, выращивание культуры
Исходный материал для культивирования (водоросли, дафнии) получают в лабораториях, занимающихся биотестированием, имеющих культуру требуемой видовой принадлежности, чувствительность которой к модельному токсиканту укладывается в установленный диапазон по п. 12, а измеряемые с помощью этой культуры тест-параметры соответствуют установленным метрологическим характеристикам (см. п. 2).
7.3.1 Транспортировка дафний
Дафний транспортируют в стеклянной емкости с крышкой (в термосе, если температура окружающей среды выходит за пределы (+20 ± 2) °С. Емкость заполняют местной культивационной водой на 2/3 объема и в нее сачком переносят дафнии. Плотность посадки приблизительно 25 особей на 1 дм3 воды; для кормления добавляют 3 см3 водорослевой суспензии на 1 дм3 воды. В лаборатории воду с дафниями по стенке сосуда переливают в емкость для культивирования, объем которой должен в 2 - 3 раза превышать количество воды с рачками. Культиватор с дафниями помещают в люминостат (климатостат, бокс) и в течение 1 - 2 дней небольшими порциями приливают предварительно приготовленную культивационную воду (см. п. 7.2) для адаптации дафний к новой воде.
В лаборатории содержат два вида культуры дафний: маточную (массовую), используемую как источник для возобновления в периоды потери культуры синхронизированной, и синхронизированную, используемую непосредственно для биотестирования.
7.3.2 Выращивание и содержание маточной культуры дафний
Культуру дафний выращивают в климатостате или эквивалентном приспособлении, обеспечивающем поддержание искусственного освещения лампами дневного света с интенсивностью света от 500 до 1000 лк, 16-часовой световой и 8-часовой ночной (без освещения) период; температуру (+20 ± 2) °С.
В качестве культиваторов используют чашки кристаллизационные толстостенные, или батарейные стаканы вместимостью (2 - 5) дм3, которые наполняют на 3/4 объема культивационной водой, сажают туда самок дафний среднего размера с выводковыми камерами, заполненными эмбрионами, и неплотно прикрывают культиваторы (от попадания пыли и для уменьшения испарения) пластинами из стекла или оргстекла толщиной не менее 6 мм. Для пересадки в культиваторы можно отобрать взрослых самок с помощью фильтрования культуры через крупное сито (размер ячеек 1800 - 2200 мкм). Маточную культуру дафний поддерживают в одном или двух сосудах. Ежедневно утром с поверхности воды в сосудах, в которых культивируются рачки, стерильной марлевой салфеткой снимают дрожжевую и бактериальную пленку. После этого воду вместе с рачками осторожно переливают в чистый культиватор так, чтобы накопившийся осадок остался на дне. В чистый культиватор добавляют свежую порцию культивационной воды. Таким образом, ежедневно проводят очистку поверхности воды и дна сосуда, в котором культивируются рачки. Кормление дафний осуществляют ежедневно в соответствии с требованиями пункта 7.4.3. Содержание растворенного кислорода в культиваторах должно быть не менее 6 мг/дм3, что достигается правильным приготовлением культивационной воды (см. п. 7.2) и регулярной пересадкой дафний в свежую культивационную воду. Аэрирование воды в культиваторах с дафниями не допускается.
Один или два раза в неделю осуществляют пересадку культуры в свежую культивационную воду. Частоту пересадки определяют плотностью маточной культуры и содержанием растворенного кислорода в культиваторах. Плотность маточной культуры 20 - 25 особей на 1 дм3 культивационной воды.
Не допускается использование молоди маточной культуры для биотестирования.
7.3.3 Выращивание синхронизированной культуры
Биотестирование воды и водных вытяжек проводят только на синхронизированной культуре дафний. Синхронизированной является одновозрастная культура, полученная от одной самки путем ациклического партеногенеза в третьем поколении. Такая культура генетически однородна. Рачки, ее составляющие, обладают близкими уровнями устойчивости к токсическим веществам, одновременно созревают и в одно время дают генетически однородное потомство. Для получения синхронизированной культуры отбирают одну самку средних размеров с выводковой камерой, заполненной эмбрионами, и помещают в химический стакан вместимостью 250 см3, заполненный культивационной водой на 200 см3. Появившуюся молодь переносят в кристаллизатор (25 особей на 1 дм3 воды) и культивируют указанным способом. Полученная третья генерация является синхронизированной культурой и может быть использована для биотестирования в возрасте 6 - 24 часов.
Чтобы отобрать для опытов одновозрастную культуру, дафний фильтруют с помощью комплекта сит. Взрослые дафнии задерживаются на крупном сите (размер ячеек 1000 - 2200 мкм), а молодые, в возрасте от 6 до 24 часов, на самом мелком (размер ячеек 450 - 560 мкм).
Для непрерывного осуществления массовых анализов на токсичность различных сред при большом количестве проб необходимо культивирование 4 - 5 генетически однородных синхронизированных культур, отличающихся друг от друга по возрасту. Таким образом обеспечивается постоянный приток тестовых организмов. Синхронизированную культуру выдерживают в условиях по п. 7.3.3; кормление по п. 7.4.3. Ежедневно осуществляют очистку поверхности воды и дна культиваторов по п. 7.3.2.
Пересадку плодоносящих самок в свежую культивационную воду осуществляют один раз в неделю. Родившуюся молодь ежедневно отсаживают и используют для биотестирования.
7.4 Подготовка корма и кормление
Дафниям необходимо обеспечить комбинированное дрожже-водорослевое питание. В качестве корма используются зеленые водоросли родов Chlorella, Scenedesmus, Selenastrum.
Водоросли для кормления дафний выращивают в стеклянных кюветах или плоскодонных колбах вместимостью 250 см3 при 12 - 16-часовом освещении лампами дневного света (освещенность 3000 - 4000 лк), температуре от +22 °С до +25 °С, на одной из питательных сред (см. табл. 2). Питательные растворы готовят на дистиллированной воде (рН 7,0 - 7,5), полученной из стеклянного перегонного аппарата (допускается приготовление питательной среды для водорослей на бидистиллированной воде, при ее приготовлении нельзя пользоваться аппаратами с ионообменными смолами).
Чтобы избежать образования осадка в питательной среде, каждый ее компонент предварительно готовят отдельно в 100 см3 дистиллированной воды. Полученные растворы солей кипятят каждый по 30 мин, охлаждают, после чего их можно использовать для приготовления среды в течение месяца при условии хранения при температуре от +2 °С до +4 °С. Каждый сосуд с питательными веществами подписывают с указанием состава, концентрации, времени приготовления и плотно закрывают притертой стерильной пробкой во избежание высыхания и концентрирования.
Для приготовления среды для культивирования водорослей добавляют по 1 см3 каждого концентрированного раствора (кроме солей железа) в колбу вместимостью 1 дм3, заполненную до половины дистиллированной водой, поочередно, в последовательности как указано в табл. 2, доводят до метки 1 дм3 дистиллированной водой, тщательно перемешивают, кипятят раствор 30 мин, охлаждают и после этого добавляют 1 см3 концентрированного раствора соли железа, и если это необходимо, отдельно приготовленные растворы микроэлементов.
Растворы солей железа и микроэлементов можно добавлять во все среды независимо от того, указано это в прописи их состава или нет.
Для предупреждения выпадения в осадок железа и других микроэлементов дополнительно во все среды можно добавлять хелатирующее вещество, образующее с ионами металлов устойчивые комплексные соединения в форме, доступной для питания водорослей. С этой целью используют стерильный раствор этилендиаминтетрауксусной кислоты динатриевой соли (трилон Б) с массовой концентрацией 0,037 г/дм3. Раствор готовят в 100 см3 дистиллированной воды совместно с солью железа. Соли железа и трилона Б отдельно растворяют в 30 см дистиллированной воды, смешивают, доводят дистиллированной водой до 100 см3, кипятят, охлаждают и добавляют в охлажденную среду для культивирования водорослей 1 см3 на 1 дм3 среды.
Таблица 2 - Состав питательных сред для культивирования водорослей
|
Массовая концентрация в среде для культивирования, г/дм3 |
|||
|
Тамия |
Успенского № 1 |
Прата |
|
|
KNO3 |
5,00 |
0,025 |
0,10 |
|
MgSO4×7H2O |
2,50 |
0,025 |
0,01 |
|
Ca(NO3)2×4H2O |
- |
0,144 |
- |
|
К2НРO4×3Н2O |
- |
|
0,01 |
|
КН2РO4×3Н2O |
1,25 |
0,025 |
|
|
К2СO3 |
- |
0,0345 |
- |
|
FeSO4×7H2O |
0,003 |
- |
- |
|
FeCl3×6H2O |
- |
- |
0,001 |
|
Микроэлементы |
по 1 см3/дм3 растворов А и В1 |
|
- |
1 Растворы А и В готовят отдельно, раствор А (Н3ВO3 - 2,86 г/дм3, MnСl2×4Н2O - 1,81 г/дм3, ZnSO4×7H2O - 0,222 г/дм3) и раствор В (МоО3 - 17,64 мг/дм3; NH4VO3 - 22,96 мг/дм3). Затем отдельно стерилизуют каждый раствор 30 мин кипячением; охлаждают, плотно закрывают притертой пробкой и хранят в холодильнике при температуре от +2 °С до +4 °С до трех месяцев.
Например, для приготовления среды Успенского растворяют 2,5 г KNO3; 2,5 г MgSO4×7H2O, 14,4 г Са(NO3)2×4Н2O, 2,5 г КН2РO4×3Н2O и 3,45 г К2СO3 в 100 см3 дистиллированной воды в отдельных склянках каждой соли. Отдельно растворяют 3,7 г трилона Б и 0,3 г Fe2(SO4)3 в 100 см3 дистиллированной воды.
Все шесть склянок кипятят 30 мин, охлаждают и, соблюдая условия стерильности, (над пламенем горелки или спиртовки) переносят в колбу вместимостью 1 дм3 по 1 см3 из каждой склянки (кроме раствора железа и трилона Б) в 0,5 дм3 дистиллированной воды, смешивают, доводят до метки 1 дм3 дистиллированной водой. Полученную смесь кипятят, охлаждают и добавляют после охлаждения 1 см3 смеси солей железа и трилона Б и по 1 см3 каждого раствора микроэлементов (А и В) на 1 дм3 среды. Готовые среды не хранят.
Приготовленную питательную среду разливают в колбы по 100 см3 и, соблюдая условия стерильности, добавляют 1 - 5 см3 концентрированной суспензии водорослей (см. п. 7.4.1). Закрывают колбы стерильными колпачками из алюминиевой фольги или ватными пробками и ставят в люминостат. В люминостате соблюдают 12 - 16-часовой световой и 8 - 12-часовой ночной период.
Во время выращивания водорослей в люминостате 2 - 3 раза в день встряхивают питательный раствор с водорослями, чтобы обеспечить удаление образующегося углекислого газа, при накоплении которого развитие водорослей угнетается. С этой же целью при интенсивном культивировании водорослей на концентрированной среде Тамия обеспечивают постоянное перемешивание водорослевой культуры на лабораторной мешалке или аэрирование.
7.4.1 Получение водорослевой суспензии
После того, как окраска питательной среды становится интенсивно зеленой (требуемая плотность клеток водорослей - 1,5×106 кл./см3), водоросли отделяют от культивационной среды центрифугированием или отстаиванием в холодильнике (от +2 °С до +4 °С) в течение 7 суток с последующим отделением супернатанта. При использовании среды Тамия суспензию дважды промывают дистиллированной водой с последующим центрифугированием или отстаиванием.
Плотность водорослей в концентрированной суспензии должна составлять (3,0 - 3,5)×107 кл./см3. Суспензию водорослей хранят в холодильнике (от +2 °С до +4 °С), не допуская замораживания. Для использования в качестве корма суспензию хранят до 14 суток, а в качестве посевного материала для выращивания водорослей - до 6 месяцев.
Плотность клеток микроводорослей подсчитывают в камере для счета форменных элементов крови по Горяеву. Камеру накрывают покровным стеклом и притирают его до образования радужных колец интерференции, что является признаком достаточно плотно притертого стекла. Пипеткой отбирают произвольное количество тщательно перемешанной культуры водорослей и наносят ее капли под нижний и на верхний край покровного стекла, заполняя камеру так, чтобы не попадали в нее пузырьки воздуха. Избыток водорослевой культуры вытесняется по канавкам камеры. Просматривают все квадраты по диагонали или камера целиком (если численность водорослей незначительная). Подсчет производят под микроскопом МБИ или МБР при увеличении в 100 или 200 раз.
В каждой пробе подсчитывают клетки водорослей как минимум в трех камерах с последующим вычислением среднего арифметического. Пересчет численности клеток водорослей проводят по формуле (1).
![]() (1)
(1)
где N - численность водорослей, кл./см3; n - численность водорослей, найденных в секторе (квадрате) сетки камеры, кл.; S - площадь сектора сетки, мм2; h - глубина счетной камеры, мм; 1000 - коэффициент пересчета кубических миллиметров в кубические сантиметры.
7.4.2 Приготовление дрожжевой суспензии
Для приготовления дрожжевой суспензии 1 г свежих или 0,5 г сухих хлебопекарных дрожжей заливают 100 см3 дистиллированной воды. После набухания суспензию тщательно перемешивают. Допускается хранить дрожжевую суспензию в холодильнике 1 - 2 суток. Перед кормлением дрожжевую суспензию тщательно перемешивают.
7.4.3 Кормление маточной и синхронизированной культуры дафний
Оптимальное количество корма и соблюдение режима кормления - одно из основных условий получения удовлетворительных результатов биотестирования, так как изобильное кормление может привести к снижению чувствительности тест-организмов, засорению фильтрующего аппарата дафний и сокращению содержания растворенного кислорода в культивируемой среде. Недостаточное питание приводит к неадекватному реагированию дафний на воздействие токсических веществ.
Кормят маточную и синхронизированную культуру дафний ежедневно, один раз в сутки, добавляя 7 - 10 см3 концентрированной водорослевой суспензии на 1 дм3 культивационной воды и 1 - 2 раза в неделю добавляя дополнительно 3 см3 дрожжевой суспензии на 1 дм3 культивационной воды.
Достаточность питания тест-организмов подтверждается удовлетворительными результатами предупредительного контроля токсикологического анализа (см. п. 12).
7.4.4 Кормление дафний в эксперименте
Дафний в остром опыте кормят также ежедневно, один раз в сутки, добавляя 1,0 см3 концентрированной или разбавленной в два раза дистиллированной водой водорослевой суспензии на 100 см3 культивационной воды.
В хроническом опыте добавляют дополнительно 1 - 2 раза в неделю 0,1 - 0,2 см3 дрожжевой суспензии на 100 см3 воды. Достаточность питания тест-организмов подтверждается удовлетворительными результатами приемлемости результатов измерений (п. 10).
Перед кормлением температуру водорослевой и дрожжевой суспензии доводят до комнатной. Добавки пищи осуществляют при помощи автоматического дозатора или микропипетки после тщательного перемешивания дрожжевой и водорослевой суспензий.
7.5 Отбор, транспортировка, хранение и подготовка проб
7.5.1 Отбор, транспортировка, хранение и подготовка проб воды
7.5.1.1 Отбор, транспортировка и хранение проб воды
Объем пробы воды для определения острого токсического действия составляет 2 дм3, хронического токсического действия - 5 дм3. Отбираемый объем должен быть в два раза больше требуемого для хранения дубликата пробы до конца биотестирования.
Методы отбора, транспортировки, хранения, подготовки к выполнению биотестирования должны обеспечить неизменность состава проб в интервале времени между отбором проб и их анализом.
Общие процедуры отбора проб определены в ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб». Требования к процедуре отбора проб изложены в разделе 5.7 ГОСТ Р ИСО/МЭК 17025-2000.
Отбор проб, транспортировку и хранение грунтовых вод осуществляют в соответствии с СТ СЭВ 4710-84 «Воды подземные. Общие требования к отбору проб».
Отбор проб в поверхностных проточных и непроточных водоемах осуществляется в соответствии с ГОСТ 17.1.5.05-85 «Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков».
Для пробоотбора используют устройства в соответствии с требованиями ГОСТ 17.1.5.04-81 «Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия».
Пробы отбирают вручную специальными приспособлениями или с применением автоматических пробоотборников, при этом емкости для проб должны быть изготовлены из нетоксичного материала, легко выниматься из пробоотборника для очистки и мытья.
Для отбора глубинных проб воды из озер, водохранилищ, прудов и рек используют батометры системы Молчанова, Рутнера или Скадовского-Зернова.
Для отбора проб с глубины 0,5 м и более используют бутыль с привязанной пробкой, которую помещают в футляр, или пробоотборник с грузом. Футляр снабжен петлей, к которой привязывают веревку с размеченными отрезками, указывающими глубину погружения. На требуемой глубине с помощью привязанной к пробке веревки выдергивают пробку из горла бутыли. После заполнения бутыли водой (на поверхности воды не появляются пузырьки воздуха) ее поднимают на поверхность.
Отбор проб питьевых вод осуществляют в соответствии с ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб».
Отбор питьевых вод перед поступлением в распределительную сеть производят из кранов на водоводах, расположенных на входе в установку обеззараживания.
Пробы питьевой воды в источнике водоснабжения с глубины 0,5 м отбирают пробоотборником любого типа объемом 500 - 700 см3.
Водопроводную воду отбирают из-под крана, многократно ополоснув его отбираемой водой, после 10-минутного слива при полностью открытом кране. Кран антисептической обработке не подвергают.
Отбор сточных вод осуществляют в соответствии с требованиями НВН 33-5.3.01-85 «Инструкция по отбору проб для анализа сточных вод».
Отбор природных и сточных вод следует производить в местах наибольшего перемешивания. Сточные воды отбирают на средней глубине потока, где твердые частицы равномерно распределены.
Очищенные сточные, а также питьевые воды на стадии водоподготовки отбирают до системы хлорирования.
При исследовании сточных вод на токсичность не допускается отбор разовой пробы. Количество необходимых порций выбирают на основе опыта проведения анализа. Среднесуточная проба составляется из равных объемов сточных вод, отобранных через равные промежутки времени. Предпочтительно отбирать среднесуточную пробу каждый час в течение 24 часов, после тщательного перемешивания всего объема отобранной пробы для исследования берется необходимое количество воды.
Допустимое минимальное количество отбираемых единичных проб для последующего смешения - три, с интервалом между отборами не менее часа.
При взятии проб измеряют температуру воды. Для этого используют термометры с ценой деления 0,5 °С. Для определения температуры на месте взятия пробы, 1 дм3 воды наливают в склянку, нижнюю часть термометра погружают в воду и через 5 мин отсчитывают показания, держат термометр вместе со склянкой на уровне глаз. Точность определения (±0,5) °С.
Не допускается консервирование проб, предназначенных для исследования на токсичность.
Отобранные пробы наливают, предварительно дважды ополаскивая отбираемой водой, в банки или флаконы, заполняя их до краев и закрыв без пузырьков воздуха пришлифованными стеклянными пробками или полиэтиленовыми крышками. Под полиэтиленовые крышки подкладывают стерильные тефлоновые прокладки или из алюминиевой фольги. Пробы упаковывают в деревянные ящики для переноски проб и прокладывают бумагой или ветошью. Для лучшей сохранности в жаркую погоду пробы транспортируют в контейнерах-холодильниках при температуре от +4 °С до +10 °С. В холодный период года контейнеры должны быть снабжены термоизолирующими прокладками, обеспечивающими предохранение проб от промерзания. При транспортировке не следует держать пробы на свету.
При отборе пробы составляют протокол по утвержденной форме (см. Приложение А). На бутыль наклеивают водостойкую этикетку или пишут несмываемым водой маркером с указанием номера пробы, места, даты и времени ее отбора.
При отборе проб соблюдают технику безопасности. На крупных водотоках и водоемах соблюдают навигационные правила и правила эксплуатации используемого судна. Постоянные точки контроля выбирают в местах, которые были бы доступны в любое время года и где отсутствуют какие-либо опасности. На очистных сооружениях отбор проб осуществляют в специально предназначенных местах, маркированных и освещаемых в темное время суток. Отбор проб воды производит бригада, состоящая минимум из двух человек. Перед работой бригаду инструктируют о мерах предосторожности при выполнении программы работ в зависимости от места отбора, климатических условий и т.д. Пробы, поступающие в лабораторию для исследования, регистрируют в журнале учета с обязательным указанием числа емкостей и номера протокола отбора проб для каждой пробы.
Биотестирование проб воды проводят не позднее 6 часов после их отбора. При невозможности проведения анализа в указанный срок пробы воды охлаждают (от +2 °С до +4 °С). Хранить пробы следует в темноте не более 24 часов после отбора. О продолжительности хранения проб воды делают отметку в протоколе биотестирования. В исключительных случаях, при отсутствии летучих органических веществ, допускается глубокая заморозка проб (-18 °С) и их хранение до двух недель, а при стабильности проб - до 2 месяцев, при этом следует помнить, что после размораживания токсичность воды может измениться. В случае предполагаемого замораживания пробы при ее отборе не следует заполнять сосуды полностью, чтобы избежать их разрыва. Если пробы требуется отстаивать, центрифугировать или фильтровать, то эти процедуры должны предшествовать замораживанию.
7.5.1.2 Подготовка проб воды к биотестированию
Перед биотестированием предварительно охлажденные или замороженные пробы доводят до температуры 20 ± 2 °С.
При наличии в сточных водах крупнодисперсных включений (с диаметром частиц более 3,5 мкм) их следует удалить отстаиванием в течение 30 - 120 мин фильтрованием или центрифугированием. Взвешенные частицы в исследуемой на токсичность воде могут искажать результаты биотестирования, так как нарушают механизм питания у дафний при помощи фильтрования и снижают освещенность для водорослей. Фильтрация пробы производится через наиболее пористые обеззоленные фильтры «белая лента» (недопустимо использовать «синюю ленту», так как она задерживает коллоидные вещества, что занижает результаты биотестирования).
Природные воды фильтруют через мембранные фильтры с диаметром пор 3,5 мкм (фильтр перед применением должен быть промыт и простерилизован кипячением в дистиллированной воде не менее 10 мин) или через обеззоленные фильтры «белая лента».
Центрифугирование является предпочтительным методом удаления взвешенных частиц перед биотестированием. Воду, предназначенную для исследования на токсичность, центрифугируют 10 мин при скорости вращения от 4000 до 4500 обор/мин.
Активный хлор, используемый для обеззараживания питьевых и сточных вод, является токсическим веществом, поэтому перед биотестированием питьевых вод, а также при необходимости анализа сточных вод после системы хлорирования хлор следует удалить из исследуемой воды отстаиванием пробы с открытой крышкой при температуре от +2 °С до +4 °С не менее 24 часов.
Проба воды, подлежащая биотестированию, должна иметь рН 7,0 - 8,5, если рН пробы выходит за указанные пределы, требуется нейтрализация рН в исследуемой пробе до оптимальных значений, при которых обеспечивается нормальная жизнедеятельность используемых биотестов. Подкисление осуществляют раствором НСl с массовой долей 10 %, подщелачивание - раствором NaOH с массовой долей 10 %. После нейтрализации пробы аэрируют 10 - 20 мин для стабилизации рН. Регулирование рН не должно вызывать химической реакции с веществами, присутствующими в пробе (выпадение осадка, комплексообразование) и не должно более чем на 5 % изменять концентрацию исследуемых вод. рН выше 9,0 маскирует токсичность также как и жесткость.
При необходимости уточнения результатов биотестирования по влиянию фактора рН на усиление токсичности вод, когда установлено, что их рН выходит за пределы диапазона 7,0 - 8,5, эксперимент расширяют и определяют токсичность исследуемых проб после нейтрализации и без нейтрализации.
В протоколе биотестирования указывают токсичность проб после нейтрализации и без нейтрализации. Заключение о токсичности вод дается по пробе без нейтрализации. Данные о токсичности проб после нейтрализации указываются в протоколе для принятия правильного природоохранного решения по снижению неблагоприятного воздействия вод на объекты окружающей среды, применяя методы нейтрализации водородного показателя.
При исследовании грунтовых или других вод с содержанием железа двухвалентного более 1 мг/дм3 (валовая форма) необходимо предварительное отстаивание проб не менее 24 часов при температуре от +2 °С до +4 °С. Осветленная вода сифонируется и анализируется на токсичность.
Биотестируемая проба воды должна иметь концентрацию растворенного кислорода не ниже 6 мг/дм3, в противном случае пробу аэрируют при помощи аквариумного компрессора перед процедурой биотестирования.
7.5.1.3 Приготовление разбавлений исследуемых вод для биотестирования
Для приготовления разбавлений исследуемых вод используют культивационную воду. Предварительно, перед приготовлением необходимых разбавлений вод для исследования, подготавливают соответствующей емкости посуду, в которой будут готовить растворы. Объем используемой посуды должен на 1/3 превышать необходимый объем приготавливаемого разбавления исследуемых вод.
Перед приготовлением разбавлений нужно подготовить по возможности два одинаковых сосуда: один для разбавления, а другой для хранения раствора (может случиться, что в ближайшие часы процедуру биотестирования в определенном разбавлении необходимо будет повторить). Как во время приготовления разбавлений, так и при их хранении бутыли или другая посуда обязательно должны быть закрыты предварительно подобранными пробками и снабжены несмываемыми водой надписями о приготовленной концентрации исследуемых вод. Приготовление растворов, разбавлений, проведение биотестирования выполняют при комнатной температуре. Температура культивационной и исследуемой воды должна быть также доведена до комнатной температуры перед приготовлением разбавлений.
Для приготовления разбавлений берут определенные, отмеренные мерной посудой, объемы исследуемой и разбавляющей (культивационной) воды. В качестве мерной посуды для объемов меньше 10 см3 используют мерные пипетки. Для объемов более 10 см3 - мерные цилиндры. Поверхностные, пресные, грунтовые и сточные воды с неизвестной степенью токсичности анализируют в 100, 30, 9, 3 и 1 %-ной концентрациях. Сточные и очищенные сточные воды (отобранные до системы хлорирования), если не известны их токсические свойства, тестируют в первичном испытании в большем наборе разведений при 100, 50, 25, 12,5, 6,25, 3,12, 1,5, 0,78 %-ной концентрации. Если предварительно известно, что сточные воды обладают гипертоксичностью, а также, если это можно предположить по данным гидрохимического исследования, исследуемые концентрации уменьшают и составляют 10, 3, 0,3, 0,1 %. Возможен произвольный выбор разведений. Чем выше предполагаемая токсичность, тем большей должна быть кратность разбавлений исходной пробы.
После получения предварительных результатов биотестирования при необходимости готовят и анализируют дополнительные разбавления.
Если при первичном токсикологическом испытании разбавление сточных вод делают в стандартных (предложенных выше концентрациях) или наугад, то при повторном исследовании разбавления готовят, исходя из полученных результатов проведенных исследований.
В процессе приготовления разбавлений пробы тщательно перемешивают.
При выполнении практического биотестирования используют в основном два (наиболее важных) показателя, характеризующих содержание исследуемой воды в разбавленном (культивационной водой) растворе: во сколько раз исследуемая вода разбавлена и каково ее процентное содержание в разбавлении. Данные показатели заносят в рабочий журнал (см. Приложение Б).
Пример. Как путем разбавления получить х %-ный раствор сточной воды и рассчитать, во сколько раз она разбавлена.
Величину х будем
измерять в долях. Тогда единица соответствует раствору, в котором х - доля исследуемой воды и (1 - х) - доля чистой культивационной воды.
Культивационной воды в растворе больше, чем сточной в ![]() раз. Степенью разбавления
называют значение
раз. Степенью разбавления
называют значение ![]() . Если х измеряют
в процентах, то это значение записывают в виде:
. Если х измеряют
в процентах, то это значение записывают в виде:
![]()
Итак, если к одной доле сточной воды добавляют (100 - х) % долей культивационной воды, то получают х %-ный раствор. Например, для получения 5 %-ного раствора сточных вод вычисляют степень разбавления следующим образом:
![]()
и получают, что 1 доля сточных вод и 19 долей культивационной воды составят при смешении 5 %-ный раствор сточных вод, т.е. 5 %-ный раствор сточных вод получат при их 20-кратном разбавлении.
7.5.2 Отбор, транспортировка, хранение и подготовка проб почвы
7.5.2.1 Отбор, транспортировка и хранение проб почвы
Методы отбора, транспортировки, хранения, подготовки к выполнению биотестирования должны обеспечить неизменность состава проб почвы в интервале времени между отбором и их анализом.
Отбор проб грунта, транспортировка и хранение осуществляют в соответствии с ГОСТ 12071-84 «Грунты. Отбор, упаковка, транспортирование и хранение образцов», ГОСТ 27753.1-88 «Грунты тепличные. Методы отбора проб».
Отбор проб почвы, их транспортировка и хранение осуществляют в соответствии с ГОСТ 17.4.3.01-83 «Охрана природы. Почвы. Общие требования к отбору проб», ГОСТ 17.4.4.02-84 «Почвы. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического анализа», ГОСТ 28168-89 «Почвы. Отбор проб».
При отборе проб почвы должна быть определена протяженность и топография зон загрязнения. Участки для отбора проб почвы должны хорошо отражать структуру района исследования: почвенный покров, материнскую породу, рельеф, геологические и гидрологические характеристики.
Необходимым условием отбора проб почвы является предохранение их от вторичного загрязнения (в том числе атмосферных осадков) на всех этапах отбора и подготовки проб к биотестированию.
Для сравнимости результатов необходимо, чтобы приемы выбора пунктов и способ отбора проб почвы были идентичны при каждом исследовании почвы на токсичность.
Для характеристики загрязнения почвы на определенной площади отбирают объединенные пробы почвы. Объединенную пробу составляют путем смешивания единичных проб почвы, отобранных в разных точках данной пробной площадки размером не менее 10´10 м (100 м2), которая располагается в типичном для данной территории месте. На каждые 20 га площади закладывают не менее одной пробной площадки. При обследовании площади менее 0,5 га размер площадки уменьшают, и он составляют 5´5 м.
Объединенную пробу составляют из 5 - 10 или 15 - 20 единичных проб (в зависимости от однородности исследуемого участка), равномерно размещенных на пробной площадке. Объем единичных проб почвы должен быть одинаков, поэтому для пробоотбора используют почвенный щуп. Щуп - это узкий металлический желоб, заостренный с одного конца и имеющий рукоятку для удобства пользования. Примерные размеры щупа: длина 1,25 - 1,5 м; диаметр 15 - 20 мм. Желоб в щупе составляет 3/4 его общей длины.
Взятие смешанного образца проводят следующим образом- лопатой делают прикопку на глубину до 30 - 40 см, отмечают мощность и цвет верхнего горизонта или слоя и изменения в цвете и состоянии от поверхности вглубь, после чего со стенки берут образец на полную глубину горизонта (слоя) массой 1 - 2 кг, предварительно очистив поверхность почвы от растений. Отбирают также образец поверхностной пробы до глубины 5 - 10 см той же массы.
Единичные пробы ссыпают на крафт-бумагу или клеенку, тщательно перемешивают, квартуют (сокращают) в 3 - 4 раза (почву разравнивают на бумаге в виде квадрата, делят на четыре части, две противоположные части отбрасывают, две оставшиеся части перемешивают). Оставшуюся после квартования почву делят на 6 - 9 квадратов, из центра которых отбирают примерно одинаковое количество почвы, обеспечивая захват всей толщины слоя, в банки из стекла с герметичной крышкой. Таким образом, получают объединенную пробу, масса которой приблизительно 2 кг (1 кг на анализ и 1 кг для хранения дубликата). При отборе проб почвы составляют протокол по утвержденной форме (см. Приложение А), в котором указывают цель пробоотбора, число, время, место отбора пробы, номер пробы, ставят подпись и расшифровывают подпись отбиравшего. На банку, контейнер наклеивают несмываемую водой этикетку с указанием номера пробы, места, даты и времени ее отбора.
Транспортируют пробы при температуре окружающего воздуха от +4 °С до +28 °С.
Пробы, которые поступают в лабораторию, регистрируют в журнале учета с обязательным указанием числа емкостей и номера протокола отбора проб для каждой пробы.
Пробы почв анализируют не позднее 12 ч от момента отбора. При невозможности обеспечения данного условия, объединенные пробы в естественно влажном состоянии хранят в холодильнике (в банках с притертой или плотно завинченной крышкой) не более одной недели при температуре от +2 °С до +4 °С. Пробы почв не консервируют.
Для проведения контрольных измерений токсичности фоновых образцов почвы проводят отбор почвы на фоновых (незагрязненных) участках обследуемых областей.
При отборе проб почвы для приготовления фоновых образцов используют типичные для данного региона почвы, характерные по агрохимическим свойствам.
7.5.2.2 Приготовление водной вытяжки из почв
В лаборатории отобранные на токсикологический анализ почвы сначала разрыхляют вручную металлическим шпателем и освобождают от материала, заведомо относящегося к инородным (случайным) механическим включениям (возможные промышленные, строительные бытовые отходы и т.п.), а также галечника, обломков камней, корневищ, веток. Решение об изъятии таких включений из подготавливаемой пробы принимают на основе изучения полевого описания конкретного места ее отбора; эти сведения должны являться обязательной частью сопроводительной документации к пробам, направленным на токсикологический анализ.
Перед биотестированием пробы просеивают сквозь сито с размером ячей 1 мм и доводят до воздушно-сухого состояния. Для чего пробу подсушивают в вытяжном шкафу или в хорошо проветриваемом помещении, размещая ее (в зависимости от массы и естественной влажности) в стеклянных кристаллизаторах подходящей вместимости, на стекле или на чистых листах плотной бумаги.
Размещенные таким образом пробы почвы выдерживают открытыми не менее 2-х часов при комнатной температуре и влажности воздуха (ГОСТ 5180-84 «Грунты. Методы лабораторного определения физических характеристик»). Подготовленную пробу распределяют на ровной поверхности слоем толщиной не более 1 см и отбирают ложкой или шпателем из 5-ти точек методом конверта. Пробы почв, предназначенные для исследования на токсичность, не подвергают тепловой обработке, поэтому гигроскопическую влажность почвы определяют в отдельном образце.
Пробу массой приблизительно 400 г делят на две равные части: для биотестирования и для определения гигроскопической влажности после высушивания до постоянной массы, что необходимо для пересчета воздушно-сухой пробы на массу абсолютно-сухой по формуле (2):
где DМабс.сух. - масса абсолютно-сухого образца, г; DМвозд.сух - масса воздушно-сухого образца почвы, г; Кср - коэффициент пересчета массы воздушно-сухой пробы на массу абсолютно-сухой (среднее расчетное значение из трех измерений).
Определение массовой доли почвы в воздушно-сухой пробе:
1 Взвешивают три пустых высушенных бюкса с крышками и фиксируют их массы (М0i), затем взвешивают эти же бюксы с навесками воздушно-сухой пробы (около 1 г) и фиксируют их массы (Мвозд.сух.i).
2 Устанавливают открытые бюксы с воздушно-сухими пробами в сушильный шкаф. Пробы выдерживают в сушильном шкафу в течение 3 ч при температуре от 105 °С до 115 °С. Закрывают бюксы притертыми крышками, переносят их в эксикатор и выдерживают там до полного остывания (около 40 мин). Взвешивают бюксы с навесками абсолютно-сухой пробы и фиксируют их массы (Mабс.сух.i). После взвешивания пробы почвы повторно высушивают в течение 2 ч, затем охлаждают в эксикаторе и снова взвешивают. После первого и второго высушивания допустимое расхождение в массе не должно превышать 0,005 г. В противном случае высушивание повторяют. Результат взвешивания для всех экспериментов записывают с точностью до 0,001 г.
3 Рассчитывают значения коэффициента пересчета Ki для каждого эксперимента по формуле (3):
где Ki - коэффициент пересчета в i-том измерении; Мабс.сух.i - масса бюкса с абсолютно-сухим образцом в i-м измерении, г; Мвозд.сух.i - масса бюкса с воздушно-сухим образцом в i-м измерении, г; M0i - масса пустого бюкса в i-м измерении, г.
4 Так как по результатам измерений получено три значения коэффициента, производят расчет его среднего значения (Kср) по формуле (4):
Далее среди трех величин Ki рассчитывают размах (R) полученных значений с учетом максимального (Kmax) и минимального (Kmin) значения по формуле (5):
![]() (5)
(5)
Если полученное значение R > 10 %, то эксперимент повторяют, устранив причину неудовлетворительных результатов.
Водную вытяжку из почвы для биотестирования готовят в соотношении: 1 часть почвы (с учетом гигроскопической влажности) и 4 части культивационной воды (допускается использование дистиллированной воды). Вода не должна содержать СО2, так как в его присутствии растворяются карбонаты кальция и магния по причине образования растворимых бикарбонатов, которые увеличивают сухой остаток и общую щелочность водной вытяжки и тем самым искажают результаты биотестирования.
Для удаления углекислого газа из культивационной или дистиллированной воды ее предварительно кипятят 30 минут.
Для приготовления водной вытяжки из почвы взвешивают (100 - 120) г пробы почвы в воздушно-сухом состоянии, пересчитав ее массу на массу абсолютно-сухой. Масса пробы на стадии перед приготовлением водной вытяжки должна быть достаточной для получения необходимого объема экстракта при проведении биотестирования во всех предполагаемых разведениях с учетом контрольных испытаний. Навеску почвы помещают в колбу вместимостью 1000 см3 и приливают 4-кратное количество культивационной воды.
Далее на аппарате для встряхивания жидкости полученную смесь в течение 2-х часов встряхивают, после чего отстаивают в течение 30 мин. Надосадочную жидкость сифонируют, а затем профильтровывают через бумажные обеззоленные фильтры «белая лента» или через мембранные фильтры с диаметром пор 3,5 мкм (фильтры предварительно промывают и кипятят в дистиллированной воде не менее 10 мин). Бумажный фильтр помещают в воронку Бюхнера диаметром 15 - 20 см.
Перед тем как вылить вытяжку на фильтр, содержимое склянки или колбы встряхивают, чтобы взмутить присутствующие взвешенные частицы почвы. На фильтр стараются перенести всю взвесь. При выливании струю суспензии направляют на боковую двойную стенку бумажного фильтра, но не на дно фильтра, так как при выливании на дно бумага может легко порваться. Фильтрацию осуществляют с помощью вакуумного водяного или электрического насоса. Для фильтрации применяют слабый вакуум (не более 20 мм рт.ст.). Первые порции фильтрата часто бывают мутными и их несколько раз фильтруют до прозрачного раствора.
В процессе подготовки проб водной вытяжки к биотестированию для их осветления и освобождения от взвешенных частиц можно применять центрифугирование (10 минут при 4000 - 4500 об/мин).
При повышенной мутности водной вытяжки из почв (гумусированные, дерново-подзолистые, торфяные, лесная подстилка и др. почвы) допускается отстаивание в холодильнике до 5 суток.
В тех случаях, если влагоемкость исследуемой почвы настолько высока, что невозможно выполнить последующий процесс сифонирования данной вытяжки, допускается готовить вытяжку в соотношении 1 : 10 (почва : вода), что указывается в протоколе биотестирования.
Затем жидкость над осадком сифонируют. Вытяжка из почв должна иметь величину рН в диапазоне 7,0 - 8,5. При необходимости вытяжку перед серийным разбавлением предварительно нейтрализуют. После нейтрализации пробы аэрируют 10 - 20 мин для стабилизации рН. Непосредственно перед началом биотестирования пробы доводят до температуры (20 ± 2) °С. Биотестируемая проба водной вытяжки из почв должна иметь концентрацию растворенного кислорода не ниже 6 мг/дм3, в противном случае пробу аэрируют.
Приготовление разведений водной вытяжки для биотестирования проводят по п. 7.5.1.3.
7.5.3 Отбор, транспортировка, хранение и подготовка проб осадков сточных вод, отходов
7.5.3.1 Отбор, транспортировка и хранение проб
Методы отбора, транспортировки, хранения, подготовки к выполнению биотестирования должны обеспечить неизменность состава проб осадков, отходов в интервале времени между отбором и их анализом.
Отбор проб осадков сточных вод на песковых, шламовых, иловых площадках производят следующим образом.
Если осадок на площадке представлен однородной массой, площадку разделяют на 4 равные части. Отбирают 4 пробы из центра каждого квадрата лопатой послойно с глубины 0 - 5 см, 5 - 10 см и до конечной глубины площадки (до песка или бетонного покрытия) не менее 1000 г каждой пробы.
Если осадок на площадке находится в твердом и жидком состоянии, отбор осуществляют из разных участков, разделяя их на квадраты и отбирая из центра каждого квадрата твердые осадки, как описано ранее, а жидкие - пробоотборником с разной глубины заполненной жидкими осадками площадки из 3 горизонтов: с поверхности, середины и со дна заполнения. Жидкие и твердые осадки отбирают в разные емкости.
Жидких осадков отбирают 2 дм3 (1 дм3 для анализа и 1 дм3 для хранения дубликата).
Пробы твердых осадков тщательно перемешивают и 3 - 4 раза квартуют как указано для почв. Вес объединенной пробы должен быть 2 кг (1 кг для анализа и 1 кг для хранения дубликата).
Пробы осадков сточных вод не подлежат консервированию.
Пробы осадков сточных вод, поступившие в лабораторию на исследование, должны быть документально оформлены и маркированы. Необходимыми сопроводительными документами являются бланк описания осадка и протокол пробоотбора (см. Приложение А).
Пробы, поступающие в лабораторию для исследования на токсичность, регистрируют в журнале учета с обязательным указанием числа емкостей и номера протокола отбора проб для каждой пробы.
Хранят пробу в холодильнике не более одной недели в стеклянной банке с притертой или плотно завинченной крышкой.
Пробоотбор отходов может быть связан с отбором следующих групп отходов, классифицируемых: а) по типу образования: отходы производства (промышленные/производственные отходы (ПО)), отходы потребления (твердые бытовые отходы (ТБО)), смешанные отходы (смесь ПО и ТБО); б) по агрегатному состоянию: твердые (пылеобразные, порошкообразные, зернистые, шлаки, гранулированные, кусковые), пасто-, смоло- и студнеобразные (текучие, пластичные, вязкие), полужидкие (шламообразные), эмульсии, суспензии, пульпы жидкие; в) по степени однородности: гомогенные и гетерогенные.
Время взятия и периодичность пробоотбора отходов имеет существенное значение для производств, использующих сырье переменного состава или перешедших на иной вид сырья, изменяющих технологический режим процесса или его технологическую (конструкционную) схему, а также для органических ПО и ТБО. При осуществлении производственного экологического контроля за отходами частота отбора проб определяется планом-графиком, согласованным с территориальными органами государственного контроля.
Отбор проб ПО производят не реже 1 раза в год при условии неизменности технологического процесса и используемого сырья, а также в любое другое время для осуществления контрольных проверок возможных технологических сбоев. При переходе на иные сырьевые ресурсы или при изменении технологии вновь образующиеся отходы нуждаются в установлении нового класса токсичности (опасности) по результатам нового пробоотбора.
Отбор проб ТБО, а также отходов, образующихся при их сжигании (инсинерации, пиролизе) и компостировании, необходимо проводить на предприятии не реже 4 раз в год (1 раз в квартал).
Для определения морфологического состава ТБО и отбора проб необходимо:
- выявить компоненты, входящие в состав ТБО;
- определить процентное содержание каждого компонента в общей массе отхода;
- произвести отбор проб для лабораторных исследований (проба должна полностью отражать морфологический состав образующегося отхода).
При установлении морфологического состава отхода ТБО следует учитывать компоненты, образующиеся в результате потребления, но не являющиеся специфичными для данного предприятия (не образующиеся в результате технологического процесса).
Определение морфологического состава ТБО, образующегося в результате деятельности предприятия, можно осуществлять по двум схемам:
а) в случаях, если предприятие имеет собственный контейнер для ТБО, определение морфологического состава пробы производится непосредственно из контейнера. Для этого контейнер с отходами переворачивают, высыпают содержимое и производят сортировку на отдельные компоненты;
Примерный перечень компонентов, входящих в ТБО: бумага, картон; пищевые отходы; дерево; пластмасса; стекло; черный металл; цветной металл; текстиль; кожа, резина; камни, штукатурка; прочее.
б) в случаях, если предприятие не имеет собственного контейнера для ТБО, можно организовать временный (не менее 5 рабочих дней) раздельный сбор отхода по отдельным компонентам или накопление общей массы отхода с последующей сортировкой. В первом случае необходимо предусмотреть для каждого компонента индивидуальное место (тару) сбора и хранения.
Массу каждого выявленного компонента взвешивают на весах, а затем определяют его процентное содержание в общей массе отхода.
Процедуру определения морфологического состава проводят работники предприятия. Данные о морфологическом составе отхода и этапы его определения оформляют на фирменном бланке предприятия с указанием лиц, проводивших сортировку отхода, и подписью ответственного исполнителя.
Отбор проб для лабораторных исследований проводят следующим образом: из массы каждого компонента отхода отбирают некоторый объем всевозможных составляющих этого компонента, упаковывают в отдельный пакет и снабжают этикеткой.
Объем проб каждого компонента должен быть не менее 500 г, если его доля в общей массе отхода составляет более 30 %; не менее 300 г, если доля компонента составляет более 10 %, не менее 100 г, если доля компонента в общей массе отхода - менее 10 %.
Пробы должны поступить в лабораторию с сопроводительной документацией не более чем через 12 ч после отбора.
Отбор проб ПО может осуществляться периодически и непрерывно. Выбираемый способ пробоотбора зависит от количества образующегося отхода в единицу времени (за один производственный цикл, сутки, год), аппаратурного оформления технологического процесса, методов сбора и накопления отхода, предполагаемой токсичности (на основании сопоставления с изученными отходами аналогичных производств).
При периодическом пробоотборе объединенную пробу отбирают из нескольких точечных проб, отобранных в одно и то же время из одного и того же источника образования или накопления отходов (из бункера, хвостохранилища, ковша, шламонакопителя, отвала, свалки, карьера и др.). Единичные пробы отбирают в местах хранения или захоронения отходов по равномерной сети опробования.
Отбор проб производят из горных выработок (расчисток, закопушек, канав, шурфов) или скважин, пройденных с помощью буровых станков, установок или приспособлений различных конструкций. Кроме того, в местах хранения отходов, являющихся источником образования пыли, проводят измерения загрязнения воздушной среды.
В зависимости от целей исследования различают периодический пространственный, периодический глубинный и периодический смешанный пробоотбор. При периодическом пробоотборе, как правило, имеют дело с большим исходным объемом отхода (более 1 т).
Для осуществления пространственного пробоотбора намечают пробную площадку в виде квадрата со сторонами не менее 10 м. Затем отбирают с поверхности по схеме конверта 5 единичных проб (ГОСТ 17.4.4.02-84). На каждые 20 га накопителя (хранилища свалки) закладывают не менее одной пробной площадки. Если территория накопителя составляет менее 0,5 га, размер пробной площадки должен быть не менее 5´5 м. Из единичных проб, отобранных с одной пробной площадки, приготавливают одну объединенную промежуточную пробу. Смесь объединенных промежуточных проб образует объединенную пробу, направляемую на исследование.
Осуществляя глубинный пробоотбор, руководствуются ориентировочной глубиной хранилища и количеством одноразово загружаемых в него отходов.
Смешанный пробоотбор заключается в отборе проб из кучи. При отборе проб из кучи отбирают одну единичную пробу с ее вершины (если это возможно осуществить), не менее четырех единичных проб из равноудаленных друг от друга точек основания кучи и произвольное количество точечных проб с ее боковой поверхности. Общее число проб, отбираемое из кучи высотой до 2 м, должно быть не менее 9. При увеличении высоты кучи на 1 м минимально необходимое число проб увеличивается на 4.
При непрерывном пробоотборе объединенная проба отхода образуется из нескольких (не менее 2-х) единичных проб, отобранных в одном и том же месте через одинаковые промежутки времени (час, сутки, месяц).
Количество отбираемых отходов может выражаться в единицах массы (грамм, килограмм) или в единицах объема (литры). Единицы массы используются для характеристики количества твердых сыпучих отходов. Единицы объема наиболее применимы для выражения количеств жидких и полужидких отходов. Количество пастообразных отходов может быть охарактеризовано как единицами массы, так и единицами объема.
Количество и необходимый объем отбираемой пробы отхода зависит от его агрегатного состояния, влажности, степени однородности и его зернистости (для сыпучих отходов).
Объединенная проба отхода может быть приготовлена из N-го количества единичных проб или из N-го количества объединенных промежуточных проб (в случае закладки нескольких пробных площадок на территории протяженных хранилищ). Недопустимо образование объединенной пробы одновременно из единичных и объединенных промежуточных проб.
Объединенная проба отхода может быть приготовлена по принципу средневзвешенности или среднепропорциональности.
По принципу средневзвешенности объединенная проба отхода образуется путем смешения одинакового массового количества вещества. Обычно так поступают, имея дело с сыпучими твердыми и пастообразными отходами с влажностью от 30 % до 70 %.
По принципу среднепропорциональности объединенная проба приготавливается из одинаковых объемов отходов. Наиболее часто таким образом готовят пробу полужидких отходов и паст с высокой влажностью (> 70 %).
Отбор единичных проб проводят по равномерной сетке, размер которой выбирают в соответствии с нормативными документами, действующими на предприятии, на котором образуется отход, или определяется необходимым числом единичных проб. Число единичных проб рассчитывают исходя из степени изменчивости нормируемых компонентов в данных отходах и заданной погрешности их определения.
Чтобы отобрать представительную единичную пробу, необходимо знать объем разового образования отходов на предприятии. Например, если образуется 10 мешков отходов, то достаточно отобрать пробу в одном мешке, произвольно выбрав его из 10 мешков, если отходы однородны. Но иногда требуется подтвердить эту однородность и отобрать пробу из нескольких мешков одной партии, т.е. для подтверждения представительности выбранных точек пробоотбора производят выборочное обследование точек пробоотбора.
Единичные пробы отходов перед объединением тщательно гомогенизируют. Обращаясь с твердыми сыпучими и пастообразными отходами, используют металлические шпатели. Полужидкие отходы гомогенизируют встряхиванием.
Для механизированной проходки скважин применяют буровые станки и установки различных способов бурения (вращательного, ударно-канатного, пневмоударного, шнекового) и самых различных конструкций, обеспечивающих представительный отбор проб. Шурфы проходят вручную и механизированным способом.
Для ручной проходки скважин применяют буры и щупы различных конструкций.
Отбор сыпучих отходов из тары (вагон, кузов автомобиля, контейнер и др.) производят с помощью щупа. Отбор единичных проб производят погружением щупа в опробуемую массу до середины или на всю высоту тары.
Массу единичных проб устанавливают в зависимости от состава отбираемого отхода и размера максимальных частиц (кусков). Расхождение по массе отдельных единичных проб не должно превышать 20 %.
Отобранные единичные пробы соединяют в объединенную пробу или сразу после пробоотбора, или после отдельной их подготовки до определенного этапа квартования, а затем объединяют в нужных пропорциях.
Сокращение пробы в зависимости от исходной массы объединенной пробы и размера частиц (кусков) проводят строго по выбранной схеме сокращения.
Для сокращения объединенной пробы применяют метод квартования с предварительным сбрасыванием на конус. Объединенная проба отхода (при отсутствии специальных требований) должна составлять не менее 5 кг (2,5 кг для анализа и 2,5 кг для хранения дубликата).
Пробы отходов не подлежат консервированию, хранятся в холодильнике (в банках с притертой или плотно закрытой крышкой) не более одной недели.
Пробы отходов, поступившие в лабораторию на исследование, должны быть документально оформлены и маркированы. Необходимыми сопроводительными документами являются бланк описания отхода и протокол пробоотбора (см. Приложение А). Маркировка отходов осуществляется в произвольной форме, но с обязательным занесением обозначений в лабораторный журнал.
При проведении отбора проб отходов должны соблюдаться меры, исключающие загрязнение окружающей среды от применения бурового оборудования. Контроль за содержанием вредных веществ в воздухе рабочей зоны осуществляют в соответствии с требованиями ГОСТ 12.1.005-88. При подготовке проб должны соблюдаться меры, исключающие запыление окружающей среды и правила захоронения (складирования) материала пробы, полученного в результате сокращения объединенной пробы.
7.5.3.2 Приготовление водной вытяжки из осадков сточных вод, отходов
Водную вытяжку из осадков сточных вод и отходов готовят из соотношения твердая фаза : жидкость равного 1 : 10. В качестве жидкости используют культивационную воду (допускается использование дистиллированной воды с рН 7,0 - 7,5).
Твердые отходы и осадки сточных вод. Пробу тщательно перемешивают перекатыванием на гладкой, гибкой и плотной подстилке, затем - совком. Для пробоподготовки пробы отходов требуется 2,5 кг, пробы осадков сточных вод - 1 кг. Общий объем отобранной пробы (5 кг, отходов или 2 кг осадков) делят на представительные половины, одну из частей возвращают в сосуд для хранения, оставшуюся часть разрыхляют и тщательно просматривают. В случае обнаружения частиц более 10 мм, - их осторожно измельчают с помощью металлического шпателя до размера менее 10 мм. Недопустимо механически размалывать смесь. Затем пробу высушивают до воздушно-сухого состояния, как указано в п. 7.5.2.2. При плохом высыхании отхода экспозицию высушивания увеличивают до 24 часов.
После этого пробу сокращают в 3 - 4 раза методом квадратирования. Тщательно перемешанную пробу разравнивают на гладкой ровной поверхности на крафт-бумаге, клеенке или полиэтиленовой пленке и с помощью линейки или специальной решетки делят на равные квадраты. Затем из квадратов в шахматном порядке отбирают порции, обеспечивая захват всей толщины слоя, и объединяя порции в пробу с минимальной абсолютно-сухой массой 200 г представительной пробы, которую делят на две части и используют для биотестирования и определения влажности.
Влажность осадков и отходов определяют по п. 7.5.2.2. Измеренную характеристику влажности используют для расчета массы воздушно-сухой пробы, предназначенной для приготовления водной вытяжки. Обычно используют (120 - 200) г воздушно-сухой массы пробы. После выщелачивания 100 г абсолютно-сухой массы пробы будет получено приблизительно 900 см3 водной вытяжки, учитывая это, рассчитывают общее необходимое минимальное количество отбираемой порции с учетом процедуры сокращения пробы. Масса пробы на стадии перед приготовлением водной вытяжки должна быть достаточной для получения необходимого объема экстракта для проведения биотестирования во всех предполагаемых разведениях Пробу осадков, отходов в воздушно-сухом состоянии взвешивают так, чтобы абсолютно-сухая масса была (100 ± 1) г. Записывают массу и содержание влаги и помещают в сосуд для выщелачивания.
Шламы. Шламы с большим содержанием твердой фазы, не разделяющиеся самостоятельно, обрабатывают также как твердые отходы. Отдельно определяют содержание влаги. Массу шлама, эквивалентную (100 ± 1) г абсолютно-сухой массы используют для приготовления водной вытяжки.
Шламы с большим содержанием жидкости (влажность более 70 %) обрабатывают следующим образом. Жидкость фильтруют через вакуумный фильтр (0,45 мкм) и собирают 300 г влажно-твердого материала. Если такого количества пробы недостаточно для получения 200 г абсолютно-сухого вещества, собирают столько, сколько необходимо. Пробы высушивают до воздушно-сухого состояния по п. 7.5.2.2. При плохом высушивании экспозицию увеличивают до 24 часов.
Пробу делят на две части, в одной определяют содержание влаги, а другую часть, составляющую (100 ± 1) г абсолютно-сухой массы, переносят в сосуд для выщелачивания. В рабочем журнале регистрируют массу остатка и содержание влаги в нем. Твердые шламы выщелачивают культивационной водой в пропорции 1 : 10.
Жидкие отходы. Отходы и осадки сточных вод, жидкие и содержащие менее 1 % взвешенного материала, не подвергают выщелачиванию, а испытывают прямо на экотоксичность методами биотестирования после фильтрации через фильтр «белая лента» или центрифугирования.
Выполнение процедуры подготовки экстракта выщелачивания. В сосуд для выщелачивания, где находится взвешенная воздушно-сухая масса отхода или осадка сточных вод с абсолютно-сухой массой (100 ± 1) г, добавляют воду, используемую для культивирования (или дистиллированную воду). Воду добавляют в сосуд для выщелачивания в соотношении сухая масса : жидкость - 1 : 10. Обычно это 1000 см3 воды на 100 г абсолютно-сухой массы. Если используют меньшее количество пробы, то уменьшают количество жидкости. Нельзя использовать для выщелачивания менее чем 20 г твердого вещества и 200 см3 воды.
Объемы воды более 10 см3 измеряют мерным цилиндром, объемы меньше 10 см3 - мерной пипеткой.
Смесь слабо перемешивают на мешалке в течение 7 - 8 часов таким образом, чтобы твердое вещество находилось во взвешенном состоянии. Недопустимо измельчение частиц отходов или осадков при перемешивании. Используют большую лопасть механической мешалки или магнитную мешалку, а скорость перемешивания должна быть наименьшей, при которой материал поддерживается во взвешенном состоянии (не более 70 об/мин).
После окончания перемешивания раствор с осадком оставляют на ночь (12 - 18 ч) для отстаивания. Затем жидкость над осадком сифонируют.
Если после отстаивания жидкость становится прозрачной, фильтрование не требуется, если же имеется какой-либо видимый взвешенный материал, то жидкость фильтруют. В случае применения фильтрования это отмечают в рабочем журнале. Фильтрацию осуществляют через фильтр «белая лента» на воронке Бюхнера. Для фильтрации применяют слабый вакуум (не более 20 мм рт.ст.) с помощью водяного или электрического насоса такой же мощности. Вакуум выключают немедленно после прохождения всей жидкости через фильтр, во избежание дегазации фильтрата. Для осветления водной вытяжки и освобождения ее от взвешенных частиц можно применять центрифугирование (10 мин при 4000 - 4500 об/мин). В исключительных случаях, при повышенной мутности водной вытяжки из отхода после фильтрации допускается ее отстаивание в холодильнике до 5 суток. Затем жидкость над осадком сифонируют.
Полученный экстракт выщелачивания исследуют на токсичность. Процедуру биотестирования начинают не позднее, чем через 6 ч после приготовления вытяжки из осадка, отхода. Если это невозможно, допускается хранение экстракта в холодильнике не более 48 ч при температуре 4 °С.
Перед биотестированием измеряют рН, температуру и содержание О2 в полученном экстракте.
Водная вытяжка из осадков сточных вод или отходов должна иметь рН = 7,0 - 8,5. При необходимости пробы нейтрализуют. После нейтрализации пробы аэрируют 10 - 20 мин для стабилизации рН.
Регулирование рН не должно вызывать химической реакции с веществами, присутствующими в пробе (выпадение осадка, комплексообразование), и не должно более чем на 5 % изменять концентрацию исследуемой пробы.
При необходимости уточнения результатов биотестирования по влиянию фактора рН на усиление токсичности водных вытяжек из отходов, когда установлено, что их рН выходит за пределы диапазона 7,0 - 8,5, эксперимент расширяют и определяют токсичность исследуемых проб после нейтрализации и без нейтрализации.
В протоколе биотестирования указывают токсичность проб после нейтрализации и без нейтрализации. Заключение о токсичности водной вытяжки из отходов дается (и класс опасности отхода устанавливается) по пробе водной вытяжки без нейтрализации. Данные о токсичности проб после нейтрализации указываются в протоколе для принятия решения о необходимости нейтрализации отхода при его размещении в объектах окружающей среды и возможности перевода отхода в менее опасный класс после его нейтрализации, если для данного вида отхода это технически осуществимо.
Перед биотестированием температуру пробы доводят до (20 ± 2) °С. Биотестируемая проба водной вытяжки из осадков и отходов должна иметь концентрацию растворенного кислорода не ниже 6 мг/дм3, в противном случае пробу аэрируют. Данные регистрируют в журнале. Приготовление разведений водной вытяжки для биотестирования проводят по п. 7.5.1.3.
Если осадки сточных вод или отходы были разделены на жидкую и твердую фракции, то результаты исследования жидкой фракции и экстракта выщелачивания из твердой фракции указывают в отчете отдельно. Если одна из этих частей была признана экотоксичной, экотоксичным признают весь отход.
При выявлении разной токсичности в пробах жидких и твердых осадков, отобранных с одной иловой площадки, решение принимается по пробе, вызывающей проявление максимальной токсичности.
7.5.4 Проведение теста на биохимическую разлагаемость осадков сточных вод, отходов
Для решения вопроса о возможности отнесения установленного класса опасности осадка или отхода к менее опасному - водную вытяжку осадка или отхода исследуют на устойчивость к биохимической деградации. Тест на устойчивость к биохимической деградации проводят в аэробных условиях в контакте вытяжки из осадка или отхода с активным илом в течение 28 дней.
До начала испытаний в вытяжке из осадка или отхода измеряют ХПК в натуральной и фильтрованной пробах и БПК5.
Тест проводят в 4 - 5-литровом сосуде с крышкой, в которой имеется отверстие для шланга подачи воздуха. В сосуд наливают 2,5 дм3 водной вытяжки. Если в исследуемой вытяжке из осадков сточных вод, отходов содержание БПК5 составляет менее 40 мг/дм3, то в раствор добавляют однократно глюкозу в количестве (5 - 40) мг/дм3 для обеспечения активного ила питательными веществами.
Активный ил отбирают на сооружениях биологической очистки с аэротенками в объеме (100 - 300) см3. В лаборатории его отстаивают не менее двух часов (или центрифугируют), после чего надиловую жидкость сливают при помощи сифона.
В сосуд, в котором проводят тест на биохимическую разлагаемость, добавляют сгущенный активный ил в расчете 1,0 г/дм3 по сухому весу.
Сосуд с приготовленной смесью ила и исследуемой водной вытяжкой инкубируют в темноте или при слабом дневном свете при температуре (22 ± 3) °С. Смесь аэрируют с помощью аквариумного аэратора так, чтобы перемешивание было удовлетворительным, но не избыточным (взвешенные частицы не адсорбируются на дне и стенках сосуда, жидкость не выплескивается).
Через 28 суток инкубации смесь водной вытяжки с илом отстаивают в течение 2-х часов, сливают сифоном и в надиловой воде определяется ХПК в натуральной и фильтрованной пробе.
Эксперимент на биоразлагаемость отхода может быть завершен в любой день до 28 суток, если при этом выполняется условие снижения ХПК в натуральной и фильтрованной пробе на 60 и 70 % соответственно.
Отход признают биохимически разлагаемым, если по истечении 28 дней или раньше ХПК в натуральной пробе снижается не менее, чем на 60 %, ХПК в фильтрованной пробе снижается не менее, чем на 70 % (Европейское соглашение..., 1998). При выполнении данного условия класс опасности отхода повышается на единицу (например, с 3 на 4 класс).
Всю грязную посуду после проведения теста подвергают стерилизации кипячением в течение 1 часа или автоклавированию.
8 ПРОЦЕДУРА БИОТЕСТИРОВАНИЯ
8.1 Эксперименты по установлению острого токсического действия
8.1.1 Для определения острого токсического действия проводятся биотестирование исходной исследуемой воды или водной вытяжки из почв, осадков сточных вод, отходов и нескольких их разбавлений, приготовленных по п. 7.5.1.3.
Определение токсичности каждой пробы без разбавления и каждого разбавления проводят в трех параллельных сериях. В качестве контроля используют три параллельные серии с культивационной водой.
Биотестирование проводят с соблюдением требований к температуре, продолжительности фотопериода и качеству культивационной воды по пунктам 7.2; 7.3.2.
Биотестирование проводят в химических стаканах вместимостью 150 - 200 см3, которые заполняют 100 см3 исследуемой воды, в них помещают по десять дафний в возрасте 6 - 24 ч. Чувствительность дафний к токсикантам зависит от возраста рачков, поэтому в протоколе отмечают возраст используемой молоди. Возраст определяют по размеру рачков, что обеспечивают фильтрацией рачков через набор сит по п. 7.3.3. Дафний отлавливают из культиваторов, в которых выращивают синхронизированную культуру. В отдельный химический стакан отсаживают одновозрастных рачков после фильтрации их через набор сит, а затем отлавливают по одному пипеткой (с отпиленным и оплавленным концом) вместимостью 2 см3 с резиновой грушей. Помещают рачков по одному на сачок, через который вода сливается в отдельный химический стакан, после чего дафний сачком вносят в стаканы с исследуемой водой.
Посадку рачков начинают с контрольной серии. В исследуемые растворы дафний помещают, начиная с больших разбавлений (меньших концентраций загрязняющих веществ) к меньшим разбавлениям. После каждой посадки в исследуемые растворы сачок тщательно промывают в сосуде объемом 2 дм3 с культивационной водой. Для работы с серией контроля должен быть отдельный сачок.
Дафнии могут пострадать от наличия на поверхности раствора масляных капель или пленок, к которым они прилипают, травмируются и могут погибнуть. В тех случаях, когда нельзя избежать образования таких пятен или пленок, необходимо сеткой из мельничного газа создать преграду для доступа рачков к поверхности исследуемых растворов.
Для каждой серии исследуемой воды используют 3 химических стакана. Общее количество стаканов, используемых в опытах, равно утроенной сумме всех разбавлений плюс 3 для исходной воды и 3 для контроля.
В экспериментах по определению острой токсичности дафний кормят перед началом эксперимента, в последующие сутки ежедневно по пункту 7.4.4.
В экспериментах по определению острой токсичности растворы не меняют.
Учет смертности дафний в опыте и контроле проводят через каждый час до конца первого дня опыта, а затем 2 раза в сутки ежедневно до истечения 96 часов.
Неподвижных особей считают погибшими, если не начинают двигаться в течение 15 секунд после легкого покачивания стакана.
Результаты наблюдений заносят в рабочий журнал (см. Приложение Б).
Если гибель дафний в контроле превышает 10 %, результаты опыта не учитывают, и он должен быть повторен.
8.1.2 После того, как результаты эксперимента учтены, все дафнии из стаканов выбрасывают и в каждом стакане проводят измерения рН, температуры, содержания растворенного кислорода с помощью оксиметра. Содержание растворенного кислорода в конце эксперимента должно быть не ниже 2 мг/дм3, рН в диапазоне 7,0 - 8,5. Все отклонения от установленных норм, а также данные по каждой серии разбавлений, исходной воды и контролю также заносят в рабочий журнал и протокол результатов эксперимента.
8.2 Эксперименты по установлению хронического токсического действия
Для определения хронического токсического действия острый эксперимент продолжают с использованием контроля и серии разбавлений, в которых острое токсическое действие не проявилось или готовят новую серию разбавлений с учетом результатов острых опытов. За исходную воду принимают разбавление исследуемых вод, водных вытяжек из почв, осадков, отходов, не вызвавшее острого токсического действия. Продолжительность хронического эксперимента 24 дня.
Определение токсичности каждой пробы и каждого разбавления проводят в 3-х параллельных сериях, что сопровождают одной для всех разбавлений серией контроля в 3-х стаканах.
Процедуру приготовления растворов и посадки рачков в эксперимент по определению хронического токсического действия проводят по п. 8.1.1.
Биотестирование по определению хронического токсического действия проводят с соблюдением требований к температуре, продолжительности фотопериода и качеству культивационной воды по пунктам 7.2, 7.3.2. Вынужденное нарушение требуемых условий отмечают в протоколе.
В экспериментах по определению хронического токсического действия кормят дафний перед началом эксперимента и в последующие дни один раз в сутки по пункту 7.4.4.
Смена растворов на новые осуществляют через каждые пять суток из свежеотобранных проб или из проб, хранящихся в холодильнике при температуре от +2,5 °С до +4 °С.
Для смены растворов готовят 3 параллельных ряда испытуемых разбавлений (и контроль), аналогичных исходным, куда из старых растворов выжившие дафнии переносят при помощи сачка, на который они помещаются пипеткой объемом 2 см3 в свежеприготовленные растворы. Старые растворы профильтровывают через сито из мельничного газа и на нем производят подсчеты родившейся молоди, а в растворах проводят измерения физико-химических параметров по пункту 8.1.2. Содержание растворенного кислорода в конце хронического эксперимента должно быть не ниже 2 мг/дм3, рН в диапазоне 7,0 - 8,5. Все отклонения от установленных норм заносят в рабочий журнал и протокол результатов эксперимента.
Учет смертности и родившейся молоди в опыте и контроле проводят один раз в сутки ежедневно до конца хронического опыта. Кроме подсчета погибших дафний, учитывают количество молоди и абортивных яиц (половозрелые самки выбрасывают неразвившиеся зародыши при действии многих токсикантов). Погибших дафний, абортивные яйца, молодь подсчитывают и удаляют пипеткой, пропуская исследуемый раствор через сито над тем стаканом, в котором производят подсчет.
Прекращают эксперимент в стаканах с погибшей самкой. Родившуюся молодь подсчитывают (при помощи лупы или стереоскопического микроскопа) и выбрасывают.
Результаты экспериментов заносят в рабочий журнал (см. Приложение Б).
9 ОБРАБОТКА, ОЦЕНКА И ОФОРМЛЕНИЕ РЕЗУЛЬТАТОВ
9.1 Острые токсикологические эксперименты
9.1.1 При определении острой токсичности питьевых, сточных, поверхностных, грунтовых вод, а также водных вытяжек из почв, осадков сточных вод, отходов и их разбавлений устанавливают:
- среднюю летальную кратность разбавления вод, водных вытяжек, вызывающую гибель 50 % тест-объектов за 96-часовую экспозицию (ЛКР50-96);
- безвредную кратность разбавления вод, водных вытяжек, вызывающую гибель не более 10 % тест-объектов за 96-часовую экспозицию (БКР10-96).
9.1.2 Для определения острой токсичности исследуемых вод, водной вытяжки рассчитывают процент погибших в тестируемой воде дафний (А, %) по сравнению с контролем по формуле (6)
где Хк - количество выживших дафний в контроле; Хт - количество выживших дафний в исследуемой воде.
При А £ 10 % исследуемая вода или водная вытяжка не оказывает острого токсического действия (безвредная кратность разбавления). При А ³ 50 % тестируемая вода, водная вытяжка оказывает острое токсическое действие (средняя летальная кратность разбавления).
9.1.3 Если экспериментально не удалось получить точного значения кратности разбавления, вызывающей 50 %-ную гибель дафний за 96 часов экспозиции, то для получения точного значения ЛКР50-96 без выполнения дополнительных экспериментов, используют графический или неграфический метод определения.
9.1.3.1 Графический метод определения ЛК50-96, ЛКР50-96. Чтобы получить на графике линейную зависимость, используют пробит-анализ. Результаты экспериментов по установлению острого токсического действия из рабочего журнала (см. Приложение 2) заносят в таблицу 3. Значения пробитов устанавливают по таблице 4. В таблицу 5 вносят значения пробитов для экспериментально установленного процента гибели дафний (см. таблицы 3, 4) и значения десятичных логарифмов для исследованных концентраций сточных вод, водных вытяжек из почв, осадков сточных вод, отходов.
По значениям пробитов (см. таблицу 4) и десятичных логарифмов от экспериментально полученных данных (таблица 3) строят график (рисунок 1). По оси абсцисс откладываются значения логарифмов процентных концентраций исследуемых вод, по оси ординат - пробиты от значений процента гибели дафний. Экспериментально полученные значения вносятся в систему координат, и через точки проводят прямую.
Таблица 3 - Форма записи результатов определения острой токсичности сточной воды
|
Исследуемая концентрация сточной воды, % |
Время от начала биотестирования |
Количество выживших дафний (ср. ариф. по параллельным сериям) |
Смертность дафний в опыте, в % к контролю |
Оценка качества водной среды |
|||
|
в контроле |
в опыте |
ЛКР50-96 |
БКР10-96 |
||||
|
10.10.1998 г., 12.00, городские о/с после вторичных отстойников |
5 |
через 96 ч |
30 |
30 |
0 |
21,38 %-ная концентрация сточных вод в растворе |
5 %-ная концентрация сточных вод в растворе |
|
10 |
|
30 |
27 |
10 |
|||
|
25 |
|
30 |
12 |
60 |
|||
|
50 |
|
30 |
6 |
80 |
|||
|
100 |
|
30 |
2 |
93 |
|||
Таблица 4 - Значения пробитов для экспериментально устанавливаемой гибели дафний от 0 до 99 %
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
0 |
- |
2,67 |
2,95 |
3,12 |
3,25 |
3,35 |
3,45 |
3,52 |
3,59 |
3,66 |
|
10 |
3,72 |
3,77 |
3,82 |
3,83 |
3,92 |
3,96 |
4,01 |
4,05 |
4,08 |
4,12 |
|
20 |
4,16 |
4,19 |
4,23 |
4,26 |
4,29 |
4,33 |
4,36 |
4,39 |
4,42 |
4,45 |
|
30 |
4,48 |
4,50 |
4,53 |
4,56 |
4,59 |
4,61 |
4,64 |
4,67 |
4,69 |
4,72 |
|
40 |
4,75 |
4,77 |
4,80 |
4,82 |
4,85 |
4,87 |
4,90 |
4,92 |
4,95 |
4,97 |
|
50 |
5,00 |
5,03 |
5,05 |
5,08 |
5,10 |
5,13 |
5,15 |
5,18 |
5,20 |
5,23 |
|
60 |
5,25 |
5,28 |
5,31 |
5,33 |
5,36 |
5,39 |
5,4 |
5,44 |
5,47 |
5,50 |
|
70 |
5,52 |
5,55 |
5,58 |
5,61 |
5,64 |
5,67 |
5,71 |
5,74 |
5,77 |
5,81 |
|
80 |
5,84 |
5,88 |
5,92 |
5,95 |
5,99 |
6,04 |
6,08 |
6,13 |
6,18 |
6,23 |
|
90 |
6,28 |
6,34 |
6,41 |
6,48 |
6,55 |
6,64 |
6,75 |
6,88 |
7,05 |
7,33 |
По значениям пробитов и логарифмов чисел, взятых из таблицы 5, строится график (рисунок 1).
Рисунок 1 - Линейная зависимость пробитного значения гибели дафний от логарифма концентраций исследуемых сточных вод
Таблица 5 - Значения десятичных логарифмов для исследованных концентраций сточных вод и пробитное значение от экспериментально установленного процента гибели дафний
|
Десятичный логарифм концентрации (lgC) |
Количество погибших дафний, % |
Значения пробитов для % гибели |
|
|
5 |
0,6989 |
0 |
- |
|
10 |
1,0000 |
10 |
3,72 |
|
25 |
1,3980 |
60 |
5,25 |
|
50 |
1,6990 |
80 |
5,84 |
|
100 |
2,0000 |
93 |
6,48 |
На графике параллельно оси логарифмов концентраций (lgC) проводят прямую из точки, соответствующей пробитному значению 5, что соответствует 50 %-ной гибели дафний (см. таблицу 4). Из точки пересечения прямых с графиком зависимости пробитного значения ингибирования тест-параметра от логарифма концентраций опускают перпендикуляр на ось логарифма концентраций и получают значение логарифма концентрации отдельного вещества, исследуемых вод, водных вытяжек, соответствующей ЛК50-96, ЛКР50-96. Далее логарифм концентрации переводят в процентную концентрацию.
Для нахождения точных значений величин логарифмов концентраций, соответствующих 50 %-ному ингибированию тест-параметра, график строят в программе Excel (пакет Microsoft Office), указывая в опции «тип диаграммы» параметр «точечная». Уравнение прямой, описывающее взаимосвязь между этими величинами, получают следующим образом: в параметре «диаграмма» указывается команда «добавить линию тренда». В опции «линия тренда», «тип» указывается «линейная», в опции «линия тренда», «параметры» помечается галочкой окошко «уравнение на диаграмме».
Из полученного уравнения линии тренда получают значения величин х = lgC, соответствующие величинам у (значениям пробитов).
Пробитное значение 5,0 соответствует логарифму концентрации исследуемой воды 1,41, вызывающей гибель 50 % тест-параметра за 96 часов экспозиции. Логарифм процентной концентрации переводят в процентную концентрацию: lgC50-96 = 1,41 соответствует процентной концентрации 25,7 %.
Таким образом, устанавливают, что 25,7 %-ная концентрация исследуемой сточной воды, или разбавление в 3,89 раза (100 %/25,7 %), вызывает 50 %-ную гибель тест-объектов за 96 часов (ЛКР50-96 = 3,89).
Все полученные расчеты, график по результатам острого эксперимента вносят в рабочий журнал и заполняются графы 12, 13 в Приложении Б.
9.1.3.2 Неграфический метод определения ЛКР50-96. Десятичный логарифм концентрации исследуемых сточных вод (lgC) обозначим х, а численные значения пробитов гибели дафний - у. Учитывают только те значения lgC, при которых наблюдается смертность. В результате испытаний получено п пар чисел:
(х1у1), (х2у2) ... (хnуn), (7)
по которым определяют линейная зависимость:
Численные значения коэффициентов k и b вычисляют по формулам:
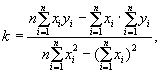 (9)
(9)
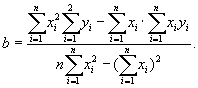 (10)
(10)
Для вычисления k и b используют расчетную таблицу 6. В первом столбце таблицы помещаются отобранные значения хi (десятичный логарифм концентрации lgC), в третьем - соответствующие им значения пробитов уi, четвертый и пятый столбцы рассчитывают:
Таблица 6
|
Величина тест-параметра, % |
yi |
хi2 |
хiуi |
|
|
1,000 |
10 |
3,72 |
1,0 |
3,720 |
|
1,398 |
60 |
5,25 |
1,954 |
7,340 |
|
1,699 |
80 |
5,84 |
2,887 |
9,922 |
|
2,000 |
93 |
6,48 |
4,000 |
12,960 |
|
|
|
|
|
|
Вычисляют искомые параметры k и b, по формулам (9), (10) при п = 4:
![]()
![]()
Искомое уравнение регрессии по формуле (8): у = 2,722x + 1,173.
Определяют значение х, соответствующее 50 %-ной гибели дафний (у = 5), по формуле (11):
![]()
Полученный логарифм процентной концентрации исследуемой воды переводят в процентную концентрацию lgC50 = 1,406, что соответствует процентной концентрации 25,47 %, ЛКР50-48 = 3,93.
Таким образом, устанавливается, что 25,47 %-ная концентрация исследуемой сточной воды, или разбавление в 3,93 раза (100 %/25,47 %), вызывает 50 %-ную гибель тест-объектов за 96 часов (ЛКР50-96 = 3,93).
Все полученные значения, расчеты и график по результатам острого эксперимента вносят в рабочий журнал.
9.2 Хронические токсикологические эксперименты
Хроническую токсичность устанавливают по двум параметрам: гибели 20 % и более исследуемых тест-организмов и (или) по достоверному отклонению в плодовитости исследуемых тест-организмов по сравнению с контролем. Результаты хронического опыта заносят в таблицу, форма которой представлена в таблице 7.
Для оценки результатов используют следующие значения.
9.2.1 При определении токсичности отдельных веществ:
- устанавливают концентрацию вещества, вызывающую хроническую токсичность за 24 суток экспозиции, если смертность дафний составит 20 % и более и (или) в их плодовитости будет установлено достоверное отклонение от контроля;
- безвредную концентрацию вещества, не вызывающую хроническую токсичность за 24 суток экспозиции, если смертность дафний составит менее 20 % и (или) в их плодовитости не будет установлено достоверное отклонение от контроля.
9.2.2 При определении хронической токсичности вод, водных вытяжек а также их разбавлений:
- устанавливают кратность разбавления вод, водных вытяжек вызывающую хроническую токсичность за 24 суток экспозиции, если смертность дафний составит 20 % и более и (или) в их плодовитости установлено достоверное отклонение от контроля:
- безвредную кратность разбавления вод, водных вытяжек не вызывающую хроническую токсичность за 24 суток экспозиции, если смертность дафний составит менее 20 % и (или) в их плодовитости не установлено достоверное отклонение от контроля.
Таблица 7 - Форма записи результатов определения хронической токсичности водной среды
|
Исследуемая концентрация сточной воды |
Время от начала биотестирования |
Количество выживших дафний (ср. ариф. по параллельным сериям) |
Плодовитость дафний* (ср. ариф. по параллельным сериям) |
Критерии достоверности отклонений опытных данных от контрольных по плодовитости дафний |
Оценка качества водной среды оказывает (не оказывает) хроническое токсическое действие |
|||
|
в контроле |
в опыте |
в опыте |
в контроле |
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
|
|
|
|
|
|
|
|
* рассчитывается на одну выжившую самку.
9.2.3 Для определения хронической токсичности воды, водной вытяжки рассчитывают:
- процент погибших дафний в тестируемой воде для каждой серии разведений по сравнению с контролем;
- среднее количество родившейся молоди на одну самку делением общего числа молоди, родившейся за 24 дня на 30 (или выживших из 30) самок для каждой серии разведений;
- достоверное отклонение в количестве родившейся молоди на одну самку из числа выживших по отношению к контролю.
Для статистической обработки результатов проводят расчеты для каждой серии разбавлений и контроля и сопоставляют полученные результаты. Проводят контроль приемлемости по пункту 10, затем определяют:
- определение среднего арифметического (![]() ) показателя плодовитости в контрольной и тестируемой воде:
) показателя плодовитости в контрольной и тестируемой воде:
где хi - количество молоди в i-ом стакане; п - количество параллельных серий (стаканов);
- определение стандартного отклонения (s):
- определение ошибки среднего арифметического показателя плодовитости т:
- определение показателя достоверности tд разности двух сравниваемых величин:
где ![]() и
и ![]() - среднее арифметическое показателя
плодовитости в контроле и тестируемой воде;
- среднее арифметическое показателя
плодовитости в контроле и тестируемой воде; ![]() и
и ![]() - квадраты ошибок среднего арифметического в контроле и
тестируемой воде.
- квадраты ошибок среднего арифметического в контроле и
тестируемой воде.
Рассчитанный показатель достоверности сравнивается с критерием Стьюдента, для определения которого принимается уровень значимости Р = 0,05 и определяется число степеней свободы f как
где nк и nт - число наблюдений (число стаканов) в контроле и в тестируемой воде.
Критерий достоверности Стьюдента для уровня достоверности Р = 0,95 и степени свободы nк + nт - 2 определяется по таблице 8.
Если рассчитанное tд ³ tСт, то изменения в плодовитости дафний достоверны, а не случайны. В этом случае принимают, что исследуемая вода, водная вытяжка оказывает хроническое токсическое действие.
Если tд £ tСт, то выявленные различия в плодовитости дафний в тестируемой воде и контроле недостоверны, следовательно, исследуемая вода, водная вытяжка не оказывает на дафний хронического токсического действия.
Таблица 8 - Значения критерия Стьюдента (tСт)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
|
tСт |
12,7 |
4,3 |
3,18 |
2,78 |
2,57 |
2,45 |
2,36 |
2,31 |
2,26 |
2,23 |
2,20 |
2,18 |
2,16 |
2,14 |
2,13 |
|
30 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
|
|
2,05 |
2,04 |
2,12 |
2,11 |
2,10 |
2,09 |
2,09 |
2,08 |
2,07 |
2,07 |
2,06 |
2,06 |
2,06 |
2,05 |
2,05 |
9.2.4 Для характеристики степени хронического токсического действия используют величину БКР (безвредная кратность разбавления, или кратность разбавления воды, водной вытяжки при которой хроническое токсическое действие не проявляется).
9.2.5 По результатам определения острой и хронической токсичности вод ведутся записи в рабочем журнале (см. Приложение Б) и оформляется протокол биотестирования (см. Приложение В).
В протоколе указывается:
при установленной 10 %-ной гибели тест-объектов или их 100 %-ной выживаемости - об отсутствии острой токсичности исследуемой пробы;
при установленной 50 %-ной гибели тест-объектов - об острой токсичности исследуемой пробы;
при установленной гибели тест-объектов между 10 % и 50 % - об отсутствии острой токсичности в исследуемой пробе. Однако, дополнительно указывается, что эти пробы нельзя признать безвредными по показателю токсичность и если того требует установленный норматив или цели исследования, данные пробы должны быть исследованы на хроническую токсичность, так как в хронических экспериментах токсичность может быть выявлена с большей долей вероятности.
10 КОНТРОЛЬ ПРИЕМЛЕМОСТИ РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ
10.1 За результат измерений принимают среднее арифметическое результатов двух параллельных определений, если выполняется условие приемлемости:
где х1, х2 - результаты параллельных определений по уровню смертности или снижению плодовитости дафний, шт.; r - значение предела повторяемости (таблица 1).
10.2 Если условие, приведенное в формуле (17), не выполняется, получают еще один результат в полном соответствии с данной методикой. За результат измерений принимают среднее арифметическое значение результатов трех определений, если выполняется условие (18):
где xmax, xmin - максимальное и минимальное значения из полученных трех результатов параллельных определений по уровню смертности или снижению плодовитости дафний, шт.; CR0,95(n) - значение критического диапазона для уровня вероятности Р = 0,95 и n - результатов определений.
Для n = 3
СR0,95 = 3,3sr,
где sr - показатель повторяемости, % (таблица 1).
Если условие, приведенное в формуле (18), не выполняется, выясняют причины превышения критического диапазона, устраняют их и повторяют выполнение измерений в соответствии с требованиями методики.
10.3 Результат анализа в документах, предусматривающих его использование, представляют в виде:
![]() , при Р =
0,95,
, при Р =
0,95,
где ![]() - среднее арифметическое значение
результатов п определений,
признанных приемлемыми (п.п. 10.1 - 10.2), шт.; ±d - границы
относительной погрешности измерений, % (таблица 1).
- среднее арифметическое значение
результатов п определений,
признанных приемлемыми (п.п. 10.1 - 10.2), шт.; ±d - границы
относительной погрешности измерений, % (таблица 1).
11 КОНТРОЛЬ КАЧЕСТВА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ ПРИ РЕАЛИЗАЦИИ МЕТОДИКИ В ЛАБОРАТОРИИ
Контроль качества результатов измерений в лаборатории при реализации методики осуществляют по ГОСТ Р ИСО 5725-6 (Точность (правильность и прецизионность) методов и результатов измерений), используя контроль стабильности среднеквадратического (стандартного) отклонения повторяемости по 6.2.2 ГОСТ Р ИСО 5725-6. Проверку стабильности осуществляют с применением контрольных карт Шухарта.
Периодичность контроля стабильности результатов выполнения измерений регламентируют в Руководстве по качеству лаборатории.
Рекомендуется устанавливать контролируемый период так, чтобы количество результатов контрольных измерений было от 20 до 30.
При неудовлетворительных результатах контроля, например, при превышении предела действия или регулярном превышении предела предупреждения, выясняют причины этих отклонений, в том числе проводят смену реактивов, проверяют работу оператора.
12 ПРЕДУПРЕДИТЕЛЬНЫЙ КОНТРОЛЬ ТОКСИКОЛОГИЧЕСКОГО АНАЛИЗА
12.1 Предупредительный контроль качества оценки токсичности воды проводят один раз в квартал по определению чувствительности используемых тест-организмов к модельному «эталонному» токсиканту - калию двухромовокислому (К2Cr2О7). Диапазон концентраций модельного токсиканта, при действии которого в течение 24 часов гибнет 50 % дафний, составляет 0,9 - 2,0 мг/дм3.
Удовлетворительные результаты, полученные при проверке диапазона реагирования тест-организмов на модельный токсикант, не обеспечивают гарантии адекватного реагирования организмов на другие токсиканты и тем более их смеси, однако регулярно проводимая проверка позволяет выявить ошибки при приготовлении исследуемых смесей и растворов, нарушения, допускаемые в процессе культивирования организмов и условиях проведения опытов.
Процедура определения диапазона реагирования тест-организмов на модельный токсикант. Определяют ту концентрацию модельного токсиканта, при которой за 24 часа гибнет 50 % подопытных организмов. Для этого на основании стандарт-титра методом последовательных разбавлений готовят серии растворов двухромовокислого калия в культивационной воде с концентрациями 0,5; 0,9; 1,0; 1,5; 2,0; 2,5 мг/дм3.
Испытания на дафниях проводят в соответствии с прописью методики. При проведении процедуры проверки чувствительности рачков к модельному токсиканту дафний не кормят.
Если концентрация двухромовокислого калия, вызвавшая острую токсичность, находится в интервале 0,9 - 2,0 мг/дм3, то чувствительность культуры дафний соответствует необходимым требованиям, и она может быть использована в биотестировании.
Если концентрация модельного токсиканта, вызвавшая острую токсичность, не находится в данном интервале, то следует проверить точность приготовления исследуемых растворов, условия проведения опытов, проверить культуру на наличие самцов. Если ошибки при проведении опытов исключены, необходимо сменить культуру тест-организмов, т.е. взять новую культуру в учреждениях, где она имеется.
В тех случаях, когда чувствительность дафний не укладывается в установленный диапазон по причине ухудшения качества водопроводной воды, используемой для приготовления культивационной воды, например, в период весенних паводков, то культуру дафний не меняют. Проводят мероприятия по улучшению качества культивационной воды, дополнительное отстаивание или фильтрование, аэрирование и т.д. В протоколах биотестирования в этот период указывают установленную концентрацию модельного токсиканта, при которой гибнет 50 % дафний за 24 ч экспозиции. После улучшения качества используемой культивационной воды чувствительность дафний к модельному токсиканту восстанавливается до установленной нормы через 1 - 2 недели.
Библиография
ГОСТ 24481-80 Вода питьевая. Отбор проб.
ГОСТ 17.1.5.04-81 Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия.
ГОСТ 17.4.3.01-83 Охрана природы. Почвы. Общие требования к отбору проб.
ГОСТ 17.4.4.02-84 Почвы. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического анализа.
ГОСТ 12071-84 Грунты. Отбор, упаковка, транспортирование и хранение образцов
ГОСТ 5180-84 Грунты. Методы лабораторного определения физических характеристик.
ГОСТ 2517-85 Нефть и нефтепродукты. Методы отбора проб.
ГОСТ 17.4.3.03-85 (СТ СЭВ 4469-84) Почвы. Общие требования к методам определения загрязняющих веществ.
ГОСТ 26423-85 - ГОСТ 26428-85 Почвы. Методы определения катионно-анионного состава водной вытяжки.
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков.
ГОСТ 27753.1-88 Грунты тепличные. Методы отбора проб.
ГОСТ 28168-89 Почвы. Отбор проб.
ГОСТ Р 8.563-96 ГСИ Методики выполнения измерений.
ГОСТ Р 50.2.008-2001 ГСОЕИ Методики количественного химического анализа. Содержание и порядок проведения метрологической экспертизы.
МУ 2.1.7.730-99 Гигиеническая оценка качества почвы населенных мест. - Минздрав России, М., 1999.
НВН 33-5.3.01-85 Инструкция по отбору проб для анализа сточных вод.
СТ СЭВ 4710-84 Воды подземные. Общие требования к отбору проб.
Аринушкина Е.В. Руководство по химическому анализу почв. - М.: Изд-во МГУ, 1970. - 488 с.
Европейское соглашение о международной дорожной перевозке опасных грузов - ДОПОГ и протокол о его подписании. Женева, 30 сентября 1997 г. - ООН, Нью-Йорк, Женева, 1998.
Исакова Е.Ф., Колосова Л.В. Метод биотестирования с использованием дафний // Методы биотестирования вод: Сб. ст. / АН СССР. - Черноголовка, 1988. - С. 50 - 57.
Плохинский Н.А. Математические методы в биологии. Учебно-методическое пособие. - М.: Изд-во МГУ, 1978. - 340 с.
Строганов Н.С., Колосова Л.В. Ведение лабораторной культуры и определение плодовитости дафний в ряде поколений // Методики биологических исследований по водной токсикологии. Под ред. Н.С. Строганова. - М.: Наука, 1971.
Deutsche Einheitsverfahren zur Wasser-, Abwasser- und Schlammuntersuchung. Shlamm und Sedimente (Gruppe S). Bestommung der Eluebarkeit mit Wasser DIN 38414-S4.
ISO 3954:1977. Powders for powders metallurgical purposes. - Sampling.
ISO 6206:1979. Chemical products for industrial use. - Sampling. - Vocabulary. - Bilingual edition.
ISO 8213:1986. Chemical products for industrial use. - Sampling techniques. - Solid chemical products in the form of particles varying from powders to course lumps.
ISO 5884:1987. Aircraft-fluid systems and components. - Methods for system sampling and measuring the solid particle contamination of hydraulic fluids.
ISO 2067:1988. Granulated cork. - Sampling.
ISO 6341:1989. Water quality. - Determination of mobility suppression Daphnia magna Straus (Cladocera, Crustacea).
ISO 8633:1992. Solid fertilizers. - Simple sampling methods for small lots.
ISO 5667-10:1992. Water quality. - Sampling. - Part 10: Guidance on sampling of waste waters.
ISO 10381:1993. Soil quality. - Sampling. - Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
ISO 11464:1994. Soil analysis. - Pretreatment of samples for physic-chemical analysis.
EPA. 1986. Test methods for evaluating solid waste. 3rd ed., SW-846, Volume II, Part III, Chapter 9. Office of Solid Waste and Emergency Response, Washington, DC.
EPA. 1993. Methods for measuring the acute toxicity of effluents and receiving waters to freshwater and marine organisms. 4th ed., EPA/600/4-90/027F. Ed. by C.I. Weber, Environmental Monitoring System Laboratory, Office of Research and Development, EPA, Cincinnati, OH.
Finney, D.J. 1971. Probit Analysis. 3rd ed., Cambridge University Press, London.
ON L 105 Sampling of forest soil.
ON L 1054 Sampling of cultivated soils. - Terms, definitions and general considerations.
ON L 1055 Sampling of arable soils.
ON M 6258 Water analysis. - Guidance on sampling technique. - Sampling of waste water.
ON M 6291 Analysis of sewage sludge: sampling.
ON S 2000 Waste. - Terms and definitions.
ON S 2072 Classification of waste by leaching test.
ON S 2111 Sampling of waste.
Zar, J.H. 1984. Biostatistical Analysis. 2nd ed., Prentice Hall, Englewood Cliffs, NJ.
Приложение А
(рекомендуемое)
Полное наименование лаборатории,
адрес, телефон, аттестат аккредитации
(№, дата выдачи, срок действия),
логотип (если имеется)
Форма протокола отбора проб
(заполняется только в том случае, если отбор проб
и КТА выполняют разные лаборатории)
Таблица А.1 - Протокол отбора проб регистрационный №, дата выдачи
|
Дата и время отбора |
|
|||
|
2 |
Цель пробоотбора |
|
||
|
3 |
Место отбора (наименование точки отбора) |
|
||
|
4 |
Объект отбираемой пробы |
Вода, почва, осадки сточных вод, отходы (нужное подчеркнуть) |
||
|
5 |
Вид пробы |
Разовая, среднесуточная, точечная, объединенная (нужное подчеркнуть) |
||
|
6 |
Вид отбора пробы |
Параллельный, последовательный (нужное подчеркнуть) |
||
|
7 |
Используемый пробоотборник |
Стеклянный, эмалированный, нержавеющая сталь, бур почвенный, щуп, лопата (нужное подчеркнуть) |
||
|
8 |
Номер на емкости |
|
||
|
9 |
Материал емкости |
полиэтилен, стекло, нержавеющая сталь (нужное подчеркнуть) |
||
|
10 |
Наличие и способ опломбирования емкости |
|
||
|
11 |
Проба отобрана для проведения анализа |
На токсичность методом биотестирования, теста на биохимическую разлагаемость (нужное подчеркнуть) |
||
|
12 |
Условия отбора |
t, °С |
рН |
O2 |
|
Примечание |
||||
Отбор проб проведен в присутствии _______________________________________
подпись расшифровка подписи
Исполнитель___________________________________________________________
подпись расшифровка подписи
Приложение Б
(рекомендуемое)
Форма регистрации условий и результатов биотестирования в рабочем журнале
Таблица Б.1 - Форма регистрации условий и результатов биотестирования в рабочем журнале
|
Дата, время отбора проб |
1130 ч, 10 марта 1996 г. |
|
|
2 |
Место отбора |
Очистные сооружения г. Троицка. Очищенная сточная вода, выходящая из вторичного отстойника |
|
3 |
Используемые тест-организмы, возраст |
Дафнии, возраст менее 24 ч, разница между особями не более 8 ч |
|
4 |
Место биотестирования и условия |
Люминостат, t = 20 ± 2 °С, фотопериод - 16 ч - световой, 8 ч - ночной, освещенность искусственная (550 лк) |
|
5 |
Время хранения пробы от отбора до начала биотестирования |
4 ч |
|
6 |
Режим кормления |
1 см3 суспензии водорослей Chlorella на 100 см3 исследуемой воды ежедневно, в хроническом опыте дополнительно 1 раз в неделю 0,1 см3 дрожжевой суспензии на 100 см3 воды |
|
7 |
Повторности для каждой концентрации |
Три |
|
8 |
Смена растворов |
В остром опыте растворы не менялись, в хроническом - смена растворов проводилась 1 раз в 5 дней |
|
9 |
Исследуемые концентрации сточных вод |
0,5; 1,5; 10; 25; 50; 100 % |
|
10 |
Соответствующая степень разбавления сточных вод по формуле:
|
Разбавления в 200; 66,7; 10; 4; 2; 1 (без разбавления) раз |
|
11 |
t, pH, O2 в исследуемой воде |
Измерения перед началом биотестирования, при смене растворов и при завершении экспериментов - все показатели в пределах установленных в методике оптимальных значений |
|
12 |
Средняя летальная кратность разбавления в остром опыте ЛКР50-96 |
25,7 %-ная концентрация сточных вод, или кратность разбавления в 3,89 раз |
|
13 |
Безвредное разбавление в остром опыте БКР10-96 |
10 %-ная концентрация сточных вод, или кратность разбавления в 10 раз |
|
14 |
Кратность разбавления, вызывающая хроническую токсичность за 24 дня эксперимента |
0,5 %-ная концентрация сточных вод, или кратность разбавления в 200 раз |
|
15 |
Безвредная кратность разбавления, не вызывающая хроническую токсичность за 24 дня эксперимента |
Не установлена |
|
16 |
Данные гидрохимических анализов исследуемой воды |
В приложении к акту проверки |
Приложение В
(рекомендуемое)
Полное наименование лаборатории,
адрес, телефон, аттестат аккредитации
(№, дата выдачи, срок действия),
логотип (если имеется)
допускается 1 лист приложения к протоколу
Протокол КТА (регистрационный номер, дата выдачи)
|
Наименование, адрес организации заказчика, природопользователя ________________ |
|
Наименование объекта испытаний, цели исследования ___________________________ |
|
Дата, время отбора проб _____________________________________________________ |
|
Место отбора проб __________________________________________________________ |
|
Условия отбора и транспортировки проб _______________________________________ |
|
Кем взяты пробы, реквизиты организации, выполнившей пробоотбор _______________ |
|
Дата, время доставки проб в лабораторию ______________________________________ |
|
Используемые МВИ, НД для метода биотестирования и отбора проб _______________ |
|
Характеристика условий испытаний и внешних факторов (О2, pH, t °C, жесткость) в начале и при завершении биотестирования _____________________________________ |
Таблица В.1 - Результаты измерений с данными контроля приемлемости результатов измерений
|
Время хранения от отбора проб до начала биотестирования |
Дата, время биотестирования |
Тест-объект |
Продолжительность наблюдения (ч, сут.) |
Оценка тестируемой пробы |
|
|
|
|
|
дафния Daphnia magna Straus |
|
Оказывает (не оказывает) острое (хроническое) токсическое действие. Безвредная кратность разбавления |
|
Биотестирование проводил ___________________________________________________ |
|
|
подпись дата расшифровка подписи |
|
|
Заключение ________________________________________________________________ |
|
|
___________________________________________________________________________ |
|
|
___________________________________________________________________________ |
|
|
Начальник лаборатории или начальник организации, включающей лабораторию |
|
|
___________________________________________________________________________ |
|
|
подпись дата расшифровка подписи |
|
|
Форма протокола утверждена начальником лаборатории |
Указывается: порядковый номер листа, общее количество листов |
|
____________________________________________ |
|
|
подпись дата расшифровка подписи |
|
Приложение Г
(справочное)
Характеристика тест-объекта
Г.1 В качестве тест-объекта используют Daphia magna Straus. Относится к низшим ракообразным, отряду ветвистоусых. Дафнии обитают в планктоне стоячих и слабопроточных пресноводных водоемов, широко распространены на территории России.
Г.2 Морфология. Тело дафний овальной формы, сжато с боков, заключено в прозрачный панцирь. Тело нечетко сегментировано на головной, грудной и брюшной отделы (рисунок Г.1). Голова покрыта щитом, передний край которого вытянут, образуя рострум. Под рострумом расположены две пары конечностей: антеннулы и антенны, последние сильно развиты, служат для скачкообразного перемещения в толще воды. Пять пар грудных конечностей сильно расчленены, снабжены щетинками, служат для фильтрации воды, питания, дыхания. Брюшной (абдоминальный) отдел туловища заканчивается постабдоменом, дорсальный край которого имеет выемку, характерную для дафний данного вида. Расположение внутренних органов представлено на рисунке Г.1. В головном отделе, не покрытом раковиной, расположена пара глаз: большой - сложный, маленький - простой. Под панцирем дафний легко различимы сердце, кишечник, выводковая камера, которая находится в спинной части туловища. В выводковой камере протекает эмбриональное развитие дафний.
Г.3 Рост, развитие и размножение. Наиболее интенсивно дафния растет первые дни после рождения, при каждой линьке сбрасывая старый панцирь. Оптимальное питание обеспечивает удвоение размеров рачков в промежутке между линьками. После наступления половой зрелости рост дафний замедляется, снижается и частота линек. Всего в течение жизни дафния может линять до 24 раз. Выметанная молодь имеет в длину 0,7 - 0,9 мм, половозрелые самки - 2,2 - 2,4 мм, самцы - 2,0 - 2,1 мм. Максимальные размеры самок - 6,0 мм при сыром весе 7 - 10 мг. В природе в летнее время, а в лаборатории при оптимальных условиях культивирования круглый год дафнии размножаются без оплодотворения - партеногенетически (рождаются только самки). При резком изменении условий существования или культивирования (похолодание, голод, перенаселенность и т.п.) в культуре появляются самцы. Самцы отличаются от самок меньшими размерами, видоизмененной формой тела, антеннул, постабдомена. Резкое изменение условий существования вызывает переход к половому размножению, дафнии откладывают «зимние яйца», размещающиеся в эффипиуме, образованном из части створок панциря. При очередной линьке эффипиум отделяется (в природе - осенью), падает на дно водоема, где яйца проходят стадию зимнего покоя. Весной из них появляются самки, снова переходящие к партеногенетическому размножению
Период созревания рачков при оптимальной температуре (+20 ± 2 °С) и хорошем питании - 5 - 8 суток, длительность эмбрионального развития - 3 - 4 суток, а при повышении температуры до 25 °С - 46 часов. Затем происходит вымет молоди (партеногенетических самок) каждые 3 - 4 суток. Количество молоди у молодых самок - 10 - 15, у зрелых - 30 - 40 особей. В природе дафнии живут в среднем 20 - 25 суток, а в лаборатории при оптимальном режиме 3 - 4 месяца и более. При температуре свыше 25 °С продолжительность жизни дафний может сокращаться до 25 суток. Голодание увеличивает продолжительность жизни, но задерживает рост и наступление линек.
Г.4 Питание и отношение к содержанию кислорода. По характеру питания относятся к фильтраторам, в природе дафнии питаются взвешенными в воде бактериями, одноклеточными водорослями, детритом, растворенными органическими веществами. Пища поступает с потоком воды, направленным грудными конечностями, через выросты - в брюшной желоб вдоль основания конечностей и ко рту рачка. Оптимальное для жизнедеятельности дафний содержание растворенного в воде кислорода - 6 - 7 мг/дм3. Однако дафния достаточно устойчива к изменению кислородного режима и снижению растворенного в воде кислорода до 2 мг/дм3 и ниже, что связано с ее способностью синтезировать гемоглобин Повышенное содержание гемоглобина в крови дафний при ухудшении кислородного режима сопровождается окрашиванием рачков в красный цвет.
Рисунок Г.1 - Строение Daphnia magna Straus:
а - самка: 1 - антенна, 2 - сложный глаз, 3 - антеннула, 4 - грудные ножки, 5 - яичник, 6 - створки панциря, 7 - каудальные когти, 8 - постабдомен, 9 - хвостовые щетинки, 10 - выводковая камера, 11 - сердце, 12 - кишечник, 13 - печеночные выросты; б - самец; в - внешний вид эффипиума
Приложение Д
Свидетельство об аттестации МВИ
|
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ УНИТАРНОЕ ПРЕДПРИЯТИЕ ВСЕРОССИЙСКИЙ НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ МЕТРОЛОГИЧЕСКОЙ СЛУЖБЫ |
119361 Москва, Озерная ул., д. 46 Е-mail: analyt-vm@vniims.ru Тел. (095) 437 9419
Факс: (095) 437 3666
СВИДЕТЕЛЬСТВО № 67-05
ОБ АТТЕСТАЦИИ МВИ
Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод, отходов по смертности и изменению плодовитости дафний
Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод, отходов по смертности и изменению плодовитости дафний, разработанная ООО «АКВАРОС», аттестована в соответствии с ГОСТ Р 8.563-96 и ГОСТ Р ИСО 5725-2002 (Части 1 - 6).
Аттестация осуществлена по результатам экспериментальных исследований МВИ.
В результате аттестации установлено, что МВИ соответствует предъявляемым к ней метрологическим требованиям и обладает основными метрологическими характеристиками, приведенными на обороте настоящего свидетельства.
При реализации методики в лаборатории обеспечивают контроль стабильности результатов анализа на основе контроля стабильности среднеквадратического отклонения повторяемости и контроля стабильности среднеквадратического отклонения промежуточной прецизионности.
Дата выдачи 17 октября 2005 года
Заместитель директора В.Н. Яншин
РЕЗУЛЬТАТЫ МЕТРОЛОГИЧЕСКОЙ АТТЕСТАЦИИ
|
Показатель точности (границы относительной погрешности) ±d, %, при Р = 0,95 |
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости), sr, % |
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости), sR, % |
Предел повторяемости, r, %, P = 0,95, n = 2 |
|
|
Вода питьевая и поверхностная пресная, грунтовая, сточная. Водные вытяжки из почв, осадков сточных вод, отходов производства. |
40 |
10 |
20 |
28 |
Начальник отдела Ш.Р. Фаткудинова
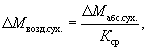 (
(
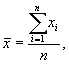 (
(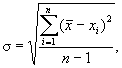 (
(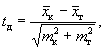 (
(