| Обозначение: |  ГОСТ Р ИСО 14630-2017 ГОСТ Р ИСО 14630-2017 |
| Обозначение англ: |  GOST R ISO 14630-2017 GOST R ISO 14630-2017 |
| Статус: | принят |
| Название рус.: | Имплантаты хирургические неактивные. Общие требования |
| Название англ.: | Non-active surgical implants. General requirements |
| Дата добавления в базу: | 05.05.2017 |
| Дата актуализации: | 05.05.2017 |
| Дата введения: | 22.02.2017 |
| Дата окончания срока действия: | 01.01.2018 |
| Область применения: | Стандарт устанавливает общие требования к неактивным хирургическим имплантатам. |
| Оглавление: | 1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Проектные технические характеристики
5 Особенности конструкции
6 Материалы
7 Оценка конструкции
7.1 Общие требования
7.2 Доклиническая оценка
7.3 Клиническая оценка
7.4 Послепродажный контроль
8 Производство
9 Стерилизация
9.1 Общие требования
9.2 Изделия, поставляемые стерильными
9.3 Стерилизация потребителем
9.4 Остаточные вещества после стерилизации.
10 Упаковка
10.1 Защита от повреждений при хранении и транспортировании
10.2 Сохранение стерильности при транспортировании
11 Информация, предоставляемая производителем
11.1 Маркировка специального назначения
11.2 Общие требования
11.3 Нанесение этикеток
11.4 Инструкции по эксплуатации
11.5 Ограничения по совместному применению
11.6 Маркировка имплантатов
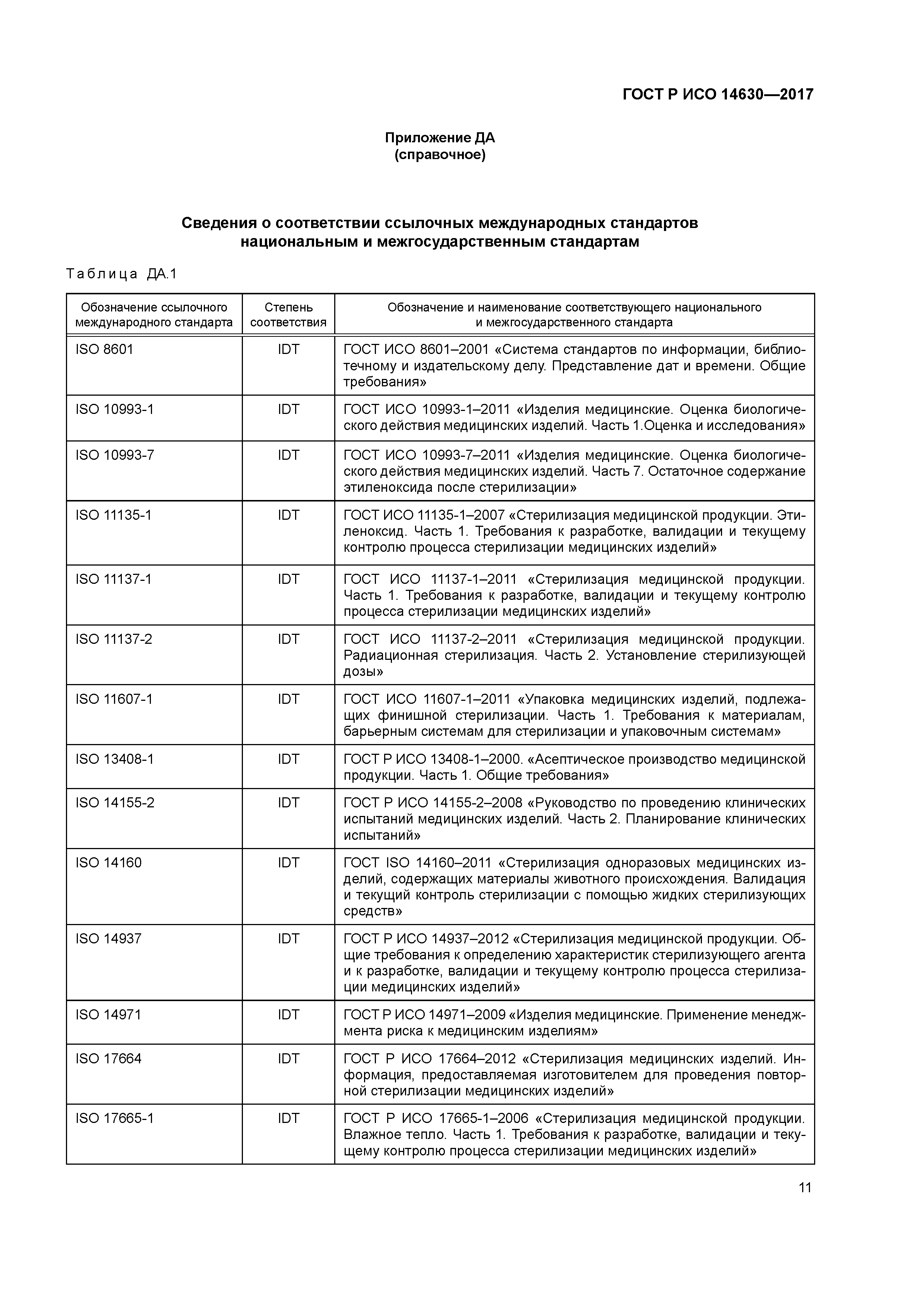
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов национальным и межгосударственным стандартам
Библиография |
| Разработан: | ООО ЦИТОпроект
|
| Утверждён: | 22.02.2017 Федеральное агентство по техническому регулированию и метрологии (61-ст)
|
| Издан: | Стандартинформ (2017 г. )
|
| Расположен в: |
|
| Заменяет собой: | |
| Нормативные ссылки: |   ГОСТ ИСО 8601-2001 «Система стандартов по информации, библиотечному и издательскому делу. Представление дат и времени. Общие требования» ГОСТ ИСО 8601-2001 «Система стандартов по информации, библиотечному и издательскому делу. Представление дат и времени. Общие требования»  ГОСТ Р ИСО 13408-1-2000 «Асептическое производство медицинской продукции. Часть 1. Общие требования» ГОСТ Р ИСО 13408-1-2000 «Асептическое производство медицинской продукции. Часть 1. Общие требования»  ГОСТ Р ИСО 14155-2-2008 «Руководство по проведению клинических испытаний медицинских изделий. Часть 2. Планирование клинических испытаний» ГОСТ Р ИСО 14155-2-2008 «Руководство по проведению клинических испытаний медицинских изделий. Часть 2. Планирование клинических испытаний»  ГОСТ Р ИСО 14971-2009 «Изделия медицинские. Применение менеджмента риска к медицинским изделиям» ГОСТ Р ИСО 14971-2009 «Изделия медицинские. Применение менеджмента риска к медицинским изделиям»  ГОСТ Р ИСО 22442-2-2011 «Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 2. Контроль отбора, сбора и обработки» ГОСТ Р ИСО 22442-2-2011 «Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 2. Контроль отбора, сбора и обработки»  ГОСТ Р ИСО 22442-3-2011 «Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 3. Валидация уничтожения и/или дезактивации вирусов и агентов инфекционной губчатой энцефалопатии» ГОСТ Р ИСО 22442-3-2011 «Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 3. Валидация уничтожения и/или дезактивации вирусов и агентов инфекционной губчатой энцефалопатии»  ГОСТ Р ИСО 22442-1-2011 «Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 1. Менеджмент риска» ГОСТ Р ИСО 22442-1-2011 «Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 1. Менеджмент риска»  ГОСТ Р ИСО 14937-2012 «Стерилизация медицинской продукции. Общие требования к определению характеристик стерилизующего агента и к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий» ГОСТ Р ИСО 14937-2012 «Стерилизация медицинской продукции. Общие требования к определению характеристик стерилизующего агента и к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий»  ГОСТ Р ИСО 17664-2012 «Стерилизация медицинских изделий. Информация, предоставляемая изготовителем для проведения повторной стерилизации медицинских изделий» ГОСТ Р ИСО 17664-2012 «Стерилизация медицинских изделий. Информация, предоставляемая изготовителем для проведения повторной стерилизации медицинских изделий»  ГОСТ ISO 11137-1-2011 «Стерилизация медицинской продукции. Радиационная стерилизация. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий» ГОСТ ISO 11137-1-2011 «Стерилизация медицинской продукции. Радиационная стерилизация. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий»  ГОСТ ISO 14160-2011 «Стерилизация одноразовых медицинских изделий, содержащих материалы животного происхождения. Валидация и текущий контроль стерилизации с помощью жидких стерилизующих средств» ГОСТ ISO 14160-2011 «Стерилизация одноразовых медицинских изделий, содержащих материалы животного происхождения. Валидация и текущий контроль стерилизации с помощью жидких стерилизующих средств»  ГОСТ ISO 11137-2-2011 «Стерилизация медицинской продукции. Радиационная стерилизация. Часть 2. Установление стерилизующей дозы» ГОСТ ISO 11137-2-2011 «Стерилизация медицинской продукции. Радиационная стерилизация. Часть 2. Установление стерилизующей дозы»  ГОСТ ISO 10993-7-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации» ГОСТ ISO 10993-7-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации»  ГОСТ ISO 10993-1-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования» ГОСТ ISO 10993-1-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования»  ГОСТ Р ИСО 17665-1-2016 «Стерилизация медицинской продукции. Влажное тепло. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий» ГОСТ Р ИСО 17665-1-2016 «Стерилизация медицинской продукции. Влажное тепло. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий»
|

 ГОСТ Р ИСО 14630-2017
ГОСТ Р ИСО 14630-2017


















 ГОСТ Р ИСО 14630-2011 «Имплантаты хирургические неактивные. Общие требования»
ГОСТ Р ИСО 14630-2011 «Имплантаты хирургические неактивные. Общие требования»